Кинетика и катализ, 2021, T. 62, № 4, стр. 446-458
Селективное О-метилирование фенола диметилкарбонатом на катализаторах, нанесенных на CaO
Zhifang Zhang a, Zhongying Xu b, Shaoying Li b, Shijun Chen b, Ying Tang b, c, *
a Школа химии и химической инженерии Юйлиньского университета
719000 Юйлинь, Китай
b Ключевая лаборатория по контролю загрязнения окружающей среды и технологии защиты резервуаров на нефтяных месторождениях провинции Шэньси, Сианьский университет Шию
710065 Сиань, Китай
c Государственная ключевая лаборатория контроля загрязнения нефтью, Исследовательский институт безопасности и экологических технологий CNPC
102206 Пекин, Китай
* E-mail: tangying78@xsyu.edu.cn
Поступила в редакцию 24.01.2021
После доработки 12.02.2021
Принята к публикации 12.02.2021
Аннотация
Показано, что катализаторы на основе СаО являются эффективными гетерогенными катализаторами метилирования фенола диметилкарбонатом (ДМК) в закрытом реакторе высокого давления. Для достижения максимальной конверсии фенола проведены опыты по оптимизации состава катализатора и условий проведения реакции. Наилучшие каталитические характеристики продемонстрировал CaO, модифицированный KCl. При температуре реакции 200°C, молярном соотношении фенол : ДМК = 1 : 2, 3% загрузке катализатора 15%KCl/CaO и продолжительности реакции 9 ч была достигнута 100% конверсия фенола при 95% селективности по анизолу. Структура и свойства катализаторов подробно охарактеризованы с помощью ИК-спектроскопии с Фурье-преобразованием (FTIR), сканирующей электронной микроскопии (СЭМ) и метода БЭТ. Обнаружено, что существует сильная взаимосвязь между основностью поверхности катализаторов и их каталитическими характеристиками в отношении конверсии фенола и селективности по анизолу.
ВВЕДЕНИЕ
Анизол является важным органическим синтетическим промежуточным продуктом, который широко используется в промышленности для производства красителей, пестицидов, фармацевтических препаратов и т.д. [1–3], которые обычно получают путем O-метилирования соответствующих фенолов метилгалогенидами или диметилсульфатом. Однако эти методы требуют не только применения вредных реагентов, но и стехиометрического количества сильного основания для нейтрализации побочных кислотных продуктов. O-метилирование фенолов также можно проводить с помощью метанола в присутствии сильнокислотного катализатора или цеолита при высокой температуре. В большинстве случаев полная конверсия фенолов труднодостижима, и О-метилирование всегда конкурирует с С-метилированием [4–12]. Диметилкарбонат (ДМК) – экологически чистый реагент для метилирования, который может заменить традиционные, такие как метилгалогениды (CH3X, X = I, Br, Cl) или диметилсульфат [13]. В последние десятилетия был разработан эффективный, удобный и экологически чистый метод O-метилирования фенола ДМК – хорошо известным нетоксичным реагентом, который используется во многих экологически безопасных технологиях. При применении в качестве реагента метилирования ДМК фактически дает только метанол и диоксид углерода в качестве побочных продуктов [14]. По мере роста понимания необходимости защиты окружающей среды проводится все больше и больше исследований этой технологии.
В реакции ДМК с фенолом для получения анизола эффективны катализаторы фазового переноса, органические оснόвные и цеолитные катализаторы [15]. Проводились интенсивные исследования синтеза анизола путем O-метилирования фенола с помощью ДМК, и были достигнуты лучшие показатели по сравнению с катализаторами фазового переноса и органическими катализаторами. В то же время, в случае гомогенных реакций не могут быть устранены недостатки, связанные с неполным извлечением катализатора и сложностью разделения продуктов. При использовании цеолитов более высокая температура реакции (250–300°C) приводит к образованию большего количества побочных продуктов C-алкилирования фенильного кольца. Были изучены различные гетерогенные катализаторы, однако исследование процесса метилирования фенола велось не столь интенсивно. Следовательно, существует острая необходимость в применении более высокоэффективных гетерогенных каталитических материалов для этой реакции [16].
В настоящей работе в качестве катализатора O-метилирования фенола ДМК использовали CaO с добавкой хлорида щелочного металла. Подробно проанализировано влияние условий реакции на его реакционную способность. Предложены маршруты образования основных продуктов и механизм каталитической реакции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализаторов
Методом пропитки по влагоемкости водным раствором хлорида металла приготовлена серия катализаторов на основе СаО. Во всех случаях 6 г коммерческого порошка CaO с размером частиц ~100–200 меш предварительно прогревали при 900°C в течение 6 ч для удаления физически абсорбированной воды и диоксида углерода. После перемешивания при комнатной температуре в течение 10 ч порошка CaO в растворах различных хлоридов металлов осадок сушили в печи в течение ночи при 105°C. Перед реакцией все катализаторы прокаливали на воздухе при заданных температурах в течение 6 ч. Катализаторы обозначены как x%YCl/CaO, где x – количество хлорида YCl.
Характеризация катализаторов
Морфологию приготовленных катализаторов определяли с помощью сканирующего электронного микроскопа JSM-6390A (“JEOL”, Япония) с ускоряющим напряжением 20.0 кВ. Структуру фаз прокаленных катализаторов анализировали, используя рентгеновский дифрактометр JDX-3530 (“JEOL”, Япония) с рентгеновской трубкой с медной мишенью (Kα-излучение, 40 мА и 40 кВ), расположенной под углом 5°–80°, скорость сканирования – 2°/мин. Измерения площади поверхности и свойств пор проводили методом физической адсорбции N2 с применением прибора ASAP 2010 (“Micromeritics”, США) при 77 К. Площадь поверхности рассчитывали с помощью уравнения БЭТ в диапазоне давлений P/P0 = 0.02–0.2, а распределение пор по размерам определяли методом Барретта–Джойнера–Халенды (BJH). Распределение силы оснόвных центров в катализаторах находили, используя температурно-программированную десорбцию (ТПД) CO2 на приборе ChemiSorb2750 (“Micromeritics”, США). Образец катализатора предварительно обрабатывали в потоке Ar при 300°C в течение 1 ч и охлаждали до 50°C в течение 3 ч в потоке диоксида углерода. Затем температуру образца повышали от 50 до 800°С со скоростью 10°С/мин в атмосфере He, десорбирующийся СО2 определяли с помощью детектора по теплопроводности. Инфракрасные спектры образцов, спрессованных с порошком KBr в соотношении 1 : 100 в виде таблеток, регистрировали на ИК-спектрометре с преобразованием Фурье Nicolet 5700 (“Thermo Electron Co.”, США) в условиях окружающей среды.
Реакция метилирования фенола ДМК
Реакцию метилирования фенола ДМК проводили в реакторе из нержавеющей стали. Фенол, ДМК и катализатор загружали в автоклав (100 мл) в определенной пропорции и нагревали до заданной температуры реакции. После перемешивания магнитной мешалкой в течение времени, необходимого для образования гомогенной смеси, катализаторы отделяли центрифугированием и собирали супернатант для анализа с помощью газовой хроматографии. Выход анизола количественно определяли с использованием ацетофенона в качестве внутреннего стандарта. Продукты количественно анализировали с использованием газового хроматографа Agilent 6890 (“Agilent”, США), оборудованного капиллярной колонкой PONA (50 м × 0.2 мм × 0.5 мкм) и пламенно-ионизационным детектором (ПИД). Конверсию и селективность рассчитывали по фенолу [17].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Скрининг катализаторов
Эксперименты по отбору катализатора проводили в присутствии свежего CaO и различных катализаторов на основе носителя CaO, содержащих 15% активных компонентов – LiCl, NaCl и KCl. Данные, представленные в табл. 1, демонстрируют влияние нанесенного на CaO хлорида активного металла на каталитические характеристики образцов (конверсия и селективность выхода фенола и анизола при молярном соотношении фенол : ДМК = 1 : 2 при 180°C). После 10 ч реакции все образцы на основе CaO, модифицированные хлоридами, показали хорошую активность. Самые высокие показатели (конверсия фенола – 36.8%, селективность по анизолу – 46.8%) были получены для KCl/CaO. Эти результаты могут быть частично связаны с присутствием K-центров на поверхности катализатора, которые значительно усиливают адсорбцию фенола, как предполагали в работе [18]. Учитывая более высокую активность KCl/CaO, последующие эксперименты по оптимизации условий проведения реакции были проведены в присутствии этого катализатора.
Характеристики физической адсорбции
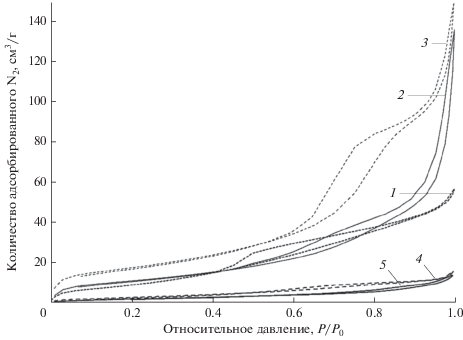
Чтобы объяснить высокую каталитическую активность CaO, модифицированного хлоридом щелочного металла, были проведены эксперименты по адсорбции–десорбции N2 для получения подробной информации о распределении пор по размерам. На рис. 1 приведены изотермы адсорбции–десорбции N2. Видно, что изотермы для всех образцов, за исключением LiCl/CaO, имеют петли гистерезиса в области относительных давлений ~0.4–0.8. Таким образом, добавление хлорида способствует значительному увеличению размера пор CaO. В случае KCl/CaO наблюдается самая большая петля гистерезиса, что указывает на его мезопористую структуру. Более того, диапазон относительных давлений для KCl/CaO и NaCl/CaO увеличивается (P/P0 ≈ 0.4–1.0), и отсутствует предел адсорбции в области более высоких давлений, что свидетельствует о наличии в основном двух типов пористых структур [19].
Рис. 1.
Изотермы адсорбции–десорбции N2 для катализаторов на основе CaO: 1 – KCl/CaO, 2 – NaCl/CaO, 3 – CaO, 4 – LiCl/CaO.
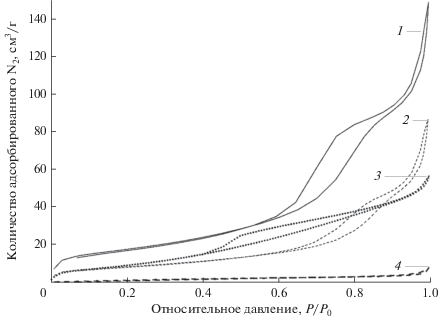
Текстурные свойства образцов приведены в табл. 2. Можно видеть, что модификация катализатора хлоридом металла вызывает значительное уменьшение удельной поверхности после второго прокаливания при высокой температуре. Размер пор в нанесенных катализаторах лежит в диапазоне от 2 до 50 нм, что указывает на типичные мезопористые свойства образцов. Увеличение объема пор катализатора имеет большое значение в гетерогенной реакции для ускорения диффузии реакционных молекул, облегчения входа реагентов в катализатор и контакта с более активными центрами. Внутренняя пористая структура катализатора влияет также на количество щелочных центров. На основании полученных результатов можно сделать вывод, что структура пор твердого катализатора является одним из важных факторов, воздействующих на его каталитическую активность, а также селективность.
Таблица 2.
Свойства пористой структуры катализаторов на основе CaO с различными нанесенными хлоридами металлов
| Катализатор | Удельная поверхность по БЭТ, м2/г | Средний диаметр пор, нм | Объем пор, см3 г–1 × 10–2 |
|---|---|---|---|
| KCl/CaO | 33.59 | 11.3 | 0.15 |
| NaCl/CaO | 30.41 | 17.7 | 0.13 |
| LiCl/CaO | 6.18 | 7.9 | 0.012 |
| Коммерческий CaO | 37.69 | 6.2 | 0.012 |
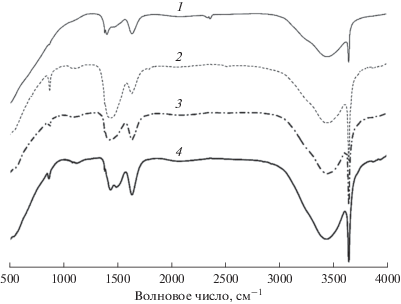
ИК-спектроскопия с Фурье-преобразованием
ИК-Фурье-спектры CaO и CaO, модифицированного различными хлоридами щелочных металлов, показаны на рис. 2. Полосу поглощения при 3641 см–1 можно отнести к симметричному валентному колебанию связи О–Н гидроксильной группы, а широкая полоса в области 3200–3600 см–1 принадлежит антисимметричным валентным колебаниям поверхностных гидроксильных групп. Это указывает на то, что в процессе приготовления катализатора невозможно избежать влияния влаги. Полосы при 1380 и 876 см–1 обусловлены колебаниями ${\text{CO}}_{3}^{{ - 2}}$. Образование –ОН и ${\text{CO}}_{3}^{{ - 2}}$ говорит об усилении распада СО2 и воды в процессе приготовления катализатора, особенно при использовании метода пропитки по влагоемкости. Относительно низкая, по сравнению с другими образцами, интенсивность колебаний –OH и ${\text{CO}}_{3}^{{ - 2}}$ характерна для KCl/CaO. Это свидетельствует о том, что присутствие KCl до определенной степени улучшает стабильность CaO на воздухе и, как было упомянуто ранее, обеспечивает его высокие каталитические показатели.
Влияние количества катализатора на реакцию метилирования
Влияние количества KCl/CaO на реакцию метилирования фенола ДМК изучено для молярного отношении фенол : ДМК = 1 : 2 при 180°C (табл. 3). В этих условиях обнаружены только два продукта – анизол (АН) и метилфенилкарбонат (МФК). При содержании катализатора 1.5% конверсия фенола и селективность метилирования равны 36.8 и 46.8% соответственно. В присутствии 3% катализатора наблюдается рост конверсии фенола до 64.9% и селективности по анизолу до 83.2%. Это указывает на то, что при наличии большего числа оснόвных центров превращение фенола в целевой продукт анизол протекает интенсивнее. Однако дальнейшее увеличение количества катализатора вызывает снижение конверсии фенола с сохранением высокой селективность образования анизола. Таким образом, оказывается, что некоторая комбинация оснований может привести к высоким каталитическим показателям.
Влияние температуры реакции на каталитические характеристики KCl/CaO
Влияние температуры реакции на процесс метилирования фенола ДМК, катализируемого KCl/CaO, показано в табл. 4. Реакцию осуществляли при Т = 160–220°C, 3%-ном содержании KCl/CaO и молярном отношении фенол : ДМК = = 1 : 2. Поскольку реакция метилирования фенола ДМК является термодинамически невыгодной и эндотермической, для увеличения выхода анизола ее надо проводить при высокой температуре. Способность ДМК к метилированию возрастает с повышением температуры реакции до 200°C. Дальнейший рост температуры реакции не приводит к заметному увеличению каталитической активности. Таким образом, температура 200°C является оптимальной для данной цели [20]. Селективность по анизолу возрастает с повышением температуры реакции; образование анизола значительно ускоряется при Т > 180°C. Результаты согласуются с данными предыдущих исследований [20], которые показали, что высокая температура способствует протеканию O-метилирования фенола.
Влияние температуры прокаливания KCl/CaO на его каталитические характеристики
Влияние температуры прокаливания KCl/CaO на процесс метилирования фенола ДМК показывают данные, приведенные в табл. 5. Реакцию проводили в тех же условиях, что были указаны выше. С целью увеличения активности KCl/CaO температуру прокаливания изменяли от 400 до 800°C. Каталитические характеристики улучшаются с повышением температуры прокаливания от 400 до 500°C: конверсия достигает 100% при 500°C, причем анизол является основным продуктом. Возможные причины зависимости каталитических характеристик KCl/CaO от температуры прокаливания будут подробно обсуждены ниже на основе характеристик образцов, полученных физико-химическими методами.
Таблица 5.
Влияние температуры прокаливания катализатора KCl/CaO на показатели реакции метилирования*
| Температура прокаливания, °C | Конверсия фенола, % | Выход, % | Селективность метилирования, % | |
|---|---|---|---|---|
| АН | МФК | |||
| 400 | 99.7 | 74.9 | 3.8 | 75.2 |
| 500 | 100.0 | 100.0 | 0 | 100.0 |
| 600 | 77.5 | 69.3 | 3.5 | 89.5 |
| 700 | 92.7 | 73.9 | 4.9 | 79.7 |
| 800 | 93.9 | 79.5 | 4.9 | 84.6 |
| 220 | 95.2 | 86.3 | 5.8 | 90.7 |
Характеристики физической адсорбции
Текстурные свойства образца катализатора приведены в табл. 6. Можно видеть, что высокая температура прокаливания способствует значительному уменьшению площади поверхности и размера пор. Наибольшая удельная поверхность (41.23 м2/г) и объем пор (0.21 × 10–2 см3/г) зафиксированы при прокаливании KCl/CaO при 500°C. Эта температура обеспечивает наличие эффективных каналов для быстрой диффузии фенола и ДМК, что позволяет достичь почти 100%-ной конверсии фенола и селективности образования анизола (табл. 5).
Таблица 6.
Влияние температуры прокаливания на структуру пор KCl/CaO
| Катализатор | Удельная поверхность по БЭТ, м2/г | Средний диаметр пор, нм | Объем пор, см3 г–1 × 10–2 |
|---|---|---|---|
| 400°C–KCl/CaO | 29.15 | 26.58 | 0.19 |
| 500°C–KCl/CaO | 41.24 | 20.34 | 0.21 |
| 600°C–KCl/CaO | 33.59 | 11.33 | 0.14 |
| 700°C–KCl/CaO | 12.01 | 8.28 | 0.025 |
| 800°C–KCl/CaO | 8.76 | 10.64 | 0.023 |
| Коммерческий CaO | 37.69 | 6.16 | 0.012 |
Эксперименты по адсорбции–десорбции N2 проводили для получения подробной информации о распределении пор по размерам в KCl/CaO, прокаленном при различных температурах. Из рис. 3 видно, что изотермы адсорбции–десорбции N2 для KCl/CaO, прокаленного при 500°C, явно отличаются от изотерм других образцов. Это свидетельствует о том, что пористость CaO сильно изменяется после модификации. Четкая петля гистерезиса в диапазоне высоких относительных давлений для образца, прокаленного при 500°C, указывает на образование дополнительной мезопористости во время процесса прокаливания, что согласуется с его большим объемом пор [21] (табл. 6). Для образцов, прокаленныx при более высоких температурах, характерна слабая петля гистерезиса в результате разрушения структуры пор. Как предполагалось ранее [22], диаметр пор играет важную роль в реакции метилирования: наилучшие каталитические характеристики были получены при использовании KCl/CaO, прокаленного при 500°C, который имеет самый большой средний диаметр пор.
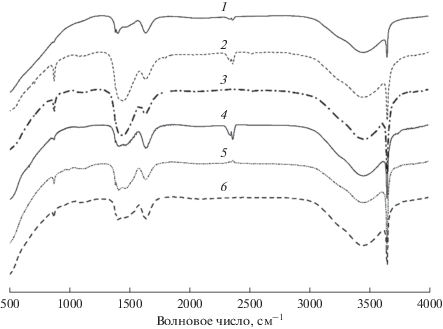
ИК-спектры с Фурье-преобразованием
На рис. 4 представлены ИК-спектры образца KCl/CaO, прокаленного при различных температурах. Во всех спектрах наблюдаются отчетливые полосы поглощения при 1450 и 876 см–1, принадлежащие валентным колебаниям ${\text{CO}}_{3}^{{ - 2}}$. В основном они возникают вследствие хемосорбции CO2 из воздуха. Эти полосы постепенно ослабевают по мере повышения температуры прокаливания. Кроме того, интенсивные пики при 3652 и 3440 см–1 от валентных колебаний поверхностных гидроксильных групп указывают на невозможность избежать коррозии поверхности KCl/CaO при контакте с воздухом в процессе его приготовления [23].
Влияние загрузки KCl на каталитическую эффективность реакции метилирования
В одинаковых условиях реакции измерена активность прокаленных образцов KCl/CaO (500°C, 6 ч) с различным содержанием KCl (табл. 7). Конверсия фенола повышается с 74.9 до 100% при увеличении концентрации KCl с 5 до 15% и немного снижается при его содержании более 15%. Селективность по анизолу имеет ту же тенденцию к изменению, что и конверсия фенола: почти 100%-ная селективность достигается при конверсии фенола 100%. Напротив, селективность по метилфенолу выше при низкой концентрации KCl. Это указывает на то, что малое содержание KCl благоприятно для C-метилирования фенола, в то время как высокое способствует превращению фенола в результате O-метилирования. Полученные данные свидетельствуют о важности KCl для образования анизола. Чтобы дать разумное объяснение влияния содержания KCl на характеристики катализаторов KCl/CaO, были выполнены дополнительные исследования с использованием методов СЭМ, РФА, ТПД CO2 и ИК-спектроскопии с Фурье-преобразованием.
Сканирующая электронная микроскопия (СЭМ)
На рис. 5 показаны снимки СЭМ образцов CaO и KCl/CaO, полученные с помощью сканирующего электронного микроскопа. Видно, что перед нанесением KCl поверхность CaO в основном состоит из сферических агрегатов частиц малого размера. При введении KCl размер частиц постепенно увеличивается, и они начинают выглядеть как относительно диспергированные чешуйчатые частицы. Ранее было показано, что добавление неорганической соли можно использовать для регулирования диаметра пор мезопористых материалов. Оно способно привести к трансформации мезофазы, которая напрямую зависит от концентрации и природы добавленной соли [24].
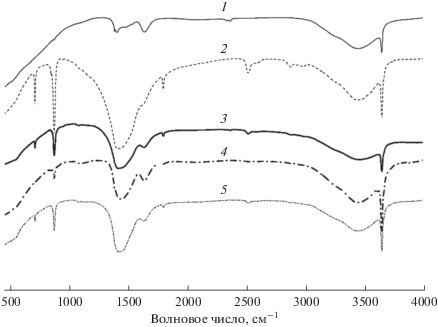
Инфракрасная спектроскопия с преобразованием Фурье (FTIR)
На рис. 6 показаны ИК-спектры образцов KCl/CaO с различным содержанием KCl. Как отмечалось выше, характерные пики валентных колебаний физически адсорбированной воды и СО2 присутствует во всех образцах, что указывает на образование –ОН и ${\text{CO}}_{3}^{{ - 2}}$, в основном, из-за воздействия на катализатор влаги и диоксида углерода, присутствующих в воздухе, при приготовлении и хранении. Интенсивность полос колебаний –OH и ${\text{CO}}_{3}^{{ - 2}}$ в катализаторах, содержащих 10 и 15%KCl, значительно ослаблена по сравнению с немодифицированным CaO. Таким образом, присутствие KCl улучшает стабильность CaO на воздухе, а так же его каталитические свойства в реакции метилирования.
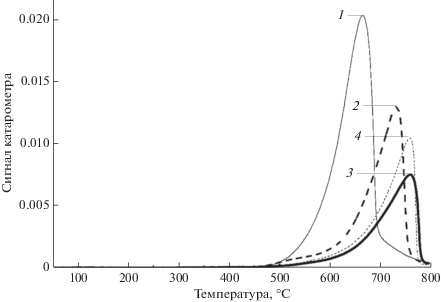
Хемосорбционные характеристики (ТПВ CO2)
Профили температурно-программированной десорбции CO2 для CaO и катализаторов KCl/CaO с различным содержанием KCl были зарегистрированы в диапазоне температур 25–800°C (рис. 7). Следует отметить, что в профилях всех образцов обнаружен только один интенсивный широкий пик десорбции в интервале температур 660–800°C, отнесенный к сильным оснόвным центрам – анионам O2–. Кроме того, пики десорбции для всех образцов KCl/CaO смещаются в сторону более высоких температур по сравнению с пиком десорбции CaO при 664.4°C. Это указывает на то, что включение калия повышает основность катализаторов. Однако избыточное его количество приводит к покрытию щелочных центров на поверхности СаО, и небольшому количеству оснόвных центров соответствует небольшая площадь десорбционного пика. Таким образом, показана взаимосвязь между оснόвными свойствами образцов и их каталитической активностью в реакции метилирования, катализируемой основанием.
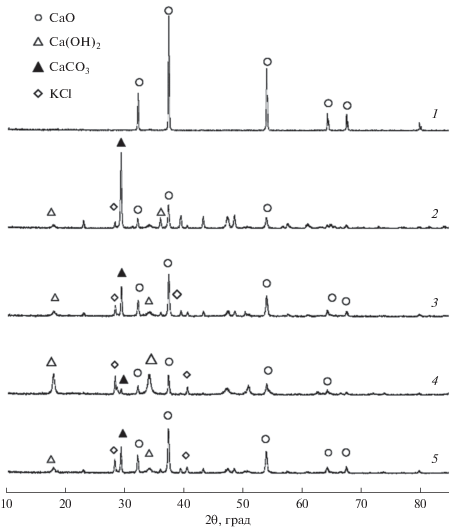
Рентгеноструктурный анализ (РФА)
Рентгенограммы образцов CaO, модифицированных различными количествами KCl, представлены на рис. 8. Видно, что добавление KCl ослабляет дифракционный пик CaO, но интенсивность дифракционных пиков CaCO3 и Ca(OH)2 увеличивается при возрастании содержания KCl. Как было показано выше, характерные дифракционные пики Ca(OH)2, наблюдаемые для всех образцов KCl/CaO, свидетельствуют о неизбежности гидратации поверхности частиц CaO. Для CaO, модифицированного 15%KCl, интенсивность дифракционного пика CaO достигает максимального значения. Это говорит о более высокой дисперсности частиц CaO и согласуется с данными об их однородной морфологии, полученными методом сканирующей электронной микроскопии.
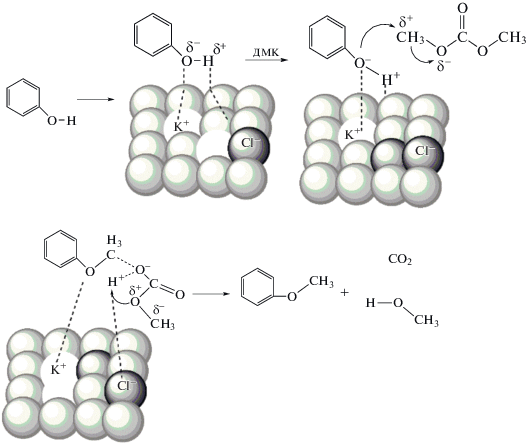
Возможный механизм метилирования фенола ДМК
Возможный механизм реакции метилирования фенола ДМК показан на рис. 9. Предполагается, что сначала фенол активируется катализатором KCl/CaO до фенольной соли (PhO.A). Анион кислорода фенольной соли является сильным нуклеофильным реагентом, реакция нуклеофильного замещения осуществляется фенокси-анионами фенольных солей, которые атакуют метильный углерод ДМК и затем образуют шестичленное кольцо, которое перегруппировывается в анизол и метилкарбонат. Далее метилкарбонат разлагается на диоксид углерода и метанол, что затрудняет реакцию и занимает много времени [25].
ЗАКЛЮЧЕНИЕ
Приготовлена серия катализаторов на основе хлоридов щелочных металлов, нанесенных на СаО, которые показали превосходную каталитическую активность и селективность в реакции метилирования фенола ДМК. Среди исследованных образцов наибольший выход анизола получен на катализаторе 15%KCl/CaO. Обнаружено, что конверсия фенола и селективность образования анизола повышается с увеличением содержания KCl и количества сильных оснόвных центров. При проведении реакции в присутствии 15%KCl/CaO при молярном соотношении фенол : ДМК = 1 : 2, Т = 473 К (200°C) в течение 8 ч конверсия фенола достигала 100% при 100%-ной селективности по анизолу. Кроме того, мезопористая структура способствовала росту селективности образования анизола за счет более благоприятных условий для протекания реакции O-метилирования. Таким образом, типичные экологически опасные гомогенные катализаторы, такие как щелочные растворы, могут быть заменены катализатором KCl/CaO, что может значительно усовершенствовать промышленный процесс получения анизола из фенола.
Список литературы
Perego C., Ingallina P. // Green Chem. 2004. V. 56. P. 247.
Vijayaraj M., Gopinath C.S. // Appl. Catal. A: Gen. 2007. V. 320. P. 64.
Byun E., Hong B., de Castro K.A., Lim M., Rhee H. // J. Org. Chem. 2007. V. 72. P. 9815.
Oae S., Kiritani R.B. // Bull. Chem. Soc. Jpn. 1966. V. 39. P. 611.
Santacesaria E., Grasso D., Gelosa D., Carra S. // Appl. Catal. A: Gen. 1990. V. 64. P. 83.
Pochet S., Su S., Doepper R., Renken A. // Chem. Eng. Technol. 1994. V. 17. P. 108.
Pochet S., Minsker L.K., Doepper R., Renken A. // Chem. Eng. Sci. 1996. V. 51. P. 2933.
Bautista F.M., Campelo J.M., Garcia A., Luna D., Marinas J.M., Romero A.A., Urbano M.R. // Catal. Lett. 1997. V. 62. P. 47.
Samolada M.C., Grigoriadou E., Kiparissides Z., Vasalos I.A. // J. Catal. 1995. V. 152. P. 52.
Lee S.C., Lee S.W., Kim K.S., Lee T.J., Kim D.H., Chang Kim J. // Catal. Today. 1998. V. 44. P. 253.
Bal R., Chaudhari K., Sivasanker S. // Catal. Lett. 2000. V. 70. P. 75.
Изотов А.И., Килман Г.В., Шалаев Р.В. // Физ. химия. 2019. Т. 13. С. (Izotov A.I., Kilman G.V., Shalayev R.V. // Russ. J. Phys. Chem. B. 2019. V. 13. P. 1169.)
Yan H.D., Zeng L.F., Xie Y.Q., Cui Y., Ye L., Tu S. // Rev. Chem. Intermed. 2016. V. 42. P. 5951.
Aricò F., Tundo P. // Russ. Chem. Rev. 2010. V. 79. P. 479.
Ouk S., Thiebaud S., Borredon E., Le Gars P. // Appl. Catal. A: Gen. 2003. V. 241. P. 227.
Mareev E.I., Aleshkevich V.A., Potemkin F.V., Minaev N.V., Gordienko V.M. // Russ. J. Phys. Chem. B. 2019. V. 13. P. 1214.
Xiao Z.L., Yang H., Zhang H., Chen T., Wang G.G. // Chem. Papers. 2018. V. 72. P. 2347.
Kosyakov D.S., Ul’yanovskii N.V., Ivakhnov A.D., Pikovskoi I.I. // Russ. J. Phys. Chem. B. 2019. V. 13. P. 1103.
Pan D.H., Dian-Chu L.I., Jing-Hong M.A. // Act. Petro. Sinica. 2005. V. 8031. P. 256.
Fedyaeva O.N., Vostrikov A.A. // Russ. J. Phys. Chem. B. 2019. V. 13. P. 1071.
Petrov L.V., Solyanikov V.M. // Russ. J. Phys. Chem. B. 2020. V. 14. P. 29.
Balasubramanian V.V., Pandurangan A., Palanichamy M., Murugesan V. // Indian. Chem. Tech. 2000. V. 7. P. 149.
Chen B., Zhao N., Wei W. // Pet. Calt. 2009. V. 38. P. 897.
Maleki H., Kazemeini M. // J. Fuel Chem. Tech. 2017. V. 45. P. 442.
Chen B., Zhao N., Wei W., et al. // J. Fuel Chem.Tech. 2011. V. 39. P. 144.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ