Кинетика и катализ, 2021, T. 62, № 4, стр. 459-465
Восстановительное аминирование 5-гидроксиметилфурфурола посредствам гидрирования промежуточных иминов на катализаторе Pt/Al2O3 в проточном реакторе
А. Л. Нуждин a, *, П. А. Симонов a, В. И. Бухтияров a
a ФБГУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: anuzhdin@catalysis.ru
Поступила в редакцию 17.02.2021
После доработки 27.03.2021
Принята к публикации 20.04.2021
Аннотация
Изучены каталитические свойства нанесенного на γ-оксид алюминия платинового катализатора в реакции гидрирования иминов, образующихся в результате конденсации 5-гидроксиметилфурфурола (ГМФ) с первичными аминами в метаноле. Реакцию проводили в проточном реакторе при давлении водорода 5 бар и температуре 15–65°C. Установлено, что восстановительное аминирование ГМФ н-гексиламином, анилином, орто-, мета- и пара-толуидинами, а также производными анилина, содержащими F-, Cl-, Br- и I-заместители в пара- или мета-положениях, приводит к образованию N-замещенных 5-гидроксиметил-2-фурфурил аминов с высоким выходом (90–99%). В тоже время при взаимодействии ГМФ с ароматическими аминами, обладающими слабыми нуклеофильными свойствами (о-хлоранилин, п-аминоацетофенон), выход целевого продукта не превышает 52%.
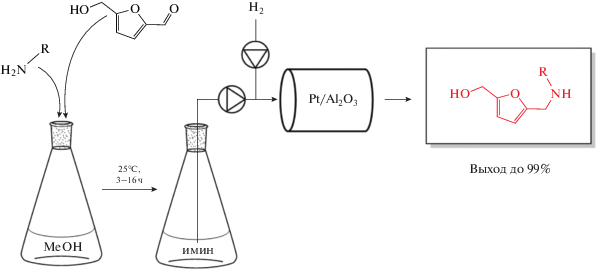
ВВЕДЕНИЕ
N-замещенные 5-гидроксиметил-2-фурфурил амины представляют собой важный класс соединений, обладающих фармацевтической активностью [1–3]. Как правило, их получают при взаимодействии фурфурилового спирта (или фурфурола) с формальдегидом и первичными аминами. Однако для осуществления реакции требуется длительное поддержание жестких условий (высокой температуры и давления), что приводит к низкому выходу целевого продукта [4–6]. Между тем, восстановительное аминирование 5-гидроксиметилфурфурола (ГМФ), который образуется из легкодоступной несъедобной лигноцеллюлозной биомассы, является привлекательным методом синтеза производных аминометилгидроксиметилфурана (АМГМФ) [2, 3, 7–10].
В ряде недавних исследований продемонстрирована возможность получения производных АМГМФ путем восстановительного аминирования ГМФ с использованием молекулярного водорода в присутствии комплекса дихлор-бис(2,9-диметил-1,10-фенантролин) рутений(II) [7], Fe–Ni-катализатора на углеродной подложке [8], Pd/C [9] и наночастиц Pd, нанесенных на композитный материал на основе пористого координационного полимера [10]. Кроме того, было реализовано восстановительное аминирование ГМФ с применением восстановительной системы CO/H2O на катализаторе Au/TiO2 [2], а также стехиометрических количеств NaBH4 в отсутствие катализатора [3].
Реакция восстановительного аминирования альдегидов (кетонов) первичными аминами включает в себя обратимую конденсацию карбонильного соединения с амином с образованием имина и восстановление последнего до вторичного амина. Одновременно с этим может происходить побочная реакция восстановления карбонильной группы. Поэтому при проведении восстановительного аминирования в одну стадию (прямое восстановительное аминирование) карбонильное соединение частично восстанавливается в соответствующий спирт, что снижает выход целевого продукта [11–13]. Этот недостаток может быть в значительной мере преодолен проведением синтеза в 2 этапа: через образование имина в отсутствие восстановителя на первой стадии и восстановление имина водородом – на второй [14].
В нашей предыдущей работе была разработана экологически безопасная двухстадийная процедура синтеза производных АМГМФ, которая включала некаталитическую конденсацию ГМФ (или его ацетильного производного) с первичными аминами в метаноле при комнатной температуре и последующее гидрирование образующихся иминов в проточном реакторе на гетерогенном Cu-содержащем катализаторе (CuAlOx), приготовленном на основе Cu–Al двойного слоистого гидроксида [15]. Данный процесс не требует выделения и очистки промежуточных иминов и позволяет получать различные вторичные амины с высоким выходом. Однако в случае первичных аминов, содержащих электроноакцепторные заместители (о-хлоранилин, п-броманилин), выход целевых продуктов был низок, а при использовании п-йоданилина гидрирование имина и вовсе не происходило.
В настоящей работе мы исследовали эффективность вышеуказанного подхода для восстановительного аминирования ГМФ первичными аминами различного строения на Pt- и Pd-катализаторах, нанесенных на γ-оксид алюминия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и материалы
Анилин (99.8%), н-гексиламин (99%), o-толуидин (99%), м-толуидин (99%), п-толуидин (99%), o-хлоранилин (>98%), м-хлоранилин (99%), п-хлоранилин (98%), п-фторанилин (98%), п-броманилин (>99%), п-йоданилин (>99%), п-аминоацетофенон (99%) – все “Acros Organics” (Бельгия) – и 5-гидроксиметилфурфурол (99%, “Sigma-Aldrich”, США) использовались без дополнительной очистки. Метанол (99.8%, “J.T. Baker”, США) применялся в качестве растворителя.
γ-Оксид алюминия (площадь удельной поверхности – 162 м2/г, объем пор – 0.69 см3/г, средний диаметр пор – 18.6 нм) получали экструзией пасты, состоящей из оксида алюминия (Puralox TH 100/150, “Sasol”, ЮАР) и метагидроксида алюминия (Disperal 20, “Sasol”) в соотношении 30 : 70 по массе, с последующей сушкой и прокаливанием при 550°C [16]. Приготовленные гранулы носителя осторожно раздавливали и рассевом отделяли рабочую фракцию 0.25–0.50 мм, которую дополнительно обеспыливали декантацией горячей водой, а затем сушили при 110°С.
Раствор H2PdCl4, полученный по реакции PdCl2 (ч., 59.9 мас. % Pd, “Реахим”, Россия) с HCl (ос. ч., “ЭКОС-1”, Россия), K2PtCl4 (98%, “Sigma-Aldrich”) и NaHCO3 (х. ч., “Реахим”) использовали для приготовления катализаторов.
Приготовление катализаторов
Катализаторы 1%Pt/Al2O3 и 1%Pd/Al2O3 были приготовлены гидролизом K2PtCl4 и H2PdCl4 соответственно. Для этого раствор K2PtCl4 (или H2PdCl4) с требуемым количеством металла добавляли по каплям в течение 10–15 мин к интенсивно взбалтываемой суспензии 2.5 г γ-Al2O3 в водном растворе NaHCO3 при температуре 90°C (для Pt) и 5°C (для Pd), при этом достигалось атомное отношение Na/Pt = 14 (или Na/Pd = 16). Суспензию перемешивали еще в течение 15 мин и затем кипятили 10 мин. Полноту осаждения металла контролировали по реакции NaBH4 с 0.5–1 мл отфильтрованного рассола. Образцы промывали декантацией горячей водой, сушили на воздухе при 80°C в течение ночи. С целью восстановления образец помещали в трубчатый реактор и сначала прокаливали в токе азота при 100, 120, 150 и 200°C, выдерживая при каждой температуре по 10 мин, а затем нагревали 30 мин в токе водорода при 200°C. Реактор охлаждали, и продували азотом, катализатор пассивировали многократным введением небольших количеств воздуха в поток азота [17].
Физико-химические свойства катализаторов
Химический анализ на содержание платины и палладия осуществляли методом атомно-абсорбционной спектрометрии на спектрометре Optima 4300 DV (“Perkin Elmer”, США). Исследование образцов методом просвечивающей электронной микроскопии высокого разрешения (ПЭМ-ВР) проводили на электронном микроскопе JEM-2010 (“JEOL”, Япония) с разрешением по решетке 0.14 нм при ускоряющем напряжении 200 кВ. Средние диаметры частиц рассчитывали из результатов измерения диаметров не менее 250 частиц на ПЭМ-снимках, сделанных со средним увеличением.
Каталитические свойства
Реакционные смеси, образующиеся при конденсации ГМФ (0.05 М) с первичными аминами (0.05 М) в метаноле при комнатной температуре в течение 3–16 ч, были подвергнуты гидрированию в проточной установке H-cube Pro (“Thalesnano”, Венгрия), оборудованной реакторами из нержавеющей стали CatCart®30 (толщина каталитического слоя 24 мм, внутренний диаметр 4 мм) [14–17]. До начала реакции катализатор (185 мг) восстанавливали в токе водородом при температуре 70°C в течение 15 мин [17]. После восстановления катализатора и установления заданной температуры и давления в реактор вводили реакционную смесь. Реакцию проводили при 15–65°C, давлении 5 бар и скоростях потоков реакционной смеси и водорода 0.5 и 30 мл/мин соответственно. Пробы отбирали через 30–32 мин после подачи реакционной смеси, удаляли растворитель в токе воздуха и определяли состав продуктов реакции на частоте 500.03 МГц, используя ЯМР-спектрометр Bruker Avance III 500 (“Bruker”, США) и дейтерохлороформ (99.8% D, “Aldrich”) в качестве растворителя. Химические сдвиги фиксировали относительно сигнала растворителя (δ = 7.26 м. д. для остаточных протонов хлороформа). Продукты реакции идентифицировали с использованием ранее опубликованных спектров [15]. Примеры спектров 1H ЯМР конечных реакционных смесей представлены в Приложении.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
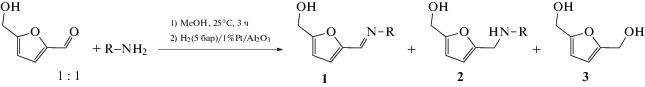
Для осуществления восстановительного аминирования ГМФ в качестве растворителя нами был использован метанол, который широко применяется в реакциях данного класса [3, 13–15, 17]. Конденсация ГМФ с анилином протекает в метаноле при комнатной температуре с 98% выходом соответствующего имина в течение 3 ч [15, 17]. Полученный имин 1a далее восстанавливали молекулярным водородом в проточном реакторе на катализаторах Me/Al2O3 (Me = Pt, Pd), содержащих 1% активного компонента. ПЭМ-исследование образца 1%Pt/Al2O3 показало, что этот катализатор содержит наночастицы размером около 1 нм. Средний размер частиц в образце 1%Pd/Al2O3 составлял 1.9 нм (рис. 1).
Установлено, что гидрирование 1a на катализаторе 1%Pt/Al2O3 при температуре 35–45°C и давлении водорода 5 бар приводит к образованию производного АМГМФ 2a с ~98% выходом (табл. 1, строки 1 и 2). В дополнение к соединениям 1a и 2a, среди продуктов реакции был обнаружен 2,5-бис(гидроксиметил)фуран 3. Катализатор 1%Pd/Al2O3 продемонстрировал несколько более низкую активность в гидрировании имина, чем 1%Pt/Al2O3. Так, выход 2a в присутствие 1%Pd/Al2O3 составил 94 и 96% при 35 и 45°C соответственно (табл. 1, строки 3 и 4). Таким образом, катализатор 1%Pt/Al2O3 позволяет получить соединение 2a с более высоким выходом, чем 1%Pd/Al2O3 при одних и тех же условиях реакции, поэтому данный образец использовали в дальнейшем для восстановительного аминитрования ГМФ первичными аминами различного строения.
Таблица 1.
Двухстадийное восстановительное аминирование ГМФ первичными аминами с использованием катализатора 1%Pt/Al2O3
 |
||||||||
|---|---|---|---|---|---|---|---|---|
| № | R | T, °C | 2 | Конверсия, % | Выход, % | |||
| 1 | 2 | 3 | прочие | |||||
| 1 | Ph | 35 | 2a | 100 | 1 | 98 | 1 | −* |
| 2 | Ph | 45 | 2a | 100 | <1 | >98 | 1 | −* |
| 3** | Ph | 35 | 2a | 98 | 5.5 | 94 | <0.5 | −* |
| 4** | Ph | 45 | 2a | 99 | 2 | 96 | 1 | −* |
| 5 | n-CH3C6H4 | 45 | 2b | 100 | <0.5 | 99 | <1 | −* |
| 6 | м-CH3C6H4 | 45 | 2с | 100 | 1 | 98 | 1 | −* |
| 7*** | о-CH3C6H4 | 45 | 2d | >99.5 | 1.5 | 95 | 2 | 1 |
| 8*** | о-CH3C6H4 | 55 | 2d | 100 | <1 | 96 | 2 | 1 |
| 9 | п-FC6H4 | 55 | 2e | 100 | 1 | 96 | 3 | −* |
| 10 | n-ClC6H4 | 55 | 2f | 100 | 2 | 96 | 2 | −* |
| 11 | п-BrC6H4 | 45 | 2g | 99 | 5.5 | 88 | 3 | 2.5**** |
| 12 | п-BrC6H4 | 55 | 2g | 100 | 3 | 90 | 4 | 3**** |
| 13 | п-IC6H4 | 35 | 2h | >99.5 | 3 | 79 | 8 | 10**** |
| 14 | п-IC6H4 | 25 | 2h | 99.5 | 4 | 86 | 4 | 5**** |
| 15 | п-IC6H4 | 15 | 2h | 99 | 6 | 90 | 2 | 1**** |
| 16*** | п-CH3C(O)C6H4 | 55 | 2i | 69 | 12 | 44 | 11 | 2 |
| 17*** | м-ClC6H4 | 55 | 2j | 100 | 3 | 94 | 3 | −* |
| 18*** | o-ClC6H4 | 55 | 2k | 73 | 6 | 52 | 13 | 2 |
| 19 | н-Гексил | 55 | 2l | >99.5 | 2 | 98 | 0 | <0.5 |
| 20 | н-Гексил | 65 | 2l | 100 | <1 | 99 | 0 | 0.5 |
Аналогично анилину, пара- и мета-толуидины реагируют с ГМФ с образованием соединений 2b и 2c с выходом 98−99% (табл. 1, строки 5 и 6). Скорость образования имина при конденсации ГМФ с о-толуидином намного меньше, чем в реакции с анилином, что объясняется стерическими затруднениями, создаваемыми метильной группой в орто-положение [14, 15, 17]. Поэтому для получения производного АМГМФ с высоким выходом конденсацию ГМФ с о-толуидином проводили в течение 16 ч. В результате гидрирования образовавшегося имина 1d на катализаторе 1%Pt/Al2O3 было синтезировано соединения 2d с выходом 95−96% (табл. 1, строки 7 и 8).
Введение электроноакцепторных заместителей (F, Cl, Br, I, C(O)CH3) в пара-положение анилина снижает выход соединений 2 (табл. 1, строки 9−16) из-за более слабых нуклеофильных свойств соответствующих ароматических аминов в сравнении с анилином, что приводит к меньшему выходу иминов на первой стадии [14]. Нуклеофильность падает в следующем ряду: п-фторанилин > п-хлоранилин > п-броманилин ~ п-иоданилин $ \gg $ п-аминоацетофенон вследствие различных индуктивных и мезомерных эффектов заместителей. Выход целевого продукта снижается в том же порядке: F (2e, 96%) ~ Cl (2f, 96%) > Br (2g, 90%) ~ ~ I (2h, 90%) $ \gg $ C(O)CH3 (2i, 44%).
При взаимодействии ГМФ с п-броманилином помимо продуктов 1g и 2g зафиксировано образование соединения 2a, однако его количество не превышало 2−3% (табл. 1, строки 11 и 12), что указывает на медленное протекание реакции гидродебромирования в условиях эксперимента. В случаe п-йоданилина выход целевого продукта 2h при 35°C составил 79% (табл. 1, строка 13), при этом отмечалось присутствие в значительном количестве продукта гидродегалогенирования (~10%). Снижение температуры реакции до 25 и 15°C позволило заметно замедлить скорость гидрирования связи C−I и синтезировать 2h с выходом 86 и 90% соответственно (табл. 1, строки 14 и 15).
Положение электроноакцепторного заместителя в ароматическом амине оказывает большое влияние на протекание реакции (табл. 1, строки 10, 17 и 18). Выход производных АМГМФ при взаимодействии ГМФ с изомерами хлоранилина уменьшается в следующем ряду: п-хлоранилин (2f, 96%) > м-хлоранилин (2j, 94%) $ \gg $ o-хлоранилин (2k, 52%), что объясняется снижением нуклеофильных свойств аминов в этом ряду [15, 17]. Таким образом, выход производных АМГМФ, вероятно, определяется выходом имина на первой стадии: увеличение выхода промежуточного имина приводит к росту выхода соответствующего целевого продукта 2 [14].
Кроме того, использование н-гексиламина в качестве реагента ведет к образованию соединения 2l c выходом, достигающим 99% (табл. 1, строки 19 и 20), что заметно превышает выход этого производного АМГМФ в присутствии катализатора CuAlOx [15]. Изучение зависимости выхода целевого продукта 2l от времени при температуре 65°C показало, что он оставался неизменным (99%) в течение 3 ч. Таким образом, катализатор 1%Pt/Al2O3 демонстрирует хорошую стабильность в ходе реакции.
ЗАКЛЮЧЕНИЕ
В настоящей работе осуществлен синтез серии производных аминометилгидроксиметилфурана (АМГМФ) по реакции двухстадийного восстановительного аминирования 5-гидроксиметилфурфурола первичными аминами. Имины, образующиеся при некаталитической конденсации ГМФ с аминами в метаноле при комнатной температуре, затем были восстановлены молекулярным водородом в проточном реакторе в присутствии нанесенных катализаторов 1%Pt/Al2O3 и 1%Pd/Al2O3, при этом 1%Pt/Al2O3 показал более высокую активность в гидрировании С=N-связи.
С использованием катализатора 1%Pt/Al2O3 были получены различные N-замещенные 5-(гидроксиметил)-2-фурфурил амины. Установлено, что двухстадийное восстановительное аминирование ГМФ н-гексиламином, анилином, орто-, мета- и пара-толуидинами, а также производными анилина, содержащими F, Cl, Br и I заместители в пара- или мета-положении, приводит к образованию целевого продукта с высоким выходом (90–99%). При взаимодействии ГМФ с ароматическими аминами, обладающими слабыми нуклеофильными свойствами (о-хлоранилин, п-аминоацетофенон), выход производного АМГМФ не превышает 52%. В отличие от смешанного оксида CuAlOx, катализатор 1%Pt/Al2O3 обеспечивает высокий выход N-замещенных 5-(гидроксиметил)-2-фурфурил аминов в реакции ГМФ с п-броманилином и п-йоданилином. Кроме того, восстановительное аминирование ГМФ о-толуидоном и н-гексиламином происходит с 96 и 99% выходом целевого продукта, что заметно превышает ранее полученные показатели с использованием CuAlOx в качестве катализатора.
Список литературы
Feriani A., Gaviraghi G., Toson G., Mor M., Barbieri A., Grana E., Boselli C., Guarneri M., Simoni D., Manfredini S. // J. Med. Chem. 1994. V. 37. P. 4278.
Zhu M.-M., Tao L., Zhang Q., Dong J., Liu Y.-M., He H.-Y., Cao Y. // Green Chem. 2017. V. 19. P. 3880.
Cukalovic A., Stevens C.V. // Green Chem. 2010. V. 12. P. 1201.
Li X., Xu R., Yang J., Nie S., Liu D., Liu Y., Si C. // Ind. Crops. Prod. 2019. V. 130. P. 184.
Hu L., Lin L., Wu Z., Zhou S., Liu S. // Renew. Sust. Energ. Rev. 2017. V. 74. P. 230.
Froidevaux V., Negrell C., Caillol S., Pascault J.-P., Boutevin B. // Chem. Rev. 2016. V. 116. P. 14181.
Xu Z., Yan P., Xu W., Jia S., Xia Z., Chung B., Zhang Z.C. // RSC Adv. 2014. V. 4. P. 59083.
Chieffi G., Braun M., Esposito D. // ChemSusChem. 2015. V. 8. P. 3590.
García-Ortiz A., Vidal J.D., Climent M.J., Concepción P., Corma A., Iborra S. // ACS Sustain. Chem. Eng. 2019. V. 7. P. 6243.
Karve V.V., Sun D.T., Trukhina O., Yang S., Oveisi E., Luterbacher J., Queen W.L. // Green Chem. 2020. V. 22. P. 368.
Exposito A.J., Bai Y., Tchabanenko K., Rebrov E.V., Cherkasov N. // Ind. Eng. Chem. Res. 2019. V. 58. P. 4433.
Gomez S., Peters J.A., Maschmeyer T. // Adv. Synth. Catal. 2002. V. 344. P. 1037.
Hizartzidis L., Cossar P.J., Robertson M.J., Simone M.I., Young K.A., McCluskey A., Gordon C.P. // RSC Adv. 2014. V. 4. P. 56743.
Nuzhdin A.L., Bukhtiyarova M.V., Bukhtiyarova G.A. // J. Chem. Technol. Biotechnol. 2020. V. 95. P. 3292.
Nuzhdin A.L., Bukhtiyarova M.V., Bukhtiyarov V.I. // Molecules. 2020. V. 25. № 4771.
Артюха Е.А., Нуждин А.Л., Бухтиярова Г.А., Деревянникова Е.А., Герасимов Е.Ю., Гладкий А.Ю., Бухтияров В.И. // Кинетика и катализ. 2018. Т. 59. С. 583. (Artyukha E.A., Nuzhdin A.L., Bukhtiyarova G.A., Derevyannikova E.A., Gerasimov E.Yu., Gladkii A.Yu., Bukhtiyarov V.I. // Kinet. Catal. 2018. V. 59. P. 593.)
Nuzhdin A.L., Simonov P.A., Bukhtiyarova G.A., Eltsov I.V., Bukhtiyarov V.I. // Mol. Catal. 2021. V. 499. № 111297.
Дополнительные материалы
- скачать ESM.docx
- 1H ЯМР спектры конечных реакционных смесей
Инструменты
Кинетика и катализ



