Кинетика и катализ, 2021, T. 62, № 5, стр. 591-601
Высокоселективный катализатор гидрирования нитробензола на основе интерметаллических частиц Rh1In1
А. В. Рассолов a, Г. А. Иванов a, Г. О. Брагина a, Г. Н. Баева a, Н. С. Смирнова a, А. В. Казаков a, Н. Я. Усачев a, А. Ю. Стахеев a, *
a ФГБУН Институт органической химии им. Н.Д. Зелинского РАН
119991 Москва, Ленинский просп., 47, Россия
* E-mail: st@ioc.ac.ru
Поступила в редакцию 01.04.2021
После доработки 18.05.2021
Принята к публикации 19.05.2021
Аннотация
Каталитические характеристики биметаллического RhIn/SiO2 катализатора изучены в жидкофазном гидрировании нитробензола (НБ). Образование интерметаллических Rh1In1 наночастиц установлено методом рентгенофазового анализа и подтверждено данными просвечивающей электронной микроскопии (ПЭМ) и ИК-спектроскопии адсорбированного СО. Показано, что в сравнении с монометаллическим Rh/SiO2 реакция гидрирования НБ на RhIn катализаторе протекает c более высокой скоростью и более высокой селективностью. На интерметаллическом образце, в отличие от монометаллического, практически не происходит образования побочных продуктов, а также не протекает реакций гидрирования бензольного кольца. Предполагается, что более высокая селективность RhIn/SiO2 может быть связана как с изменением электронного состояния атомов Rh, так и с геометрией активного центра.
Графический реферат
ВВЕДЕНИЕ
Каталитическое гидрирование нитробензола (НБ) является важным химико-технологическим процессом получения анилина, используемого в качестве полупродукта в синтезе полиуретанов, резины, фармацевтических препаратов, пестицидов и гербицидов [1].
Суммарно, реакцию этого процесса можно представить как:
Промышленное гидрирование нитробензола осуществляется как в газовой, так и в жидкой фазах. Процесс газофазного гидрирования нитробензола обычно ведут с использованием Ni- или Cu-содержащих катализаторов при парциальном давлении водорода 1–5 атм и температуре 250–300°С [2, 3]. Жидкофазное гидрирование нитробензола проводят в присутствии Pt-, Pd-, Ni-содержащих катализаторов при температуре 50–100°С и давлении 10–50 атм как в среде различных растворителей, так и в их отсутствии [4], а также как на нанесенных, так и на ненанесенных [5, 6] катализаторах. Селективность по целевому продукту обычно составляет 75–95%, и повышение этого показателя для каталитических систем, используемых в вышеуказанном процессе, является весьма актуальной задачей.
В последние годы все больше работ посвящается изучению катализаторов на основе родия, благодаря их высокой активности и селективности в реакциях гидрирования нитробензола и его производных. Так, в работах [7–9] были изучены характеристики катализатора Rh/SiO2 с разной массовой долей активного металла, а также различным размером наночастиц и пористостью носителя в гидрировании 4-нитроацетофенона, а в работе [10] было исследовано влияние носителя на свойства Rh-катализатора в гидрировании динитробензола.
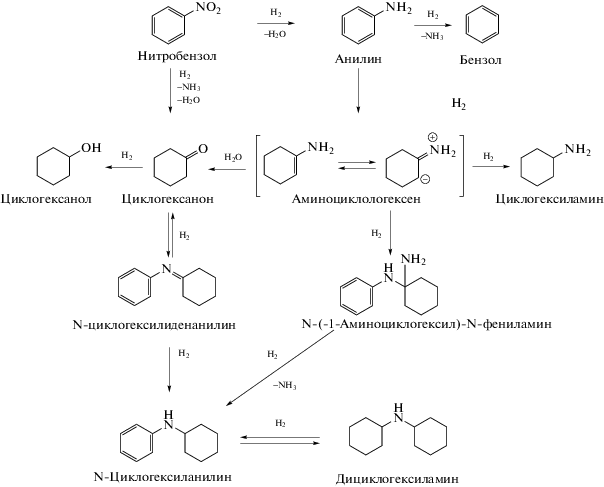
Однако проблема повышения селективности катализаторов до сих пор не решена окончательно, поскольку проведение гидрирования нитробензола на большинстве используемых в настоящее время катализаторов приводит не только к восстановлению нитрогруппы, но и к протеканию ряда побочных процессов, связанных с дальнейшим восстановлением продуктов реакции. В результате этих реакций могут образовываться как продукты гидрирования ароматического кольца или аминогруппы, например: циклогексиламин, циклогексанон, циклогексанол, бензол, так и вторичные амины, такие как дициклогексиламин или N-циклогексиланилин [11].
Перспективным способом увеличения селективности катализаторов является применение интерметаллических композиций [12, 13]. Например, в исследовании [14] рассмотрен широкий спектр интерметаллических катализаторов, обладающих высокой селективностью и активностью в гидрировании ряда производных нитробензола. Такие структуры позволяют достичь значительно большей селективности в образовании аминосоединений в сравнении с монометаллическими аналогами.
Весьма перспективным представляется катализатор на основе интерметаллида RhIn. В работе [15] была продемонстрирована его высокая селективность в гидрировании нитрогруппы до аминогруппы в нитростироле.
Тем не менее, практически отсутствуют исследования, посвященные изучению свойств интерметаллических катализаторов на основе родия в реакциях восстановления незамещенного нитробензола. Поэтому в настоящей работе мы изучили каталитические характеристики родий-индиевого интерметаллида с атомным соотношением металлов 1 : 1, нанесенного на оксид кремния, в реакции восстановления незамещенного нитробензола молекулярным водородом. В качестве катализатора сравнения был использован монометаллический Rh/SiO2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализаторов
Катализаторы RhIn/SiO2(С-80) готовили методом совместной пропитки по влагоемкости. Носитель SiO2 (Силохром С-80, удельная площадь поверхности SBET = 70–100 м2/г), предварительно прокаленный в токе воздуха при 550°С, был пропитан раствором, содержащим смесь нитратов родия и индия и высушен на воздухе при комнатной температуре. Полученные образцы восстанавливали в токе 5% H2/Ar (“Линде Газ Рус”) при 550°С в течение 2 ч (скорость подъема температуры от комнатной до 550°С – 4°С/мин), после чего охлаждали в токе 5% H2/Ar до 200°С, затем в токе N2 (чистота 5.0) (“Линде Газ Рус”) до 20°С. Массовое содержание металлов в полученном катализаторе составило: 3% Rh, 3.35% In. В качестве образца сравнения был использован монометаллический 3% Rh/SiO2(С-80), приготовленный по аналогичной методике. Высокое содержание активного компонента в катализаторах было обусловлено необходимостью проведения физико-химического анализа.
Просвечивающая электронная микроскопия (ПЭМ)
Микроструктуру образцов изучали методом просвечивающей электронной микроскопии (ПЭМ) на приборе HT7700 (“Hitachi”, Япония). Съемку изображений вели в режиме регистрации прошедших электронов (режим светлого поля) при ускоряющем напряжении 100 кВ. Для проведения исследования порошкообразные образцы диспергировали из суспензии в изопропаноле на медные сетки, покрытые слоем углерода (d = 3 мм). Микроскопические измерения оптимизировали в рамках описанной ранее методологии [16]. Средний диаметр металлических частиц и их распределение по размерам определяли на основе измерения 150–180 частиц на микрофотографиях различных участков образцов.
Рентгенофазовый анализ (РФА)
Дифрактограммы синтезированных катализаторов и исходного носителя получены на дифрактометре ДРОН-4 (Россия) в Брегг-Брентано геометрии, с использованием излучения СuKα (Ni-фильтр), в диапазоне углов 15°–95° (2θ) с шагом 0.02° (2θ) и выдержкой в точке 1 с. Кристаллографические параметры рассчитаны с помощью компьютерной программы Rietan-FT [17], реализующей метод Ритвельда. Индексацию спектров проводили с использованием базы данных PDF-4 2018.
ИК-спектроскопия адсорбированного СО
ИК-спектры диффузного отражения адсорбированного СО регистрировали на ИК-спектрометре Tensor 27 (“Bruker”, Германия), снабженном приставкой диффузного отражения (“Harrick Scientific Products, Inc.”, Великобритания) и MCT-детектором (mercury cadmium telluride). Измельченную навеску образца (20 мг) помещали на металлическую чашку термостатируемой ячейки со стеклами из CaF2, после чего ячейку продували током аргона (30 мл/мин). Далее катализатор восстанавливали в токе 5% H2/Ar (30 мл/мин) при 500°С в течение 1 ч, после чего охлаждали до 200°С. Дальнейшее охлаждение до 50°С проводили в токе Ar. По достижении требуемой температуры осуществляли регистрацию фонового спектра, затем в ячейку подавали 0.5% СО/Не (30 мл/мин) и записывали спектр адсорбированного СО (250 сканов, разрешение – 4 см–1).
Жидкофазное гидрирование нитробензола
Для исследования каталитических свойств катализаторов были использованы следующие реактивы: нитробензол (99% чистоты, “Sigma-Aldrich”); н-гексан (98%, “Merck”); газы и газовые смеси производства “Линде Газ Рус” (Балашиха, Россия).
Реакцию жидкофазного гидрирования проводили в реакторе автоклавного типа при температуре 25°С, начальном давлении водорода 10 бар и при постоянном перемешивании (1000 об/с). В реактор помещали навеску катализатора 10 мг, 9 мл растворителя (н-гексан) и 1 ммоль субстрата, после чего реактор загружали в автоклав и подключали к блоку дозирования газов и электронному датчику давления для контроля степени поглощения водорода.
Продукты реакции анализировали методами хромато-масс-спектрометрии на приборе Маэстро-2 (“Интерлаб”, Россия) и газожидкостной хроматографии на приборе Кристалл 5000 (“Хроматэк”, Россия) с пламенно-ионизационным детектором, укомплектованным хроматографической колонкой HP5-MS (5% фенилдиметилсилоксан) длиной 30 м, внутренним диаметром 0.25 мм и толщиной пленки неподвижной фазы 0.25 мкм. Газ-носитель – гелий, метод ионизации – электронный удар, 100 эВ. Спектры обрабатывали в программе MSD ChemStation [18] с использованием библиотеки масс-спектров NIST14 [19]. Каталитическую активность рассчитывали по наклону начальных участков кривых поглощения водорода в пересчете на грамм катализатора (моль мин–1 ${\text{г}}_{{{\text{кат}}}}^{{--{\text{1}}}}$).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Просвечивающая электронная микроскопия
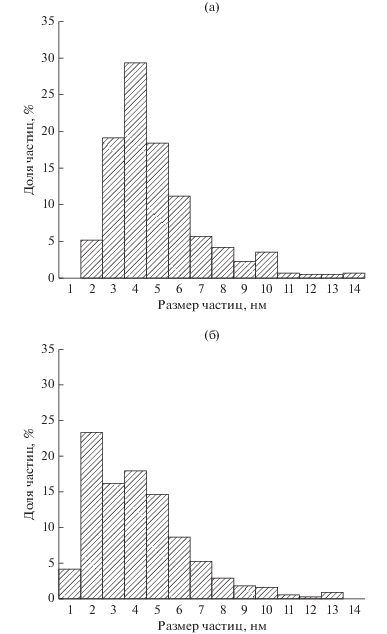
Для определения морфологических характеристик наночастиц, входящих в состав синтезированных моно- и биметаллических катализаторов, был проведен анализ методом просвечивающей электронной микроскопии (ПЭМ). На рис. 1 представлены микрофотографии катализаторов Rh/SiO2 и RhIn/SiO2. Для обоих образцов характерно равномерное распределение частиц активного компонента в структуре носителя. Для монометаллического образца (рис. 2а) наблюдается преимущественное образование небольших сферических наночастиц размером 3–5 нм, средний диаметр – 4.4 нм. Для биметаллического образца (рис. 2б) также характерны наночастицы сферической формы, однако их распределение по размерам чуть более широкое (2–5 нм), а средний диаметр немного меньше (4.1 нм).
ИК-спектроскопия адсорбированного СО
В ИК-спектрах СО, адсорбированного на родии, нанесенном на разные носители, может присутствовать несколько различных полос поглощения (п. п.) в зависимости от типа носителя. Согласно полученным данным в случае родия, нанесенного на SiO2 (рис. 3а), в спектре наблюдается высокоинтенсивная ассиметричная полоса поглощения с максимумом 2070 см–1, которая соответствует молекулам СО, линейно адсорбированным на атомах металлического родия [20, 21]. В районе 2000–1800 см–1 присутствует широкая п. п. низкой интенсивности, отвечающая мостиковой адсорбции СО на Rh0. Дополнительных полос в районе ~2097 и 2030 см–1, соответствующих симметричным и ассиметричным колебаниям дикарбонильного комплекса на Rh+, не наблюдается, что свидетельствует о присутствии родия только в металлическом состоянии [21].
Рис. 3.
ИК-спектры диффузного отражения CO, адсорбированного на поверхности катализаторов Rh/SiO2(С-80) (a) и RhIn/SiO2(С-80) (б).
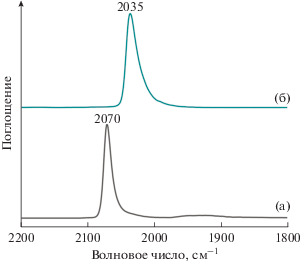
Для Rh–In-катализатора по сравнению с родиевым (рис. 3б) наблюдается сдвиг полосы поглощения линейного СО с 2070 до 2035 см–1 и полное исчезновение п. п. в области 2000–1800 см–1. Следует также отметить, что адсорбция молекул СО на атомах In0 при комнатной температуре не наблюдается [22]. Согласно [15] подобные батохромные сдвиги в ИК-спектрах адсорбированного СО для Rh–М-катализаторов (М: Sn, Zn, In, Pb, Bi) свидетельствуют об отсутствии монометаллических родиевых наночастиц в исследуемых образцах. Это предположение было доказано данными рентгенофазового анализа [15], которые показали, что в катализаторе RhIn/SiO2 происходит образование интерметаллического соединения RhIn с кубической решеткой, что также было подтверждено методом РФА и в нашей работе (см. ниже). Расчеты DFT [15] показали, что теоретические значения для частоты, соответствующей линейным колебаниям СО, адсорбированного на грани интерметаллида RhIn(110), ниже, чем для монометаллического родия. Данный сдвиг может быть связан как с уменьшением латерального взаимодействия между молекулами адсорбированного СО на поверхности RhIn, так и с эффектами, возникающими вследствие перераспределения электронной плотности между Rh и In. Следует отметить, что исследователи не регистрировали п. п. для мостиковой формы СО, адсорбированного на гранях RhIn. Предположительно эта особенность связана с геометрическим строением поверхности RhIn-интерметаллида – чередование атомов Rh и In делает мостиковую форму адсорбции СО энергетически невыгодной. Из этого можно заключить, что в данной системе, по аналогии с ранее изученным PdIn-интерметаллидом [23, 24], основным типом активных центров являются моноатомные Rh1-центры, изолированные друг от друга атомами индия.
Рентгенофазовый анализ (РФА)
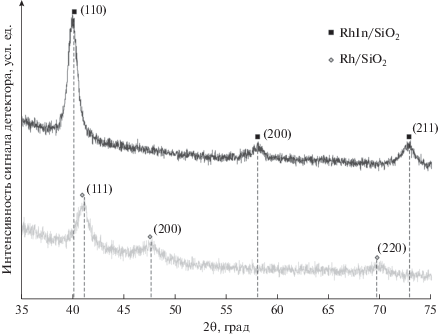
Дифрактограммы синтезированных катализаторов Rh/SiO2(С-80) и RhIn/SiO2(С-80) приведены на рис. 4. Для монометаллического образца на дифрактограмме кроме пика оксида кремния (максимум 21°–22°) присутствуют характеристические пики (41.0°, 47.7°, 69.7° при 2θ), которые можно проиндексировать как пики кубичеcкой фазы Rh (111), (200) и (220) соответственно. Расчеты дают размер элементарной ячейки кубического родия равным 0.3813 нм, что согласуется с литературными данными 0.383 нм для кубического родия (COD Database, № 1534917). Размер частиц (область когерентного рассеяния) определяли по уширению пиков по формуле Шеррера. Уширение наиболее интенсивного пика (111) для монометаллического образца отвечает размеру частиц 6 нм. Содержание Rh составляет 3.7 вес. %.
Для биметаллического образца на дифрактограмме в диапазоне 15°–75°, кроме пика аморфного оксида кремния (максимум 21°–22° при 2θ), видны характеристические пики (40.2°, 58.1°, 72.9° при 2θ). Эти пики относятся к кубическому RhIn (COD Database, № 1539275) – (110), (200), (211). Размер элементарной ячейки для нашего образца равен 0.3186 нм, что сравнимо с данными из базы ICDD PDF-4+ 2018 для RhIn (№ 04-004-8141) – 0.3190 нм. Уширение главного пика (110) соответствует размеру частиц 8.9 нм, весовое содержание фазы RhIn, согласно проведенному численному расчету, равно 6.9%. Таким образом, наблюдается изменение размеров элементарной ячейки от 0.3813 нм для монометаллического образца до 0.3186 нм для биметаллического RhIn/SiO2, что свидетельствует об образовании интерметаллического соединения RhIn с кубической решеткой.
Анализ каталитических свойств
Для сопоставления активности моно- и биметаллического катализатора гидрирования нитробензола было выполнено сравнение кинетических кривых поглощения водорода (рис. 5). Начальная скорость реакции составила 0.025 ммоль мин–1${\text{г}}_{{{\text{кат}}}}^{{ - {\text{1}}}}$ для Rh/SiO2 и 0.051 ммоль мин–1${\text{г}}_{{{\text{кат}}}}^{{ - {\text{1}}}}$ для RhIn/SiO2. При этом поглощение водорода в количестве, равном теоретически необходимому, для полного гидрирования нитрогруппы (3 экв.) на RhIn/SiO2 достигается приблизительно в три раза быстрее, чем на Rh/SiO2. Подобное соотношение времен завершения реакции на этих катализаторах наблюдали и в работе [15].
Рис. 5.
Кинетические профили поглощения водорода в процессе гидрирования нитробензола на Rh/SiO2(С-80) и RhIn/SiO2(С-80). Условия: ${{Р}_{{{{{\text{Н}}}_{{\text{2}}}}}}}$ = 10 бар, Т = 25°С, mкат = 10 мг, [CНБ] = 1 ммоль, растворитель – н-гексан.
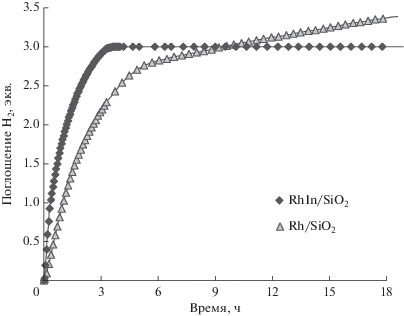
Более высокую активность интерметаллического Rh–In-катализатора можно объяснить разницей в энергии адсорбции нитробензола на Rh- и Rh–In-образцах. Так, в работе Фурукавы (Furukawa) [14] были сопоставлены величины энергии адсорбции нитрогруппы на образцах Rh/SiO2 и RhIn/SiO2, которые составили –27.4 и –41.0 кДж/моль соответственно, что указывает на более прочную адсорбцию нитробензола на образце RhIn/SiO2. Это обеспечивает повышенную концентрацию реагента на поверхности катализатора, в результате чего возрастает скорость гидрирования.
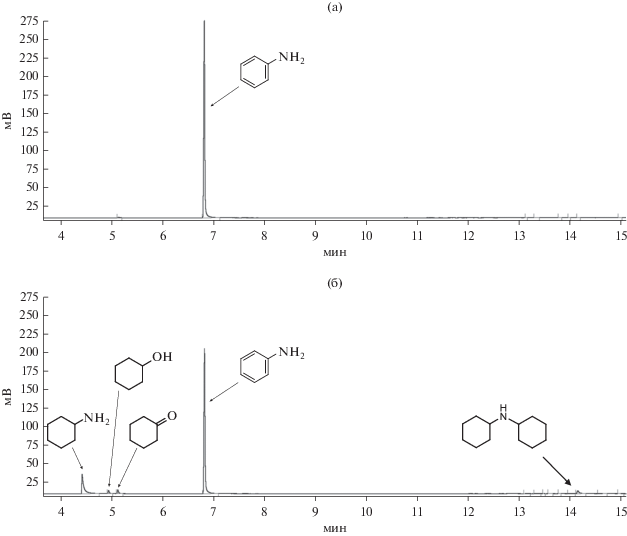
На катализаторе RhIn/SiO2 в точке достижения 3 экв. поглощение водорода прекращается, что свидетельствует о завершении реакции (рис. 5). Хроматографический анализ продуктов реакции подтверждает этот вывод и показывает, что в реакционной смеси присутствует только анилин даже после выдерживания ее в условиях реакции более 15 ч (рис. 6а). В то же время на катализаторе Rh/SiO2 наблюдается дальнейшее поглощение водорода, что может говорить о протекании побочных реакций гидрирования. На это также указывают данные хромато-масс-спектрометрии, согласно которым в продуктах реакции, помимо анилина, детектируется ряд побочных продуктов (рис. 6б). Все найденные побочные продукты образуются в результате гидрирования аминогруппы и/или ароматического кольца. Причем среди них есть как “легкие” (циклогексанол, циклогексанон и циклогексиламин), так и “тяжелые” (дициклогексиламин) соединения.
Рис. 6.
Результаты хроматографического анализа реакционной смеси после протекания реакции гидрирования нитробензола в течение 15 ч на RhIn/SiO2(С-80) (а) и Rh/SiO2(С-80) (б).
Анализ продуктов реакции (рис. 7) показывает, что на образце Rh/SiO2 циклогексиламин и дициклогексиламин начинают образовываться уже при достижении конверсии нитробензола порядка 80%, и по мере протекания реакции концентрация этих соединений продолжает возрастать. Согласно схеме 1 [25] можно заключить, что в дальнейших превращениях эти вещества не участвуют. Несколько раньше, при конверсии нитробензола порядка 50%, отмечено появление циклогексанона. В соответствии со схемой реакции он может получаться либо из анилина через аминоциклогексен, либо непосредственно из нитробензола. Принимая во внимание то, что образование циклогексанона наблюдается раньше, чем в реакционной системе фиксируется аминоциклогексен, можно с уверенностью утверждать, что он получается непосредственно из нитробензола. Появление циклогексанола в заметных количествах начинается, как и в случае циклогексиламинов, при конверсии нитробензола ~80%.
Рис. 7.
Изменение состава реакционной смеси в ходе гидрирования нитробензола на катализаторах Rh/SiO2(С-80) (а) и RhIn/SiO2(С-80) (б).
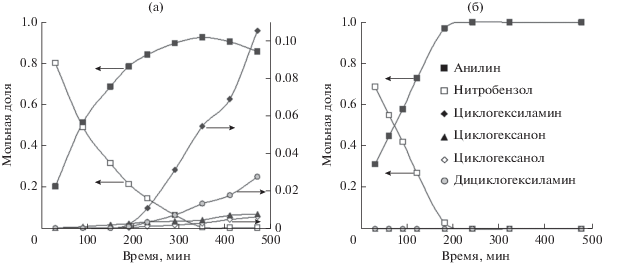
В присутствии образца RhIn/SiO2 не наблюдается отличных от анилина продуктов в течение всего времени реакции.
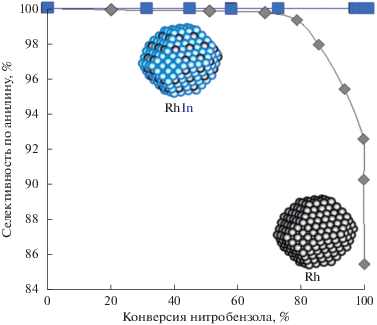
На рис. 8 приведены зависимости селективности катализаторов по анилину от степени превращения нитробензола. Для образца Rh/SiO2 отмечено снижение селективности в ходе реакции, начиная с 70% конверсии нитробензола. Для образца RhIn/SiO2 селективность остается неизменной во всем диапазоне превращений и превышает 99%.
Рис. 8.
Зависимость селективности в образовании анилина от конверсии нитробензола в гидрировании нитробензола на катализаторах на Rh/SiO2(С-80) и RhIn/SiO2(С-80).
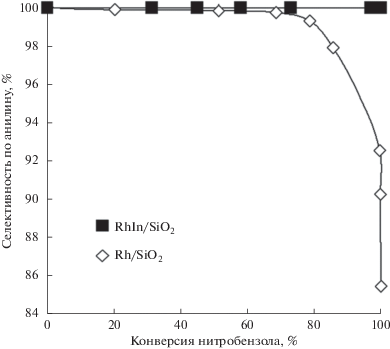
Повышение селективности Rh–In-катализатора по сравнению с монометаллическим образцом сравнения можно объяснить электронным состоянием атомов родия на поверхности Rh- и RhIn-наночастиц. По данным ИК-спектроскопии наблюдается сдвиг п. п. адсорбированного СО от 2070 для Rh/SiO2 до 2035 см–1 для RhIn/SiO2. Смещение в область более низких волновых чисел указывает на увеличение электронной плотности на поверхностных атомах родия. Так, для поверхностных атомов Rh в катализаторе Rh/SiO2 предлагается заряд по Хиршфилду, равный нулю, а для поверхностных атомов RhIn/SiO2 – –0.07 единиц элементарного электрического заряда [15]. Полученные данные позволяют предположить, что увеличение электронной плотности на атомах Rh, происходящее в результате формирования интерметаллида RhIn, приводит к снижению энергии адсорбции образующегося в ходе гидрирования анилина по сравнению с монометаллическим Rh-катализатором. Это облегчает десорбцию молекулы анилина с поверхности RhIn-интерметаллических наночастиц, что препятствует дальнейшим превращениям и способствует повышению селективности.
Кроме того, различие в селективности может быть обусловлено геометрическим фактором. В работе [26] было показано, что на катализаторе Rh/SiO2 молекула нитробензола на поверхности наночастиц Rh координируется на мультиатомных центрах Rhn как с участием нитрогруппы, так и ароматического кольца. На катализаторе RhIn/SiO2 адсорбция происходит иным образом. Благодаря чередованию атомов Rh и In на поверхности интерметаллических RhIn-наночастиц нитроароматические соединения координируются лишь с участием нитрогруппы, тогда как ароматическое кольцо непосредственно с поверхностью металла не связывается. В результате этого на интерметаллическом катализаторе, в отличие от монометаллического, реакция гидрирования бензольного кольца оказывается подавленной, что также приводит к увеличению селективности по анилину.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящей работе с помощью нескольких методов подтверждено образование интерметаллического катализатора. Рентгенофазовый анализ выявил изменение размеров элементарной кристаллической ячейки RhIn/SiO2 по сравнению с Rh/SiO2 от 0.3186 до 0.3813 нм, что свидетельствует об образовании интерметаллического соединения RhIn, обладающего кубической решеткой. В ИК-спектрах адсорбированного СО для родий-индиевого катализатора наблюдается сдвиг п. п. линейного СО с 2070 до 2035 см–1 за счет перераспределения электронной плотности между атомами Rh и In, а также полное исчезновение п. п. мостиковой формы адсорбированного СО в области 2000–1800 см–1, что связано с исчезновением центров мультиатомной адсорбции Rhn (n ≥ 2) в результате образования интерметаллических частиц. Методом ПЭМ было показано образование частиц со схожим распределением по размерам, от 2 до 5 нм, и близким средним размером частиц – 4.1 нм для RhIn/SiO2 и 4.4 нм для Rh/SiO2.
Результаты исследования каталитических свойств в реакции жидкофазного гидрирования нитробензола свидетельствуют о более высоких активности и селективности в образовании анилина при протекании реакции на RhIn/SiO2 в сравнении с образцом Rh/SiO2. Установлено, что в случае протекания реакции на интерметаллическом катализаторе практически не образуются побочные и промежуточные продукты гидрирования, в то время как на монометаллическом Rh/SiO2, помимо превращения нитробензола в анилин, происходит также дальнейшее гидрирование аминогруппы и ароматического кольца. Полученные в работе данные физико-химических исследований, а также анализ имеющихся литературных сведений позволяют объяснить наблюдаемые различия в каталитических свойствах двумя факторами, связанными со спецификой структуры поверхности интерметаллических наночастиц RhIn:
1) повышение электронной плотности на атомах Rh, входящих в состав интерметаллида, приводит к увеличению энергии адсорбции нитробензола и уменьшению энергии адсорбции анилина на RhIn/SiO2;
2) чередование атомов Rh и In на поверхности интерметаллических наночастиц RhIn препятствует участию ароматического кольца в адсорбции, что предотвращает его гидрирование.
Список литературы
Fujita S., Yoshida H., Asai K., Meng X., Arai M.J. // Supercrit. Fluids. 2011. V. 60. P. 106.
Dao S., Qian W., Luo G., Wei F., Wang Y. // Appl. Catal. A: General. 2005. V. 286. P. 30.
Vishwanathan V., Jayasri V., Basha P., Mahata N., Sikhwivhilu L., Coville N. // Catal. Commun. 2008. V. 9. P. 453
Kantam M., Chakravati R., Pal U., Sreedhar B., Bhargava S. // Adv. Synth. Catal. 2008. V. 350. P. 822.
Turek F., Geike R., Lange R. // Chem. Eng. Process. 1986. V. 20. P. 213.
Mahata N., Cunha A.F., Órfão J.J.M., Figueiredo J.L. // Appl. Catal. A: General. 2008. V. 351. P. 204.
Abdul-Wahab M.I., Jackson S.D. // Appl. Catal. A: General. 2013. V. 462–463. P. 121.
Currall K., Jackson S.D. // Top. Catal. 2014. V. 57. P. 1519.
Currall K., Jackson S.D. // Appl. Catal. A: General. 2014. V. 484. P. 59.
Martínez J.J., Aguilera E.X., Cubillos J., Rojas H., Gómez-Cortés A., Díaz G. // Mol. Catal. 2019. V. 465. P. 54.
Couto C.Sá., Madeira L.M., Nunes C.P., Araújo P. // Appl. Catal. A: General. 2016. V. 522. P. 152.
Машковский И.С., Марков П.В., Брагина Г.О., Рассолов А.В., Баева Г.Н., Стахеев А.Ю. // Кинетика и катализ. 2017. Т. 58. С. 508.
Марков П.В., Бухтияров А.В., Машковский И.С., Смирнова Н.С., Просвирин И.П., Винокуров З.С., Панафидин М.А., Баева Г.Н., Зубавичус Я.В., Бухтияров В.И., Стахеев А.Ю. // Кинетика и катализ. 2019. Т. 60. С. 816.
Furukawa S., Yoshida Y., Komatsu T. // ACS Catal., 2014. V. 4. P. 1441.
Furukawa S., Takahashi K., Komatsu T. // Chem. Sci., 2016. V. 7. P. 4476.
Качала В.В., Хемчян Л.Л., Кашин А.С., Орлов Н.В., Грачев А.А., Залесский С.С., Анаников В.П. // Успехи химии. 2013. Т. 82. С. 648.
Izumi F., Momma K. // Solid State Phenom. 2007. V. 130. P. 15.
MSD ChemStation Data Analysis Software B.07.03.2129, released in May 2015 by Agilent Technologies Inc. (USA).
NIST14 Mass Spectral Library & Search Software by Scientific Instrument Services, Inc. (USA). 2014.
Fisher I.A., Bell A.T. // J. Catal. 1996. V. 162. P. 54.
Trautmann S., Baerns M. // J. Catal. 1994. V. 150. P. 335.
Hadjiivanov K.I., Vayssilov G.N. // Adv. Catal. 2002. V. 47. P. 307.
Stakheev A.Yu., Smirnova N.S., Krivoruchenko D.S., Baeva G.N., Mashkovsky I.S., Yakushev Il. A., Vargaftik M.N. // Mendeleev Commun. 2017. V. 27. P. 515.
Mashkovsky I.S., Smirnova N.S., Markov P.V., Baeva G.N., Bragina G.O., Bukhtiyarov A.V., Prosvirin I.P., Stakheev A.Yu. // Mendeleev Commun. 2018. V. 28. P. 603.
Couto C.Sá., Madeira L.M., Nunes C.P., Araújo P. // Appl. Catal. A. General. 2016. V. 522. P. 152.
Furukawa S., Komatsu T. // ACS Catal. 2017. V. 7. P. 735.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ