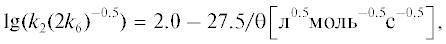Кинетика и катализ, 2021, T. 62, № 5, стр. 527-535
Кинетические закономерности окисления метилолеата в микроэмульсии, стабилизированной тритоном Х-100. I. Липидрастворимый инициатор 2,2'-азо-бис-изобутиронитрил
О. В. Семикашева a, Р. А. Насибуллина a, Л. Р. Якупова a, *, Р. Л. Сафиуллин a
a Уфимский Институт химии – обособленное структурное подразделение ФГБНУ Уфимского федерального исследовательского центра РАН
450054 Башкортостан, Уфа, просп. Октября, 69, Россия
* E-mail: stargar@inbox.ru
Поступила в редакцию 21.04.2021
После доработки 26.05.2021
Принята к публикации 26.05.2021
Аннотация
Изучены кинетические закономерности окисления метилового эфира олеиновой кислоты в микроэмульсии, стабилизированной тритоном Х-100. Для генерирования пероксильных радикалов использован липидрастворимый инициатор 2,2'-азо-бис-изобутиронитрил. Установлено, что окисление метилолеата в микроэмульсии протекает по радикально-цепному механизму с квадратичным обрывом цепи. Определены оптимальные концентрации поверхностно-активного вещества и метилолеата. Методом ингибиторов измерена скорость инициирования и найден параметр окисляемости метилолеата в микроэмульсии. Измерены константы скорости реакции пероксильного радикала метилолеата с α-токоферолом и тролоксом (fk7, л моль–1 с–1, 333 К), которые составляют (2.9 ± 0.2) × 104 и (4.0 ± 0.2) × 104 соответственно.
Графический реферат
ВВЕДЕНИЕ
Окисление веществ молекулярным кислородом – одна из фундаментальных реакций в химии и биологии. Биохимическое окисление органических веществ является основой жизнедеятельности организмов. Важную роль в этом процессе играют пероксильные радикалы липида. При неблагоприятных условиях концентрация этих частиц возрастает, и они способны повреждать липидный слой мембраны клетки, контактирующей с водной средой [1]. Биомедицинские аспекты окисления липидов клеточной мембраны стимулировали интерес к исследованию действия ингибиторов окисления липидов в водной среде. В последнее время для тестирования антиоксидантов используется процесс окисления липида в мицеллах, образуемых поверхностно-активным веществом (ПАВ) [2–8]. В этом случае осуществляется радикально-цепная реакция, которая отражает окисление липида в мембране клетки. В качестве ПАВ применяются додецилсульфат натрия (ДДС) [9, 10], цетилтриметиламмоний бромид (ЦТАБ) [11, 12], тритон Х-100 [4, 5, 13]. В роли модельного субстрата в подавляющем большинстве используется метиллинолеат [6–8, 13]. Более доступным липидом для исследования закономерностей окисления в эмульсии является метиловый эфир олеиновой кислоты (метилолеат). Это позволяет проводить тестирование веществ на антиоксидантную активность при достаточно высокой концентрации субстрата, т.е. создавать условия, когда окисление протекает в капельке метилолеата, стабилизированной поверхностно-активным веществом. Существенными факторами являются доступность метилолеата и простота его очистки и хранения. Кинетика окисления этого субстрата изучена, и его используют в качестве модельного для тестирования антиоксидантов [14, 15]. Ранее были исследованы кинетические закономерности окисления метилолеата в водоэмульсионной системе, содержащей цетилтриметиламмоний бромид (ЦТАБ) [12]. Было установлено, что ЦТАБ практически не влияет на кинетические закономерности окисления метилолеата. Максимальная концентрация ЦТАБ в воде составляет 1.8 × 10–3 моль л–1, что может быть недостаточным для образования устойчивой эмульсии метилолеата в воде. В связи с этим в настоящей работе в роли ПАВ были рассмотрены додецилсульфат натрия и тритон Х-100.
Поскольку данные об окислении метилолеата в водном растворе ПАВ немногочисленны [12, 16], в представленной работе изучены кинетические закономерности окисления его в микроэмульсии, стабилизированной ПАВ. Для генерирования радикалов применяли липидрастворимый инициатор 2,2'-азо-бис-изобутиронитрил. Скорость инициирования измеряли методом ингибиторов, в роли которых использовали α-токоферол и тролокс.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
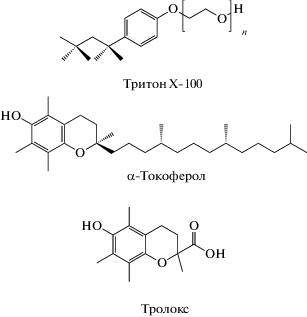
Метиловый эфир олеиновой кислоты (МО, C17H33CОOCH3) и 2,2'-азо-бис-изобутиронитрил (АИБН, С8H12N4), хлорбензол и воду очищали согласно [12]. Тритон Х-100 (C14H22O(C2H4O)n с n = = 9–10, чистота 98%) производства фирмы “Acros Organics”, 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновая кислота (тролокс, C14H18O4, чистота 97%) фирмы “Acros” и 6-гидрокси-2,5,7,8-тетраметил-2-(4,8,12-триметилтридецил)-хроман (α-токоферол, C29H50O2, чистота 96%) фирмы “Sigma” дополнительной очистке не подвергали. Структурные формулы тритона Х-100, α-токоферола и тролокса приведены на схеме 1 .
Схема 1 . Структурные формулы тритона Х-100, α-токоферола и тролокса.
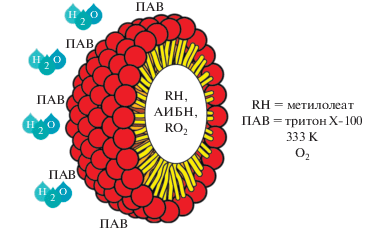
Опыты проводили в стеклянном реакторе, в который загружали метилолеат, хлорбензол и водный раствор поверхностно-активного вещества, термостатировали и затем добавляли раствор инициатора в хлорбензоле. В случае ингибированного окисления вместо хлорбензола вводили раствор антиоксиданта в хлорбензоле. Соотношение органической и водной фаз составляло 1 : 2.7 v/v (по объему). Так как радикально-цепное окисление в условиях наших экспериментов протекает в органической фазе, концентрацию субстрата, инициатора и ингибитора рассчитывали исходя из суммарного объема загруженных в реактор метилолеата, раствора инициатора АИБН и хлорбензола (или раствора ингибитора) без учета объема воды. Концентрацию ДДС и тритона Х-100 вычисляли с учетом объема только водной фазы. Окисление метилолеата кислородом воздуха проводили при температуре 333 К. За поглощением кислорода следили с помощью универсальной манометрической дифференциальной установки [17]. Скорость поглощения кислорода в жидкой фазе определяли по методике, описанной в работах [17, 18]. Объем газовой фазы составлял 26 мл, объем реакционной смеси – 8.2 мл.
В качестве инициатора окисления использовали АИБН. Скорость инициирования находили по формуле: wi = ki[АИБН] = 2ekр[АИБН], где ki и kр – константа скорости инициирования и константа скорости распада инициатора соответственно, е – вероятность выхода радикалов в объем, [АИБН] – концентрация инициатора. Константа скорости распада АИБН в метилолеате в безводной среде lgkр = 15 – 127.5/θ [с–1], 2e = 0.65 [19, 20].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В отсутствие водной фазы жидкофазное окисление МО кислородом воздуха, инициированное АИБН, протекает по радикально-цепному механизму с квадратичным обрывом цепи [12] (схема 2 ):
Схема 2 . Элементарные реакции радикально-цепного окисления метилолеата, начальная стадия.
Нумерация реакций соответствует общепринятой схеме жидкофазного окисления углеводородов.
Скорость окисления описывается уравнением:
Здесь k2 и 2k6 – константы скорости продолжения и обрыва цепи на пероксильных радикалах метилолеата соответственно. Параметр k2(2k6)–0.5 характеризует окисляемость метилолеата. Зависимость параметра k2(2k6)–0.5 от температуры (303–333 К) в координатах уравнения Аррениуса описывается выражением [12]:
где θ = 2.303 × 10–3RT кДж/моль.При температуре 333 К k2(2k6)–0.5 = 4.9 × × 10–3 л0.5 моль–0.5 с–0.5.
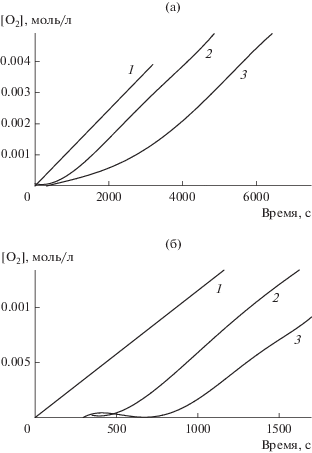
На рис. 1а представлена зависимость скорости окисления метилолеата (w) от концентрации ДДС. Видно, что c увеличением концентрации ПАВ скорость окисления снижается. При концентрации ДДС равной 0.6 моль/л скорость окисления минимальна. При дальнейшем повышении концентрации ДДС вязкость реакционной смеси заметно возрастает и перемешивание затрудняется. На рис. 1б показана зависимость скорости окисления метилолеата от концентрации тритона Х-100. При [тритон Х-100] ≥ 0.2 моль/л скорость окисления метилолеата (w) в нашей системе не меняется. Зависимость получена при концентрациях метилолеата 2.7 и 1.6 моль/л.
Рис. 1.
Зависимость скорости окисления метилолеата от концентрации ПАВ: а − ДДС, [МО] = 2.7 моль/л; б − тритон Х-100, [МО] = 2.7 (1) и 1.6 моль/л (2). Условия реакции: [АИБН] = 5.6 × 10–3 моль/л, соотношение водная фаза : органическая фаза = 2.7 : 1 v/v, 333 К.
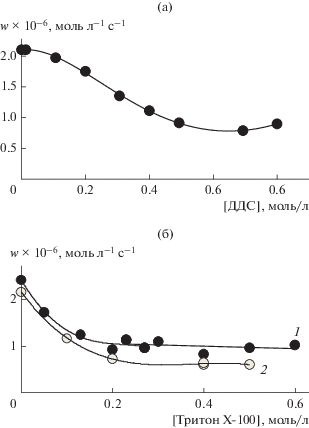
Снижение скорости инициированного АИБН окисления метилолеата с увеличением концентрации как ДДС, так и тритона Х-100 согласуется с литературными данными для системы с метиллинолеатом [2, 21]. В нашей системе также наблюдается уменьшение реакционной способности пероксильного радикала, но не в такой значительной степени.
Анализируя полученные результаты, можно рассматривать тритон Х-100 более подходящим ПАВ для стабилизации метилолеата в микроэмульсии. Во-первых, максимальная концентрация тритона Х-100, при которой скорость окисления метилолеата не зависит от концентрации ПАВ, ниже, чем для ДДС, следовательно, меньше затраты на реагент. Во-вторых, при применении ДДС не наблюдается четкого плато. После достижения минимальной скорости окисления при [ДДС] = 0.6 моль/л дальнейший рост концентрации данного ПАВ приводит к увеличению вязкости реакционной смеси и перемешивание затрудняется.
Кинетические закономерности окисления метилолеата в микроэмульсии, стабилизированной тритоном Х-100
Скорость инициированного АИБН окисления метилолеата при температуре 333 К в отсутствие воды составляет 2.4 × 10–6 моль л–1 с–1, что удовлетворительно согласуется с литературными данными [12]. Добавление воды не влияет на скорость окисления (рис. 2, кинетическая кривая 2), соответственно и параметр окисляемости метилолеата сохраняется. В отсутствие метилолеата в системе водного раствора тритона Х-100 в присутствии АИБН поглощение кислорода составляет 3.9 × 10–8 моль л–1 с–1 (рис. 2, кинетическая кривая 3), что мало по сравнению со скоростью окисления метилолеата. Следовательно, в этих условиях окислением тритона можно пренебречь.
Рис. 2.
Кинетика поглощения кислорода в зависимости от состава реакционной смеси при Т = 333 К и [АИБН] = 5.6 × 10–3 моль/л: 1 – [МО] = 2.7 моль/л; 2 – [МО] = 2.7 моль/л, соотношение Н2О : МО = 2.7 : 1, 3 – [МО] = 0 моль/л, [тритон Х-100] = 0.2 моль/л, водная фаза : органическая фаза = 2.7 : 1 v/v.
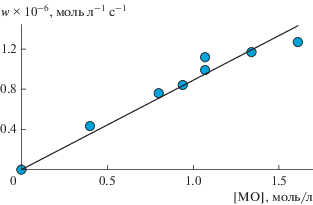
На рис. 3 представлена зависимость скорости окисления метилолеата в микроэмульсии, стабилизированной тритоном Х-100, от концентрации субстрата. Для снижения концентрации метилолеата в качестве растворителя был применен хлорбензол. Линейность зависимости сохраняется в интервале концентрации метилолеата 0.4–1.6 моль/л. При дальнейшем увеличении концентрации МО скорость окисления метилолеата остается постоянной, поэтому опыты проводили при [МО] ≤ 1.6 моль/л. Как видно из рис. 1б, как при [МО] = 2.7 моль/л, так и в растворе его в хлорбензоле ([МО] = 1.6 моль/л) характер зависимости w от концентрации тритона Х-100 идентичен.
Рис. 3.
Зависимость скорости окисления метилолеата от его концентрации. Условия реакции: [АИБН] = = 5.6 × 10–3 моль/л, [тритон Х-100] = 0.2 моль/л, соотношение водная фаза : органическая фаза = 2.7 : 1 v/v, 333 К.
Зависимость скорости окисления метилолеата от концентрации инициатора рассматривали при концентрации метилолеата 1.5 моль/л. Как видно из рис. 4, наблюдается квадратичная зависимость от [АИБН].
Рис. 4.
Зависимость скорости окисления метилолеата от концентрации инициатора. Условия реакции: [МО] = 1.5 моль/л, [тритон Х-100] = 0.2 моль/л, соотношение водная фаза : органическая фаза = 2.7 : 1 v/v, 333 К.
Таким образом, окисление метилолеата в микроэмульсии, стабилизированной тритоном Х-100, протекает по такому же механизму, что и в гомогенной среде, т.е. в среде самого субстрата. Аналогичная закономерность наблюдалось при окислении метиллинолеата в водной дисперсии, образованной тритоном Х-100 [13].
Из изложенного выше следует, что жидкофазное окисление метилолеата в микроэмульсии, стабилизированной тритоном Х-100, идет по радикально-цепному механизму с квадратичным обрывом цепи (схема 2 ). Для измерения скорости инициирования в предлагаемых условиях окисление метилолеата проводили в присутствии ингибиторов окисления – α-токоферола и тролокса.
Ингибированное α-токоферолом окисление метилолеата в микроэмульсии, стабилизированной тритоном Х-100
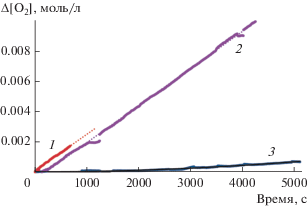
Добавление α-токоферола в реакционную смесь окисляющегося метилолеата в микроэмульсии приводит к снижению скорости поглощения кислорода (рис. 5а), поскольку появляется дополнительный канал расходования пероксильных радикалов по реакциям (VII) и (VIII):
(VIII)
${\text{RO}}_{2}^{\centerdot } + {\text{I}}{{{\text{n}}}^{\centerdot }}\xrightarrow{{{{k}_{8}}}}{{{\text{P}}}_{8}}.$Рис. 5.
Кинетические зависимости поглощения кислорода при окислении метилолеата: а − без ингибитора (1), [α-токоферол] = 2.7 × 10–5 (2) и 6.8 × 10–5 моль/л (3); б − без ингибитора (1), [тролокс] = 1.2 × 10–5 (2) и 1.5 × × 10–5 моль/л (3). Условия реакции: [МО] = 1.1 моль/л, [АИБН] = 5.6 × 10–3 моль/л, [тритон Х-100] = 0.2 моль/л, водная фаза : органическая фаза = 2.7 : 1 v/v, 333 К.
Продолжительность индукционного периода определяли, обрабатывая кинетическую кривую по уравнению (1) [22]:
(1)
${{\tau }} = \int\limits_0^\infty {\left( {1 - {{{\left( {\frac{w}{{{{w}_{0}}}}} \right)}}^{2}}} \right)} {\text{d}}t,$В табл. 1 приведены значения индукционного периода (τ), наблюдаемого на кинетической кривой поглощения кислорода в процессе окисления метилолеата в микроэмульсии. Данные получены при разных концентрациях ингибитора.
Таблица 1.
Зависимость скорости окисления метилолеата и индукционного периода от концентрации α‑токоферола*
| [α-Токоферол] × 10–5, моль/л | w × 10–7, моль л–1 с–1 | τ, с | k2, л моль–1 с–1 |
|---|---|---|---|
| 0 | 12.2 | 0 | |
| 0.7 | 7.7 | 300 | 6.3 |
| 1.4 | 5.5 | 558 | 6.7 |
| 2.7 | 3.6 | 947 | 5.4 |
| 3.4 | 2.4 | 1621 | 4.6 |
| 4.1 | 1.6 | 1800 | 8.2 |
| 6.8 | 1.3 | 2600 | 5.8 |
| 9.6 | 0.9 | 4370 | 6.3 |
Согласно уравнению (2) скорость инициирования (wi) обратно пропорциональна τ:
где [InH] – начальная концентрация α-токоферола, f – стехиометрический коэффициент ингибирования.Следовательно, зная индукционный период, можно рассчитать значение скорости инициирования. Предположив, что на молекуле α-токоферола гибнет два пероксильных радикала метилолеата, найдено wi = (4.2 ± 0.4) × 10–8 моль л–1 с–1. Согласно литературным данным (см. раздел Экспериментальная часть) в метилолеате без водной фазы wi = 2еkp[АИБН] = 0.65 × 1 × 10–5 с–1 × 5.6 × × 10–3 моль л–1 = 3.6 × 10–8 моль л–1 с–1. Следовательно, проведение окисления метилолеата в микроэмульсии практически не оказывает влияние на распад АИБН. Найденное значение wi дает возможность вычислить константу скорости инициирования ki = 7.5 × 10–6 с–1. А это в свою очередь позволяет рассчитать параметр окисляемости метилолеата в микроэмульсии, стабилизированной тритоном Х-100. Для этого рассмотрим зависимости скорости окисления w от концентрации субстрата и инициатора (рис. 3 и 4). Из тангенсов угла наклона этих графиков найдены значения параметра окисляемости k2/(2k6)0.5, которые составляют 4.4 × 10–3 л0.5 моль–0.5 с–0.5 и 4.9 × 10–3 л0.5 моль–0.5 с–0.5 соответственно. Это свидетельствует о том, что в условиях, когда [RH] = = 0.4–1.6 моль/л, [АИБН] = (1.3–8.8) × 10–3 моль/л, [тритон Х-100] = 0.2 моль/л и при соотношении водной и органической фаз 2.7 : 1 v/v, параметр окисляемости метилолеата в микроэмульсии сохраняется таким же, как и в отсутствие водного раствора ПАВ.
Константа скорости реакции пероксильного радикала метилолеата с α-токоферолом
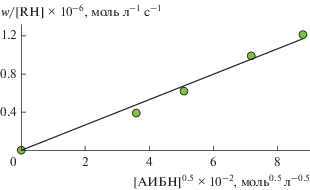
Начальную скорость ингибированного α-токоферолом окисления метилолеата (w) определяли по наклону касательной к кривой зависимости количества поглощенного кислорода через 300 с после введения ингибитора в реактор. Для того, чтобы получить эффективную константу скорости fk7, зависимость w от концентрации α-токоферола (рис. 6) преобразовывали в координатах уравнения (3) [23]:
(3)
$F = {{w}_{0}}{{w}^{{--1}}}--w{{\left( {{{w}_{0}}} \right)}^{{--1}}} = f{{k}_{7}}{{\left[ {{\text{InH}}} \right]}_{0}}{{\left( {2{{k}_{6}}{{w}_{{\text{i}}}}} \right)}^{{--0.5}}}.$Рис. 6.
Зависимость начальной скорости окисления в мицеллах от концентрации α-токоферола и преобразование ее в координатах уравнения (3). Условия реакции: [RH] = 1.1 моль/л, wi = 4.2 × 10–8 моль л–1 с–1, [тритон Х-100] = 0.2 моль/л, соотношение водная фаза : органическая фаза = 2.7 : 1 v/v, 333 К.
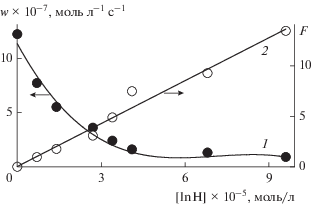
С применением найденного значения скорости инициирования (wi = (4.2 ± 0.4) × 10–8. моль л–1 с–1) и допущением того, что 2k6 = 106 л моль–1 с–1, получено fk7 = (2.9 ± 0.2) × 104 л моль–1 с–1. Так как для α-токоферола свойственно перехватывать 2 пероксильных радикала (f = 2), можно предположить, что k7 = 1.5 × 104 л моль–1 с–1.
В практически чистом метилолеате ([МО] = = 2.6 моль/л) в отсутствие водного раствора ПАВ константа скорости реакции пероксильного радикала метилолеата с α-токоферолом значительно выше: k7 = 4.5 × 105 л моль–1 с–1 [12]. Снижение антиоксидантной активности α-токоферола в микроэмульсии можно объяснить образованием водородной связи между молекулами воды и ингибитора [24]. Снижение реакционной способности α-токоферола наблюдалось и при окислении метиллинолеата в микрогетерогенном растворе, где найдена константа скорости k7 = 2.3 × × 104 л моль–1 с–1 [9, 10].
Для расчета константы скорости продолжения цепи (k2) окисления метилолеата в микроэмульсии применимо уравнение (4) [23]:
(4)
$\Delta [{{{\text{O}}}_{2}}]{\text{ }} = --{{k}_{2}}{{({{k}_{7}})}^{{--1}}}[{\text{RH}}]{\text{ }}\ln (1{\text{ }}--t{\text{/}}\tau ),$Результаты приведены в табл. 1. Найдено k2 = = (6.2 ± 0.8) л моль–1 с–1, что согласуется с измеренными ранее значениями этой константы: 5.3 л моль–1 с–1 в чистом метилолеате и 6.3 л моль–1 с–1 в микроэмульсии метилолеата, стабилизированной ЦТАБ [12].
Константа скорости реакции пероксильного радикала метилолеата с тролоксом
Окисление метилолеата в микроэмульсии, стабилизированной тритоном Х-100, инициировали липидрастворимым АИБН. Тролокс в реакционную массу вводили в виде раствора в хлорбензоле. На рис. 5б приведены кинетические кривые поглощения кислорода в ходе окисления метилолеата.
Индукционный период находили при помощи уравнения (1). Результаты приведены в табл. 2. Значение скорости инициирования рассчитывали по экспериментально найденным значениям продолжительности индукционного периода (уравнение (2)). В предположении, что на молекуле тролокса гибнет два пероксильных радикала метилолеата, найдено wi = (3.5 ± 0.4) × 10–8 моль л–1 с–1. Следовательно, константа скорости инициирования для АИБН в этих условиях равна ki = 6.3 × 10–6 c–1. По литературным данным (см. раздел Экспериментальная часть) в метилолеате без водной фазы ki = 6.5 × 10–6 c–1 [19, 20].
Таблица 2.
Зависимость скорости окисления метилолеата и индукционного периода от концентрации тролокса*
| [Тролокс] × 10–5, моль/л | w × 10–7, моль л –1 с–1 | τ, с | k7 × 104, л моль–1 с–1 |
|---|---|---|---|
| 0 | 12.6 | 0 | –** |
| 0.2 | 11.2 | 80 | 3.1 |
| 0.5 | 8.5 | 200 | 2.2 |
| 1.0 | 6.5 | 600 | 1.7 |
| 1.2 | 5.0 | 630 | 1.5 |
| 1.5 | 4.6 | 800 | 1.5 |
| 2.5 | 2.5 | 1300 | 1.4 |
Константу скорости реакции пероксильного радикала метилолеата с тролоксом (k7) находили, обрабатывая кинетические зависимости поглощения кислорода в координатах уравнения (4). При расчете использовали найденную константу скорости k2 = (6.2 ± 0.8) л моль–1 с–1 (см. выше). Эффективную константу скорости этой реакции (fk7) получали при помощи уравнения (3). Найдено k7 = (1.7 ± 0.2) × 104 л моль–1 с–1 и fk7 = (4.0 ± ± 0.2) × 104 л моль–1 с–1. С учетом стехиометрического коэффициента ингибирования f = 2 параметры fk7 и k7 удовлетворительно согласуются между собой и с данными работы [4], в которой в эмульсии, стабилизированной ДДС, была измерена константа скорости реакции перекисного радикала метиллинолеата с тролоксом, составившая 2 × 104 л моль–1 с–1 (310 К).
Таким образом, константа скорости реакции α-токоферола и тролокса с пероксильным радикалом метилолеата в микроэмульсии, стабилизированной тритоном Х-100, существенно ниже, чем в чистом метилолеате в отсутствие водного раствора ПАВ. Несмотря на это, α-токоферол и тролокс остаются эффективными ингибиторами окисления метилолеата в микроэмульсии.
ЗАКЛЮЧЕНИЕ
Определены кинетические закономерности инициированного липидрастворимым 2,2'-азо-бис-изобутиронитрилом окисления метилолеата в микроэмульсии, стабилизированной тритоном Х-100. Установлено, что окисление протекает по радикально-цепному механизму с квадратичным обрывом цепи. Методом ингибиторов с применением α-токоферола и тролокса измерена скорость инициирования окисления метилолеата в микроэмульсии, стабилизированной тритоном Х-100. Найдены эффективные константы скорости реакции пероксильного радикала метилолеата с α‑токоферолом и тролоксом fk7, составившие при 333 К (2.9 ± 0.2) × 104 и (4.0 ± 0.2) × 104 л моль–1 с–1 соответственно.
Список литературы
Биохимия. Учебник для студентов медицинских вузов. Под ред. Северина Е.С. М.: ГЕОТАР-Медиа, 2008. 760с.
Barclay L.R.C. // Can. J . Chem. 1993. V. 71. № 1. P. 1.
Плисс Е.М., Лошадкин Д.В., Гробов А.М., Кузнецова Т.С., Русаков А.И. // Хим. физика. 2015. Т. 34. № 1. С. 66.
Jodko-Piórecka K., Litwinienko G. // Free Rad. Biol. Med. 2015. V. 83. P. 1.
Москаленко И.В., Петрова С.Ю., Плисс Е.М., Русаков А.И., Бучаченко А.Л. // Хим. физика. 2016. Т. 35. № 4. С. 36.
Лошадкин Д.В., Плисс Е.М., Касаикина О.Т. // Журн. прикл. химии. 2020. Т. 93. № 7. С. 1051.
Тихонов И.В., Бородин Л.И., Плисс Е.М. // Хим. физика. 2020. Т. 39. № 11. С. 3.
Grebowski J., Konopko A., Krokosz A., DiLabio G.A., Litwinienko G. // Free Radical Biol. Med. 2020. V. 160. P. 734.
Рогинский В.А. // Биологические мембраны. 1990. Т. 7. № 3. С. 297.
Roginsky V.A., Barsukova T.K. Remorova A.A., Bors W. // J. Am. Oil Chem. Soc. 1996. V. 73. № 6. P. 777.
Касаикина О.Т., Карташева З.С., Писаренко Л.М. // Журн. общ. химии. 2008. Т. 78. № 8. С. 1298.
Якупова Л.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2011. Т. 52. № 6. С. 806.
Yamamoto Y., Haga S., Niki E., Kamiya Y. // Bull. Chem. Soc. Jpn. 1984. V. 57. № 5. P. 1260.
Якупова Л.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2020. Т. 61. № 6. С. 797.
Якупова Л.Р., Баева Л.А., Сафиуллин Р.Л. // Кинетика и катализ. 2021. Т. 62. № 1. С. 21.
Тихонов И.В., Москаленко И.В., Плисс Е.М., Фомич М.А., Бекиш А.В., Шманай В.В. // Хим. физика. 2017. Т. 36. № 5. С. 14.
Якупова Л.Р., Проскуряков С.Г., Зарипов Р.Н., Рамеев Ш.Р., Сафиуллин Р.Л. // Бутлеров. сообщ. 2011. Т. 28. № 19. С. 71.
Зарипов Р.Н., Сафиуллин Р.Л., Рамеев Ш.Р., Ахунов И.Р., Комиссаров В.Д. // Кинетика и катализ. 1990. Т. 31 .№ 5. С. 1086.
Denisov E.T., Afanas’ev I.B. Oxidation and Antioxdants in Organic Chemistry and Biology. Boca Raton: FL: CRC Press, Taylor and Francis Group, 2005. 981 c.
Письменский А.В., Психа Б.Л., Харитонов В.В. // Нефтехимия. 2000. Т. 40. № 2. С. 112.
Garrec J., Monari A., Assfeld X., Mir L.M., Tarek M. // J. Phys. Chem. Lett. 2014. V. 5. № 10. C. 1653.
Loshadkin D., Roginsky V., Pliss E. // Int. J. Chem. Kin. 2002. T. 34. № 3. C. 162.
Денисов Е.Т., Азатян В.В. Ингибирование цепных реакций. Черноголовка: Изд-во РАН, 1997. 266 с.
Barclay L.R.C., Baskin K.A., Dakin K.A., Locke S.J., Vinqvist M.R. // Can. J. Chem. V. 68. № 12. P. 2258.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ