Кинетика и катализ, 2021, T. 62, № 5, стр. 536-548
Гомогенные катализаторы окислительно-восстановительных процессов на основе растворов гетерополикислот. IV. Испытания катализатора синтеза метилэтилкетона в присутствии продуктов коррозии аппаратуры (катионов металлов)
Е. Г. Жижина a, Л. Л. Гогин a, *
a ФГБУН ФИЦ Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: gogin@catalysis.ru
Поступила в редакцию 12.03.2021
После доработки 18.05.2021
Принята к публикации 19.05.2021
Аннотация
Исследовано влияние продуктов коррозии аппаратуры (катионов переходных металлов) на физико-химические и каталитические свойства гомогенного катализатора Pd(II) + ГПК-х, разработанного для двухстадийного окисления н-бутена в метилэтилкетон (МЭК) кислородом. Оценена термостойкость раствора катализатора на основе ГПК-х (Мо−V−P-гетерополикислоты с х атомами ванадия) в присутствии катионов переходных металлов. Проведена оптимизация состава двухкомпонентного катализатора, рекомендованного для опытно-промышленных испытаний МЭК-процесса.
Графический реферат
$\begin{gathered} {\text{С}}{{{\text{Н}}}_{{\text{3}}}}{\text{С}}{{{\text{Н}}}_{{\text{2}}}}{\text{СН = С}}{{{\text{Н}}}_{{\text{2}}}} + 0.5{{{\text{О}}}_{2}}\xrightarrow{{{\text{Cat}}}}~{\text{С}}{{{\text{Н}}}_{{\text{3}}}}{\text{С}}{{{\text{Н}}}_{{\text{2}}}}{\text{СОС}}{{{\text{Н}}}_{{\text{3}}}} \\ {\text{Cat}}--{\text{P}}{{{\text{d}}}^{{{\text{II}}}}} + {\text{M}}{{{\text{e}}}_{x}}{\text{ГПК - }}7;\,\,\,\,{\text{Ме}} - {\text{Ni}},{\text{Fe}},{\text{Cr}};\,\,\,\,x = {\text{ }}0.1{\kern 1pt} --{\kern 1pt} 0.2;\,\,\,\,{\text{ГПК - 7 }}--{\text{ }}{{{\text{Н}}}_{{10}}}{{{\text{Р}}}_{3}}{\text{М}}{{{\text{о}}}_{{18}}}{{{\text{V}}}_{7}}{{{\text{O}}}_{8}} \\ \end{gathered} $ВВЕДЕНИЕ
Растворы молибдованадофосфорных гетерополикислот (ГПК-х, где х – число атомов ванадия в составе ГПК) начали применять в окислительном катализе около 50-ти лет назад. Выяснилось, что они обладают рядом уникальных свойств, главным из которых является обратимая окисляемость – способность восстановленных растворов ГПК-х окисляться молекулярным кислородом. Эта особенность позволила в присутствии растворов ГПК-х замкнуть двухстадийные каталитические циклы окисления субстратов разных классов кислородом [1]. За прошедшие годы накоплен значительный опыт работы с растворами ГПК-х и исследовано большое количество каталитических реакций в их присутствии [2–11]. Если сначала применялись только низкованадиевые растворы ГПК-х состава Кеггина (Н3 +хРМо12– хVxO40, х ≤ 4), то впоследствии удалось разработать способы синтеза модифицированных (некеггиновских) высокованадиевых растворов ГПК-х [12], обладающих существенно более высокой термостабильностью и производительностью.
Модифицированные растворы ГПК-х, позволившие достаточно быстро проводить стадию регенерации катализаторов на их основе кислородом (воздухом) при высоких температурах (160–190°С), открыли тем самым перспективу промышленной реализации окислительных процессов с участием растворов ГПК-х. Следует отметить, что в случае кеггиновских растворов именно стадия регенерации ГПК-х кислородом была ключевой, поскольку вызывала наибольшие проблемы для реализации каталитических процессов из-за своей низкой скорости и образования осадков при T > > 135°С [13].
Модифицированные растворы ГПК-х оказались высокоэффективными катализаторами не только реакций окисления. В силу своей высокой бренстедовской кислотности они нашли удачное применение и как бифункциональные (кислотные и окислительные) катализаторы [10]. Высокие активности и селективности в целевых реакциях, а также успешное решение проблемы регенерации катализаторов на основе модифицированных растворов ГПК-х позволили ряду разработанных процессов выйти на уровень опытно-промышленных испытаний. Однако при этом встали задачи технологического плана, при которых особую значимость приобретают сведения о физико-химических свойствах растворов ГПК-х (плотность, вязкость, рН, редокс-потенциал Е [14], электропроводность [15] и коррозионные свойства [16, 17]) и их изменениях в ходе редокс-процессов. Серьезную значимость в этом ряду имеют и сведения о влиянии продуктов коррозии аппаратуры (катионов переходных металлов), в частности пилотных установок, на состояние гомогенного катализатора на основе ГПК-х, запрограммированного на длительную работу. На примере одного из разработанных процессов на основе раствора ГПК-х ниже будет показано, как решались важные технологические задачи при подготовке опытно-промышленных испытаний.
Итак, настоящая работа продолжает цикл исследований [18, 19] гомогенного катализатора Pd(II) + ГПК-х, разработанного в Институте катализа СО РАН для опытно-промышленной реализации двухстадийного процесса окисления н-бутилена в метилэтилкетон (МЭК) кислородом [20, 21] по реакциям (I) + (II). Проведение этих реакций в разных реакторах обеспечило 98%-ную селективность и взрывобезопасность МЭК-процесса.
(I)
$\begin{gathered} {\raise0.5ex\hbox{$\scriptstyle m$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 2$}}н{\text{ - }}{{{\text{C}}}_{4}}{{{\text{H}}}_{8}} + {\text{ГПК - }}x + {\raise0.5ex\hbox{$\scriptstyle m$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 2$}}{{{\text{Н}}}_{2}}{\text{О}}\xrightarrow{{{\text{P}}{{{\text{d}}}^{{{\text{II}}}}}}} \\ ~ \to {\raise0.5ex\hbox{$\scriptstyle m$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 2$}}{\text{C}}{{{\text{H}}}_{3}}{\text{CO}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}} + {\text{ }}{{{\text{Н}}}_{m}}{\text{ГПК - }}x, \\ \end{gathered} $(II)
${{{\text{Н}}}_{m}}{\text{ГПК - }}x + \,\,{\raise0.5ex\hbox{$\scriptstyle m$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 4$}}{{{\text{O}}}_{2}}~ \to {\text{ГПК - }}x~ + \,\,~{\raise0.5ex\hbox{$\scriptstyle m$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 2$}}{{{\text{H}}}_{2}}{\text{O}}{\text{.}}$Здесь НmГПК-x (H3 +x + m${\text{PV}}_{m}^{{{\text{IV}}}}{\text{V}}_{{x - m}}^{{\text{V}}}$Mo12– xO40) – восстановленная форма ГПК-х; m – степень восстановления раствора ГПК-х, вычисляемая по формуле: m = [V(IV)]∑/[ГПК-х]. Значение m может изменяться в интервале от 0 до х (0 ≤ m ≤ х).
На первой стадии этого процесса (бутиленовая реакция) н-бутилен при 50–60°С окисляется комплексом Pd(II) в МЭК, а образовавшийся Pd(0) сразу же окисляется в Pd(II) Mo–V–Р-гетерополикислотой. Таким образом, в ходе реакции (I) наряду с образованием продукта происходит постепенное восстановление раствора ГПК-х, глубина которого зависит от концентрации в нем V(V). Далее, после отпарки МЭК, раствор катализатора на стадии (II) регенерируется кислородом (воздухом) при температурах 160–190°С и ${{P}_{{{{{\text{O}}}_{2}}}}}$ = = 0.4 МПа (кислородная реакция) [18]. После регенерации окисленный раствор катализатора Pd(II) + ГПК-х готов вновь готов к использованию в качестве обратимо действующего окислителя на следующем цикле каталитической реакции окисления н-бутилена кислородом. Следовательно, в нестационарном двухстадийном (I) + (II) каталитическом МЭК-процессе ГПК-x (обратимо действующий окислитель) фактически является компонентом катализатора Pd(II) + ГПК-х.
Новый МЭК-процесс прошел опытно-промышленные испытания, основные результаты которых были представлены в работе [18]. Установлено, что водный раствор катализатора на основе ГПК-х обладает большой коррозионной активностью в отношении большинства сталей. Как показали наши исследования [16], высокой коррозионной стойкостью в отношении этого катализатора отличается лишь титан. Именно поэтому при разработке технологии МЭК-процесса первоначально намечалось реализовать его в аппаратуре, полностью изготовленной из титана. Однако в ходе проектных работ выявилась необходимость использования спецсталей вместо титана для запорной и регулирующей арматуры, а также для отдельных узлов опытно-промышленной установки синтеза МЭК.
Применение спецсталей, пригодных для работы в контакте с катализатором Pd(II) + ГПК-х, многократно увеличило масштаб и сложность задач реализации МЭК-процесса. К ним, кроме определения стойкости сталей, добавилась трудно решаемая проблема преодоления негативного влияния продуктов коррозии на работоспособность, свойства и срок службы гомогенного катализатора. Для выхода из этой ситуации пришлось выполнить довольно большой объем исследований.
На основе детальных исследований коррозии пяти видов спецсталей, представленных в работе [16], нами были выбраны два наименее корродирующих образца. Лучшей заменой титану оказалась сталь 06ХН28МДТ (ЭИ-943), менее коррозионностойкими были сталь Х17Н13М2Т и подобная ей Х17Н13М3Т.
Зная состав продуктов коррозии этой группы сталей (Ме = Fe2+(3+), Cr3+, Ni2+) и экспериментально установив предельно допустимое (ПД) содержание катионов Ме в растворе катализатора (<0.1 М), для детального изучения мы искусственно ввели эти катионы в гомогенный катализатор, приготовленный на основе раствора ГПК-7 брутто-состава H10P3Mo18V7O84. Отметим, что именно раствор ГПК-7 был использован в качестве базового (наиболее стабильного и эффективного) для приготовления двухкомпонентного катализатора Pd(II) + ГПК-х, на котором осуществляли оптимизацию МЭК-процесса. Поэтому целый ряд фундаментальных исследований, в том числе физико-химических и коррозионных свойств, был проведен именно с раствором ГПК-7 [14, 17].
Подготовленные образцы Pd(II) + ГПК-7 с примесями различных Ме (см. ниже) были испытаны в нескольких циклах МЭК-процесса (бутиленовая + кислородная реакции). Кроме этого они были проверены на термостойкость. В настоящей работе представлены данные комплексного исследования влияния катионов переходных металлов на активность и стабильность катализатора в обеих стадиях МЭК-процесса. Выводы, сделанные на основе полученных данных, позволили осуществить оптимизацию гомогенного катализатора синтеза МЭК до опытно-промышленных испытаний [18, 19].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез раствора ГПК-7
Использованный в работе 0.25 М водный раствор ГПК-7 брутто-состава Н10Р3Мо18V7O84 синтезировали из V2O5, H3PO4, MoO3 и H2O2 по разработанной нами методике [12]. В начале синтеза V2O5 растворяли в охлажденном (4–5°C) и разбавленном растворе H2O2. Образовавшиеся пероксиванадиевые соединения самопроизвольно разлагались, давая разбавленный раствор H6V10O28, который сразу же стабилизировали добавлением избытка H3PO4. Полученный раствор дробно добавляли к постепенно упариваемой суспензии (MoO3 + H3PO4). В итоге получали гомогенный 0.25 М раствор ГПК-7, состав которого контролировали методом 31P и 51V ЯМР [22].
Приготовление образцов катализаторов, содержащих продукты коррозии спецсталей
Для испытаний в бутиленовой реакции был приготовлен ряд образцов катализаторов Pd(II) + + ГПК-7 с катионами металлов, являющимися продуктами коррозии спецсталей (Ме = Fe2+(3+), Cr3+, Ni2+). Для этого в исходный 0.25 М раствор ГПК-7 (H10P3Mo18V7O84) сначала вводили рассчитанное количество 0.1 M PdSO4 до получения [Pd] = 6 × 10–3 M, а затем стабилизатор палладия – фталоцианиновый лиганд Рс [20, 21] в концентрации 9 × 10–3 M, где Рс – это динатриевая соль дихлордисульфофталоцианина кобальта (производитель ООО “Химполимер”, г. Тамбов)11.
В итоге был подготовлен достаточный объем стандартного раствора катализатора, из которого путем его частичной нейтрализации готовили растворы катализаторов на основе кислых солей ГПК-7. Были получены катализаторы на основе солей следующих составов:
1. Ni0.2H9.6P3Mo18V7O84 (Ni0.2ГПК-7),
2. Fe0.2H9.4P3Mo18V7O84 (Fe0.2ГПК-7),
3. Fe0.1H9.7P3Mo18V7O84 (Fe0.1ГПК-7),
4. Cr0.2H9.4P3Mo18V7O84 (Cr0.2ГПК-7).
Так, катализатор Ni0.2ГПК-7 приготовлен введением в стандартный 0.25 М раствор катализатора на основе ГПК-7 (с Pd и Pc) навески основного карбоната Ni с последующим кипячением раствора в течение 5 мин. После охлаждения контролировали объем раствора (20 мл) и измеряли значение его редокс-потенциала Е.
Катализатор Fe0.2ГПК-7 получали введением в стандартный раствор катализатора точной навески железной проволоки. Раствор кипятили в течение 40–50 мин до ее полного растворения. Из охлажденного раствора при стоянии в течение суток выпало некоторое количество осадка оранжевого цвета, который при повторном кипячении раствора в течение 15 мин растворился. После охлаждения контролировали объем раствора (20 мл) и измеряли значение Е.
Катализатор Fe0.1ГПК-7 был синтезирован аналогично катализатору Fe0.2ГПК-7. После приготовления и контроля объема (20 мл) раствора также определяли значение Е.
Катализатор Cr0.2ГПК-7 готовили из навески CrO3, которую растворяли в заданном объеме стандартного раствора катализатора, после чего к нему добавляли расчетное количество 10 М раствора гидразин-гидрата, требуемое для восстановления Cr(VI) в Cr(III), без восстановления самой ГПК-7. Раствор кипятили в течение 5 мин, охлаждали, контролировали объем (20 мл) и измеряли значение Е.
Измерение редокс-потенциалов растворов катализаторов
Величины редокс-потенциалов E окисленных и восстановленных растворов катализаторов определяли при комнатной температуре на pH-метре InoLab pH 730 (“Wissenschaftlich-Technische Werkstatten GmbH”, Германия) с использованием комбинированного Pt-электрода SenTix ORP. Постоянство значений Е достигалось за 1 мин с точностью до ±0.001 В. Значения Е в настоящей работе приведены относительно нормального водородного электрода (НВЭ).
Бутиленовая реакция (I)
Бутиленовую реакцию (взаимодействие н-бутилена с раствором Pd(II) + МеГПК-7) исследовали при атмосферном давлении в термостатированном встряхиваемом стеклянном реакторе – каталитической “утке” объемом 170 мл. Аналогично методике, детально описанной в [23], сначала через реактор с 20 мл катализатора продували C4H8 без барботажа, затем соединяли реактор с бюреткой, заполненной н-бутиленом, и начинали встряхивание. При частоте встряхивания реактора 1200 мин−1 реакция протекала в кинетической области. Ниже на рис. 1–6 представлены зависимости объемов н-C4H8, поглощенных растворами Pd(II) + МеГПК-7, от времени. Скорость реакции определяли на начальном участке кинетической кривой, на котором она была постоянной. Селективность бутиленовой реакции контролировали методом ГЖХ на хроматографе Хромос ГХ-1000 (Россия) [23].
Рис. 1.
Окисление н-бутилена в МЭК в присутствии катализатора Ni0.2ГПК-7, 5 циклов. Номер кривой соответствует номеру цикла, 6 – стандартный катализатор без катионов. Условия: Vкат = 20 мл; Т = 60°С (см. табл. 1).
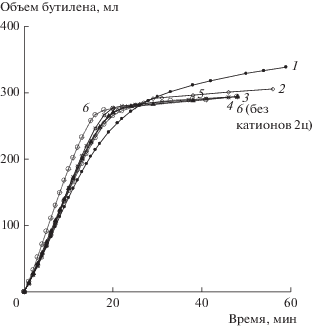
Рис. 2.
Окисление н-бутилена в МЭК в присутствии катализатора Fe0.2ГПК-7, 5 циклов. Номер кривой соответствует номеру цикла, 6 – стандартный катализатор без катионов. Условия: Vкат = 20 мл; Т = 60°С (см. табл. 2).
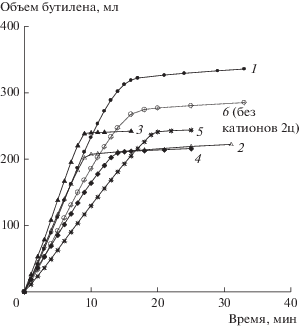
Рис. 3.
Окисление н-бутилена в МЭК в присутствии катализатора Fe0.1ГПК-7, 5 циклов. Номер кривой соответствует номеру цикла, 6 – стандартный катализатор без катионов. Условия: Vкат = 20 мл; Т = 60°С (см. табл. 3).
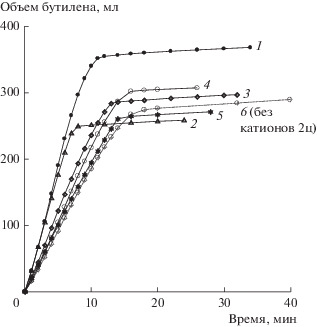
Рис. 4.
Окисление н-бутилена в МЭК в присутствии катализатора Cr0.2ГПК-7, 5 циклов. Номер кривой соответствует номеру цикла, 6 – стандартный катализатор без катионов. Условия: Vкат = 20 мл; Т = 60°С (см. табл. 4).
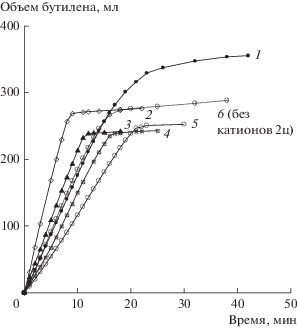
Рис. 5.
Окисление н-бутилена в МЭК в присутствии катализатора ГПК-7 (без дополнительных катионов), 5 циклов. Номер кривой соответствует номеру цикла. Условия: Vкат = 20 мл; Т = 60°С (см. табл. 5).
Регенерация катализаторов по реакции (II)
Регенерацию растворов катализаторов Pd(II) + + МеГПК-7 проводили в термостатированном автоклаве со стеклянным вкладышем при температурах 160−190°С и РО2 = 0.4 МПа по методике [13] с перемешиванием, дополнительные условия указаны в подписях к таблицам.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследования влияния продуктов коррозии спецсталей на эффективность гомогенного двухкомпонентного катализатора синтеза МЭК были начаты с катализатора, приготовленного на основе Ni0.2ГПК-7. Следует отметить, что у стандартного (исходного) 0.25 М раствора ГПК-7 значение Е составляет 1.090 В, однако после введения 0.2 молей Ni на моль ГПК-7 потенциал снизился и стал равным 1.044 В. При стоянии приготовленного раствора (20 мл) в течение 3 дней на дне стаканчика появились следы осадка светло-коричневого цвета (соединения ванадия), который при кипячении растворился. После этого катализатор Ni0.2ГПК-7 (концентрации Pd и Рс приведены в таблицах) был испытан в 5 циклах бутиленовой реакции. Полученные результаты представлены в табл. 1 и на рис. 1.
Таблица 1.
Испытание катализатора Ni0.2ГПК-7 в 5 циклах окисления н-С4Н8 в МЭК*
| № цикла | Ео, В | τбут, мин |
Vбут, мл (∆m) |
Wбут средн. за 10 мин, мл/мин |
Евосст, В | τкисл, мин |
Еокисл, В |
Примечания |
|---|---|---|---|---|---|---|---|---|
| 1 | 1.044 | 59 | 320 (5.43) | 14.1 | 0.510 | 40 | 1.000 | После опыта на “утке” есть налет Pdмет, который растворяется в окисленном катализаторе |
| 2 | 1.000 | 56 | 288 (4.56) | 15.2 | 0.509 | 40 | 0.978 | » |
| 3 | 0.978 | 48 | 279.5 (4.40) | 15.6 | 0.506 | 30 | 1.000 | » |
| 4 | 1.000 | 41 | 278.6 (4.46) | 15.6 | 0.506 | 30 | 0.979 | » |
| 5 | 0.979 | 37 | 279.3 (4.48) | 15.1 | 0.510 | 30 | 0.980 | » |
Испытания вышеуказанного катализатора показали, что при введении Ni стабильность палладия в растворе ухудшается. При полном восстановлении раствора катализатора на основе Ni0.2ГПК-7 уже на первом цикле часть палладия в виде черного налета осаждалась на стенках реактора и электродах при измерении значения Е. Можно заключить, что Ni+2 конкурирует с Pd(0) за координационное место в молекуле фталоцианина кобальта (Рс). Тем не менее, после окисления восстановленного раствора катализатора (регенерации) в течение 30 мин при 190°С его активность в реакции (I) на последующих 4-х циклах оставалась такой же, как и на 1-м цикле. Это значит, что весь Pd-металл, выделившийся в виде “зеркала” из восстановленного раствора катализатора на основе Ni0.2ГПК-7 при значительном снижении Е в ходе бутиленовой реакции до значения Евосст = 0.506–0.510 В (табл. 1), полностью растворялся в процессе кислородной реакции (II) с ростом Еокисл раствора до 1.000 В.
Анализируя данные табл. 1, следует отметить, что при уменьшении времени регенерации катализатора (τкисл) с 40 до 30 мин глубина его окисления (Еокисл) практически не изменяется. Следовательно, можно сделать вывод, что при температуре 190°С время 30 мин – вполне достаточное для полного окисления восстановленной формы катализатора.
Значение окислительного потенциала следующего раствора катализатора на основе Fe0.2ГПК-7 (Е = 1.040 В) близко к значению Е катализатора Ni0.2ГПК-7 (Е = 1.044 В), что объясняется почти одинаковым снижением кислотности растворов при введении в них катионов Ni и Fe в равных концентрациях, а не природой этих катионов. После повторного кипячения раствор Fe0.2ГПК-7 простоял еще 4 дня. На дне стаканчика замечен небольшой коричневый желеобразный осадок, видимо, гидроксиды Fe(III). С этим осадком катализатор и был испытан в 5 циклах бутиленовой реакции, результаты приведены в табл. 2 и на рис. 2.
Таблица 2.
Испытание катализатора Fe0.2ГПК-7 в 5 циклах окисления н-С4Н8 в МЭК*
| № цикла | Е0, В |
τбут, мин |
Vбут, мл (∆m) |
Wбут средн. за 10 мин, мл/мин |
Евосст, В | τкисл, мин |
Еокисл, В |
Примечания |
|---|---|---|---|---|---|---|---|---|
| 1 | 1.040 | 33 | 324.4 (5.23) |
23.2 | 0.518 | 20 | 0.906 | До опыта в растворе был желеобразный осадок. После опыта Pdмет нет |
| 2 | 0.906 | 31 | 211.8 (3.48) |
20.6 | 0.521 | 20 | 0.959 | До опыта был небольшой осадок |
| 3 | 0.959 | 16 | 236.2 (3.86) |
23.9 | 0.520 | 20 | 0.917 | До опыта был небольшой светл. осадок. На “утке” − Pdмет |
| 4 | 0.917 | 25 | 207.3 (3.39) |
16.3 | 0.519 | 20 | 0.963 | До опыта был небольшой светл. осадок. После реакции (I) много Pdмет, он не весь растворился в регенерир. катализаторе |
| 5 | 0.979 | 37 | 279.3 (4.48) |
12.9 | 0.516 | 20 | 0.949 | » |
Уже после первого цикла желеобразный осадок растворился и больше не появлялся, но появились следы светло-коричневого осадка (видимо, V2O5), который выделялся только из раствора регенерированного катализатора. В ходе испытаний масса твердой фазы не нарастала.
Следует заметить, что из восстановленного раствора на основе Fe0.2ГПК-7 металлический палладий выделялся в бόльшей степени, чем из катализатора Ni0.2ГПК-7, то есть катионы Fe(III) сильнее снижают стабильность восстановленного палладия. Из данных табл. 2 следует, что в присутствии Fe0.2ГПК-7 значение Е предельно восстановленного раствора катализатора составляет 0.516–0.521 В, что несколько выше, чем в случае Ni0.2ГПК-7.
Для получения дополнительных данных о необходимой длительности кислородной реакции время регенерации этого катализатора было снижено с 30 до 20 мин. Судя по значению Еокисл, за 20 мин при 190°С такой катализатор явно не успевает достаточно глубоко окислиться (Еокисл = = 0.950–0.960 В), поэтому и Pd не полностью возвращается в раствор. Это отражает снижение средней скорости бутиленовой реакции Wбут на 4-м и 5-м циклах (табл. 2).
Для определения предельно допустимой (ПД) концентрации железа в растворе был испытан также катализатор, содержащий в 2 раза меньше катионов железа (Fe0.1ГПК-7). После приготовления раствор стоял 2 дня без выделения осадков, в нем была лишь легкая муть. С этим катализатором проведено 5 циклов окисления н-C4H8 (табл. 3, рис. 3).
Таблица 3.
Испытание катализатора Fe0.1ГПК-7 в 5 циклах окисления н-С4Н8 в МЭК*
| № цикла | Е0, В | τбут, мин |
Vбут, мл (∆m) |
Wбут средн. за 10 мин, мл/мин |
Евосст, В | τкисл, мин |
Еокисл, В |
Примечания |
|---|---|---|---|---|---|---|---|---|
| 1 | 1.066 | 34 | 357.3 (5.79) |
33.9 | 0.518 | 20 | 0.966 | Исх. раствор гомогенный. После реакции (I) следы Pdмет |
| 2 | 0.966 | 24 | 250.6 (4.08) |
25.1 | 0.515 | 30** | 1.000 | После реакции (I) следы Pdмет |
| 3 | 1.000 | 32 | 286.6 (4.65) |
23.5 | 0.516 | 30 | 1.018 | До опыта раствор гомогенный. После реакции (I) не отмечено Pdмет |
| 4 | 1.018 | 26 | 268.8 (4.89) |
21.7 | 0.516 | 30 | 0.982 | Есть следы Pdмет в восст. растворе |
| 5 | 0.982 | 28 | 262.1 (4.23) |
19.4 | 0.519 | 30 | 0.980 | Заметное кол-во Pdмет, особенно при отпарке МЭК |
В первых двух циклах бутиленовой реакции он работал с очень высокой скоростью, превосходящей скорость реакции с раствором без дополнительных катионов (2-ой цикл для стандартного раствора катализатора показан пунктиром на рис. 3, кривая 6). Это происходило вследствие того, что катионы железа вытесняли палладий из его комплекса с фталоцианином кобальта, а аквакомплекс Pd, как известно, имеет значительно бóльшую активность в бутиленовой реакции [24]. На последующих циклах активность катализатора Fe0.1ГПК-7, как и Fe0.2ГПК-7, систематически снижалась (сравнить рис. 2 и 3).
Результаты, полученные при увеличении времени регенерации катализатора на основе Fe0.1ГПК-7 с 20 до 30 мин (табл. 3), свидетельствуют, что за 30 мин при 190°С раствор успевает достаточно глубоко окислиться, достигая значения Еокисл ~ 0.980 В. Тем не менее, более длительное время регенерации раствора не улучшило устойчивость палладиевого компонента катализатора. Скорость бутиленовой реакции при введении Fe в раствор сначала резко возрастает (сравнить кривые 1 и 6 на рис. 2 и 3), но от цикла к циклу она постепенно падает вследствие снижения устойчивости Pd и его потерь в виде осадков металла на аппаратуре. В присутствии Fe0.1ГПК-7 значение Е предельно восстановленного раствора катализатора варьирует от 0.515 до 0.519 В. Восстановленный раствор Fe0.1ГПК-7, как и Fe0.2ГПК-7, после 4-го и 5-го циклов выделяет заметное количество металлического палладия.
Наконец, был испытан катализатор на основе Cr0.2ГПК-7. Оказалось, что при введении 0.2 молей Сr на моль ГПК-7 значение Е = 1.081 В, т.е. по сравнению с катионами никеля и железа значение Е в присутствии хрома снижается в меньшей степени (от стандартного значения 1.090 В). Раствор Cr0.2ГПК-7 стоял 3 дня и остался гомогенным. Затем он был испытан в 5 циклах бутиленовой реакции (табл. 4, рис. 4).
Таблица 4.
Испытание катализатора Cr0.2ГПК-7 в 5 циклах окисления н-С4Н8 в МЭК*
| № цикла | Е0, В | τбут, мин |
Vбут, мл (∆m) |
Wбут средн. за 10 мин, мл/мин |
Евосст, В | τкисл, мин |
Еокисл, В |
Примечания |
|---|---|---|---|---|---|---|---|---|
| 1 | 1.081 | 42 | 342.5 (5.62) |
17.6 | 0.520 | 20 | 0.988 | До опыта раствор гомогенный. После опыта не отмечено Pdмет |
| 2 | 0.988 | 22 | 269.4 (4.40) |
29.8 | 0.518 | 20 | 0.962 | » |
| 3 | 0.962 | 18 | 235.3 (3.85) |
21.3 | 0.514 | 20 | 0.963 | До опыта был незначительный светлый осадок. После опыта есть Pdмет |
| 4 | 0.963 | 25 | 235.2 (3.82) |
15.0 | 0.518 | 30** | 0.976 | До опыта был незначительный светлый осадок. Следы Pd в восст. растворе |
| 5 | 0.976 | 30 | 243.2 (3.98) |
11.6 | 0.520 | 20 | 0.960 | В исходном растворе – легкая муть. После опыта есть Pdмет |
На первом цикле активность в бутиленовой реакции раствора Cr0.2ГПК-7 совпадает с активностью ГПК-7 без катионов, на втором цикле она резко возрастает, а затем от цикла к циклу постепенно падает. Значение E предельно восстановленного раствора катализатора на основе Cr0.2ГПК-7 находится в интервале 0.514–0.520 В.
Увеличение времени регенерации этого катализатора с 20 до 30 мин не стабилизирует его активность в реакции (I), поскольку за 30 мин он не окисляется достаточно глубоко (до Еокисл > 0.98 В). С 3-го цикла отмечено выделение Pdмет из восстановленного катализатора (табл. 4).
Анализируя данные по поведению 4-х разных растворов катализаторов на основе кислых солей переходных металлов, можно заключить, что стабильность палладия в растворе катализатора Cr0.2ГПК-7 ниже, чем в стандартном растворе, однако его устойчивость в растворе Fe0.2ГПК-7 еще хуже, чем в Cr-содержащем катализаторе.
Таким образом, проведенное исследование доказало, что появление в гомогенном катализаторе синтеза МЭК катионов переходных металлов, являющихся продуктами коррозии спецсталей, заметно ухудшает стабильность катализатора Pd(II) + ГПК-7. В нем накапливаются железосодержащие осадки; предположительно это гидроксид железа(III) и ванадат железа(III) – FeVO4. Наряду с провоцированием осадкообразования катионы переходных металлов снижают стабильность Pd(0) в восстановленном катализаторе, так как конкурируют с палладием за координационное место в молекуле фталоцианинового лиганда Рс и вытесняют его из комплекса Pd0Pc. Это приводит к образованию фазы Pdмет и постепенному снижению концентрации палладия в растворе катализатора.
Дополнительная проверка стабильности палладия в стандартном растворе катализатора на основе свободной ГПК-7 (без дополнительного введения катионов Ме) в 5 циклах реакции окисления бутилена в МЭК показала, что этот катализатор сохраняет гомогенность. Металлический палладий из восстановленных растворов не выделяется (табл. 5, рис. 5), поэтому его активность в реакции (I) постоянна. Предельно восстановленный катализатор на основе свободной ГПК-7 имеет значения Евосст в интервале 0.508–0.511 В.
Таблица 5.
Испытание катализатора на основе ГПК-7 (без дополнительных катионов металлов) в 5 циклах окисления н-С4Н8 в МЭК*
| № цикла | Е0, В |
τбут, мин |
Vбут, мл (∆m) |
Wбут средн. за 10 мин, мл/мин |
Евосст, В | τкисл, мин |
Еокисл, В |
Примечания |
|---|---|---|---|---|---|---|---|---|
| 1 | 1.090 | 52 | 353.2 (5.70) |
17.2 | 0.508 | 30 | 1.000 | Осадков нет |
| 2 | 1.000 | 47 | 279.3 (4.49) |
18.6 | 0.511 | 30 | 1.002 | » |
| 3 | 1.002 | 46 | 276.3 (4.44) |
18.3 | 0.509 | 30 | 0.973 | » |
| 4 | 0.973 | 33 | 251.0 (4.10) |
20.3 | 0.510 | 20* | 0.963 | До опыта была легкая муть. После реакции (I) Pdмет нет |
| 5 | 0.963 | 38 | 259.5 (4.21) |
20.9 | 0.510 | 30 | 0.984 | В исходном растворе легкая муть. Pdмет не выделяется |
Следует отметить, что при снижении времени реакции (II) для стандартного катализатора c 30 до 20 мин (табл. 5) заметно снижается Еокисл. Поэтому заключаем, что регенерацию катализатора нужно проводить не менее 30 мин. Кроме того, в стандартном растворе на 1–2 циклах возможно образование весьма незначительного осадка (вероятно, V2O5), масса которого впоследствии не возрастает (его не отфильтровывали).
Полученные данные о влиянии продуктов коррозии спецсталей (катионов переходных металлов) на свойства и устойчивость гомогенного катализатора Pd(II) + ГПК-7 (H10P3Mo18V7O84) двухстадийного окисления н-бутилена кислородом в МЭК позволили сделать ряд важных выводов. Во-первых, раствор ГПК-7 как компонент катализатора был все-таки недостаточно стабилен в окисленной форме катализатора (при 190°C после кислородной реакции): в ходе многоцикловых испытаний наблюдалось постепенное накопление ванадийсодержащих осадков. Во-вторых, палладиевый компонент катализатора – комплекс Pd0 с фталоцианиновым лигандом (Pd0Pc) – был неустойчив в растворе полностью восстановленного катализатора при температурах 60–100°C. В этом случае после реакции (I) и на стадии отпарки МЭК наблюдалось появление палладиевого “зеркала”.
Подтверждено (табл. 5 и рис. 5), что нестабильность катализатора всегда проявлялась только в присутствии продуктов коррозии Ме в предельно допустимых концентрациях. Она выражалась в систематическом снижении активностей катализатора в бутиленовой и кислородной реакциях и выпадении осадков. Так, из окисленной формы катализатора при 190°C выпадали осадки, уносившие из раствора Ме-ионы и часть ванадия, однако эти осадки никогда не содержали палладия. Из раствора же полностью восстановленной формы катализатора постепенно выпадал только палладий, тогда как продукты коррозии Ме и ГПК-7 были вполне устойчивы и не выделяли осадков из восстановленных растворов во всем диапазоне температур 20–190°C.
Здесь будет к месту упомянуть исследования термостойкости катализаторов, выполненные нами при изучении коррозии спецсталей в растворах ГПК-х [16]. Если катионы Ni2+ не изменяют термостойкость катализаторов, то катионы Cr3+ и особенно Fe3+ (при [Fe3+] > 0.025 M) значительно ухудшают ее. Катионы Cr3+ и Fe3+ инициируют образование осадков, в основном из соединений ванадия. Эти осадки не растворяются в катализаторе в процессе циклической работы и поэтому ведут к снижению его производительности, поскольку именно атомы ванадия в растворах ГПК-х претерпевают редокс-превращения: V(V) → V(IV) → V(V). В результате встает необходимость периодической фильтрации катализатора на основе ГПК-х и коррекции его состава добавлением потерянной части ванадия.
В отдельных опытах без введения в раствор катионов Ме было показано, что 2–4-часовая выдержка стандартного катализатора Pd(II) + ГПК-7 при 190°С приводит к осадкообразованию. Это обусловлено тем, что исходный раствор катализатора уже содержал Fe3+-ионы (~0.05 M), внесенные с V2O5 х. ч. в процессе синтеза раствора ГПК-7 по методике [12], поэтому при длительной высокотемпературной выдержке даже при малых концентрациях катионов Fe3+ нестабильность катализатора проявлялась.
Для многочасовых коррозионных исследований использовали полностью окисленный 0.25 М раствор ГПК-7, имеющий очень низкие значения рН ~ –0.25 и высокое значение Е = 1.090 В. Этот раствор, обладающий максимальной коррозионной активностью, сильнее всего дестабилизировал образец стали 12Х18Н10Т, наиболее сильно подвергавшийся коррозии и поставлявший в раствор катионы Fe3+ [16].
Совокупность данных по активности катализатора синтеза МЭК на основе раствора ГПК-7 в реакциях (I) и (II), а также по коррозии образцов спецсталей [16] привела к заключению, что состав указанного катализатора не является оптимальным.
Изменение физико-химических свойств катализаторов с разным содержанием продуктов коррозии
Для оценки всестороннего влияния продуктов коррозии Ме на состояние катализатора синтеза МЭК необходимо было оценить изменения его физико-химических свойств в присутствии катионов переходных металлов. С этой целью по методикам, детально описанным в работах [14, 17], для трех образцов катализаторов на основе ГПК-7 с разными катионами Ме были исследованы изменения плотности и вязкости раствора ГПК-7 (определяющего компонента катализатора) в окисленном и восстановленном состоянии при разных температурах и разных степенях восстановления ГПК-7 (m = [V(IV)]∑/[ГПК-7]). Среди исследованных были катализаторы на основе Ni0.2H9.6P3Mo18V7O84, Fe0.2H9.4P3Mo18V7O84 и Cr0.2H9.4P3Mo18V7O84.
Результаты измерений (табл. 6–8) показали, что при введении в стандартный раствор катализатора катионов Ni+2, Fe+3 и Cr+3 в концентрациях 5 × 10–2 М плотность растворов существенным образом не изменяется. В присутствии всех этих катионов значение ρ лишь несущественно возрастает по сравнению со стандартным раствором.
Таблица 6.
Зависимость плотности (ρ) 0.25 M растворов Ni0.2H9.4P3Mo18V7O84 от степени восстановления (m) при разных температурах
| Степень восстанов-ления m | Плотность ρ, г/см3 | ||||
|---|---|---|---|---|---|
| температура, °С | |||||
| 50 | 60 | 70 | 80 | 90 | |
| 0.35* | 1.682 | 1.675 | 1.668 | 1.662 | 1.659 |
| 0.35 | 1.685 | 1.680 | 1.673 | 1.666 | 1.663 |
| 2.12 | 1.689 | 1.686 | 1.675 | 1.669 | 1.665 |
| 4.22 | 1.691 | 1.688 | 1.676 | 1.671 | 1.666 |
| 6.10 | 1.692 | 1.689 | 1.678 | 1.672 | 1.667 |
Таблица 7.
Зависимость плотности (ρ) растворов 0.25 M Fe0.2H9.4P3Mo18V7O84 от степени восстановления (m) при разных температурах
| Степень восстанов-ления m | Плотность ρ, г/см3 | ||||
|---|---|---|---|---|---|
| температура, °С | |||||
| 50 | 60 | 70 | 80 | 90 | |
| 0.35* | 1.682 | 1.675 | 1.668 | 1.662 | 1.659 |
| 0.35 | 1.686 | 1.681 | 1.674 | 1.668 | 1.663 |
| 2.12 | 1.690 | 1.686 | 1.677 | 1.672 | 1.666 |
| 4.22 | 1.692 | 1.690 | 1.678 | 1.674 | 1.667 |
| 6.10 | 1.694 | 1.691 | 1.679 | 1.675 | 1.668 |
Таблица 8.
Зависимость плотности (ρ) растворов 0.25 M Cr0.2H9.4P3Mo18V7O84 от степени восстановления (m) при разных температурах
| Степень восстанов-ления m | Плотность ρ, г/см3 | ||||
|---|---|---|---|---|---|
| температура, °С | |||||
| 50 | 60 | 70 | 80 | 90 | |
| 0.35* | 1.682 | 1.675 | 1.668 | 1.662 | 1.659 |
| 0.35 | 1.685 | 1.680 | 1.673 | 1.666 | 1.662 |
| 2.12 | 1.690 | 1.685 | 1.676 | 1.670 | 1.665 |
| 4.22 | 1.692 | 1.688 | 1.678 | 1.673 | 1.667 |
| 6.10 | 1.693 | 1.690 | 1.679 | 1.674 | 1.667 |
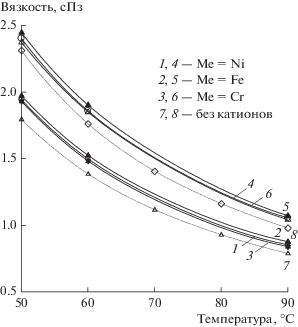
Для этих же трех растворов с катионами переходных металлов была измерена вязкость (табл. 9). Зависимости η от температуры для трех окисленных (m = 0.35) и восстановленных (m = 6.1) растворов, а также для стандартного раствора катализатора без катионов при тех же степенях восстановления представлены на рис. 6. Видно, что вязкость растворов с продуктами коррозии спецсталей несколько более заметно (по сравнению с плотностью) возрастает относительно вязкости раствора свободной ГПК-7. При этом природа катиона принципиально не оказывает воздействие на величину η, влияет только концентрация продуктов коррозии – катионов переходных металлов. Но это влияние существенным назвать нельзя, поскольку изменения η не превышают 7–8%.
Таблица 9.
Зависимость вязкости (η) 0.25 M растворов Me0.2H9.6P3Mo18V7O84 (Me = Ni, Fe, Cr) от температуры при разных степенях восстановления (m)
| Степень восстанов-ления m | Вязкость η, сПз | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| температура, °С | |||||||||
| 50 | 60 | 90 | |||||||
| Ni | Fe | Cr | Ni | Fe | Cr | Ni | Fe | Cr | |
| 0.35* | 1.7935 | 1.7935 | 1.7935 | 1.3836 | 1.3836 | 1.3836 | 0.7879 | 0.7879 | 0.7879 |
| 0.35 | 1.9402 | 1.9715 | 1.9290 | 1.4970 | 1.5231 | 1.4810 | 0.8510 | 0.8757 | 0.8339 |
| 6.10 | 2.4004 | 2.4451 | 2.3718 | 1.8573 | 1.9008 | 1.8490 | 1.0542 | 1.0704 | 1.0415 |
Анализ полученных данных позволил сделать вывод о том, что продукты коррозии спецсталей весьма мало изменяют основные физико-химические свойства катализатора Pd(II) + ГПК-7, поэтому их действием на эти свойства в ходе длительных циклических испытаний катализатора по реакциям (I) + (II) можно пренебречь. Однако этого не скажешь об устойчивости катализаторов.
Анализ совокупности результатов исследования устойчивости, активности в реакциях (I) и (II) и термостойкости катализатора Pd(II) + ГПК-7 позволил заключить, что в окисленной форме раствор на основе ГПК-7 недостаточно стабилен в присутствии предельно допустимых (<0.1 М) концентраций Ме – продуктов коррозии спецсталей. Источником катионов переходных металлов является арматура опытно-промышленной установки синтеза МЭК. Следовательно, для получения высокотехнологичного катализатора МЭК-процесса необходимо было оптимизировать финальный состав ГПК-х. Катализатор должен сохранять гомогенность и высокую окислительную емкость в присутствии ПД концентраций переходных металлов в ходе опытных работ.
Экспериментальным путем было установлено, что устойчивость раствора ГПК-х можно повысить только изменением его состава в направлении увеличения содержания фосфора. В результате вместо стандартного раствора на основе ГПК-7 (H10P3Mo18V7O84) был предложен новый раствор на основе ГПК-7' оптимизированного состава (H11P4Mo18V7O87).
Новый катализатор Pd(II) + ГПК-7' был достаточно стабилен в области ПД концентраций ионов Ме как в окисленной форме (до 190°C), так и в восстановленной (при 60–100°C). Однако при концентрациях продуктов коррозии, превышающих ПД (т.е. [Me] > 0.1 M), осадки в растворе катализатора все-таки могли появляться. В таких случаях в ходе циклических испытаний из окисленного раствора катализатора (после регенерации) осадки удаляли фильтрованием, определяли их массу и элементный состав. Установлено, что в осадок обычно уходила основная масса продуктов коррозии Ме и небольшая часть ванадия в виде смешанных оксидов. Если потеря ванадия превышала 8–10% от его содержания в растворе ГПК-7', то проводили коррекцию состава катализатора по ванадию. В результате отфильтровывание осадков позволяло очистить катализатор от основной массы продуктов коррозии Ме в том случае, когда их концентрации были больше предельно допустимых. Это значительно облегчало прокачивание раствора катализатора по замкнутому циклу опытно-промышленной установки [18].
Задача обеспечения устойчивости палладия в восстановленной форме нового катализатора в присутствии катионов Ме была решена путем компенсации потерь фталоцианинового лиганда Рс, который уносился из раствора с осадками, вызванными продуктами коррозии, а также постепенно выгорал во время экспозиции в окислительной среде при высокой температуре (кислородная реакция при 180–190°C).
В опытах по контролю активности нового катализатора в бутиленовой реакции убыль Рс в растворе проявлялась в резком возрастании скорости реакции (I), по завершении которой палладий частично осаждался в виде черного налета на стенках реактора. Выпавший Pd легко возвращался в раствор при контакте с окисленной формой ГПК-7'. После добавления Рс палладий стабилизировался в растворе и не выпадал из восстановленного катализатора, пока в нем присутствовал Рс. Описанный метод возвращения палладия из фазы Pdмет в раствор был использован при отработке технологии МЭК-процесса на опытно-промышленной установке, когда периодически (при необходимости) отключали подачу бутилена и циркулировали окисленный раствор катализатора (с высоким Еокисл) в замкнутом цикле опытной установки. В ходе такой процедуры Pdмет окислялся ГП-кислотой и переходил со стенок аппаратуры в раствор катализатора, возвращая его активность к исходному значению [18].
В итоге проведенные исследования показали, что при изменении состава гомогенного катализатора синтеза МЭК с Pd(II) + ГПК-7 на Pd(II) + + ГПК-7' удалось резко уменьшить его чувствительность к присутствию продуктов коррозии Ме. В результате, по нашей оценке, скорость образования осадков была снижена примерно в 300–350 раз. Их возникновение в малых количествах возможно лишь при длительной эксплуатации катализатора (в течение нескольких месяцев). Именно катализатор оптимизированного состава на основе раствора ГПК-7' или его кислой натриевой соли (Na1.2ГПК-7') был запатентован нами в качестве гомогенного двухкомпонентного катализатора МЭК-процесса [20, 21].
Было подтверждено, что окислительная емкость катализатора Pd(II) + ГПК-7' четко пропорциональна концентрации V(V) в растворе, т.е. степени восстановления m. Базовые зависимости Е и рН от m для оптимизированного катализатора на основе ГПК-7' и его кислой натриевой соли состава Na1.2ГПК-7' в сравнении со стандартным раствором ГПК-7 представлены на рис. 7.
Рис. 7.
Зависимости Е (кривые 1–3) и рН (кривые 1'–3') от m для 0.25 М растворов катализаторов, содержащих: Н10P3Mo18V7O84 (1, 1'), H11P4Mo18V7O87 (2, 2') и Na1.2H9.8P4Mo18V7O87 (3, 3').
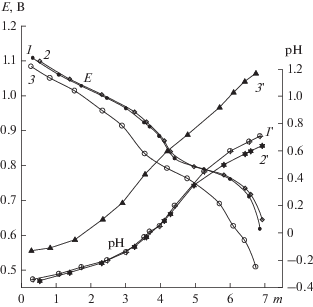
Видно, что значения Е растворов ГПК-7 и ГПК-7' практически не различаются, в то время как Е раствора Na1.2ГПК-7' при тех же самых значениях m заметно ниже. Тем не менее, этот вариант катализатора интересен тем, что время кислородной реакции, скорость которой существенно возрастает при снижении кислотности раствора ГПК-х [13], в присутствии Na1.2ГПК-7' может быть уменьшено. Катализатор этого состава сохраняет свою активность в бутиленовой реакции не менее 15 циклов [20, 21].
Из проведенных исследований сделан и еще один важный вывод. Он заключается в том, устойчивость палладия в растворах Pd(II) + ГПК-7' в ходе многоцикловых испытаний можно обеспечить и без введения фталоцианинового лиганда Рс. Для этого необходимо работать строго в области выше минимально допустимых концентраций V(V) в растворе. В этом случае значение ${{Е}_{{({{{\text{ГПК - 7}}{\kern 1pt} '} \mathord{\left/ {\vphantom {{{\text{ГПК - 7}}{\kern 1pt} '} {{{{\text{Н}}}_{{\text{m}}}}{\text{ГПК - 7}}{\kern 1pt} '}}} \right. \kern-0em} {{{{\text{Н}}}_{{\text{m}}}}{\text{ГПК - 7}}{\kern 1pt} '}})}}}$ будет оставаться выше значения ${{Е}_{{\left( {{{{\text{P}}{{{\text{d}}}^{{{\text{2}} + }}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{d}}}^{{{\text{2}} + }}}} {{\text{P}}{{{\text{d}}}_{{{\text{мет}}}}}}}} \right. \kern-0em} {{\text{P}}{{{\text{d}}}_{{{\text{мет}}}}}}}} \right)}}},$ что обеспечит быструю передачу электронов с Pd0 на ГПК-7' и предотвратит его агрегацию в виде фазы Pdмет. Точные значения редокс-потенциалов этих систем назвать трудно. Однако, по нашей экспериментальной оценке, область устойчивости восстановленного палладия находится в интервале 0 > m > 5.6–5.7 для степени восстановления ГПК-7', что ограничивает снизу значение Евосст раствора ГПК-х, который должен оставаться заведомо >0.77 В. То есть, если раствор Pd(II) + ГПК-7' не будет перевосстанавливаться во время реакции (I), то можно с высокой долей вероятности обеспечить стабильность палладия в гомогенном катализаторе и без стабилизатора.
ЗАКЛЮЧЕНИЕ
Таким образом, комплексное исследование влияния продуктов коррозии аппаратуры (катионов переходных металлов) на физико-химические и каталитические свойства, а также на термостойкость гомогенного двухкомпонентного катализатора Pd(II) + ГПК-х, разработанного для двухстадийного процесса окисления н-бутилена в метилэтилкетон кислородом, позволило провести эффективную оптимизацию катализатора МЭК-процесса, в результате которой был создан катализатор Pd(II) + ГПК-7'. В присутствии этого катализатора скорость образования осадков, вызванных продуктами коррозии аппаратуры из спецсталей, удалось снизить более чем в 300 раз, и именно на нем были проведены опытно-промышленные испытания МЭК-процесса.
Список литературы
Kozhevnikov I.V., Matveev K.I. // Appl. Catal. 1983. V. 5. № 2. P. 135.
Okuhara T., Mizuno N., Misono M. // Appl. Catal. A: General. 2001. V. 222. № 1. P. 63.
Kozhevnikov I.V. Catalysis by Polyoxometalates. Chichester: John Wiley, 2002. 202 p.
López X., Carbó J.J., Bo C., Poblet J.M. // Chem. Soc. Rev. 2012. V. 41. P. 7537.
Zhou Yu, Guo Z., Hou W., Wang Q., Wang J. // Catal. Sci. Technol. 2015. V. 5. P. 4324.
Wang S.S., Yang G.Yu. // Chem. Rev. 2015. V. 115. P. 4893.
Rodikova Yu.A., Zhizhina E.G., Pai Z.P. // Chem. Select. 2016. V. 1. P. 2113.
Duca G. Homogeneous Catalysis with Metal Complexes: Fundamentals and Applications. Springer (Springer Series in Chemical Physics), 2012. 480 p.
Alharbi K., Alharbi W., Kozhevnikova E.F., Kozhevnikov I.V. // ACS Catal. 2016. V. 6. P. 2067.
Гогин Л.Л., Жижина Е.Г. // Кинетика и катализ. 2020. Т. 61. № 4. С. 469.
Жижина Е.Г., Гогин Л.Л., Родикова Ю.А., Бухтияров В.И. // Кинетика и катализ. 2021. Т. 62. № 2. С. 135.
Odyakov V.F., Zhizhina E.G., Rodikova Yu.A., Gogin L.L. // Eur. J. Inorg. Chem. 2015. V. 2015. № 22. P. 3618.
Zhizhina E.G., Odyakov V.F. // Int. J. Chem. Kinet. 2014. V. 46. № 9. P. 567.
Zhizhina E.G., Odyakov V.F. // Appl. Catal. A: General. 2009. V. 358. № 2. P. 254.
Родикова Ю.А., Жижина Е.Г. // Кинетика и катализ. 2019. Т. 60. № 5. С. 1.
Zhizhina E.G., Odyakov V.F. // React. Kinet. Catal. Lett. 2009. V. 98. № 1. P. 51.
Жижина Е.Г., Одяков В.Ф. // Катализ в промышленности. 2010. № 2. С. 14.
Матвеев К.И., Жижина Е.Г., Одяков В.Ф., Пармон В.Н. // Катализ в промышленности. 2014. № 3. С. 32.
Одяков В.Ф., Жижина Е.Г., Матвеев К.И., Пармон В.Н. // Катализ в промышленности. 2015. № 1. С. 19.
Пaтeнт 2230612 PФ. Б. И. 2004. № 17. C. 389.
Пaтeнт 2275960 PФ. Б. И. 2006. № 13. C. 334.
Одяков В.Ф., Жижина Е.Г., Максимовская Р.И., Матвеев К.И. // Кинетика и катализ. 1995. Т. 36. № 5. С. 795.
Zhizhina E.G., Simonova M.V., Odyakov V.F., Matveev K.I. // Appl. Catal. A: General. 2007. V. 319. P. 91.
Zhizhina E.G., Odyakov V.F., Matveev K.I. // React. Kinet. Catal. Lett. 2007. V. 91. № 2. P. 325.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ