Кинетика и катализ, 2021, T. 62, № 5, стр. 619-632
Взаимодействие NO2 с наночастицами родия, нанесенными на поверхность высоко ориентированного пиролитического графита (ВОПГ) при комнатной температуре
М. Ю. Смирнов a, *, А. В. Калинкин a, А. Н. Саланов a, А. М. Сорокин a, В. И. Бухтияров a
a ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: smirnov@catalysis.ru
Поступила в редакцию 27.05.2021
После доработки 06.06.2021
Принята к публикации 06.06.2021
Аннотация
Методом вакуумного напыления приготовлены образцы наночастиц родия на поверхности высоко ориентированного пиролитического графита (ВОПГ) и исследовано их взаимодействие с диоксидом азота с применением методов рентгеновской фотоэлектронной спектроскопии (РФЭС) и растровой электронной микроскопии (РЭМ). В исходном состоянии частицы металлического родия с размером ∼2–5 нм собраны в агрегаты, локализованные на ступенях, а также на террасах, вероятно, в области расположения структурных дефектов. После обработки в NO2 при комнатной температуре и давлении 10–6 и 10–5 мбар наблюдается окисление углерода, сопровождаемое разрушением структуры 12–15 графеновых слоев на поверхности ВОПГ. В этих условиях родий сохраняет металлическое состояние, и происходит инкапсулирование частиц Rh углеродом. Проведено сравнение с результатами, полученными при взаимодействии NO2 с наночастицами Pt и Pd, нанесенными на поверхность ВОПГ.
Графический реферат
ВВЕДЕНИЕ
Активность нанесенных металлических катализаторов, ведущих окислительно-восстановительные процессы, зависит от степени окисления металла; при этом в одних реакциях активным является металлическое состояние, а в других – оксидное. Несмотря на то, что родий на углеродных носителях широко используется в качестве катализатора в различных процессах [1–13], в том числе протекающих в окислительной среде [14–19], лишь в единичных случаях определено, в какой степени окисления нанесенный родий проявляет каталитическую активность. С помощью метода рентгеновской фотоэлектронной спектроскопии (РФЭС) было показано, что в карбонилировании анилина этанолом в присутствии кислорода до этилфенилкарбамата на катализаторе Rh на активированном угле (Rh/AC) до и после проведения реакции родий пребывает в металлическом состоянии [14]. В реакции восстановления фенола до циклогексана на катализаторе Rh на мезопористом углероде примерно треть родия находится в состоянии, характеризуемом линией Rh3d5/2 с энергией связи Eсв = 309.6 эВ, что соответствует степени окисления +4, а остальные две трети – в металлическом состоянии (Eсв = 307.6 эВ) [8]. Предполагается, что активной фазой на пути образования целевого продукта – циклогексана – является металлический родий, но также допускается, что в реакции принимает участие электронный перенос с изменением состояния окисления родия Rh0$ \rightleftarrows $ Rhδ+. При проведении на катализаторах Rh/AC реакции гидроформилирования этилена в пропаналь, которая протекает при участии CO и молекулярного водорода, как скорость реакции, так и селективность возрастают при наличии активных окисленных центров Rhδ+ [1].
Для выяснения механизма влияния реакционной среды на состояние нанесенных на углерод наночастиц металла (в том числе и родия) в качестве модельных объектов часто используют системы, приготовленные вакуумным напылением металлов на поверхность высоко ориентированного пиролитического графита (ВОПГ) [20, 21]. Благодаря хорошей проводимости графита при исследовании таких систем методом РФЭС достигаются наилучшие спектральные характеристики. Кроме того, в отличие от образцов, в которых в качестве носителя используются оксиды, возникает возможность проводить анализ линии O1s и исследовать поверхностные состояния кислорода, формируемые под воздействием реакционной среды. В пользу корректности использования таких модельных систем для исследования механизма действия реальных катализаторов свидетельствует похожее поведение частиц платины, нанесенных на ВОПГ и на Сибунит, при их обработке в NO2 [22].
Ранее нами было обнаружено, что при взаимодействии модельной системы Pd/ВОПГ с NO2 при комнатной температуре углерод в составе ВОПГ окисляется, что приводит к разрушению >10 графеновых слоев c сохранением при этом у палладия металлического состояния [23, 24]. Было показано, что реакция окисления протекает при нанесении палладия как на исходный ВОПГ, отожженный в вакууме при 600°С [24], так и на ВОПГ, предварительно активированный травлением ионами аргона [23]. Полученный результат дает основание полагать, что частицы Pd могут служить катализатором низкотемпературного окисления сажи в выхлопных газах дизельных двигателей. Иная картина наблюдалась при исследовании модельных систем Pt/ВОПГ. Когда платина была нанесена на исходный ВОПГ, графит вступал в реакцию с NO2 лишь в незначительной степени; при этом платина сохраняла металлическое состояние [24, 25]. При взаимодействии NO2 с платиной, нанесенной на активированный ВОПГ, углерод окислялся в несколько большей степени, но и в этом случае структура поверхности графита не претерпевала серьезных изменений [26]. Частицы платины переходили при этом в окисленное состояние [25, 26]. Взаимодействие Ag и Au, нанесенных на поверхность активированного ВОПГ, с NO2 в аналогичных условиях также приводило к окислению частиц металлического серебра и золота до оксидов Ag2O и Au2O3 с сохранением целостности структуры у графита [27, 28].
В настоящей работе с применением методов рентгеновской фотоэлектронной спектроскопии (РФЭС) и растровой электронной микроскопии (РЭМ) исследуется взаимодействие NO2 с еще одним платиновым металлом – родием, нанесенным на ВОПГ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
РФЭ-спектры регистрировали с помощью фотоэлектронного спектрометра SPECS (Германия). Условия регистрации и обработки спектров подробно изложены в работах [23, 24]. Для изучения морфологии поверхностного слоя образцов Rh/ВОПГ применяли растровый электронный микроскоп Regulus 8230 (“Hitachi”, Япония) с холодной автоэмиссией при величинах энергии электронов зонда (Е0), равных 15 и 20 кэВ, в режиме вторичных электронов (ВЭ).
При проведении исследований в работе были использованы два образца Rh/ВОПГ с близкими поверхностными концентрациями нанесенного родия, обозначенные как Rh-1 и Rh-2. Они были получены в камере подготовки спектрометра вакуумным напылением металлического родия на поверхность ВОПГ, отожженную в вакууме при температуре 600°С в течение 30 мин. В РФЭ-спектрах образцов присутствовали только линии углерода и родия. Атомные отношения [Rh]/[C], рассчитанные для Rh-1 и Rh-2 из интенсивностей линий Rh3d и C1s с учетом факторов атомной чувствительности, взятых из справочника [29], равны 0.025 и 0.022 соответственно. Образец Rh-1 был использован для исследования морфологии исходного состояния системы Rh/ВОПГ методом РЭМ. Образец Rh-2 был подвергнут обработке в NO2 в камере подготовки РФЭС спектрометра с последующей регистрацией спектров, после чего он также был изучен методом РЭМ. Диоксид азота получали термическим разложением нитрата свинца, применяя для этого источник, устройство и принцип работы которого описаны в работе [25]. Взаимодействие образца Rh/ВОПГ с NO2 осуществляли при комнатной температуре и давлениях 10–6 и 10–5 мбар.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
На рис. 1 показаны спектры региона C1s для исходного ВОПГ до (спектр 1) и после напыления на его поверхность металлического родия в процессе приготовления образца Rh-2 (спектр 2), а также спектры после взаимодействия полученного образца с NO2 при комнатной температуре и давлении 10–6 (спектр 3) и 10–5 (спектр 4) мбар. Спектры на рис. 1а представлены в широком интервале энергий связи, захватывающем область регистрации характерного для графита плазмона с Eсв ∼ 291 эВ. На рис. 1б приведены спектры, записанные в более узком интервале Eсв, включающем в себя только фотоэмиссионные линии образца Rh-2, прореагировавшего с NO2. Спектры 5 на рис. 1а и 1б зарегистрированы после нагрева в вакууме при 300°С образца, обработанного в NO2.
Рис. 1.
РФЭ-спектры в регионе C1s, записанные для исходного ВОПГ (1), образца Rh-2, приготовленного напылением родия на ВОПГ, до (2) и после взаимодействия с NO2 при комнатной температуре и давлении 10–6 (3) и 10–5 мбар (4) в течение 30 мин, а также последующего прогрева Rh-2, обработанного в NO2, в вакууме при 300°С (5): а – спектры в широком интервале энергий связи, включающем область регистрации поверхностного плазмона (∼291 эВ); б – спектры в узком интервале энергий связи с разложением фотоэмиссионной линии C1s на компоненты.
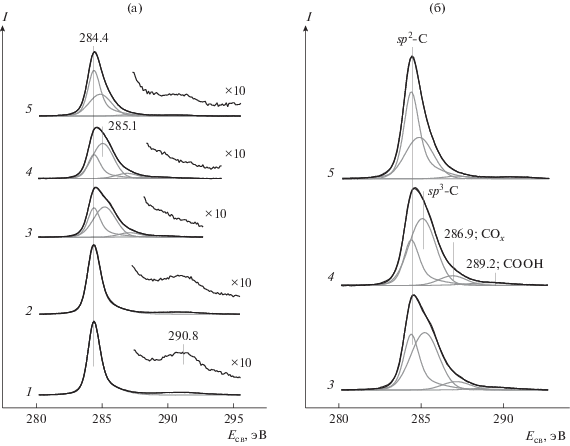
В соответствии с литературными данными [30–34], в спектре 1 исходного ВОПГ присутствует одна узкая линия C1s с Eсв = 284.4 эВ, которая имеет асимметричную форму с “хвостом”, вытянутым в сторону бóльших энергией связи. На “хвосте” в районе ∼291 эВ отчетливо проявляется плазмон, характерный для графита, обладающего упорядоченной трехмерной структурой [31–33, 35, 36]. Напыление родия до атомного отношения [Rh]/[C] = 0.022 не вызывает сколь-нибудь значительных изменений в спектре С1s (рис. 1а, спектр 2). После проведения реакции с NO2 плазмон исчезает (спектры 3 и 4), что указывает на разрушение упорядоченной структуры в поверхностном слое графита. При этом спектр в районе регистрации фотоэмиссионных линий C1s приобретет сложную форму, которая может быть описана суперпозицией нескольких компонентов. Анализ формы спектров 3, 4 и 5 позволил выявить присутствие четырех компонентов с энергиями связи 284.4, ~285, ~287 и ~289 эВ (рис. 1б). Основываясь на литературных данных, указанные линии были отнесены, соответственно, sp2-углероду в структуре графита [30–33, 35, 37–39], sp3-углероду, не связанному с атомами кислорода (связи C–C, C–H) [32, 33, 35, 40], атомам углерода, связанным с кислородом одинарной связью (C–OH, C–O–C), а также в составе карбонильной C=O [37, 40–43] и карбоксильной COOH групп [35, 37, 41, 42, 44–49]. При разложении спектров на компоненты с помощью программы XPSPeak [50] полагалось, что ширина и параметры асимметрии пика, отвечающего sp2-углероду, такие же, как в спектре исходного ВОПГ. Остальные компоненты были описаны симметричными пиками [51] с произвольно варьируемыми параметрами (энергия связи, ширина на половине высоты, интегральная интенсивность). Из сравнения спектров 3 и 4 видно, что с ростом давления NO2 глубина превращения графита увеличивается; при этом относительный вклад образованных в реакции поверхностных соединений углерода в спектр C1s возрастает от 0.60 до 0.68. Следует отметить, что в отличие от системы Pd/ВОПГ, для которой после проведения взаимодействия с NO2 в аналогичных условиях наблюдалось полное исчезновение линии sp2-углерода, принадлежащей графиту [24], в случае Rh/ВОПГ данная линия видна в спектре, и интенсивность ее достаточно велика.
Из отношения интенсивностей пиков sp2-углерода, измеренных до (I0) и после (I) взаимодействия образца Rh-2 с NO2, с помощью выражения
была оценена толщина разрушенного слоя графита d. Здесь λ – длина свободного пробега в графите фотоэлектрона, эмитируемого с уровня C1s sp2-углерода; в соответствии с данными [52], она составляет 3.31 нм; θ – угол, под которым осуществляется регистрация фотоэлектронов анализатором спектрометра; в нашем случае θ = 0° (cosθ = 1). Для образца Rh-2, обработанного при давлении 10–6 и 10–5 мбар, d составляет ∼4 и ∼5 нм соответственно, что отвечает ∼12 и ∼15 графеновым слоям. Взаимодействие образца Pd/ВОПГ с NO2 при комнатной температуре и давлении 10–6 мбар приводит к тому, что sp2-углерод в спектре C1s не обнаруживается [24], что указывает на более глубокое разрушение поверхностного слоя графита.После проведения реакции при давлении 10–5 мбар образец Rh-2 был прогрет в вакууме при 300°С (спектр 5 на рис. 1). В результате, с одной стороны, увеличилась интенсивность линии sp2-гибридного углерода и появился плазмон, а с другой стороны, упала интенсивность линий sp3-углерода и кислородсодержащих поверхностных соединений, так что их суммарный вклад в спектр C1s снизился до 38%.
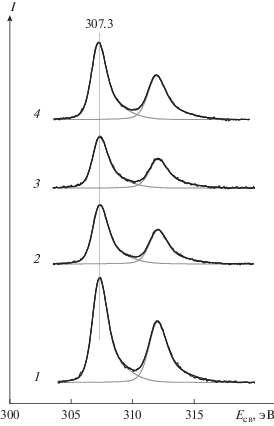
На рис. 2 показаны спектры, записанные в регионе Rh3d для образца Rh-2 сразу после его приготовления (спектр 1), после взаимодействия с NO2 при комнатной температуре и давлении 10–6 (спектр 2) и 10–5 мбар (спектр 3), а также после прогрева образца, обработанного в NO2, в вакууме при 300°С (спектр 4). Видно, что после обработки в NO2 родий сохраняет металлическое состояние (Eсв = 307.3 эВ). Форма линии также остается прежней, с характерной для металла асимметрией спин-орбитальных компонент. Единственное обнаруженное изменение в спектре Rh3d заключается в заметном уменьшении интенсивности сигнала, падающей после обработки при 10–6 и 10–5 мбар, соответственно, до 0.66 и 0.58 от величины в исходном образце. После прогрева в вакууме при 300°С (спектр 4) интенсивность возрастает, но лишь до 0.85 от своего первоначального значения.
Рис. 2.
РФЭ-спектры в регионе Rh3d образца Rh-2 до (1) и после взаимодействия с NO2 при комнатной температуре и давлении 10–6 (2) и 10–5 мбар (3) в течение 30 мин, а также последующего прогрева в вакууме при 300°С в течение 30 мин (4).
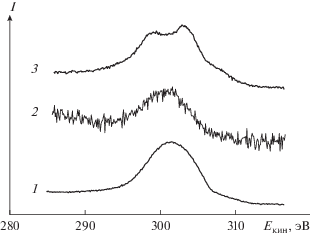
На рис. 3 показан регион, в который попадают Оже-линии углерода, C-KLL, и родия, Rh-M45VV и Rh-M45N23V. По шкале абсцисс отложены значения кинетической энергии Оже-электронов, Eкин. Спектр 1 относится к исходному ВОПГ; в нем присутствуют только Оже-линии углерода, в том числе линия с Eкин ∼ 270 эВ, отвечающая Оже-процессу с участием π-электронов валентной зоны, который характерен для упорядоченной трехмерной структуры графита, образованной параллельно ориентированными слоями графена [53]. Эта линия сохраняется после напыления родия (спектр 2), но исчезает после обработок в NO2 (спектры 3 и 4), что является еще одним аргументом в пользу того, что взаимодействие с NO2 приводит к разрушению поверхности графита. После прогрева в вакууме при 300°С линия с Eкин ∼ 270 эВ снова обнаруживается в спектре 5 в виде плеча с меньшей интенсивностью, указывая на частичное восстановление структуры.
Рис. 3.
Оже-спектры родия и углерода, записанные для исходного ВОПГ (1), образца Rh-2 до (2) и после взаимодействия с NO2 при комнатной температуре и давлении 10–6 (3) и 10–5 мбар (4) в течение 30 мин, а также последующего прогрева в вакууме при 300°С в течение 30 мин (5).
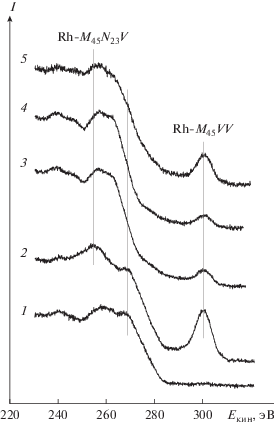
После напыления родия в спектре 2 появляются Оже-линии Rh-M45VV и Rh-M45N23V. Взаимодействие Rh/ВОПГ с NO2 приводит, как и в случае с фотоэмиссионной линией Rh3d, к падению интенсивности Оже-линий родия, что особенно отчетливо проявляется для отдельно расположенной линии Rh-M45VV (рис. 3, спектры 2 и 3). После прогрева в вакууме при 300°С интенсивность линии Rh-M45VV увеличивается (спектр 4), но при этом не достигает первоначального значения, определенного для нее из спектра 1 до начала проведения реакции с NO2. На рис. 4 для сравнения приведены Оже-линии Rh-M45VV, записанные для образца Rh-2 после его взаимодействия с NO2 при комнатной температуре и давлении 10–5 мбар (спектр 2), для массивного металлического родия в виде фольги (спектр 1) и для фольги после ее окисления в NO2 в условиях образования трехмерной пленки поверхностного оксида Rh2O3 (спектр 3) [54]. Видно, что спектр 2 больше похож на спектр 1, нежели на спектр 3, что подтверждает факт сохранения частицами Rh в системе Rh/ВОПГ исходной металлической природы после взаимодействия с NO2.
Рис. 4.
Оже-линия родия Rh-M45VV, записанная для образца Rh-2 после взаимодействия с NO2 при комнатной температуре и давлении 10–5 мбар (2), а также для Rh-фольги до (1) и после (3) образования на ней поверхностного оксида Rh2O3 в результате взаимодействия с NO2 при 450°С и 10–4 мбар [54].
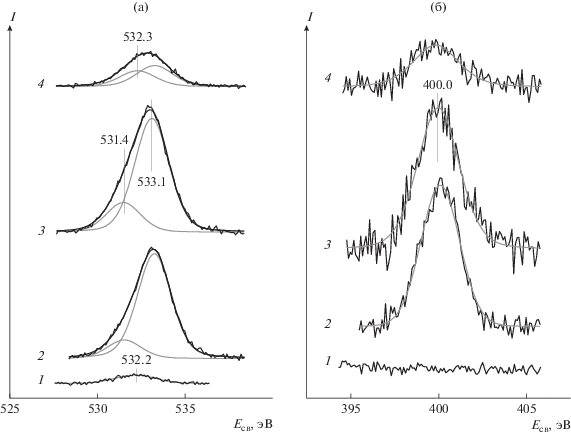
На рис. 5 показаны спектры, записанные в регионах O1s (рис. 5а) и N1s (рис. 5б) для образца Rh-2 сразу после приготовления (спектр 1), после взаимодействия с NO2 (спектры 2 и 3) и последующего прогрева в вакууме при 300°С (спектр 4). В спектре 1 образца до реакции обнаружена очень слабая линия O1s с Eсв = 532.2 эВ, которая может быть отнесена гидроксильным группам на поверхности ВОПГ [40]. После взаимодействия с NO2 эта линия исчезает и появляются две другие линии c Eсв ∼ 531.5 и ∼533 эВ (рис. 5а, спектры 2 и 3); при этом в регионе N1s обнаруживается линия c Eсв ∼ 400 эВ (рис. 5б, спектры 2 и 3). Концентрации атомов кислорода и азота на поверхности образца, определенные из интенсивностей этих линий, невелики; они соответствует атомным отношениям [O]/[C] ∼ 0.1 и [N]/[C] ∼ 0.02. Если принять в расчет только атомы углерода в составе продуктов взаимодействия ВОПГ с NO2, которым отвечают линии C1s с Eсв ∼ 287 и ∼289 эВ, то отношение [O]/[C] становится приблизительно равным 1. Величины энергий связи, определенные для линии N1s и менее интенсивной из линий O1s (531.5 эВ), позволяют отнести их адсорбированным молекулам NOад [55–61], образующимся на поверхности частиц родия в результате диссоциации молекул NO2. Рассчитанное из интенсивностей этих линий атомное отношение [N]/[O] составляет ∼1. Также близкой величиной энергии связи обладает линия N1s, принадлежащая связанным с углеродом атомам азота, которые могут возникнуть в результате встраивания их в графит с образованием поверхностных соединений со структурой пиррола [34, 36, 40, 62–65] или α-пиридона [40, 62–64]. Второй пик O1s с бóльшей интенсивностью (∼533 эВ) следует отнести кислородсодержащим фрагментам C–OH, C–O–C и COOH, образующимся при окислении графита [44–46, 48, 62, 66]. После прогрева в вакууме при 300°С интенсивность линии N1s уменьшается в несколько раз (рис. 5б, 4). Линия O1s c Eсв = 531.4 эВ исчезает, а вместо нее снова появляется линия с Eсв ∼ 532.2 эВ (рис. 5а, 4). Наблюдаемые изменения можно связать с десорбцией молекул NO с поверхности родия [61, 67, 68].
Рис. 5.
Спектры O1s (а) и N1s (б) образца Rh-2 до (1) и после взаимодействия с NO2 при комнатной температуре и давлении 10–6 (2) и 10–5 мбар (3) в течение 30 мин, а также последующего прогрева в вакууме при 300°С в течение 30 мин (4).
На рис. 6 приведены изображения, полученные методом РЭМ для образца Rh-1 (атомное отношение [Rh]/[C] = 0.025) в исходном состоянии (рис. 6а–6в) и аналогичным образом приготовленного образца Rh-2 ([Rh]/[C] = 0.022), обработанного в NO2 при комнатной температуре и давлении 10–5 мбар с последующим прогревом в вакууме при 300°С (рис. 6г, 6д). В образце Rh-1 частицы родия имеют округлую форму; их средний размер, определенный из гистограммы, представленной на рис. 6е, составляет ∼3 нм. Частицы распределены по поверхности неравномерно: на рис. 6а и 6б отчетливо видно их концентрирование в области ступеней. Частицы обнаруживаются также на террасах, вероятно, в области расположения структурных дефектов. Похожее пространственное распределение частиц наблюдалось нами с помощью метода СТМ для платины, нанесенной на исходную поверхность ВОПГ [25]. Мы считаем, что такой характер распределения частиц Rh (а также и Pt) по поверхности ВОПГ обусловлен их слабым взаимодействием с носителем.
Рис. 6.
Микрофотографии поверхности ВОПГ, полученные методом РЭМ в режиме ВЭ при E0 = 15 и 20 кэВ и различных увеличениях для образца Rh-1 (а–в) и для образца Rh-2, предварительно обработанного в NO2 при комнатной температуре и давлении 10–5 мбар в течение 30 мин и затем прогретого в вакууме при 300°С в течение 30 мин (г, д); е – распределение частиц родия по размерам, полученное из центрального фрагмента участка поверхности, показанного на рис. 6б, с использованием 80 частиц Rh.

Для образца Rh-2, обработанного в NO2 и прогретого в вакууме, были получены нечеткие изображения (рис. 6г, 6д). Тем не менее, на них видно, что характер распределения частиц Rh в плоскости, параллельной поверхности ВОПГ, не меняется: частицы по-прежнему сконцентрированы в области ступеней. Мы предполагаем, что наблюдаемая на рис. 6г и 6д картина обусловлена тем, что частицы инкапсулированы углеродом или продуктами его взаимодействия с NO2. Ввиду нечеткости изображений определить размер частиц родия в образце Rh-2, обработанном в NO2, не представляется возможным. После того как на образце Rh-2 были проведены исследования методом РЭМ, для него повторно были записаны РФЭ-спектры. За исключением появления линии O1s вследствие накопления на поверхности образца воды и других примесных молекул, адсорбирующихся при контакте с атмосферой, никаких других принципиальных изменений в состоянии Rh и ВОПГ обнаружено не было.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Наряду с рассмотренной в настоящей работе системой Rh/ВОПГ ранее нами было исследовано взаимодействие NO2 при комнатной температуре с еще двумя платиновыми металлами – Pt [24, 25] и Pd [24], нанесенными на исходную поверхность ВОПГ. По данным РФЭС поведение этих трех металлов одинаково только в том, что после реакции при комнатной температуре и давлениях ∼10–6–10–5 мбар они остаются в металлическом состоянии. В то же время было установлено, что они существенно отличаются друг от друга в плане инициирования окисления графита, на поверхность которого были нанесены.
Хорошо известно, что исходный ВОПГ, отожженный в вакууме при высоких температурах (≥600°С), в области температур, близких к комнатной, химически инертен даже к таким сильным окислителям как NO2. Взаимодействие ограничивается окислением атомов углерода в области структурных дефектов поверхности ВОПГ [69].
При переходе к системе Pt/ВОПГ ситуация меняется несущественно [24, 25]: после обработки в NO2 при давлении 4 × 10–6 мбар наблюдается появление некоторого количества кислорода, который связан с атомами углерода в поверхностные соединения c группами C–OH, C–O–C и C=O. Спектр C1s при этом меняется незначительно, так что практически весь углерод остается в характерном для графита sp2-гибридном состоянии. По сравнению с исходным ВОПГ на поверхности образца Pt/ВОПГ при взаимодействии с NO2 накапливается в ∼6 раз больше кислорода [25]. Предполагается, что в этом случае окисляются главным образом атомы углерода, расположенные на границе раздела Pt–графит по периметру частиц платины.
Исключительно высокую активность в реакции окислении графита проявляет палладий [24]. Это выражается не только в появлении в РФЭ-спектре линий O1s, но также и в исчезновении из спектра C1s линии sp2-углерода, вместо которой возникают линии, принадлежащие sp3-углероду и поверхностным кислородсодержащим соединениям CxOy. Отмеченные изменения в спектре фотоэмиссионных линий C1s, а также исчезновение плазмона при ∼291 эВ указывают на разрушение структуры верхних графеновых слоев. Из анализа интенсивностей Оже- и фотоэмиссионной линий палладия, было сделано заключение о том, что одновременно с окислением графита частицы Pd внедряются вглубь углеродного носителя [23, 24].
В настоящей работе показано, что родий также проявляет достаточно высокую активность в реакции окисления графита. В спектре C1s наблюдается уменьшение интенсивности линии sp2-углерода и появление линий sp3-углерода и кислородсодержащих соединений CxOy. Образование CxOy сопровождается возникновением соответствующих линий в спектре O1s. Толщина разрушенного слоя графита в результате взаимодействия образца Rh-2 c NO2 при давлении 10–6 и 10–5 мбар, оцененная по падению интенсивности линии C1s от sp2-углерода, составила ∼4 и ∼5 нм соответственно. Здесь необходимо отметить, что степень превращения графита существенно меньше, чем в случае палладия. По оценкам, выполненным в работе [24], глубина области разрушений в образце Pd/ВОПГ после его взаимодействия с NO2 была существенно больше 5 нм, несмотря на то, что реакция проводилась при меньшем давлении (10–6 мбар), и атомное отношение [Pd]/[C] в этом образце, равное 0.0067, было меньше величины атомного отношения [Rh]/[C] (0.022) в рассматриваемом здесь образце Rh-2.
По аналогии с системой Pd/ВОПГ был проведен анализ отношения интенсивностей линий родия в спектрах, зарегистрированных после различных обработок образца Rh-2, с целью получения информации о локализации частиц родия в системе Rh/ВОПГ. Для этой цели удобно использовать интенсивные линии Rh-M45VV и Rh3d с сильно различающимися кинетическими энергиями (Eкин ~ 300 и ∼1180 эВ соответственно), а, следовательно, и величинами длины свободного пробега электронов, которые при прохождении через графит составляют λ3d ≈ 3.25 и λMVV ≈ 1.23 нм [52]. После взаимодействия с NO2 отношение интенсивности Оже-линии Rh-M45VV к интенсивности фотоэмиссионной линии Rh3d, IMVV/I3d, уменьшается в ∼4 раза. Поскольку λ3d > λMVV, то для частиц родия нанометрового размера, сопоставимого по величине с λ3d, λMVV, отношение интенсивностей IMVV/I3d должно быть больше отношения ${{I_{{MVV}}^{0}} \mathord{\left/ {\vphantom {{I_{{MVV}}^{0}} {I_{{3d}}^{0}}}} \right. \kern-0em} {I_{{3d}}^{0}}}$, характеризующего массивный родий, что и наблюдается в эксперименте. Если принять величину ${{I_{{MVV}}^{0}} \mathord{\left/ {\vphantom {{I_{{MVV}}^{0}} {I_{{3d}}^{0}}}} \right. \kern-0em} {I_{{3d}}^{0}}}$ за единицу, то для наночастиц Rh нормированное отношение интенсивностей RN = IMVV ⋅ ${{I_{{3d}}^{0}} \mathord{\left/ {\vphantom {{I_{{3d}}^{0}} {{{I}_{{3d}}}}}} \right. \kern-0em} {{{I}_{{3d}}}}}$ ⋅ $I_{{MVV}}^{0} > 1.$ Очевидно, что с увеличением размера частиц RN должно уменьшаться, стремясь к 1. Действительно, величина RN составляет 1.35 для исходного образца Rh-2 и уменьшается после проведения взаимодействия с NO2 при давлениях 10–6 и 10–5 мбар, однако при этом она в обоих случаях становится равной 0.35, т.е. существенно меньше ожидаемой величины. Следовательно, укрупнение частиц Rh не является основной причиной изменений, происходящих с интенсивностями линий родия. Мы предполагаем, что, как и в случае с палладием, частицы Rh после реакции оказываются покрытыми углеродом или продуктами его взаимодействия с NO2 вследствие внедрения частиц в объем графита или инкапсулирования. Эмиссия электронов из частиц родия экранируется материалом носителя, причем в тем большей степени, чем толще углеродная пленка и чем меньше λ. В силу того, что λMVV < λ3d, Оже-электроны экранируются сильнее, чем фотоэлектроны, что также объясняет уменьшение RN после проведения реакции; причем в этом случае данное отношение может достигать значений <1. Нечеткие изображения, полученные методом РЭМ при исследовании образца Rh-2, обработанного в NO2 (рис. 6г, 6д), также указывают на то, что частицы родия покрыты пленкой инородного материала. Прогрев образца при 300°С в вакууме приводит к тому, что RN возрастает до 0.7, но при этом остается примерно вдвое меньше исходного значения до обработки образца в NO2. Одновременно с этим наблюдается значительное уменьшение интенсивности пиков O1s кислорода (рис. 5а), а из спектра C1s исчезают линии кислородсодержащих соединений углерода (рис. 1). Можно предположить, что при прогреве окисленного образца происходит частичное разрушение экранирующей пленки, приводящее к удалению карбонильных и карбоксильных фрагментов, которые входят в состав пленки наряду с аморфным углеродом.
При исследовании Rh/ВОПГ, как и для системы Pd/ВОПГ, в РФЭ-спектрах после взаимодействия с NO2 было обнаружено появление линии N1s с энергией связи ∼400 эВ (рис. 5б). Судя по величине атомного отношения [N]/[C] = 0.012, концентрация азота, накапливаемого на поверхности образца Rh-2, значительно больше, чем в случае образцов Pd/ВОПГ ([N]/[C] = 0.003 [24]). Как уже было упомянуто выше, линия N1s с энергией связи ∼400 эВ может принадлежать, с одной стороны, молекулам NO, адсорбированным на поверхности частиц родия [55–61], и, с другой стороны, атомам азота, связанным с атомами углерода в области разрушений ВОПГ в структурах, аналогичных пирролу [34, 36, 40, 62–64] и α-пиридону [40, 62–64]. Прогрев при 300°С приводит к уменьшению интенсивности линии N1s более чем в 2 раза, а также ее уширению и небольшому смещению в сторону меньших энергий связи (рис. 5б). Изменения в спектре N1s, по-видимому, можно связать с десорбцией NOад, что наблюдалось при прогреве образцов массивного родия до температур ∼150–200°С [59, 67, 70, 71]. Оставшийся после прогрева азот можно отнести атомам N в структуре пиррола и/или α-пиридона, которые, как известно, обладают достаточно высокой термической стабильностью и сохраняются в условиях пиролиза вплоть до 600 и 500°С соответственно [63].
Таким образом, для описания механизма окисления графита при взаимодействии Rh/ВОПГ и Pd/ВОПГ с NO2 может быть предложена следующая схема. При комнатной температуре молекулы NO2 легко диссоциируют на NOад и Oад как на Rh [72], так и на Pd [73, 74]. Атомы Oад внедряются в приповерхностную область частицы металла с дальнейшим перемещением в объем и движением в направлении границы раздела с графитом, где и происходит их участие в реакции окисления углерода. Показано, что растворение кислорода в палладии протекает легко [75–80], что и обуславливает его высокую активность в реакции окислении графита до степеней превращения более глубоких, чем в случае родия и платины. В теоретической работе [81] был выполнен расчет энергии активации перемещения атома кислорода из адсорбированного состояния на поверхности (111) металлических Pd, Rh и Pt в приповерхностный слой, и было показано, что эта величина имеет существенно меньшее значение на Pd (155 кДж/моль), чем на Rh (183 кДж/моль) и Pt (191 кДж/моль). Скорость диффузии растворенных атомов кислорода в объеме металлического палладия также достаточно велика [78, 80].
Хорошо известно, что в родии также способен образовываться приповерхностный кислород [82–85]. Тем не менее, существуют определенные факторы, которые затрудняют процесс окисления графита при комнатной температуре при участии в нем родия вместо палладия. Так, диссоциативная адсорбция NO2 на поверхности родия протекает с высокой скоростью, а образующиеся молекулы NO десорбируются только после нагрева до температур ≥150°С [59, 67, 70, 71], вследствие чего при комнатной температуре вся поверхность родия быстро заполняется NOад. Свидетельством тому служит обнаружение в РФЭ-спектре линий N1s и O1s с энергиями связи 400.0 и 531.4 эВ соответственно (рис. 5). Поверхность родия, заблокированная молекулами NOад, не способна к диссоциации NO2, ад и NOад из-за отсутствия на ней свободных адсорбционных мест, требуемых для размещения атомов кислорода, вследствие чего процесс окисления графита в системе Rh/ВОПГ прекращается.
Сильная адгезия частиц палладия к поверхности ВОПГ, по-видимому, также способствует проявлению им более высокой активности по сравнению с двумя другими платиновыми металлами в реакции окисления графита молекулами NO2 при комнатной температуре. Прочное связывание палладия с графитом приводит к равномерному заполнению поверхности ВОПГ частицами Pd (рис. 1 в работе [24]), тогда как для слабее взаимодействующих родия и платины наблюдается преимущественное заселение ступеней и дефектов на террасах (см. рис. 6 в настоящей работе и рис. 1а в работах [24, 25]). В подтверждение сказанному можно упомянуть работу [86], в которой было показано, что прочная адгезия частиц CoO к поверхности ВОПГ выступает одним из основных факторов, обеспечивающих эффективное окисление графита при взаимодействии системы CoO/ВОПГ с кислородом при комнатной температуре и давлении 10–3–1 мбар.
В завершении обсуждения необходимо отметить остающийся открытым вопрос: каким образом формирование углеродной пленки на поверхности частиц родия сочетается с возможностью заполнения ее молекулами NOад? Ответ на него требует проведения дополнительных исследований. В настоящий момент можно предположить, что экранирующая пленка не является сплошной, и имеются участки поверхности, доступные для диссоциативной адсорбции NO2 с образованием NOад. Возможно также, что инкапсулируются углеродом частицы Rh, уже содержащие на своей поверхности прочно удерживаемые ею молекулы NOад.
ЗАКЛЮЧЕНИЕ
Основываясь на результатах исследований, проведенных в настоящей работе, можно сделать следующие выводы:
1. Нанесение родия методом вакуумного напыления на поверхность ВОПГ, предварительно отожженную при 600°С, приводит к формированию частиц металлического Rh размером от 2 до 5 нм. Значительная часть частиц концентрируется в области ступеней.
2. Взаимодействие системы Rh/ВОПГ с NO2 при комнатной температуре и давлении 10–6–105 мбар ведет к окислению нескольких графеновых слоев, что сопровождается разрушением упорядоченной трехмерной структуры графита на глубину 4–5 нм. В этом отношении по своему поведению Rh/ВОПГ напоминает Pd/ВОПГ, хотя степень превращения графита во втором случае значительно больше. Предположительно в системе Rh/ВОПГ процесс тормозится по причине насыщения поверхности родия прочно связанными молекулами NOад, что препятствует диссоциации NO2 и образованию активных атомов кислорода.
3. После проведения реакции с NO2 частицы родия остаются в исходном металлическом состоянии, однако происходит их внедрение в приповерхностный слой графита либо инкапсулирование углеродом или продуктами его окисления.
4. Из сравнения результатов исследования, полученных для систем Rh/ВОПГ, Pd/ВОПГ и Pt/ВОПГ, следует, что в реакции окисления графита молекулами NO2 при комнатной температуре металлы выстраиваются в ряд активности: Pd > > Rh > Pt.
Список литературы
Kainulainen T.A., Niemela M.K., Krause A.O.I. // J. Mol. Cat. A: Chem. 1999. V. 140. P. 173.
Ukisu Y., Miyadera T. // React. Kinet. Catal. Lett. 2004. V. 81. P. 305.
Стахеев А.Ю., Ткаченко О.Р., Клементьев К.В., Grünert W., Брагина Г.О., Машковский И.С., Кустов Л.М. // Кинетика и катализ. 2005. Т. 46. С. 122.
Делий И.В., Симакова И.Л. // Изв. Акад. Наук, сер. хим. 2008. Т. 57. С. 2020.
Deliy I.V., Simakova I.L., Ravasio N., Psaro R. // Appl. Catal. A: Gen. 2009. V. 357. P. 170.
Chatterjee M., Ishizaka T., Suzuki A., Kawanami H. // Chem. Commun. 2013. V. 49. P. 4567.
Hattori T., Ida T., Tsubone A., Sawama Y., Monguchi Y., Sajiki H. // Eur. J. Org. Chem. 2015. P. 2492.
Kordouli E.,Kordulis Ch., Lycourghiotis A., Cole R., Vasudevan P.T., Pawelec B., Fierro J.L.G. // Mol. Catal. 2017. V. 441. P. 209.
Monguchi Y., Mizuno M., Ichikawa T., Fujita Y., Murakami E., Hattori T., Maegawa T., Sawama Y., Sajiki H. // J. Org. Chem. 2017. V. 82. P. 10939.
Katayama Y., Aoyagi M., Matsumoto T., Harada H., Simion A.M., Egashira N., Mitoma Y., Simion C. // Environ. Sci. Pollut. Res. 2017. V. 24. P. 591.
Song S., Wang Y., Yan N. // Molec. Cat. 2018. V. 454. P. 87.
Althikrallah H., Kunstmann-Olsen C., Kozhevnikova E.F., Kozhevnikov I.V. // Catalysts. 2020. V. 10. P. 1171.
Martin-Martinez M., Rodriguez J.J., Baker R.T., Gymez-Sainero L.M. // Chem. Eng. J. 2020. V. 397. P. 125479.
Prasad K.V., Chaudhari R.V. // J. Cat. 1994. V. 145. P. 204.
Matsumoto K., Dougomori K., Tachikawa S., Ishii T., Shindo M. // Org. Lett. 2014. V. 16. P. 4754.
Matsumoto K., Yoshida M., Shindo M. // Angew. Chem. Int. Ed. 2016. V. 55. P. 5272.
Sawama Y., Asai S., Monguchi Y., Sajiki H. // Chem. Rec. 2016. V. 16. P. 261.
Wilde C.A., Ryabenkova Y., Firth I.M., Pratt L., Railton J., Bravo-Sanchez M., Sano N., Cumpson P.J., Coates P.D., Liu X., Conte M. // Appl. Catal. A: Gen. 2019. V. 570. P. 271.
Matsumoto K., Kobayashi Y., Hirokane T., Yoshida M. // Chem. Pharm. Bull. 2020. V. 68. P. 167.
Бухтияров В.И., Слинько М.Г. // Успехи химии. 2001. Т. 70. С. 167.
Анаников В.П., Хемчян Л.Л., Иванова Ю.В., Бухтияров В.И., Сорокин А.М., Просвирин И.П., Вацадзе С.З., Медведько А.В., Нуриев В.Н., Дильман А.Д., Левин В.В., Коптюг И.В., Ковтунов К.В., Живонитко В.В., Лихолобов В.А. и др. // Успехи химии. 2014. Т. 83. С. 885.
Smirnov M.Yu., Kalinkin A.V., Vovk E.I., Simonov P.A., Gerasimov E.Yu., Sorokin A.M., Bukhtiyarov V.I. // Appl. Surf. Sci. 2018. V. 428. P. 972.
Смирнов М.Ю., Калинкин А.В., Сорокин А.М., Бухтияров В.И. // Кинетика и катализ. 2020. Т. 61. С. 568.
Смирнов М.Ю., Калинкин А.В., Сорокин А.М., Бухтияров В.И. // Кинетика и катализ. 2020. Т. 61. С. 893.
Калинкин А.В., Сорокин А.М., Смирнов М.Ю., Бухтияров В.И. // Кинетика и катализ. 2014. Т. 55. С. 371.
Смирнов М.Ю., Вовк Е.И., Нартова А.В., Калинкин А.В., Бухтияров В.И. // Кинетика и катализ. 2018. Т. 59. С. 631.
Калинкин А.В., Смирнов М.Ю., Бухтияров А.В., Бухтияров В.И. // Кинетика и катализ. 2015. Т. 56. С. 785.
Калинкин А.В., Смирнов М.Ю., Клембовский И.О., Сорокин А.М., Гладкий А.Ю., Бухтияров В.И. // ЖСХ. 2018. Т. 59. С. 1785.
Moulder J.F., Stickle W.F., Sobol P.E., Bomben K.D. Handbook of X-ray Photoelectron Spectroscopy. Eden Prairie: Perkin-Elmer Co, 1992.
Schnyder B., Alliata D., Kotz R., Siegenthaler H. // Appl. Surf. Sci. 2001.V. 173. P. 221.
Yang D.-Q., Sacher E. // Surf. Sci. 2002. V. 504. P. 125.
Rousseau B., Estrade-Szwarckopf H., Thomann A.-L., Brault P. // Appl. Phys. A. 2003. V. 77. P. 591.
Blume R., Rosenthal D., Tessonnier J.-P., Li H., Knop-Gericke A., Schlogl R. // ChemCatChem. 2015. V. 7. P. 2871.
Susi T., Pichler T., Ayala P. // Beilstein J. Nanotechnol. 2015. V. 6. P.177.
Paredes J.I., Martınez-Alonso A., Tascon J.M.D. // Langmuir. 2007. V. 23. P. 8932.
Favaro M., Agnoli S., Perini L., Durante C., Gennaro A., Granozzi G. // Phys. Chem. Chem. Phys. 2013. V. 15. P. 2923.
Utsumi S., Honda H., Hattori Y., Kanoh H., Takahashi K.,Sakai H., Abe M., Yudasaka M., Iijima S., Kaneko K. // J. Phys. Chem. C. 2007. V. 111. P. 5572.
Demoisson F., Raes M., Terryn H., Guillot J., Migeon H.-N., Reniers F // Surf. Interface Anal. 2008. V. 40. P. 566.
Sandhu J., Chauhan A.K.S., Govind. // J. Nanopart. Res. 2011. V. 13. P. 3503.
Figueiredo J.L., Pereira M.F.R. // Catal. Today. 2010. V. 150. P. 2.
Wang Z.-M., Kanoh H., Kaneko K., Lu G.Q., Do D. // Carbon. 2002. V. 40. P. 1231.
Fu C., Zhao G., Zhang H., Li S. // Int. J. Electrochem. Sci. 2013. V. 8. P. 6269.
Saravanan M., Girisun T.C.S., Rao S.V. // J. Mater. Chem. C. 2017. V. 5. P. 9929.
Martınez M.T., Callejas M.A., Benito A.M., Cochet M., Seeger T., Anson A., Schreiber J., Gordon C., Marhic C., Chauvet O., Fierro J.L.G., Maser W.K. // Carbon. 2003. V. 41. P. 2247.
Yang D., Velamakanni A., Bozoklu G., Park S., Stoller M., Piner R.D., Stankovich S., Jung I., Field D.A., Ventrice C.A., Ruoff R.S. // Carbon. 2009. V. 47. P. 145.
Hou S., Su S., Kasner M.L., Shah P., Patel K., Madarang C.J. // Chem. Phys. Lett. 2010. V. 501. P. 68.
Ganguly A., Sharma S., Papakonstantinou P., Hamilton J. // J. Phys. Chem. C. 2011. V. 115. P. 17009.
Stobinski L., Lesiak B., Malolepszy A., Mazurkiewicz M., Mierzwa B., Zemek J., Jiricek P., Bieloshapka I. // J. Electron Spectrosc. Related Phenom. 2014. V. 195. P. 145.
Jena G., Vanithakumari S.C., Thinaharan C., George R.P., Mudali U.K. // J. Bio. Tribol. Corrosion. 2018. V. 4. P. 20.
http://xpspeak.software.informer.com/4.1/
Haerle R., Riedo E., Pasquarello A., Baldereschi A. // Phys. Rev. B. 2001. V. 65. P. 045101.
Shinotsuka H., Tanuma S., Powell C.J., Penn D.R. // Surf. Interf. Anal. 2015. V. 47. P. 871.
Dementjev A.P., Ivanov K.E., Tsyvkunova E.A. // Appl. Surf. Sci. 2015. V. 357. P. 1434.
Смирнов М.Ю., Калинкин А.В., Бухтияров В.И. // Кинетика и катализ. 2019. Т. 60. С. 798.
Baird R.J., Ku R.C., Wynblatt P. // Surf. Sci. 1980. V. 97. P. 346.
Baraldi A., Dhanak V.R., Kiskinova M., Rosei R. // Appl. Surf. Sci. 1994. V. 78. P. 445.
Lizzit S., Baraldi A., Cocco D., Comelli G., Paolucci G., Rosei R., Kiskinova M. // Surf. Sci. 1998. V. 410. P. 228.
Saito T., Esaka F., Furuya K., Kikuchi T., Imamura M., Matsubayashi N., Shimada H. // J. Electron Spectrosc. Related Phenom. 1998. V. 88–91. P. 763.
Bondino F., Comelli G., Baraldi A., Vesselli E., Rosei R., Goldoni A., Lizzit S. // J. Chem. Phys. 2003. V. 119. P. 12534.
Requejo F.G., Hebenstreit E.L.D., Ogletree D.F., Salmeron M. // J. Catal. 2004. V. 226. P. 83.
Nakamura I., Kobayashi Y., Hamada H., Fujitani T. // Surf. Sci. 2006. V. 600. P. 3235.
Stanczyk K., Dziembaj R., Piwowarsca Z., Witkowski S. // Carbon. 1995. V. 33. P. 1383.
Pels J.R., Kapteijn F., Moulijn J.A., Zhu Q., Thomas K.M. // Carbon. 1995. V. 33. P. 1641.
Biniak S., Szymanski G., Siedlewski J., Swiatkowski A. // Carbon. 1997. V. 35. P. 1799.
Ghosh B., Sarma S., Pontsho M., Ray S.C. // Diamond Relat. Mater. 2018. V. 89. P. 35.
Kostecki R., Schnyder B., Alliata D., Song X., Kinoshita K., Kotz R. // Thin Solid Films. 2001. V. 396. P. 36.
Root T.W., Schmidt L.D., Fisher G.B. // Surf. Sci. 1983. V. 134. P. 30.
Jansen M.M.M., Caniaz O., Nieuwenhuys B.E., Niemantsverdriet J.W.H. // Langmuir. 2010. V. 26. P. 16239.
Sjovall P., So S.K., Kasemo B., Franchy R., Ho W. // Chem. Phys. Lett. 1990. V. 172. P. 125.
Campbell C.T., White J.M. // Appl. Surf. Sci. 1978. V. 1. P. 347.
Schmatloch V., Kruse N. // Surf. Sci. 1992. V. 269/270. P. 488.
Jirsak T., Dvorak J., Rodriguez J.A. // Surf. Sci. 1999. V. 436. P. L683.
Wickham D.T., Banse B.A., Koel B.E. // Surf. Sci. 1991. V. 243. P. 83.
Zheng G., Altman E.I. // Surf. Sci. 2000. V. 462. P. 151.
Heras J.M., Estiu G., Viscido L. // Thin Solid Films. 1990. V. 188. P. 165.
Stara I., Nehasil V., Matolin V. // Surf. Sci. 1995. V. 331–333. P. 173.
Leisenberger F.P., Koller G., Sock M., Surnev S., Ramsey M.G., Netzer F.P., Klotzer B., Hayek K. // Surf. Sci. 2000. V. 445. P. 380.
Han J., Zemlyanov D.Y., Ribeiro F.H. // Surf. Sci. 2006. V. 600. P. 2752.
Nagarajan S., Thirunavukkarasu K., Gopinath C.S. // J. Phys. Chem. C. 2009. V. 113. P. 7385.
Супрун Е.А., Саланов А.Н. // Кинетика и катализ. 2017. Т. 58. С. 98.
German E.D., Sheintuch M., Kuznetsov A.M. // J. Phys. Chem. C. 2009. V. 113. P. 15326.
Farber R.G., Turano M.E., Oskorep E.C.N., Wands N.T., Juurlink L.B.F., Killelea D.R. // J. Phys.: Condens. Matter. 2017. V. 29. P. 164002.
Wider J., Greber T., Wetli E., Kreutz T.J., Schwaller P., Osterwalder J. // Surf. Sci. 1998. V. 417. P. 301.
Monine M.I., Schaak A., Rubinstein B.Y., Imbihl R., Pismen L.M. // Catal. Today. 2001. V. 70. P. 321.
Gibson K.D., Killelea D.R., Sibener S.J. // J. Phys. Chem. C. 2014. V. 118. P. 14977.
Morales C., Díaz-Fernández D., Mossanek R.J.O., Abbate M., Méndez J., Pérez-Dieste V., Escudero C., Rubio-Zuazo J., Prieto P., Soriano L. // Appl. Surf. Sci. 2020. V. 509. P. 145118.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


