Кинетика и катализ, 2022, T. 63, № 1, стр. 122-131
Синтез и структура нового клатрохелата рутения(II) и использование высокопористого керамического материала с иммобилизованным комплексом в реакциях окислительной конверсии метана
А. С. Чуприн a, b, d, С. А. Белова a, d, М. Г. Бугаенко a, c, А. В. Вологжанина a, А. С. Локтев c, d, e, Я. З. Волошин a, c, d, *, **, В. М. Бузник c, f, А. Г. Дедов c, d, e
a ФГБУН Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
b ФГБУН Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119991 Москва, Ленинский просп., 31, корп. 4, Россия
c ФГБУН РГУ нефти и газа (НИУ) им. И.М. Губкина
119991 Москва, Ленинский просп., 65, корп. 1, Россия
d ФГБУН Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский просп., 31, Россия
e ФГБУН Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Ленинский просп., 27, Россия
f Всероссийский научно-исследовательский институт авиационных материалов
105005 Москва, ул. Радио, 17, Россия
* E-mail: voloshin@igic.ras.ru
** E-mail: voloshin@ineos.ac.ru
Поступила в редакцию 28.05.2021
После доработки 09.07.2021
Принята к публикации 11.08.2021
- EDN: VOQBFM
- DOI: 10.31857/S0453881122010026
Аннотация
Синтезирован новый клеточный комплекс рутения(II) с терминальными полярными группами в его апикальных заместителях, молекулярный дизайн которого способствует его эффективной иммобилизации за счет адсорбции на поверхность термоустойчивого высокопористого силикатного волокнистого материала, применяемого в качестве носителя. Комплекс получен темплатной конденсацией на ионе рутения(II) как матрице циклогександион-1,2-диоксима (ниоксима) и 4-(гидроксиметил)фенилборной кислоты с использованием его сольвато-комплекса [Ru(CH3CN)3(COD)Cl](BF4) как источникa катионов Ru2+. Состав и строение синтезированного макробициклического соединения установлены на основании данных элементного анализа, MALDI-TOF масс-спектрометрии, 1H и 13C{1H} ЯМР-спектроскопии, а также методом РСА. Показано, что полученный гибридный материал с иммобилизованным клатрохелатом рутения катализирует реакцию углекислотной конверсии метана. Производительность каталитической системы при 900°C достигает 9437 молей СО и 11797 молей Н2 на грамм-атом рутения в час.
ВВЕДЕНИЕ
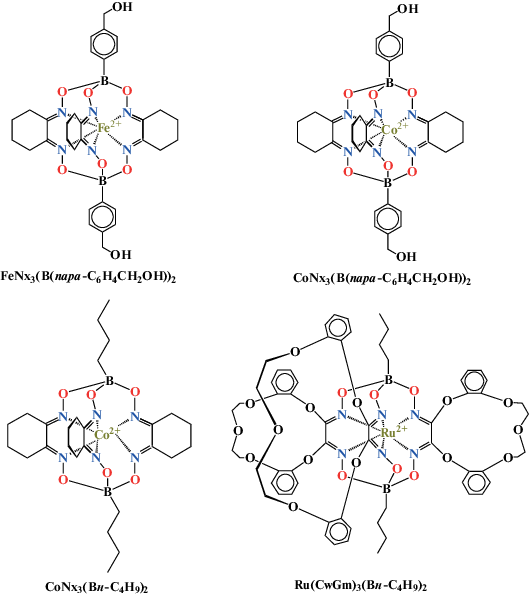
Паровая конверсия метана в смесь водорода и монооксида углерода (синтез-газ, СГ) в настоящее время является основным промышленным способом получения водорода [1–7]. В качестве перспективной альтернативы этому процессу рассматриваются представленные на схеме 1 реакции кислородной конверсии метана (ККМ) [1–15] и углекислотной конверсии метана (УКМ) [1–9, 14–22]. Преимущество УКМ заключается в образовании синтез-газа с соотношением Н2/СО = = 1, что позволяет использовать его без дальнейшей переработки в ряде промышленных синтезов топлив и ценных химических продуктов (в частности, спиртов, альдегидов, эфиров, кислот и углеводородов по реакции Фишера–Тропша). Кроме того, утилизация парниковых газов – метана и диоксида углерода – позволяет решить ряд глобальных экологических проблем, стоящих перед человечеством [23, 24]. Однако разработка высокоактивных и устойчивых к зауглероживанию катализаторов реакций окислительной конверсии метана по-прежнему остается актуальной задачей современной химической науки. Действительно, рациональный выбор каталитически активных центров и носителей для их иммобилизации играет ключевую роль в общей эффективности работы катализаторов. Высокопористые (до 95%) керамические материалы из волокон диоксида кремния типа ТЗМК [25–27] представляются перспективными носителями для достижения этой цели, поскольку они сочетают в себе низкую плотность и развитую удельную поверхность с наличием открытых и взаимосвязанных пор размером до сотен микрометров. Материалы обладают высокой термостойкостью (в некоторых случаях до 1700°C). Такие высокопористые носители ранее [28] успешно использовались для получения ряда каталитических материалов, содержащих клатрохелаты d-металлов, которые впервые были описаны авторами [29, 30]. В частности, было показано [29], что эффективным катализатором УКМ может служить гибридная клатрохелатсодержащая каталитическая система. Действительно, особенностью химических структур представленных на схеме 2 клатрохелатных комплексов железа, рутения и кобальта(II) является наличие в их молекулах терминальных реакционноспособных (полярных) групп, которые предназначены для эффективной физической адсорбции и/или хемосорбции этих комплексов на керамические и оксидные подложки. Это позволяет осуществить такую иммобилизацию на поверхность этих материалов за счет либо супрамолекулярных взаимодействий, либо ковалентного связывания; эти процессы могут быть проиллюстрированы схемой 3 . Ранее [29] вышеуказанные клеточные комплексы железа, кобальта и рутения с терминальными полярными группами были иммобилизованы на поверхность ТЗМК как твердую подложку, также как и представленный на схеме 2 макробициклический комплекс кобальта(II), молекула которого не содержит таких групп (его использовали в качестве контроля). Полученные гибридные клатрохелатсодержащие материалы были протестированы [29] в реакциях получения синтез-газа из метана путeм обоих вышеупомянутых процессов его окислительной конверсии (ККМ и УКМ). Результаты соответствующих каталитических экспериментов [29] по ККМ показали, что рутенийсодержащий катализатор на основе ТЗМК с иммобилизованным клатрохелатом рутения(II) Ru(CwGm)3(Bн-C4H9)2, впервые описанный в [31], в интервале температур 500–900°С был неэффективен в реакции получения синтез-газа из смеси метан–О2. Преимущественно наблюдали образование продуктов глубокого окисления метана – воды и углекислого газа; при 750°С детектировали заметное количество этилена: его вход составлял 6%. В присутствии катализатора на основе комплекса железа(II) FeNx3(B(пара-C6H4CH2OH))2 отмечали [29] образование заметных количеств синтез-газа, выход которого при 920–950°С и скорости подачи метан-кислородной смеси 14 л ${\text{г}}_{{{\text{кат}}}}^{{ - {\text{1}}}}$ ч–1 достигал 20%; также зарегистрировали появление значительного количества этилена с выходом до 10%. Гибридный катализатор, содержавший комплекс кобальта(II) СoNx3(B(пара-C6H4CH2OH))2, показал аналогичные результаты, которые, однако, не отличались значительно от таковых, полученных с использованием ТЗМК как катализатора в отсутствие соответствующей клатрохелатной компоненты.
Схема 1 . Основные процессы окислительной конверсии метана.
Более впечатляющие результаты были получены [29] при изучении УКМ в присутствии гибридных клатрохелатсодержащих каталитических систем. Использование ТЗМК с иммобилизованным комплексом кобальта(II) CoNx3(Bн-C4H9)2 как катализатора при 950°С и скорости подачи метан-углекислотной смеси 16 л ${\text{г}}_{{{\text{кат}}}}^{{ - {\text{1}}}}$ ч–1 приводило к выделению водорода с выходом 15–16%. При этом монооксид углерода практически не образовывался, но было зафиксировано появление этилена с выходом до 9%; следует также отметить невысокие степени конверсии метана (21–24%) и СО2 (12–15%). В то же время в присутствии рутенийсодержащего гибридного катализатора на основе ТЗМК с нанесенным на его поверхность комплексом рутения(II) Ru(CwGm)3(Bн-C4H9)2 при 900°С в потоке эквимолярной смеси СО2 и метана (скорость подачи 15 л ${\text{г}}_{{{\text{кат}}}}^{{ - {\text{1}}}}$ ч–1) выходы монооксида углерода и водорода составляли [29] приблизительно 82 мол. % по сумме поданных CH4 и CO2. При снижении температуры до 700°С выходы водорода и СО понижались до 40 и 52% соответственно. Последующее повышение температуры процесса УКМ до 800°С привело [29] к возрастанию выхода Н2 до 60–71%, а СО – до 79%. Дальнейший подъем температуры в слое катализатора до 900°С позволил увеличить выходы СО и водорода до 95%. При 950°С выходы этих продуктов уменьшались (88–91%), но по-прежнему сохраняли высокие значения. Результаты [29, 32, 33] свидетельствуют о том, что использованные клатрохелаты металлов(II) являются только предшественниками одноатомных катализаторов: каждый из их каталитически активных изолированных металлоцентров включен в матрицу – производную исходного инкапсулирующего лиганда, который претерпевал термическое разложение в использованных условиях каталитических реакций. Выбор таких макробициклических лигандов, предназначенных для эффективной иммобилизации их клеточных комплексов на поверхность волокон заданной высокопористой керамической подложки, позволяет увеличить поверхностную концентрацию вышеуказанных каталитически активных металлоцентров (и, следовательно, каталитическую активность гибридного органо-неорганического материала). В частности, как было упомянуто, в результате иммобилизации трехреберно-функционализированного трис-краунэфирсодержащего макробициклического комплекса рутения(II) Ru(CwGm)3(Bн-C4H9)2 как прекатализатора на поверхность ТЗМК как подложки был получен [29] активный и селективный каталитический материал для превращения смеси CH4 + CO2 в синтез-газ с эквимолярными количествами H2 и CO. Однако этот реберно-функционализированный трис-краунэфирный клатрохелат рутения(II) синтетически малодоступен: для его получения была использована [31] многостадийная синтетическая процедура с очень низким общим выходом по отношению к рутению – дорогостоящему и малораспространенному металлу группы платины. Поэтому целью настоящего исследования был синтез нового клеточного комплекса рутения(II) с терминальными полярными группами в его апикальных заместителях, установление его состава и строения (в том числе, методом РСА) и изучение каталитической активности гибридного материала на основе ТЗМК с таким нанесенным комплексом рутения в реакции УГК.
Схема 2 . Химические структуры использованных клатрохелатов d-металлов.
Схема 3 . Иммобилизация клатрохелатов d-металлов на поверхность керамического материала.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы
Использовали 1,5-циклооктадиен, 4-(гидроксиметил)фенилборную кислоту (“Acros”), циклогександион-1,2 диоксим (ниоксим, H2Nx, “Sigma- Aldrich”), Ru(OH)Cl3 (“Аурат”), тетрафтороборат аммония (“Реахим”), сорбенты и органические растворители (“Acros”). Исходный сольвато-комплекс [Ru(CH3CN)3(COD)Cl](BF4) получали по методике, аналогичной описанной [34], использовав (NH4)BF4 вместо (NH4)PF6.
Элементный анализ на содержание C, H и N выполняли на приборе Carlo Erba 1106 (“CARLO ERBA Reagents”, Франция) в Лаборатории микроанализа ИНЭОС РАН.
Масс-спектр MALDI-TOF полученного клатрохелата рутения(II) RuNx3(B4-C6H4CH2OH)2 в положительной и отрицательной областях регистрировали на масс-спектрометре MALDI-TOF MS Bruker Autoflex II (“Bruker Daltonics”, Германия) в режиме reflecto-mol. Ионизацию проводили УФ-лазером с длиной волны 337 нм. Образец помещали на никелевую пластину, в качестве матрицы использовали 2,5-дигидроксибензойную кислоту. Точность измерений составляла 0.1%.
Спектры ЯМР 1Н и 13С{1H} раствора соединения регистрировали на спектрометре ЯМР INOVA 400 (“Varian”, США, 400.13 МГц). В качестве растворителя использовали дейтерированный CD2Cl2 с содержанием дейтерия не менее 99.6%.
Синтез, аналитические и спектральные характеристики комплекса RuNx3(B4-C6H4CH2OH)2
Комплекс [Ru(CH3CN)3(COD)Cl](BF4) (0.051 г, 0.11 ммоль) и ниоксим (0.040 г, 0.28 ммоль) растворяли/суспендировали в метаноле (10 мл) в атмосфере аргона. Реакционную смесь кипятили в течение 8 ч и затем прибавляли 4-(гидроксиметил)фенилборную кислоту (0.020 г, 0.13 ммоль), перемешивали в течение 16 ч при комнатной температуре. Выпавший осадок отфильтровывали, промывали метанолом (15 мл), диэтиловым эфиром (15 мл), гексаном (5 мл) и высушивали в вакууме. Выход составил 0.016 г (32%). Вычислено (%) для C32H38B2RuN6O8: C, 50.75; H, 5.06; N, 11.10. Найдено (%): C, 50.71; H, 5.08; N, 11.16. MALDI-TOF MS, m/z: 757 [M]+•. 1H ЯМР (CD2Сl2, δ, м. д.): 1.74 (уш. м, 12H, β-CH2 (Nx)), 2.86 (уш. т, 12H, α‑CH2(Nx)), 4.69 (с, 4H, CH2OH), 7.38 (д, 4H, мета-Ph), 7.80 (д, 4H, oртo-Ph). 13C{1H} ЯМР (CD2Сl2, δ, м. д.): 22.10 (с, β-CH2(Nx)), 25.97 (с, α-CH2(Nx)), 65.38 (с, CH2OH), 126.64 (с, мета-Ph), 132.56 (с, oртo-Ph), 141.43 (с, пара-Ph), 148.72 (с, C=N).
Рентгеноструктурный анализ
Монокристаллы комплекса RuNx3(B4-C6H4CH2OH)2, пригодные для рентгеноструктурного анализа (РСА), были получены медленным упариванием его насыщенного раствора в смеси хлористый метилен : гексан = 1 : 2. Интенсивности отражений кристалла RuNx3(B4-C6H4CH2OH)2 были зарегистрированы на дифрактометре APEX II (“Bruker”, Германия), оснащенном двухкоординатным CCD-детектором, с использованием излучения молибденового анода (λ = 0.71073 Å) и графитового монохроматора. Параметры этого кристалла при 120.0(2) К: C32H38B2RuN6O8, M = 757.37, триклинная сингония, пространственная группа $P\bar {1},$ a = 12.8576(11) Å, b = 14.9846(13) Å, c = 18.6646(15) Å, α = 108.963(2)°, β = 95.616(2)°, γ = 105.592(2)°, V = = 3207.3(5) Å3, Z = 4, Dвыч = 1.568 г/см3, μ = 0.552 мм–1, 19051 независимое отражение (Rint = 0.041), 11726 наблюденных отражений, окончательные параметры сходимости R1[I > 2σ(I)] = 0.053, wR(F2) = 0.137 и GOF = 0.998. Структура была решена прямым методом и рассчитана с использованием полноматричного метода наименьших квадратов относительно F2. Неводородные атомы были уточнены анизотропно, положения атомов водорода были вычислены и все атомы водорода включены в этот расчет по модели наездника с Uiso(H) = 1.5Ueq(O) и Uiso(H) = 1.2Ueq(C). Три из четырех независимых терминальных гидроксильных групп молекулы RuNx3(B4-C6H4CH2OH)2 разупорядочены по двум положениям. Все вычисления были проведены с помощью программных пакетов SHELXL2014 [35] и OLEX2 [36]. Координаты атомов, величины тепловых параметров и список всех отражений депонированы в Кембриджском банке структурных данных (№ 2083845; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ structures).
Приготовление гибридного каталитического материала
Каталитическую систему готовили нанесением на термоустойчивый и высокопористый керамический носитель нового макробициклического комплекса RuNx3(B4–C6H4CH2OH)2. В качестве высокопористого носителя использовали силикатный волокнистый материал ТЗМК [25–27]. Нанесение этого высоко интенсивно окрашенного в видимой области (450–500 нм) клеточного комплекса рутения(II) с терминальными гидроксильными группами в апикальных заместителях как прекатализатора осуществляли путем его растворения в хлористом метилене и испарением полученного раствора в объеме ТЗМК как носителе: раствор комплекса диффундировал (проникал) в его поры, полученный гибридный материал высушивали на воздухе. Это позволило достичь эффективной иммобилизации клатрохелата рутения(II) RuNx3(B4-C6H4CH2OH)2 с терминальными полярными группами на этом носителе за счет физической адсорбции на общей (внутренней и внешней) поверхности ТЗМК. Затем вышеупомянутый гибридный каталитический материал промывали небольшим количеством хлористого метилена, визуально контролируя удаление исходного клатрохелатного комплекса, который не был иммобилизован на поверхность керамического носителя.
Каталитические эксперименты
Изучение каталитических характеристик гибридной системы ТЗМК–клатрохелат рутения(II) RuNx3(B4-C6H4CH2OH)2 в реакциях ККМ и УКМ проводили в обогреваемом кварцевом реакторе проточного типа с карманом для термопары; конец термопары располагался в центре слоя катализатора. Размер частиц катализатора весом 0.135 г составлял 1–2 мм, содержание соответствующего клатрохелатного комплекса рутения было равно 0.064 г (5%), содержание рутения – 0.00086 г (0.6%). Свободный объем реактора при проведении ККМ заполняли кварцевой крошкой. В реактор подавали неразбавленные инертным газом смеси CH4 с O2 или c CO2 (чистота 99.9%) с соотношением компонентов CH4/O2 = 2 и CH4/CO2 = 1 соответственно. Скорость подачи газовых смесей составляла 23 л г–1 ч–1. Катализатор разогревали в течение 1 ч до заданной температуры в токе смеси метана с кислородом или c диоксидом углерода, далее температуру в реакторе варьировали, как указано в табл. 1. Анализ состава продуктов проводили методом газовой хроматографии с использованием хроматографа ГАЛС-311, снабженного детектором по теплопроводности (“Люмэкс-маркетинг”); газ-носитель – гелий. Газохроматографическая стальная колонка № 1: длина 3 м, внутренний диаметр 3 мм, заполнена адсорбентом “Порапак-Q” с размером зерна 80–100 меш. Газохроматографическая стальная колонка № 2: длина 2 м, внутренний диаметр 3 мм, заполнена адсорбентом цеолитом NaX, фракция 0.2–0.25 мм. Регистрацию и обработку газовых хроматограмм осуществляли с помощью программно-аппаратного комплекса автоматизации хроматографического анализа “Экохром”, зарегистрирован в Государственном реестре средств измерений под № 16616-03. Газы из реактора вводили в газовые хроматографы через краны-дозаторы. Скорость газа-носителя гелия на выходе из колонок была установлена 40 мл/мин. Использовали два вышеупомянутых газовых хроматографа с детектором по теплопроводности (ДИП), ток детектора 130 мА. На первом хроматографе, укомплектованном колонкой № 1, при температуре 80°С устанавливали величину суммы О2 и СО, а также содержание СН4, СО2, С2Н4 и С2Н6. На втором хроматографе, укомплектованном колонкой № 2, при комнатной температуре количественно детектировали H2, O2, N2, CH4 и CO.
Таблица 1.
Результаты реакции УКМ в присутствии гибридного каталитического материала ТЗМК–комплекс RuNx3(B4-C6H4CH2OH)2*
| T, °C | Kонверсия, % | Выход, % | ||
|---|---|---|---|---|
| CH4, | CO2 | Н2 | СО | |
| 900 | 15 | 19 | 5.3 | 0.6 |
| 900 | 21 | 27 | 9 | 9 |
| 900 | 20 | 28 | 11 | 9 |
| 900 | 19 | 24 | 9 | 7 |
| 850 | 11 | 15 | 3 | 0.2 |
| 850 | 15 | 16 | 3 | 0.1 |
| 800 | 14 | 15 | 1 | 0.03 |
| 800 | 16 | 15 | 1 | 0.01 |
| 750 | 16 | 16 | 0.8 | 0 |
| 750 | 14 | 19 | 0.8 | 0 |
| 900 | 20 | 31 | 10 | 8 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Реакцию темплатной конденсации на матрице – ионе рутения(II) ниоксима и 4-(гидроксиметил)фенилборной кислоты – проводили в кипящем метаноле с использованием сольвато-комплекса рутения(II) [Ru(CH3CN)3(COD)Cl](BF4) в качестве источника этих ионов (схема 4 ). На первой стадии реакции наблюдали изменение окраски реакционной смеси от слабо-желтой до темно-коричневой; последующее прибавление 4-(гидроксиметил)фенилборной кислоты (как сшивающего агента), обладающей также льюисовской кислотностью, привело к постепенному выпадению осадка целевого темно-желтого клатрохелатного комплекса рутения(II) RuNx3(B4-C6H4CH2OH)2. Предпринятые нами попытки его получения из соединений [Ru(COD)Cl2] и [Ru(CH3CN)3(COD)Cl2] как рутенийсодержащих предшественников привели к тому, что выходы этого клеточного комплекса были более низкими, чем в случае использования сольвато-комплекса [Ru(CH3CN)3(COD)Cl](BF4). Также было установлено, что избыток ниоксима как α-диоксиматного лигандного синтона (4.5 эквивалента вместо трех) способствует увеличению выхода целевого макробициклического продукта.
Схема 4 . Получение клатрохелатов рутения(II) с терминальными гидроксильными группами.
Состав и строение макробициклического комплекса RuNx3(B4-C6H4CH2OH)2 установлены с использованием данных элементного анализа, MALDI-TOF масс-спектрометрии, 1H и 13C{1H} ЯМР-спектроскопии, а также методом РСА.
Наиболее интенсивный пик в положительной области MALDI-TOF масс-спектра этого нового клатрохелата рутения(II) относится к его молекулярному иону.
Число и положение сигналов в 1H и 13C{1H} ЯМР-спектрах его раствора (в частности, протонов апикальных гидроксиметилсодержащих ароматических заместителей и протонов CH2-групп хелатирующих α-ниоксиматных фрагментов), а также соотношение интегральных интенсивностей сигналов этих протонов в 1Н ЯМР-спектре, подтвердили состав и симметрию молекулы RuNx3(B4-C6H4CH2OH)2. Число линий в его 13C{1H} ЯМР-спектре указывает на эквивалентность реберных хелатирующих фрагментов этой молекулы.
Кристаллическая и молекулярная структура комплекса RuNx3(B4-C6H4CH2OH)2 установлена прямым методом рентгеноструктурного анализа (РСА). Независимая часть кристаллической ячейки содержит две молекулы RuNx3(B4-C6H4CH2OH)2, вид одной из них представлен на рис. 1. Инкапсулированный ион металла находится в окружении шести атомов азота трех хелатирующих α-диоксиматных фрагментов, образующих RuN6-координационный полиэдр, длины связей Ru–N в котором изменяются в диапазоне 1.977(3)–1.994(3) Å. Его геометрия приближается к идеальной тригональной призме (ТП, угол искажения φ = 0°) с углами φ равными 0.8° для одной из молекул RuNx3(B4-C6H4CH2OH)2 и 11.6° – для другой молекулы этого типа. Для сравнения, в ранее изученном [37] клатрохелате RuNx3(Bн-С4Н9)2 соответствующие усредненные геометрические параметры составляют 1.972(4) Å и 12.0°. В молекулах алкильных боратных макробициклических трис-ниоксиматов с инкапсулированным ионом железа или кобальта(II) эти величины находятся в диапазоне 1.91–1.92 Å и 10–22.9°, и 1.943(3) Å и 7.0° соответственно [37–39]. Геометрия макробициклического остова молекулы RuNx3(B4-C6H4CH2OH)2 близка к известной для ранее уже изученных методом РСА клеточных комплексов d-металлов этого типа [40, 41]. В отличие от большинства охарактеризованных с использованием вышеуказанного метода трис-ниоксиматов железа(II), все шестичленные циклы молекул комплекса RuNx3(B4-C6H4CH2OH)2 упорядочены в его монокристалле. Структурная жесткость оксимных фрагментов не позволяет шестичленным алициклическим реберным заместителям реализовать конформации типа “кресло” или “ванна”. В результате, как и в кристалле исходного α-диоксиматного лигандного синтона – ниоксима [42], все алициклические фрагменты этого типа в кристалле RuNx3(B4-C6H4CH2OH)2 имеют “твист”-конформацию. Разупорядоченные терминальные гидроксильные группы в апикальных функционализированных заместителях клатрохелатной молекулы образуют в кристалле слабые водородные связи с атомами кислорода макробициклического остова или с гидроксильными группами соседних макробициклических молекул, что приводит к формированию соответствующих тетрамеров показанных на рис. 2.
Рис. 1.
Молекулярная структура клатрохелата RuNx3(B4-C6H4CH2OH)2 в представлении атомов тепловыми эллипсоидами (р = 50%).

Рис. 2.
Образование тетрамеров клатрохелатными молекулами RuNx3(B4-C6H4CH2OH)2 за счет образования водородных связей О–Н…О (показаны пунктирными линиями); атомы Н(С) не показаны.

Каталитическая активность
В табл. 1 представлены сведения об образовании синтез-газа в присутствии гибридной системы ТЗМК–иммобилизированный комплекс RuNx3(B4-C6H4CH2OH)2 (схема 5 ) в зависимости от температуры (Т, °C) в слое исследуемой каталитической системы. В качестве показателей эффективности этого процесса использовали данные о конверсии СН4 и СO2, выходе целевых продуктов и производительности катализатора (моль СО на грамм-атом рутения в час). Выход монооксида углерода рассчитывали путем деления суммарного числа молей образовавшегося СО на сумму числа молей, поданных в реактор CH4 и CO2. Выход водорода (%) находили по формуле Y(H2) = W(Н2) × 100/(W(CH4) × 2), где W(Н2) – количество водорода на выходе из реактора, моль; W(CH4) – скорость подачи метана на входе в реактор, моль.
Схема 5. Эффективная иммобилизация клатрохелата рутения(II) на поверхность керамического материала .
Как видно из данных табл. 1, полученная новая гибридная рутенийсодержащая каталитическая система обеспечивает конверсию метана и СО2 до 20 и 31 мас. % соответственно; выходы Н2 и СО находятся в диапазоне 9–11 мас. %. В целом производительность каталитической системы ТЗМК–RuNx3(B4-C6H4CH2OH)2 достигает 9437 молей СО и 11797 молей Н2 на грамм-атом рутения в час. Повышение температуры в слое этого гибридного катализатора приводит к увеличению степени конверсии метана и углекислого газа, а также к росту выхода целевых продуктов и производительности катализатора. Оптимальное протекание процесса УКМ наблюдается при температуре близкой к 900°C, которая обеспечивает бóльшие степени конверсии метана и СО2, увеличение выходов Н2 и СО, а также высокую производительность каталитической системы. Достоинством такой клатрохелатсодержащей системы является возможность проведения процесса УКМ без разбавления исходной смеси инертными газами, наличие которых, как известно, вызывает значительные технологические проблемы.
Рутенийсодержащие материалы являются эффективными катализаторами УКМ, которые не склонны к зауглероживанию [21, 22, 43]. В [22] для проведения реакции УКМ использовали катализаторы Ru/ZrO2–SiO2 с низким содержанием рутения (0.11–1 мас. %). Катализатор, в состав которого входит 0.13% рутения, не подвергался зауглероживанию и был наиболее активным, число оборотов реакции превращения метана составило 0.92 моль ${\text{г}}_{{{\text{кат}}}}^{{ - {\text{1}}}}$ ч–1 [22]. Для предложенного нами ранее [29] катализатора c 0.6 мас. % рутения число оборотов реакции конверсии метана было 0.76 моль ${\text{г}}_{{{\text{кат}}}}^{{ - {\text{1}}}}$ ч–1, что близко к полученному значению для изученной в настоящей работе системы. Для рутениевых катализаторов, нанесенных на оксид алюминия, в обзоре [21] приводятся величины числа оборотов реакции превращения метана в диапазоне 2–4 моль ${\text{моль}}_{{{\text{Ru}}}}^{{ - {\text{1}}}}$ с–1. Для испытанного нами катализатора этот показатель составил 3.3 моль ${\text{моль}}_{{{\text{Ru}}}}^{{ - {\text{1}}}}$ с–1, что в ряде случаев превосходит литературные данные. Наиболее близким по составу к полученной нами гибридной системе является описанный [43] катализатор УКМ Ru/SiO2, числа оборотов реакции превращения метана которого было близко к 2.1 моль ${\text{моль}}_{{{\text{Ru}}}}^{{ - {\text{1}}}}$ с–1, что существенно меньше установленной нами величины.
После использования в реакции УКМ гибридный рутенийсодержащий катализатор был протестирован также в реакции ККМ. Он не проявил аналогичной активности в реакции получении синтез-газа, катализируя при этом глубокое окисление метана до СО2 и воды.
Природа каталитически активных центров на поверхности синтезированной гибридной системы требует тщательного дальнейшего изучения с использованием современных физических методов исследований (прежде всего, синхротронных экспериментов РФЭС и XANES [33]). Детальное исследование исходных клатрохелатсодержащих каталитических материалов и их превращений в ходе реакции УКМ в настоящее время начато в нашей исследовательской группе.
ЗАКЛЮЧЕНИЕ
Таким образом, нами был осуществлен направленный на эффективную иммобилизацию на керамические подложки молекулярный дизайн и проведен синтез нового клеточного комплекса рутения(II) с терминальными полярными группами в его апикальных заместителях. Установлен состав и строение молекулы полученного клатрохелата (в том числе, с использованием РСА) и изучена каталитическая активность гибридного материала на основе ТЗМК как термоустойчивого и высокопористого силикатного волокнистого материала с иммобилизованным клатрохелатом рутения. Гибридный каталитический материал получали нанесением комплекса с терминальными гидроксильными группами в апикальных заместителях как прекатализатор из его раствора на высокопористый носитель с последующим испарением растворителя в объеме ТЗМК. Новая гибридная рутенийсодержащая каталитическая система обеспечивала конверсию метана и СО2 приблизительно до 20 и 30 мас. % соответственно и выход Н2 и СО в диапазоне 9–11 мас. %; производительность такой каталитической системы достигала 9437 молей СО и 11797 молей Н2 на грамм-атом рутения в час. Повышение температуры в слое полученного гибридного катализатора приводило к увеличению степени конверсии метана и углекислого газа, а также к возрастанию выхода целевых продуктов и производительности каталитической системы. Оптимальное протекание процесса УКМ наблюдалось при температуре в слое близкой к 900°C: она обеспечила более высокие степени конверсии метана и СО2, увеличение выходов Н2 и СО, а также увеличение производительности клатрохелатсодержащей каталитической системы. Существенным преимуществом такой системы является возможность проведения процесса УКМ без разбавления исходной смеси инертными газами и при атмосферном давлении, что значительно упрощает возможное технологическое решение.
Список литературы
Holmen A. // Catal. Today. 2009. V. 142. P. 2.
Liu K., Song C., Subramani V. Hydrogen and syngas production and purification technologies. Wiley-Interscience, 2009. 533 p.
Арутюнов В.С., Крылов О.В. // Успехи химии. 2005. Т. 74. С. 1216.
Usachev N.Y., Kharlamov V.V., Belanova E.P., Kazakov A.V., Starostina T.S., Kanaev A.S. // Petrol. Chem. 2011. V. 51. P. 96.
Song C.S., Wei P. // Catal. Today. 2004. V. 98. P. 463.
Pena M.A., Gomez J.P., Fierro J.L.G. // Appl. Catal. A: General. 1996. V. 144. P. 7.
Moiseev I.I., Loktev A.S., Shlyakhtin O.A., Mazo G.N., Dedov A.G. // Petrol. Chem. 2019. V. 59. S1.
Nguyen T.H., Łamacz A., Krztoń A., Liszka B., Djéga-Mariadassou G. // Appl. Catal. B: Environ. 2016. V. 182. P. 385.
Hu Y.H., Ruckenstein E. // Adv. Catal. 2004. V. 48. P. 297.
Enger B.C., Lødeng R., Holmen A. // Appl. Catal. A: General. 2008. V. 346. P. 1.
Dedov A.G., Loktev A.S., Komissarenko D.A., Mazo G.N., Shlyakhtin O.A., Parkhomenko K.V., Kiennemann A.A., Roger A.-C., Ishmurzin A.V., Moiseev I.I. // Appl. Catal. A: General. 2015. V. 489. P. 140.
Al-Sayari S.A. // Open Catal. J. 2013. V. 6. P. 17.
Dedov A.G., Loktev A.S., Komissarenko D.A., Parkhomenko K.V., Roger A.-C., Shlyakhtin O.A., Mazo G.N., Moiseev I.I. // Fuel Process. Technol. 2016. V. 148. P. 128.
Zagaynov I.V., Loktev A.S., Arashanova A.L., Kutsev S.V., Ivanov V.K., Dedov A.G., Moiseev I.I. // Chem. Eng. J. 2016. V. 290. P. 193.
Дедов А.Г., Локтев А.С., Мухин И.Е., Баранчиков А.Е., Иванов В.К., Быков М.А., Солодова Е.В., Моисеев И.И. // Нефтехимия. 2019. Т. 59. С. 261. [Dedov A.G., Loktev A.S., Mukhin I.E., Baranchikov A.E., Ivanov V.K., Bykov M.A., Solodova E.V., Moiseev I.I. // Petrol. Chem. 2019. V. 59. P. 385.]
Bradford M.C.J., Vannice M.A. // Appl. Catal. A: General. 1996. V. 142. P. 73.
Bradford M.C.J., Vannice M.A. // Catal. Rev. Sci. Eng. 1999. V. 41. P.1.
Nikoo M.K., Amin N.A.S. // Fuel Proc. Technol. 2011. V. 92. P. 678.
Кислов В.Р., Скудин В.В., Адаму А. // Кинетика и катализ. 2017. Т. 58. № 1. С. 78.
Гаврилова Н.Н., Мячина М.А., Ардашев Д.В., Назаров В.В., Скудин В.В. // Кинетика и катализ. 2018. Т. 59. № 5. С. 612.
Erd˝ohelyi A. // Catalysts. 2021. V. 11. P. 159.
Whang H.S., Choi M.S., Lim J., Kim C., Heo I., Chang T.-S., Lee H. // Catal. Today. 2017. V. 293–294. P. 122.
Zhenghong B., Fei Y. //Adv. Bioenergy. 2018. V. 3. P. 43.
Esswein A.J., Nocera D.G. // Chem. Rev. 2007. V. 107. P. 4022.
Patent US 5.569.423, 1996.
Щетанов Б.В., Ивахненко Ю.А., Бабашов В.Г. // Рос. хим. журн. 2010. Т. 54. С. 12. [Schetanov B.V., Ivakhnenko Yu.A., Babashov V.G. Heat shield materials // Russ. J. Gen. Chem. 2011. V. 81. P. 978.]
Доспехи для Бурана. Материалы и технологии ВИАМ для МКС “Энергия–Буран” (Броня для “Бурана”. Материалы и технологии ВИАМ для Международной космической станции “Энергия–Буран”), под ред. Е.Н. Каблова, Наука и жизнь, Москва, 2013. [Dospekhi dlya Burana. Materialy i teknologii VIAM dlya MKS ‘Energiya–Buran’ (Armour for ‘Buran’. Materials and Technologies of VIAM for the International Space Station ‘Energy–Buran’), ed. E.N. Kablov, Nauka i Zhizn’, Moscow, 2013 (in Russian).]
Бузник В.М., Бабашов В.Г., Беспалов А.С., Гращенков Д.В., Дедов А.Г., Волошин Я.З., Локтев А.С., Кирюхин Д.П., Лермонтов С.А., Морозов Е.В., Никитин Л.Н. / В сб.: Роль фундаментальных исследований при реализации Стратегических направлений развития материалов и технологий их переработки на период до 2030 г. Материалы V Всероссийской научно-технической конференции, 28 июня 2019 г. Федеральное государственное унитарное предприятие “Всероссийский научно-исследовательский институт авиационных материалов”. 2019. 418 с. С. 18.
Dedov A.G., Voloshin Y.Z., Belov A.S., Loktev A.S., Bespalov A.S., Buznik V.M. // Mendeleev Commun. 2019. V. 29. P. 669.
Voloshin Ya.Z., Buznik V.M., Dedov A.G. // Pure Appl. Chem. 2020. V. 92. P. 1159.
Voloshin Y.Z., Varzatskii O.A., Kron T.E., Belsky V.K., Zavodnik V.E., Strizhakova N.G., Nadtochenko V.A., Smirnov V.A. // Dalton Trans. 2002. P. 1203.
Пaтeнт PФ № 2719176, 17.04.2020.
Зубавичус Я.В., Григорьев С.А., Пушкарев А.С., Борисов М.М., Бугаенко М.Г., Волошин Я.З., Дедов А.Г. // Рос. нанотехнол. 2020. Т. 15. С. 352.
Albers M.O., Ashworth T.V., Oosthuizen H.E., Singleton E., Merola J.S., Kacmarcik R.T. // Inorg. Syntheses. 1989. V. 26. P. 68.
Sheldrick G.M. // Acta Crystallogr. 2015. V. A71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J., Howard J.A.K., Puschmann H. // J. Appl. Crystallogr. 2009. V. 42. P. 339.
Kubow S.A., Takeuchi K.J., Grzybowski J.J., Jircitano A.J., Goedken V.L. // Inorg. Chim. Acta. 1996. V. 241. P. 21.
Voloshin Y.Z., Varzatskii O.A., Stash A.I., Belsky V.K., Bubnov Yu.N., Vorontsov I.V., Potekhin K.A., Antipin M.Yu., Polshin E.V. // Polyhedron. 2001. V. 20. P. 2721.
Voloshin Y.Z., Varzatskii O.A., Belov A.S., Lebedev A.Yu., Makarov I.S., Gurskii M.E., Antipin M.Yu., Starikova Z.A., Bubnov Yu.N. // Inorg. Chim. Acta. 2007. V. 360. P. 1543.
Voloshin Y.Z., Kostromina N.A., Krämer R. Clathrochelates: Synthesis, Structure and Properties, Elsevier, 2002.
Voloshin Y.Z., Belaya I.G., Krämer R. Cage Metal Complexes: Clathrochelates Revisited, Springer, 2017.
Streltsova N.R., Bel’sky V.K., Voloshin Y.Z. // Acta Cryst. 1993. V. C49. P.635.
Das S., Shah M., Gupta R.K., Bordoloi A. // J. CO2 Utilization. 2019. V. 29. P. 240. https://doi.org/10.1016/j.jcou.2018.12.016
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ