Кинетика и катализ, 2022, T. 63, № 1, стр. 132-137
Исследование электрохимических характеристик твердооксидных топливных элементов с неразделенными электродными пространствами и электродами на основе платины и манганита лантана, допированного стронцием, в метан-воздушной смеси
М. В. Юсенко a, В. Д. Беляев a, А. К. Демин b, Д. И. Бронин b, В. А. Собянин a, П. В. Снытников a, *
a ФГБУН ФИЦ Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
b ФГБУН Институт высокотемпературной электрохимии УрО РАН
620066 Екатеринбург, ул. С. Ковалевской, 22/ул. Академическая, 20, Россия
* E-mail: pvsnyt@catalysis.ru
Поступила в редакцию 21.09.2021
После доработки 04.10.2021
Принята к публикации 04.10.2021
- EDN: BQPHGA
- DOI: 10.31857/S0453881122010105
Аннотация
Исследованы свойства твердооксидных топливных элементов с неразделенными электродными пространствами (ТОТЭ с НЭП) с электролитом на основе оксида циркония, допированного оксидом иттрия (YSZ), платиновым анодом и катодом на основе манганита лантана, допированного стронцием (LSM), в интервале температур 500–750°С в смеси метана с воздухом. Продемонстрировано, что на LSM конверсия метана при 650°С в реакции окисления не превышает 10%, поэтому LSM можно использовать в качестве катодного материала в ТОТЭ с НЭП. Показано, что ячейка Pt│YSZ│LSM позволяет получать электричество. Максимальные удельная мощность (36 мВт/см2), напряжение (0.85 В) и плотность тока короткого замыкания (132 мA/см2) достигались при 700°C, отношении [CH4]/[O2] ~ 1.0 при скорости подачи реакционной смеси 330 см3/мин. Проведенное исследование свидетельствует о возможности создания твердооксидных топливных элементов с неразделенными электродными пространствами, питаемых смесью метана и воздуха, которые способны генерировать электроэнергию. Остающийся после работы ТОТЭ с НЭП метан может быть использован для генерации тепла либо переработан в синтез-газ, применяемый в качестве сырья при производстве, например, аммиака, метанола или углеводородов по Фишеру–Тропшу.
ВВЕДЕНИЕ
Деятельность Института катализа СО РАН с момента его создания и по настоящее время неразрывно связана с решением важных научных и технологических задач по получению, хранению и использованию водорода. Это относится не только к традиционным для химической и нефтехимической отраслям промышленности технологиям, но и достаточно специфическим направлениям, например, применению водорода в ракетно-космической отрасли, для обеспечения потребностей которой в 1971 г. было создано уникальное криогенное гетерогенно-каталитическое промышленное производство жидкого пара-водорода и разработаны эффективные катализаторы для реализации этого процесса [1–11]. К сожалению, единственный крупный и стратегически важный промышленный объект по производству жидкого пара-водорода входил в состав Государственного Чирчикского электрохимического комбината им. И.В. Сталина в Узбекистане и прекратил свое существование вместе с распадом СССР [12].
Новое время ставит новые задачи, и есть надежда, что принятая в августе 2021 г. Правительством Российской Федерации “Концепция развития водородной энергетики” придаст импульс к возрождению утраченных технологий [13, 14], воссозданию разрушенных производств и развитию новых наукоемких направлений [15–18]. Современные вызовы по освоению “зеленых” технологий, декарбонизации промышленности, внедрению возобновляемых источников энергии, электрификации, повышению энергоэффективности требуют разработки новых подходов на стыке каталитических и электрохимических технологий. Учитывая известные запасы природного газа, текущее состояние по его разведке и добыче, нет никаких сомнений, что еще на протяжении долгого времени именно метан будет оставаться основным сырьем для получения ценных химических продуктов и использоваться как топливо в энергетике для производства тепла и электроэнергии. В этой связи особую привлекательность представляют высокотемпературные твердооксидные топливные элементы (ТОТЭ) с рабочей температурой 800–1000°С. Они могут потреблять в качестве топлива непосредственно метан, при электрохимическом окислении которого когенерируются электроэнергия и тепло, и образуются такие ценные продукты, как синтез-газ и углеводороды С2 [19].
Длительное время после создания традиционного топливного элемента с разделенными электродными пространствами предпринимались попытки по кардинальному упрощению его конструкции, в результате чего был предложен твердооксидный топливный элемент с неразделенными электродными пространствами (ТОТЭ с НЭП) [20–25]. Конструктивно ТОТЭ с НЭП также состоит из двух электродов (катода и анода) и электролита, но в отличие от традиционных ТОТЭ здесь в анодное и катодное пространства подается одинаковая по составу смесь топлива и окислителя. Такое упрощение конструкции предъявляет специфические требования к катоду и аноду. С одной стороны, они не должны проявлять высокую каталитическую активность в реакции глубокого окисления топлива, а с другой стороны – быть высокоактивны в отношении электрохимического окисления топлива в присутствии окислителя и электрохимического восстановления окислителя в присутствии топлива. Питаемый смесью метана и воздуха ТОТЭ с НЭП функционирует следующим образом. На аноде (в качестве которого могут, например, выступать Pt или Ni) вначале происходит парциальное каталитическое окисление метана с образованием синтез-газа. Затем водород и монооксид углерода электрохимически окисляются до углекислого газа и воды ионами O2–, которые выделяются на катоде. Катодными материалами могут быть Ag, Au или обладающая высокой электронной проводимостью керамика на основе перовскитов Lа1–xSrxMnO3 – δ (LSM), реже – кобальтиты типа Sm0.5Sr0.5CoO3 [26]. Образующиеся ионы O2– за счет электрохимического восстановления кислорода в присутствии метана через электролит переносятся к аноду. Принципиально ТОТЭ с НЭП могут быть выполнены в двух конфигурациях, отличающихся относительным расположением катода и анода. В одной из них анод и катод наносятся на противоположные стороны твердого электролита, а в другой – на одну сторону, при этом подача смеси метана и воздуха для обеих конфигураций осуществляется одновременно и на анод, и на катод.
Так как электролит в ТЭ служит для транспорта ионов кислорода от катода к аноду, то одними из основных требований, предъявляемых к материалу электролита, являются высокая ионная проводимость и низкая (в идеале – отсутствие) электронная проводимость. Число возможных материалов ограничивается температурой, при которой достигается достаточная ионная проводимость, а также стабильностью в реакционных условиях. Наиболее известны ТОТЭ на электролитах с проводимостью по ионам кислорода. Обычно твердый кислородпроводящий электролит представляет раствор ZrO2, допированный 8–10 мол. % Y2O3 (YSZ). Другой вариант – электролит на основе СеO2, в котором церий частично заменен гадолинием Ce0.8Gd0.2O1.9. Он обладает сравнимой проводимостью даже при более низкой рабочей температуре [13, 14]. Однако более высокая стоимость этого материала, заметная электронная проводимость в восстановительной среде и низкие механические свойства по сравнению с электролитом на основе ZrO2 несколько ограничивают его широкое использование в качестве электролита для ТОТЭ.
Основные усилия исследователей в области ТОТЭ с НЭП были направлены на поиск новых материалов для электролита, обладающих повышенной ионной проводимостью, а также более активных электродов. Обобщенная информация представлена в обзорных работах [27, 28].
В настоящей работе исследована каталитическая активность электродов на основе LSM в реакции окисления метана, а также проведено сопоставительное изучение электрохимических характеристик ячеек с неразделенными электродными пространствами и электродами на основе Pt (анод) и LSM (катод) в метан-воздушной смеси.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ТОТЭ с НЭП представлял собой трубку (диаметр – 10 мм, длина – 60 мм, толщина стенки – 0.5 мм) из твердого газоплотного кислородпроводящего электролита YSZ (состава 0.9ZrO2 + + 0.1Y2O3). На внутреннюю поверхность трубки наносили Pt-керамический анод, который получали из пасты, содержащей смесь мелкодисперсных порошков Pt и YSZ (5 вес. %), припеканием при температуре 950оС. На внешнюю поверхность трубки наносили катод из LSM. Катод готовили из пасты, состоящей из смеси мелкодисперсных порошков La0.7Sr0.3MnO3 (50 вес. %) и YSZ (50 вес. %). К электролиту пасту припекали на воздухе при температуре 1200°С. Внешний вид изготовленного ТОТЭ с НЭП Pt|YSZ|LSM показан на рис. 1.
Площадь каждого электрода составляла около 4 см2. Для снижения поляризации электродов анод и катод пропитывали спиртовыми растворами Ce(NO3)3 и Pr(NO3)3 соответственно, после чего прокаливали на воздухе при 500°С. Содержание оксидов церия и празеодима в электродах составляло около 1 вес. %. Далее эти электроды обозначены как Pt + CeO2 и LSM + PrO2. В качестве токовыводов с электродов использовали платиновую проволоку. Ячейку помещали в кварцевый реактор, через который пропускали метан-воздушную смесь ([CH4]/[O2] = 0.4–2.0) со скоростью 120–360 см3/мин. Реактор нагревали при помощи электрической печи. Эксперименты проводили в проточной кинетической установке при атмосферном давлении в интервале температур 500–750°С. Состав газа на входе в реактор и на выходе из него анализировали на газовом хроматографе Цвет-500 (Россия). Измерение электрических характеристик осуществляли при помощи потенциостата-гальваностата ПИ-50-1 (Россия). За выходом системы на стационарное состояние следили по установлению постоянных концентраций газов на выходе из реактора и по достижению постоянных значений тока и напряжения ячейки.
Для исследования каталитической активности LSM и LSM + PrO2 в реакции окисления метана на трубку из YSZ наносили только катод площадью 4 см2. Как и в случае с ТОТЭ с НЭП, трубку помещали в кварцевый реактор, через который продували метан-воздушную смесь ([CH4]/[O2] = = 1.32) со скоростью 120 см3/мин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Каталитическая активность LSM и LSM + PrO2 в окислении метана
При изучении каталитической активности LSM в окислении метана было обнаружено, что с ростом температуры конверсия реагентов увеличивалась (рис. 2).
Рис. 2.
Зависимости конверсии О2 (круги) и СН4 (квадраты) от температуры при окислении метана на LSM (закрытые символы) и LSM + PrO2 (открытые символы). Скорость потока – 120 см3/мин; [CH4]/[O2] = 1.32.
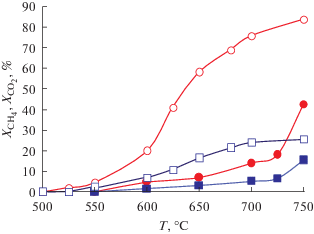
Видно, что на LSM заметная конверсия метана и кислорода наблюдались при температурах выше 650°С. При 750°С значение ${{Х}_{{{\text{C}}{{{\text{H}}}_{{\text{4}}}}}}}$ составляло 18%, а ${{Х}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ – 42.5%. Основными продуктами реакции являлись диоксид углерода и вода. Селективность по СО2 достигала 92.6%. Модификация LSM оксидом празеодима приводила к росту каталитической активности в окислении метана. Заметная конверсия метана и кислорода фиксировались уже при температурах выше 600°С. При 750°С конверсия метана возрастала до 25.8%, а кислорода – до 84.2%. Селективность образования СО2 превышала 99%.
Учитывая, что на LSM и LSM + PrO2 протекает только каталитическая реакция глубокого окисления метана и существует широкий диапазон температур, где конверсия кислорода невысока, можно полагать, что эти материалы могут быть использованы в качестве катодов ТОТЭ с НЭП.
Электрохимические характеристики ТОТЭ с НЭП
Были исследованы электрохимические характеристики ТОТЭ с НЭП в зависимости от температуры, состава и скорости потока метан-воздушной смеси. При исследовании были использованы три ТОТЭ с немодифицированными и модифицированными электродами: Pt|YSZ|LSM, Pt|YSZ|LSM + PrO2 и ГPt + CeO2|YSZ|LSM + PrO2. Сразу же отметим, что конверсия метана во всех экспериментах не превышала 20%.
Было обнаружено, что для топливного элемента с немодифицированными электродами (Pt|YSZ|LSM) при температурах выше 600°С ЭДС (U0) достигала величин порядка 0.6 В. Это связано с тем, что в области анода появляется водород за счет протекания на нем каталитической реакции окисления СН4 в синтез-газ, и при замыкании электрической цепи этот ТОТЭ генерирует электроэнергию. В качестве примера на рис. 3 приведены зависимости напряжения (U) и удельной электрической мощности (P) от плотности тока (J).
Рис. 3.
Зависимости напряжения и удельной мощности от плотности тока для ТОТЭ С НЭП с немодифицированными электродами (Pt|YSZ|LSM). Условия эксперимента: температура – 750°С, скорость потока – 120 см3/мин, [CH4]/[O2] = 1.4.

Видно, что при 750°С для смеси [CH4]/[O2] = 1.4 максимальная удельная мощность (Pmax) и плотность тока короткого замыкания были равны 1 мВт/см2 и 10 мА/см2 соответственно.
Проведение активации катода спиртовым раствором Pr(NO3)3 с последующим прокаливанием привело к увеличению электрохимической активности катода и улучшению электрохимических характеристик ячейки (рис. 4): максимальная удельная мощность ТОТЭ уже при 650°С составляла 6.3 мВт/см2.
Рис. 4.
Зависимости напряжения и удельной мощности от плотности тока для ТОТЭ С НЭП с модифицированным катодом (Pt|YSZ|LSM + PrO2) при температурах 600 (открытые символы) и 650°С (закрытые символы). Условия эксперимента: скорость потока – 120 см3/мин, [CH4]/[O2] = 0.7.

Для оптимизации условий функционирования такого ТОТЭ были исследованы зависимости электрохимических характеристик от температуры, скорости потока и состава газовой смеси.
На рис. 5 показаны зависимости ЭДС и выходных концентраций Н2 и О2 от соотношения [CH4]/[O2] на входе в ТОТЭ с НЭП с модифицированным катодом. Видно, что с ростом отношения [CH4]/[O2] концентрация водорода увеличивается, а концентрация кислорода уменьшается. Наибольшее значение ЭДС наблюдается при [CH4]/[O2] ~ 0.6–0.7, когда в выходящем из ТОТЭ газе одновременно присутствуют Н2 и О2.
Рис. 5.
Зависимости ЭДС и выходных концентраций Н2 и О2 от отношения [CH4]/[O2] на входе в ТОТЭ с НЭП с модифицированным катодом (Pt|YSZ|LSM + + PrO2). Условия эксперимента: T = 750°C, скорость потока – 120 см3/мин.

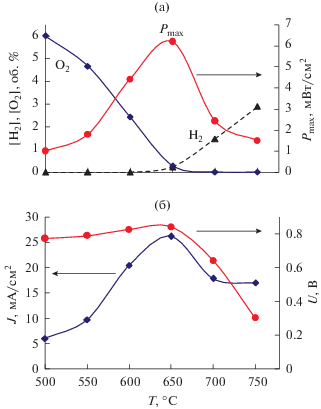
Следующую серию экспериментов проводили с ТОТЭ с НЭП, в котором была проведена модификация как катода (LSM + PrO2), так и анода (Pt + CeO2). Модификация анода мало отразилась на конверсии метана и кислорода по сравнению с ячейкой, в которой был модифицирован только катод, но существенно повлияла на электрохимические характеристики ячейки. Модификация обоих электродов приводила к улучшению их электрохимических характеристик и, соответственно, к увеличению удельной электри-ческой мощности ТОТЭ с НЭП. Из рис. 6а. видно, что зависимость Pmax от температуры представляет собой кривую с максимумом при 650°С, где в газовой фазе одновременно присутствуют как водород, так и кислород. При этой температуре также наблюдаются наибольшие значения напряжения разомкнутой цепи и тока короткого замыкания (рис. 6б).
Рис. 6.
Зависимости максимальной удельной мощности, концентраций водорода и кислорода (а), напряжения разомкнутой цепи и плотности тока короткого замыкания (б) от температуры ТОТЭ с НЭП с модифицированными электродами (Pt + CeO2|YSZ|LSM + + PrO2). Условия эксперимента: скорость потока – 120 см3/мин, [CH4]/[O2] = 1.8.
Последующие эксперименты, в которых варьировали скорость потока и состав смеси метан–воздух, показали, что наилучшие электрохимические характеристики (мощность и ток короткого замыкания) для ТОТЭ с НЭП с модифицированными электродами также достигались, когда в выходящем газе одновременно присутствовали водород и кислород. Некоторые из полученных данных приведены в табл. 1.
Таблица 1.
ЭДС (U0), ток короткого замыкания (I), максимальная электрическая мощность (Pmax), выходные концентрация водорода ([H2]) и кислорода ([O2]) при двух значениях скорости потока смеси метан–воздух (v) для ТОТЭ с НЭП с модифицированными электродами (Pt + CeO2│YSZ│LSM + PrO2– x)*
| v, cм3/мин | U0, В |
I, мА |
Pmax, мВт |
[H2], об. % |
O2, об. % |
|---|---|---|---|---|---|
| 194 | 0.826 | 185 | 46.6 | 0.017 | 0.33 |
| 360 | 0.851 | 497 | 132 | 0.15 | 1.69 |
Из таблицы видно, что увеличение скорости потока смеси метан–воздух от 194 до 360 см3/мин приводит к росту ЭДС, Pmax и выходных концентраций Н2 и О2. Наилучшие электрические характеристики ТОТЭ с НЭП с модифицированными электродами представлены на рис. 7.
Рис. 7.
Зависимости напряжения и удельной мощности от плотности тока для ТОТЭ с НЭП с модифицированными электродами (Pt + CeO2|YSZ|LSM + + PrO2). Условия эксперимента: Т = 700°С, скорость потока – 330 см3/мин, [CH4]/[O2] = 1.04.

Максимальные удельная мощность и плотность тока короткого замыкания при 700°С составили 36 мВт/см2 и 130 мА/см2 соответственно.
ЗАКЛЮЧЕНИЕ
Проведенное исследование свидетельствует о возможности создания твердооксидных топливных элементов с неразделенными электродными пространствами, питаемых смесью метана и воздуха, способных генерировать электроэнергию. Остающийся после работы ТОТЭ с НЭП метан может быть использован для генерации тепла либо переработан в синтез-газ, который может выступать в качестве сырья при производстве, например, аммиака, метанола, или углеводородов по Фишеру–Тропшу.
Работы в этом направлении представляются перспективными, т. к. конструкция ТОТЭ с НЭП намного проще, чем конструкция традиционных ТОТЭ, и поэтому ТОТЭ с НЭП могут быть значительно дешевле. Кроме того, дальнейшие исследования должны быть направлены на поиск более электрохимически активных анодов из неблагородных металлов, например Ni.
Список литературы
Буянов Р.А. // Кинетика и катализ. 1960. Т. 1. Вып. 2. С. 306.
Буянов Р.А. // Кинетика и катализ. 1960. Т. 1. Вып. 3. С. 418.
Буянов Р.А. // Кинетика и катализ. 1960. Т. 1. Вып. 4. С. 617.
Буянов Р.А., Зельдович А.Г., Пилипенко Ю.К. // Приборы и техника эксперимента. 1961. № 2. С. 188.
Буянов Р.А., Зельдович А.Г., Пилипенко Ю.К. // Хим. пром-сть. 1961. № 2. С. 31.
Buyanov R.A., Zel’dovich A.G., Pilipenko Yu.K. // Cryogenics. 1962. V. 2(3). P. 143.
Головин А.В., Буянов Р.А. // Кинетика и катализ. 1968. Т. 9. С. 464.
Головин А.В., Буянов Р.А. // Кинетика и катализ. 1969. Т. 10. С.113.
Головин А.В., Буянов Р.А. // Кинетика и катализ. 1970. Т. 11. С. 957.
Буянов Р.А., Криворучко О.П., Малахов В.В., Матвиенко Л.Г., Буянова Н.Е., Чернявская О.Н. // Кинетика и катализ. 1969. Т. 10. Вып. 4. С. 894.
Криворучко О.П., Буянов Р.А. // Кинетика и катализ. 1972. Т. 13. Вып. 4. С. 1050.
Буянов Р.А., Пармон В.Н. // Катализ в промышленности. 2017. Т. 17. № 5. С. 390.
Жужгов А.В., Криворучко О.П., Исупова Л.А., Мартьянов О.Н., Пармон В.Н. // Катализ в промышленности. 2017. Т. 17. № 5. С. 6.
Жужгов А.В., Криворучко О.П., Исупова Л.А. // Журн. физ. химии. 2020. Т. 94. № 1. С. 50.
Ильичев А.Н., Быховский М.Я., Фаттахова З.Т., Шашкин Д.П., Корчак В.Н. // Кинетика и катализ. 2021. Т. 62. № 1. С. 44.
Горлова А.М., Симонов П.А., Стонкус О.А., Пахарукова В.П., Снытников П.В., Потемкин Д.И. // Кинетика и катализ. 2021. Т. 62. № 6. Принята в печать.
Марковская Д.В., Люлюкин М.Н. Журенок А.В., Козлова Е.А. // Кинетика и катализ. 2021. Т. 62. № 4. С. 437.
Куренкова А.Ю., Козлова Е.А., Каичев В.В. // Кинетика и катализ. 2020. Т. 61. № 6. С. 812.
Собянин В.А. // Рос. Хим. Журн. 2003. Т. 47. № 6. С. 62
Dyer C.K. // Nature. 1990. V. 343. P. 547.
Moseley P., Willians D. // Nature. 1990. V. 346. P. 23.
Gottesfeld S. // Nature. 1990. V. 345. P. 673.
Riess I., Van der Put P.S., Schonman J. // Solid State Ionics. 1995. V. 82. P. 1.
Asano K., Hibino T., Iwahara H. // Denki Kagaky. 1996. V. 64. P. 649.
Demin A.K., Gulbis F.Ya. // Solid State Ionics. 2000. V. 135. P. 451.
Skinner S.J. // Int. J. Inorg. Mater. 2001. V. 3. P. 113.
Yano M., Tomita A., Sano M., Hibino T. // Solid State Ionics. 2007. V. 177. P. 3351.
Kuhn M., Napporn T.W. // Energies. 2010. V. 3. P. 57.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ



