Кинетика и катализ, 2022, T. 63, № 1, стр. 99-109
Нелинейные явления в реакции окисления СО на никеле
М. М. Слинько a, *, А. Г. Макеев b, В. Ю. Бычков a, В. Н. Корчак a
a ФГБУН Институт химической физики РАН им. Н.Н. Семенова
119991 Москва, ул. Косыгина, 4, Россия
b ФГБОУ ВО МГУ им. М.В. Ломоносова, Факультет вычислительной математики и кибернетики
119992 Москва, Ленинские Горы, Россия
* E-mail: slinko@polymer.chph.ras.ru
Поступила в редакцию 25.06.2021
После доработки 16.07.2021
Принята к публикации 16.07.2021
- EDN: TSMIOL
- DOI: 10.31857/S0453881122010099
Аннотация
Статья посвящена экспериментальному и теоретическому исследованию автоколебательных режимов и волновых явлений в реакции окисления СО на никелевой фольге. Впервые изучен новый тип пространственных структур, которые наблюдаются при атмосферном давлении в изотермических условиях и механизм возникновения которых обусловлен процессами окисления–восстановления катализатора. В работе построена 3D распределенная математическая модель, которая описывает изменение цвета и распространение кинетических волн окисления–восстановления никеля в проточном реакторе. Показано, что основной причиной возникновения и распространения волновых явлений в реакции окисления СО на никеле является наличие градиента концентрации кислорода в объеме проточного реактора за счет влияния процесса массопереноса на скорость реакции.
1. ВВЕДЕНИЕ
Несмотря на то, что реакция окисления СО на металлах интенсивно изучалась в течение многих десятилетий, автоколебания скорости реакции окисления СО на никеле были обнаружены совсем недавно [1]. Причина заключалась в том, что в отличие от колебательных режимов скорости реакции окисления СО на металлах платиновой группы автоколебания скорости реакции окисления СО на никелевой фольге наблюдаются не в избытке кислорода, а при использовании смесей с избытком СО, которые ранее активно не исследовали. Другой особенностью данной системы является то, что автоколебания скорости реакции сопровождаются волновыми процессами на поверхности катализатора [2].
Впервые волновые явления были зафиксированы в 1975 г. в реакции окисления аммиака на Pt-проволоке [3]. Тепловые (неизотермические) волны возникали за счет распространения по ней диффузионного или кинетического режима протекания реакции при локальном возбуждении системы. При этом усредненная температура Pt-проволоки оставалась неизменной за счет поддержания постоянного тока с помощью электротермографа [4]. Сейчас известны как тепловые, так и кинетические волновые явления. Кинетические волны наблюдались до настоящего времени только на гранях монокристаллов металлов в условиях высокого вакуума [5]. Наибольшее разнообразие пространственно-временных структур, возникающих за счет особенностей механизма реакции, а именно: однородные колебания, реакционные фронты, бегущие и стоячие волны, спиральные волны, “химическая турбулентность”, было зафиксировано в высоком вакууме с помощью метода фотоэмиссионной электронной микроскопии (PEEM) при протекании реакции окисления СО на грани монокристалла Pt(110) [6].
При атмосферном давлении были обнаружены, в основном, тепловые волны, которые регистрировали методом инфракрасной термографии [7]. В реакциях окисления CO, H2, NH3 на нанесенных и массивных металлических катализаторах были зафиксированы неизотермические бегущие волны, “горячие пятна” и “дышащие” структуры [7]. В последнее время для изучения пространственных структур при атмосферном давлении был успешно применен метод визуального наблюдения за состоянием поверхности металлических катализаторов в ходе колебательных реакций [8]. Этот метод оказался наиболее информативен в случае пространственных структур во время колебаний скорости реакций окисления на никелевых и кобальтовых катализаторах, для которых существует значительное различие в цветах восстановленной (светлый цвет) и окисленной (темный цвет) поверхностей металла [1, 9]. Визуальное наблюдение за цветом поверхности катализатора позволило обнаружить бегущие волны в реакции окисления метана [8], этана [9] и пропана [10]. Спиральные волны и режим “поверхностной турбулентности” были зафиксированы в ходе реакции окисления СО [11] и С2Н6 [12] на кобальтовом катализаторе. Использование методов термогравиметрии (ТГА) совместно с online масс-спектрометрическим анализом газовой фазы [8], рентгеновской дифракции и рентгенофазового анализа (РФА) для изучения колебаний скорости реакции окисления метана [13], а также рентгеновской фотоэлектронной спектроскопии (РФЭС) в режиме in situ для анализа свойств колебаний скорости реакции окисления пропана [14] на никелевых катализаторах показало, что механизм колебаний обусловлен периодическими процессами окисления–восстановления катализатора. Применение импульсного метода к изучению автоколебаний скорости реакции окисления метана на Ni позволило исключить тепловую природу данного явления [15].
Автоколебания скорости реакции окисления СО кроме Ni наблюдались также на Co [11] и Cu [16]. Если сравнивать три металла, то период колебаний скорости реакции окисления СО на никеле был самым большим, поэтому эта система наиболее удобна для исследования волновых явлений на поверхности катализатора. Настоящая работа посвящена детальному изучению распространения фронтов окисления и восстановления в ходе колебаний скорости реакции окисления СО на никелевой фольге и математическому моделированию данного явления.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реакцию окисления СО изучали в проточном кварцевом реакторе со внутренним диаметром 6 мм. Состав газа на выходе из реактора непрерывно измеряли с помощью квадрупольного масс-спектрометра OmniStar GSD 301 (“Pfeiffer Vacuum”, Германия). Реактор был помещен в печь специальной конструкции, которая позволяла визуально следить за цветом поверхности в ходе протекания реакции и фиксировать изменение цвета катализатора и образование поверхностных пространственных структур с помощью видеокамеры Canon EOS 70D. В качестве катализатора использовали никелевую фольгу (5.5 × 3 × 0.5 мм) со встроенной термопарой хромель–алюмель. Особенности приготовления катализатора и детали эксперимента изложены в работе [1].
Колебания скорости реакции окисления СО были обнаружены в интервале температур газовой смеси 500–590°С, содержащей 40% CO и 10% O2 в He. Диапазон концентраций реагентов, при которых фиксировали колебания, был небольшим. При составе смеси 45% CO и 5% O2 в He уже отмечалось устойчивое стационарное состояние. Смеси с высокими концентрациями кислорода не использовали из-за близости к пределу воспламенения смеси кислорода в СО.
Визуальное наблюдение за цветом поверхности никелевой фольги показало, что во время колебательного режима происходит периодическая смена цвета поверхности. Цвет восстановленной металлической поверхности светлый с желтоватым оттенком. Процесс зарождения волны окисления начинается в большинстве случаев в правом верхнем углу никелевой фольги. Во время распространения волны окисления цвет никелевой пленки меняется. Он зависит от интерференции между светом, отраженным от низа и верха оксидной пленки [17]. Связь цвета поверхности никелевой фольги с толщиной окисной пленки никеля обсуждалась в работе [1].
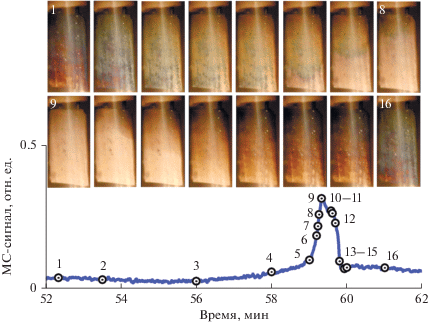
При температуре газа 520°С на предварительно окисленном катализаторе наблюдаемые колебания скорости реакции были практически регулярными, период колебаний составлял 8 мин (рис. 1а). При данной температуре газовой смеси система длительное время находится в низкоактивном состоянии и периодически переходит в высокоактивное состояние, но затем быстро возвращается обратно. Рисунок 2 демонстрирует cнимки поверхности в разные моменты колебательного режима, представленного на рис. 1а. Фотографии, сделанные в моменты времени 1–3, показывают процесс окисления катализатора, который заключается в увеличении толщины оксидной пленки, что видно по смене цветов побежалости. Скорость реакции при этом остается все время близкой к минимальной. В момент времени 4 в нижнем правом углу начинается процесс зарождения волны восстановления, которая распространяется по поверхности никеля и охватывает всю площадь пластины в точке 9, соответствующей максимуму скорости реакции на полностью восстановленном катализаторе. Точки 10–13 характеризуют волну окисления соломенного цвета, которая возникает в правом верхнем углу и довольно быстро захватывает всю никелевую пластину, при этом скорость образования СО2 резко падает, что указывает на сильное снижение скорости реакции за счет формирования поверхностного оксида никеля. Далее протекает длительный процесс глубинного окисления катализатора (точки 14–16), и цикл колебаний завершается. Видеофильм с записью движения волн при температуре 520°С представлен в дополнительном материале, файл ESM-1.mp4.
Рис. 1.
Зависимость свойств колебаний скорости реакции окисления СО на никеле от температуры газа в реакторе при скорости подачи реакционной смеси 20 мл/мин и температуре газа 520 (а), 540 (б), 550 (в) и 570°С (г).
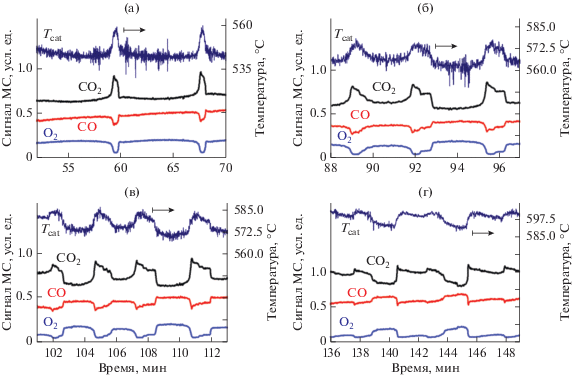
Рис. 2.
Различные состояния поверхности в разные моменты колебательного режима при температуре газовой смеси 520°С и скорости ее подачи 20 мл/мин. Вверху – фотографии поверхности никелевой пластины в разные моменты колебательного цикла. Внизу – изменения скорости реакции в ходе колебательного цикла. Цифрами показаны моменты времени, которые соответствуют приведенным выше фотографиям поверхности катализатора.
С повышением температуры газовой смеси до 550°С период колебаний уменьшается, и форма колебаний становится более сложной (рис. 1б и 1в). Изменение формы колебаний связано с замедлением движения фронта волны окисления и его возможной остановкой в ряде моментов времени, что сказывается и на регулярности колебаний.
В табл. 1 показано, как температура газовой смеси влияет на период колебаний. Из таблицы следует, что период колебаний сначала уменьшается, а затем начинает увеличиваться. Такая сложная и довольно необычная зависимость периода колебаний от температуры газа обусловлена изменением характера волновых процессов, которые происходят в ходе колебаний скорости реакции. Начиная с температуры газа 560°С волна окисления не всегда может распространяться на всю площадь фольги. Она останавливается, покрывая только часть пластины, а затем возвращается назад. Из рис. 3 видно, как меняется состояние поверхности катализатора в ходе колебаний скорости реакции при температуре газа 570°С. В некоторые моменты времени фронт движения волны окисления прекращает свое распространение (точки 1, 2 и 15, 16), приводя к возникновению ступеньки на кривой изменения скорости реакции образования СО2 и к более длительному нахождению каталитической системы в состоянии высокой активности, что вызывает увеличение периода колебаний. Из рис. 3 также следует, что с ростом температуры газовой смеси цвет границы фронта окисления становится все более темным, и скорость его распространения по поверхности катализатора уменьшается. Это показывает, что при повышении температуры газа в реакторе окисление начинает затрагивать более глубинные слои никеля, в результате чего скорость распространения фронта волны окисления замедляется. Видеофильм с соответствующими экспериментальными данными приведен в дополнительном материале, файл ESM-2.mp4.
Таблица 1.
Зависимость периода колебаний от температуры газовой смеси
| Температура, °С | Период колебаний, мин |
|---|---|
| 520 | 8.2 |
| 530 | 5.1 |
| 540 | 3.5 |
| 550 | 2.6 |
| 560 | 3.2 |
| 570 | 4.9 |
Рис. 3.
Различные состояния поверхности в разные моменты колебательного режима при температуре газовой смеси 570°С и скорости ее подачи 20 мл/мин. Вверху – фотографии поверхности никелевой пластины в разные моменты колебательного цикла. Внизу – изменения скорости реакции в ходе колебательного цикла. Цифрами показаны моменты времени, которые соответствуют приведенным выше фотографиям поверхности катализатора.
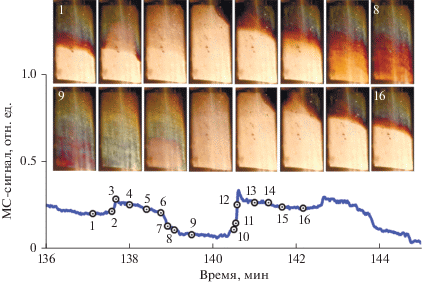
Надо отметить, что состав реакционной смеси содержит избыток СО. Одной из причин остановки фронта волны окисления при повышении температуры газа может быть нехватка кислорода в реакторе из-за увеличения скорости реакции. Об этом свидетельствует следующий факт: возрастание скорости подачи реакционной смеси с 20 до 30 мл/мин при 570°С приводит к тому, что остановка фронта волны окисления прекращается, волна окисления охватывает всю площадь никелевой фольги, и период колебаний соответственно уменьшается.
Если скорость распространения волны окисления снижается с повышением температуры газа, то скорость распространения волны восстановления, напротив, увеличивается. При 590°С никелевая фольга восстанавливается практически мгновенно, причем волна восстановления начинается не только в нижней части фольги, но и в ее верхней части.
Форма колебаний и характер волновых явлений существенно зависят от начального состояния катализатора. На предварительно восстановленном катализаторе колебания возникают при более низкой температуре газа в реакторе (500°С) и имеют совсем другую форму, как видно из рис. 4. В отличие от предварительно окисленного катализатора (рис. 1а), вышеуказанная система более длительное время находится в состоянии с высокой активностью, где поверхность никеля полностью восстановлена. Скорость движения фронта волны восстановления при 500°С минимальна и составляет всего 0.05–0.1 см/с, тогда как при температуре газа 590°С процесс восстановления всей пластины происходит практически мгновенно.
3. МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ВОЛНОВЫХ ПРОЦЕССОВ НА ПОВЕРХНОСТИ КАТАЛИЗАТОРА
Для понимания причин и механизма возникновения волновых явлений в ходе реакции окисления СО на никеле необходимо проведение математического моделирования. Для решения этой задачи требуется создание распределенных математических моделей типа реакция–диффузия, учитывающих градиенты концентраций реагентов реакции на поверхности, в объеме катализатора, а также в газовой фазе. Такие модели представляют собой систему уравнений в частных производных, которые используют точечную кинетическую модель, описывающую свойства локального осциллятора.
3.1. Точечная модель колебаний скорости реакции окисления СО на никеле
В качестве точечной модели колебаний скорости реакции окисления СО в настоящей работе будет применяться математическая модель, разработанная ранее [2]. В ее основе лежит механизм Ленгмюра–Хиншельвуда для реакции окисления СО:
(I)
${{{\text{O}}}_{2}} + 2{\text{N}}{{{\text{i}}}_{{\text{s}}}} \to 2{\text{N}}{{{\text{i}}}_{{\text{s}}}}{\kern 1pt} --{\kern 1pt} {\text{O}},$(II)
$~{\text{CO}} + {\text{N}}{{{\text{i}}}_{{\text{s}}}} \to {\text{N}}{{{\text{i}}}_{{\text{s}}}}{\kern 1pt} --{\kern 1pt} {\text{CO}},$(III)
${\text{N}}{{{\text{i}}}_{{\text{s}}}}{\text{--CO}} \to {\text{N}}{{{\text{i}}}_{{\text{s}}}} + {\text{C}}{{{\text{O}}}_{{{\text{gas}}}}},~~$(IV)
${\text{N}}{{{\text{i}}}_{{\text{s}}}}{\kern 1pt} --{\kern 1pt} {\text{O}} + {\text{N}}{{{\text{i}}}_{{\text{s}}}}{\kern 1pt} --{\kern 1pt} {\text{CO}} \to {\text{C}}{{{\text{O}}}_{{{\text{2gas}}}}} + 2{\text{N}}{{{\text{i}}}_{{\text{s}}}},$(V)
${\text{N}}{{{\text{i}}}_{{\text{s}}}}{\kern 1pt} --{\kern 1pt} {\text{O}} \to {\text{N}}{{{\text{i}}}_{{\text{s}}}}{\text{O}},$(VI)
${\text{\;N}}{{{\text{i}}}_{{\text{s}}}}{\text{O}} \to {\text{ N}}{{{\text{i}}}_{{\text{s}}}}{\kern 1pt} --{\kern 1pt} {\text{O}}{\text{.}}~$Для описания изменения цвета никеля в ходе колебаний были добавлены стадии диффузии кислорода в объем катализатора и обратно:
(VII)
${\text{N}}{{{\text{i}}}_{{\text{s}}}}{\kern 1pt} --{\kern 1pt} {\text{O}} \to {\text{N}}{{{\text{i}}}_{{\text{v}}}}{\text{O}},$(VIII)
${\text{N}}{{{\text{i}}}_{{\text{v}}}}{\text{O}} \to {\text{N}}{{{\text{i}}}_{{\text{s}}}}{\kern 1pt} --{\kern 1pt} {\text{O}},$Локальное колебательное поведение системы может быть описано в рамках следующей точечной модели, соответствующей механизму (I)–(VIII):
(1)
$\begin{gathered} {{{\text{d}}{{{{\theta }}}_{{\text{O}}}}} \mathord{\left/ {\vphantom {{{\text{d}}{{{{\theta }}}_{{\text{O}}}}} {{\text{d}}t}}} \right. \kern-0em} {{\text{d}}t}} = 2{{k}_{1}}{{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}{{\theta }}_{{\text{*}}}^{{\text{2}}} - {{k}_{4}}{{{{\theta }}}_{{\text{O}}}}{{{{\theta }}}_{{{\text{CO}}}}} - {{k}_{5}}{{{{\theta }}}_{{\text{O}}}} + {{k}_{6}}{{{{\theta }}}_{{{\text{ox}}}}} - \\ - \,\,{{R}_{{{\text{O,v}}}}} = {{f}_{1}},\,\,\,\,{{{\text{d}}{{{{\theta }}}_{{{\text{CO}}}}}} \mathord{\left/ {\vphantom {{{\text{d}}{{{{\theta }}}_{{{\text{CO}}}}}} {{\text{d}}t}}} \right. \kern-0em} {{\text{d}}t}} = R_{{{\text{CO}}}}^{{{\text{ads}}}} - {{k}_{3}}{{{{\theta }}}_{{{\text{CO}}}}} - \\ - \,\,{{k}_{4}}{{{{\theta }}}_{{\text{O}}}}{{{{\theta }}}_{{{\text{CO}}}}} = {{f}_{2}},\,\,\,\,{{{\text{d}}{{{{\theta }}}_{{{\text{ox}}}}}} \mathord{\left/ {\vphantom {{{\text{d}}{{{{\theta }}}_{{{\text{ox}}}}}} {{\text{d}}t}}} \right. \kern-0em} {{\text{d}}t}} = {{k}_{5}}{{{{\theta }}}_{{\text{O}}}} - {{k}_{6}}{{{{\theta }}}_{{{\text{ox}}}}} = {{f}_{3}}, \\ {{{\text{d}}{{{{\theta }}}_{{{\text{O,v}}}}}} \mathord{\left/ {\vphantom {{{\text{d}}{{{{\theta }}}_{{{\text{O,v}}}}}} {{\text{d}}t}}} \right. \kern-0em} {{\text{d}}t}} = {{{{R}_{{{\text{O,v}}}}}} \mathord{\left/ {\vphantom {{{{R}_{{{\text{O,v}}}}}} {{{n}_{{\text{L}}}}}}} \right. \kern-0em} {{{n}_{{\text{L}}}}}} = {{f}_{4}}. \\ \end{gathered} $Переменными модели являются концентрации адсорбированного кислорода (${{{{\theta }}}_{{\text{O}}}}$), адсорбированного моноксида углерода (${{{{\theta }}}_{{{\text{CO}}}}}$), поверхностного оксида (${{{{\theta }}}_{{{\text{ox}}}}}$) и подповерхностного кислорода (${{{{\theta }}}_{{{\text{O,v}}}}}$); ${{{{\theta }}}_{{\text{*}}}} = 1 - {{{{\theta }}}_{{\text{O}}}} - {{{{\theta }}}_{{{\text{CO}}}}} - {{{{\theta }}}_{{{\text{ox}}}}}$ – концентрация пустых адсорбционных центров; ${{n}_{{\text{L}}}}$ – число монослоев в объеме Ni, в которые может проникать атомарный кислород. Скорость адсорбции CO вычисляли по формуле:
Значения констант скоростей реакций ${{k}_{j}}$ ($j = 1,\,\,...,\,\,8$) вычисляли из уравнения Аррениуса: ${{k}_{j}} = k_{j}^{0}\exp \left( {{{ - {{E}_{j}}} \mathord{\left/ {\vphantom {{ - {{E}_{j}}} {R{{T}_{{\text{c}}}}}}} \right. \kern-0em} {R{{T}_{{\text{c}}}}}}} \right),$ где $k_{j}^{0}$ – предэкспонента, c–1; ${{E}_{j}}$ – энергия активации, Дж/К; ${{T}_{{\text{c}}}}$ – температура катализатора, K; $R$ – универсальная газовая постоянная. Предэкспоненты для процессов адсорбции $k_{i}^{0}$ ($i = 1,2$) определяли из кинетической теории газов по формуле:
(2)
$k_{i}^{0} = {{s}_{i}}{{\left( {2\pi {{m}_{i}}{{k}_{{\text{B}}}}{{T}_{{\text{g}}}}} \right)}^{{ - 0.5}}}{{\left( {{{N}_{{\text{S}}}}} \right)}^{{ - 1}}},$Изменение температуры катализатора в процессе автоколебаний, которое наблюдается в экспериментах, можно описать с помощью следующего простого уравнения:
(3)
${{{\text{d}}{{T}_{{\text{c}}}}} \mathord{\left/ {\vphantom {{{\text{d}}{{T}_{{\text{c}}}}} {{\text{d}}t}}} \right. \kern-0em} {{\text{d}}t}} = {{a}_{1}}({{T}_{{\text{g}}}} - {{T}_{{\text{c}}}}) + {{a}_{2}}{{R}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}},$Модель реактора идеального смешения (CSTR) получается, если к уравнениям (1) и (3) добавить следующие уравнения для парциальных давлений:
(4)
$\begin{gathered} {{{\text{d}}{{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{\text{d}}{{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}} {{\text{d}}t}}} \right. \kern-0em} {{\text{d}}t}} = \left( {P_{{{{{\text{O}}}_{{\text{2}}}}}}^{{{\text{in}}}} - {{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}} \right)F{{V}^{{ - 1}}} - \sigma {{k}_{1}}{{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}{{\theta }}_{{\text{*}}}^{{\text{2}}}, \\ {{{\text{d}}{{P}_{{{\text{CO}}}}}} \mathord{\left/ {\vphantom {{{\text{d}}{{P}_{{{\text{CO}}}}}} {{\text{d}}t}}} \right. \kern-0em} {{\text{d}}t}} = \left( {P_{{{\text{CO}}}}^{{{\text{in}}}} - {{P}_{{{\text{CO}}}}}} \right)F{{V}^{{ - 1}}} - \sigma \left( {R_{{{\text{CO}}}}^{{{\text{ads}}}} - {{k}_{3}}{{{{\theta }}}_{{{\text{CO}}}}}} \right), \\ {{{\text{d}}{{P}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{\text{d}}{{P}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}} {{\text{d}}t}}} \right. \kern-0em} {{\text{d}}t}} = - {{P}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}F{{V}^{{ - 1}}} + \sigma {{R}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}, \\ \end{gathered} $3.2. Распределенная математическая модель для описания волновых явлений в реакции окисления СО на никеле
Пространственно-распределенная модель предполагает, что проточный реактор представляет собой прямоугольный параллелепипед размеров ${{L}_{x}} \times {{L}_{y}} \times {{L}_{z}}.$ Плоский прямоугольный катализатор размеров $L_{x}^{{{\text{cat}}}} \times L_{y}^{{{\text{cat}}}}$ расположен в центре реакционной камеры (см. рис. 5). В экспериментальной установке реакция протекает с обеих сторон тонкой пластины катализатора. Свойство симметрии по осям $y$ и $z$ относительно центральной оси реактора при расчетах позволяет рассматривать только четверть реактора. При этом предполагается, что толщина пластины катализатора ничтожно мала. Двумерная поверхность катализатора обозначена как ${{\Omega }_{{{\text{cat}}}}};$ эта область расположена в центре нижней стенки камеры реактора, что соответствует $z = 0.$ Газовая смесь поступает через левую сторону реактора при $x = 0$ и покидает его через противоположную правую сторону при $x = {{L}_{x}}.$ Изменение локальных концентраций компонент газовой смеси можно описать следующими уравнениями в частных производных (УЧП) типа реакция–диффузия–конвекция для трехмерной области:
(5)
$\frac{{\partial {{C}_{i}}}}{{\partial t}} = - u\nabla {{C}_{i}} + \nabla \cdot \left[ {{{D}_{i}}\nabla {{C}_{i}}} \right] + W_{i}^{{{\text{reac}}}},$(6)
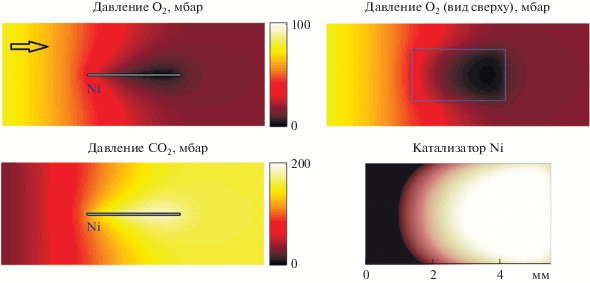
$\begin{gathered} \frac{{\partial {{{{\theta }}}_{{\text{O}}}}}}{{\partial t}} = {{f}_{1}}(x,y,{{{{\theta }}}_{{\text{O}}}}{\text{,}}{{{{\theta }}}_{{{\text{CO}}}}}{\text{,}}{{{{\theta }}}_{{{\text{ox}}}}},{{{{\theta }}}_{{{\text{O,v}}}}}), \\ \frac{{\partial {{{{\theta }}}_{{{\text{CO}}}}}}}{{\partial t}} = {{f}_{2}}(x,y,{{{{\theta }}}_{{\text{O}}}}{\text{,}}{{{{\theta }}}_{{{\text{CO}}}}}{\text{,}}{{{{\theta }}}_{{{\text{ox}}}}},{{{{\theta }}}_{{{\text{O,v}}}}}), \\ \frac{{\partial {{{{\theta }}}_{{{\text{ox}}}}}}}{{\partial t}} = {{f}_{3}}(x,y,{{{{\theta }}}_{{\text{O}}}}{\text{,}}{{{{\theta }}}_{{{\text{CO}}}}}{\text{,}}{{{{\theta }}}_{{{\text{ox}}}}}{\text{,}}{{{{\theta }}}_{{{\text{O,v}}}}}), \\ \frac{{\partial {{{{\theta }}}_{{{\text{O,v}}}}}}}{{\partial t}} = {{f}_{4}}(x,y,{{{{\theta }}}_{{\text{O}}}}{\text{,}}{{{{\theta }}}_{{{\text{CO}}}}}{\text{,}}{{{{\theta }}}_{{{\text{ox}}}}},{{{{\theta }}}_{{{\text{O,v}}}}}). \\ \end{gathered} $Рис. 5.
Неоднородное пространственное распределение парциальных давлений O2 и CO2 в реакторе при диффузионном режиме протекания реакции в момент времени $t = 125$ с при ${{T}_{{\text{g}}}} = 843$ K. Вверху показано распределение кислорода в газовой фазе, слева – вертикальный разрез, вид сбоку; справа – горизонтальный разрез вблизи поверхности катализатора, вид сверху. Внизу слева представлено распределение продукта реакции СО2 в газовой фазе (вертикальный разрез). Внизу справа приведен “снимок” поверхности никеля (вид сверху). Волна окисления (темный цвет) движется слева направо.
Здесь значения переменных ${{{{\theta }}}_{{\text{O}}}},$ ${{{{\theta }}}_{{{\text{CO}}}}},$ ${{{{\theta }}}_{{{\text{ox}}}}}$ и ${{{{\theta }}}_{{{\text{O,v}}}}}$ зависят от пространственных переменных $(x,y) \in {{\Omega }_{{{\text{cat}}}}}.$ Скорости адсорбции в уравнениях (6) определяются парциальными давлениями ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}} = R{{T}_{{\text{g}}}}{{C}_{1}}(x,y,z)$ и ${{P}_{{{\text{CO}}}}} = R{{T}_{{\text{g}}}}{{C}_{2}}(x,y,z)$ вблизи поверхности катализатора. Значения $W_{1}^{{{\text{cat}}}}$ и $W_{2}^{{{\text{cat}}}}$ находили как разности потоков адсорбции и десорбции (для O2 и CO, соответственно), а значение $W_{3}^{{{\text{cat}}}}$ есть скорость образования CO2. Реакции в газовой фазе не учитывали, поэтому $W_{i}^{{{\text{reac}}}} = W_{i}^{{{\text{reac}}}}(t,x,y,z) \equiv 0$ при $(x,y,z) \notin {{\Omega }_{{{\text{cat}}}}}.$ На левой и правой границе реактора использовали граничные условия Данквертса, другие стенки реактора считали непроницаемыми. Значения давлений на входе в реактор $P_{i}^{{{\text{in}}}} = R{{T}_{{\text{g}}}}C_{i}^{{{\text{in}}}}$ определяются условиями проведения эксперимента.
Для вычисления коэффициентов диффузии частиц разного сорта в многокомпонентной газовой смеси применяли уравнения Вильке и Фуллера–Шеттлера–Гиддингса:
Таблица 2.
Значения параметров для точечной кинетической модели [2]
| № | Стадия | $k_{i}^{0}$, [с−1] или [с−1 Pa–1] | ${{E}_{i}}$, кДж/моль |
|---|---|---|---|
| I | O2 адсорбция | ${{s}_{1}} = 0.7$ | 0 |
| II | CO адсорбция | ${{s}_{2}} = 0.7$ | 0 |
| III | CO десорбция | 2 × 1015 | 127 |
| IV | CO2 образование | 2 × 1014 | 92 |
| V | NisO образование | 106 | 69 |
| VI | NisO разложение | 24 | 69 |
| VII | NivO образование | 1011 | 69 |
| VIII | NivO разложение | 1011 | 90 |
Таблица 3.
Используемые при моделировании физические параметры системы
| Параметр | Ед. изм. | Значение |
|---|---|---|
| $P_{{{\text{CO}}}}^{{{\text{in}}}}$ – входное давление CO | Мбар | 400 |
| $P_{{{{{\text{O}}}_{{\text{2}}}}}}^{{{\text{in}}}}$ – входное давление O2 | Мбар | 100 |
| ${{T}_{{\text{g}}}}$ – температура газа | K | 803–903 |
| ${{F}_{n}}$ – скорость подачи газа (норм. усл.) | м3/с | 5 × 10–7 |
| ${{N}_{{\text{s}}}}$ – емкость поверхности Ni | узлы/м2 | 1.5 × 1019 |
| ${{S}_{{\text{c}}}}$ – площадь поверхности Ni | м2 | 3.3 × 10–5 |
| ${{W}_{{\text{c}}}}$ – масса катализатора | г | 0.074 |
Для численного решения уравнений (3), (5) и (6) распределенной модели применяли “метод прямых”, в рамках которого УЧП были преобразованы в систему ОДУ (обыкновенных дифференциальных уравнений) путем дискретизации пространственных переменных и применения метода конечных объемов. Использовалась регулярная трехмерная сетка с кубическими ячейками размера $h$; объем реактора $V$ был разделен на ${{N}_{{\text{V}}}} = {V \mathord{\left/ {\vphantom {V {{{h}^{3}}}}} \right. \kern-0em} {{{h}^{3}}}}$ контрольных объемов. Это приводило к необходимости численно решать систему ОДУ большой размерности, для чего применяли безматричный неявный многошаговый метод интегрирования с автоматическим выбором шага по времени.
3.3. Результаты расчетов
С помощью распределенной модели были изучены автоколебания в реакторе размера 15.5 × 6 × × 6 мм (длина × ширина × высота). При расчетах использовали пространственный шаг $h = 0.1$ мм, при этом всю поверхность катализатора размером 5.5 × 3 мм разбивали на 55 × 30 ячеек, а рассматриваемая система содержала 421 801 уравнений (для одной четверти объема реактора).
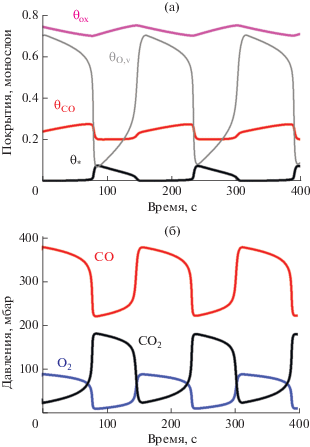
На рис. 5–7 приведены результаты расчетов при ${{T}_{{\text{g}}}} = 843$ K. Рис. 5 и 6 соответствуют фиксированному моменту времени $t = 125$ с, а на рис. 7 показаны зависимости от времени средних значений поверхностных концентраций и парциальных давлений на выходе из реактора. Видеофильм, демонстрирующий результаты моделирования автоколебаний при температуре газа 843 K, представлен в дополнительном материале, файл ESM-3.mp4.
В момент времени $t = 125$ с наблюдается высокая скорость реакции, что отражено на рис. 5, 6 и 7 б. В данный момент времени система находится в области, где скорость реакции определяется диффузией реагирующих веществ к наружной поверхности катализатора. Этому состоянию соответствует сильно неоднородное пространственное распределение парциальных давлений O2 и CO2 в реакторе, что можно увидеть на рис. 5. Здесь показаны вертикальные и горизонтальные разрезы для трехмерных распределений парциальных давлений. Локальное давление кислорода падает почти до нуля около дальнего (от входа в реактор) конца катализатора, при этом там наблюдается наиболее высокая скорость реакции (рис. 6 а при $x \approx 10$ мм). В это же время в самом начале катализатора давление кислорода во много раз выше (рис. 6 а при $x \approx 5$ мм). Ближняя ко входу в реактор часть катализатора оказывается в окисленном состоянии, что можно увидеть на “снимке” поверхности Ni на рис. 5. Здесь отмечается большое количество растворенного в объеме Ni кислорода (${{{{\theta }}}_{{{\text{O,v}}}}} > 0.4$). Для отображения состояния поверхности Ni строили двумерные распределения для разности $\xi {\text{ = }}{{{{\theta }}}_{{{\text{O,v}}}}} - {{{{\theta }}}_{{\text{*}}}}.$ Черный цвет соответствует $\xi {\text{ > 0}}{\text{.25,}}$ белый цвет – $\xi \leqslant 0.$ Предполагается, что увеличение ${{{{\theta }}}_{{{\text{O,v}}}}}$ ведет к потемнению катализатора, в то время как возрастание ${{{{\theta }}}_{{\text{*}}}}$ (числа “чистых” атомов Ni на поверхности) – к его осветлению.
Моделирование с помощью распределенной модели дает результаты, которые аналогичны экспериментально наблюдаемым явлениям. Автоколебания сопровождаются появлением и исчезновением кислорода, растворенного в приповерхностном объеме никелевого катализатора, что приводит к появлению волн окисления–восстановления Ni. Пространственные эффекты в проточном реакторе возникают из-за ограниченной скорости диффузии кислорода в объеме реактора.
Отметим, что в механизме автоколебаний основную роль играют процессы, происходящие на поверхности катализатора, в том числе, процессы образования/разложения поверхностного оксида, в то время как наличие растворенного кислорода не оказывает значительного воздействия на механизм колебаний. Типичное значение скорости реакции в высокореакционном состоянии системы составляет до $5 \times {{10}^{3}}$ монослоев/c, поэтому заполнение нескольких десятков подповерхностных слоев атомами кислорода существенно не влияет на скорость реакции и динамическое поведение системы (учитывая достаточно большой период автоколебаний). Однако появление растворенного кислорода приводит к изменению цвета, а именно к “потемнению” катализатора, и визуально наблюдаемым волновым процессам.
Отметим, что при больших значениях коэффициентов диффузии (${{D}_{i}} \to \infty $) решения распределенной модели совпадают с решениями модели CSTR. Модели типа CSTR предполагают полное перемешивание в реакторе и, следовательно, не описывают диффузионный режим, при котором скорость реакции лимитируется скоростью диффузии реагентов в объеме реактора. Полученные в настоящей работе результаты показывают, что разработка распределенных моделей может стать необходимой для получения адекватного математического описания каталитических реакций при атмосферных и более высоких давлениях.
4. ЗАКЛЮЧЕНИЕ
Приведенные выше экспериментальные данные показывают, что кинетические волны наблюдаются не только в условиях высокого вакуума, но и при атмосферном давлении. Если в условиях высокого вакуума колебательные режимы и бегущие волны могут быть связаны с перестройкой верхнего слоя металла, то при атмосферном давлении кинетические колебания и волновые процессы обусловлены периодическими процессами окисления–восстановления, которые затрагивают глубокие слои катализатора. Это является причиной различия в поведении бегущих волн. В условиях высокого вакуума концентрационные волны обычно распространяются с постоянной скоростью, которая всегда возрастает с повышением температуры катализатора, а при атмосферном давлении скорость продвижения фронта волны окисления может существенно замедляться с ростом температуры.
Результаты математического моделирования показывают, что основной причиной возникновения и распространения волновых явлений в реакции окисления СО на никеле является наличие градиента концентрации кислорода в объеме проточного реактора за счет влияния процесса массопереноса на скорость реакции.
Рис. 6.
Диффузионный режим протекания реакции при ${{T}_{{\text{g}}}} = 843$ K в момент времени $t = 125$ с. (a) – Распределение парциальных давлений кислорода и продукта реакции CO2 вблизи центральной оси x реактора над катализатором. Расположение катализатора показано в виде отрезка длиной 5.5 мм на горизонтальной оси рисунка. Значение пространственной координаты x = 0 (x = 15.5 мм) соответствует входу в реактор (выходу из реактора). (б) – Распределение концентраций ${{{{\theta }}}_{{\text{*}}}}$ и ${{{{\theta }}}_{{{\text{O,v}}}}}$ в середине поверхности катализатора вдоль центральной оси x реактора.
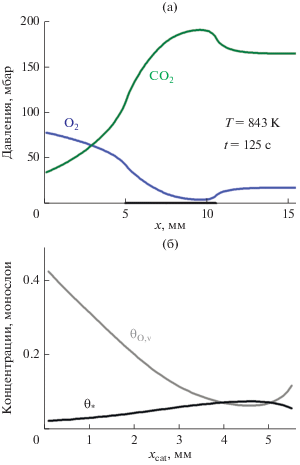
Рис. 7.
Автоколебания скорости реакции CO + O2 на Ni, рассчитанные по распределенной модели при Tg = 843 K. Показаны зависимости от времени для: (a) – средних значений концентраций θCO, θox, θ* и θO,v (при этом значения θO близки к нулю); (б) – парциальных давлении O2, CO и CO2 на выходе из реактора.
Список литературы
Bychkov V.Yu., Tulenin Yu.P., Slinko M.M., Gordienko Yu.A., Korchak V.N. // Catal. Lett. 2018. V. 148. P. 653.
Makeev A.G., Peskov N.V., Slinko M.M., Bychkov V.Yu., Korchak V.N. // Top. Catal. 2020. V. 63. P. 49.
Мержанов А.Г., Барелко В.В., Курочка И.И., Шкадинский К.Г. // Докл. АН СССР. 1975. Т. 221. № 6. С. 1114.
Барелко В.В., Володин Ю.Е. // Кинетика и катализ. 1976. Т. 17. № 1. С. 112.
Slinko M.M., Jaeger N.I. Oscillating heterogeneous catalytic systems, V. 86. Eds. Delmon B. and Yates J.T., Elsevier, 1994.
Imbihl R., Ertl G. // Chem. Rev. 1995. V. 95. P. 697.
Luss D., Sheintuch M. // Catal. Today. 2005. V. 105. P. 254.
Bychkov V.Y., Tyulenin Y.P., Slinko M.M., Korchak V.N. // Surf. Sci. 2009. V. 603. P. 1680.
Bychkov V.Y., Tyulenin Y.P., Slinko M.M., Korchak V.N. // Catal. Lett. 2007. V. 119. P. 339.
Kaichev V.V., Saraev A.A., Gladky A.Y., Prosvirin I.P., Blume R., Teschner D., Hävecker M., Knop-Gericke A., Schlögl R., Bukhtiyarov V.I. // Phys. Rev. Lett. 2017. V. 119. P. 026001.
Bychkov V.Yu., Tulenin Yu.P., Slinko M.M., Gorenberg A.Ya., Shashkin D.P., Korchak V.N. // Reac. Kinet. Mech. Catal. 2019. V. 128. P. 587.
Bychkov V.Y., Tyulenin Y.P., Slinko M.M., Korchak V.N. // Catal. Lett. 2007. V. 119. P. 339.
Saraev A.A., Vinokurov Z.S., Kaichev V.V., Shmakov A.N., Bukhtiyarov V.I. // Catal. Sci. Technol. 2017. V. 7. P. 1646.
Kaichev V.V., Gladky A.Y., Prosvirin I.P., Saraev A.A., Hävecker M., Knop-Gericke A., Schlögl R., Bukhtiyarov V.I. // Surf. Sci. 2013. V. 609. P. 113.
Bychkov V.Y., Tyulenin Y.P., Slinko M.M., Gorenberg A.Ya., Korchak V.N. // Catal. Lett. 2017. V. 147. P. 2664.
Bychkov V.Yu., Tulenin Yu.P., Gorenberg A.Ya., Korchak V.N. // Reac. Kinet. Mech. Catal. 2020. V. 129. P. 57.
Рябухин А.Г., Новоселова Е.Г., Самарин И.М. // Вестн. ЮУрГУ. 2005. № 10. С. 34.
Sales B.C., Turner J.E., Maple M.B. // Surf. Sci. 1982. V. 114. P. 381.
Makeev A.G., Slinko M.M. // Surf. Sci. 2020. V. 691. P. 121488.
Дополнительные материалы
- скачать ESM-1.mp4
- Видео 1.
- скачать ESM-2.mp4
- Видео 2.
- скачать ESM-3.mp4
- Видео 3.
Инструменты
Кинетика и катализ



