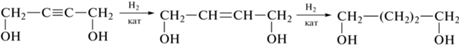Кинетика и катализ, 2022, T. 63, № 2, стр. 223-233
Особенности жидкофазного гидрирования бутин-2-диола-1,4 под действием палладийфосфорных частиц
Н. И. Скрипов a, Л. Б. Белых a, *, Т. П. Стеренчук a, Т. А. Корнаухова a, Е. А. Миленькая a, Ф. К. Шмидт a
a ФГБОУ ВО Иркутский государственный университет, химический факультет
664003 Иркутск, ул. К. Маркса, 1, Россия
* E-mail: belykh@chem.isu.ru
Поступила в редакцию 03.07.2021
После доработки 01.11.2021
Принята к публикации 19.11.2021
- EDN: ZFTAZT
- DOI: 10.31857/S0453881122020101
Аннотация
Предложены эффективные каталитические системы для хемоселективного гидрирования бутин-2-диола-1,4 на основе Pd–P-частиц, которые по частоте оборотов в мягких условиях превосходят системы циглеровского типа. Введение фосфора в состав наночастиц палладия позволяет сохранять близкую к 100%-ной селективность по бутен-2-диолу-1,4 до 90%-ной конверсии алкиндиола, и оказывает влияние на соотношение скоростей гидрирования тройной и двойной связи алкиндиола. PVP повышает агрегативную устойчивость Pd–P-частиц в процессе их функционирования, но практически не влияет на активность и селективность в гидрировании бутин-2-диола-1,4.
ВВЕДЕНИЕ
Научный прогресс в нефтехимической промышленности и в тонком органическом синтезе во многом определяется состоянием фундаментальных исследований в области катализа. Современные требования к экологической безопасности вызывают необходимость поиска новых селективных и активных катализаторов. Для ряда процессов тонкого органического синтеза на первое место выходит разработка не просто высокоселективных катализаторов, а катализаторов, позволяющих регулировать состав продуктов с атомарной точностью [1].
Среди многообразных каталитических процессов важное место отводится реакциям гидрирования. Около четверти от общего количества химических производств включают как минимум одну стадию каталитического гидрирования, что соответствует приблизительно 8% мирового ВВП [2]. Особый научный и практический интерес представляют реакции гидрирования ацетиленовых производных до моноенов и селективное восстановление кратных связей в присутствии других функциональных групп. К таким процессам относится, в частности, хемоселективное гидрирование бутин-2-диола-1,4 (BYD) в цис-бутен-2-диол-1,4 (BED) или полное насыщение тройной C≡C-связи бутин-2-диола-1,4 до бутандиола-1,4 (BAD). Промежуточный продукт полугидрирования – цис-бутен-2-диол-1,4 – используют для получения витамина B6, противоэпилептических препаратов, пестицидов, например, эндосульфана и дигидрофурана [3]. Мировое производство бутен-2-диола-1,4 в 2000 г. уже достигало практически 5000 т/год [3]. Продукт полного насыщения бутиндиола – бутандиол-1,4 – применяют в качестве растворителя и в синтезе тетрагидрофурана. Его эфиры используют в фармацевтической и парфюмерной отраслях [4, 5], а продукты дегидратации – в производстве различных синтетических каучуков [6, 7].
Процесс гидрирования бутин-2-диола-1,4, как и других производных ацетилена, представляет собой типичную последовательную реакцию, на первой стадии которой образуется бутен-2-диол-1,4 (BED), дальнейшее насыщение которого приводит к появлению бутандиола-1,4 (BAD):
Однако наряду с гидрированием бутин-2-диола-1,4 протекают разнообразные термодинамически разрешенные побочные процессы, которые значительно снижают выход целевых продуктов. В частности, в зависимости от природы катализатора и условий проведения реакции встречается прямое гидрирование бутин-2-диола-1,4 до бутандиола-1,4 без предварительной стадии десорбции бутен-2-диола-1,4 [3]. Гидрирование бутин-2-диола-1,4 может сопровождаться позиционной изомеризацией образующегося BED, гидрогенолизом связи С–ОН, гетероциклизацией с образованием 2,5,2',5'-тетрагидро(3,3')бифуранила. Если в качестве растворителя применяют спирт (этанол, изопропанол), то он вступает в реакцию с одним из продуктов превращения BED – циклическим изомером γ-оксимасляного альдегида.
В качестве катализаторов хемоселективного гидрирования бутин-2-диола-1,4 до цис-бутен-2-диола-1,4 чаще всего используют никелевые [3, 8], палладиевые [9, 10] или платиновые катализаторы [11, 12]. Для никелевых катализаторов характерно полное гидрирование BYD в бутан-1,4-диол, которое проводят в жестких условиях (150–300 атм, Т ≤ ≤ 160°С) [11]. Применение катализатора никеля Рения позволяет вести процесс в мягких условиях (2 атм, Т = 30–70°С), но основным продуктом также является бутан-1,4-диол (90–92%) [8]. Немодифицированные палладиевые катализаторы обладают более высокой активностью, чем никелевые, однако для достижения селективности по BED > 60% необходимо введение модификаторов [11]. Так, селективность по BED в присутствии катализатора 1 мас. % Pd/C в ходе гидрирования бутин-2-диола-1,4 изменяется от 100% при 43% конверсии BYD до 73% при 65% конверсии BYD при Т = 65°С. При этом частота оборотов (TOF), рассчитанная на поверхностные атомы Pd, в этих условиях не превышала 68 мин–1 [9]. Селективность по BED платиновых катализаторов в зависимости от размера кристаллитов платины, природы носителя и условий проведения реакции варьируется от 80% (Т < 150°С, Р(Н2) = 30 атм) до 96% (0.5 мас. % Pt/SiC, dPt = 2–3 нм, условия: Т = = 100°С и Р(H2) = 10 атм), но их активность в гидрировании BYD, несмотря на более жесткие условия реакции (Т = 100°С, Р(Н2) = 10 атм), невысока [11]. Поэтому разработка катализаторов, обладающих оптимальным соотношением активности и селективности, остается важной задачей.
В качестве нового класса потенциальных катализаторов гидропроцессов исследуют фосфиды переходных металлов [13–19]. Несмотря на то, что кристаллические фосфиды переходных металлов по активности значительно уступают металлическим катализаторам, они более устойчивы к дезактивации в сравнении с металлами, сульфидами, карбидами и боридами металлов в промышленно важных процессах гидродесульфидирования [14, 17, 18], гидродеазотирования [16] и гидрирования ненасыщенных соединений [13, 19]. Повышение эффективности фосфидов переходных металлов путем получения их в наноразмерном состоянии способствует активному вовлечению их в катализ. В частности, фосфиды никеля Ni2P и Ni5P4 оказались более селективными по сравнению с немодифицированными никелевыми катализаторами в гидрировании 2-метил-3-бутин-2-ола (90–92% против 60%), уступая им по активности не более чем в 2.5–3 раза [20].
Наиболее распространенным способом синтеза фосфидов переходных металлов является высокотемпературное восстановление соединений переходных металлов водородом или гипофосфитом натрия в присутствии различных фосфорных прекурсоров (Mz(PO4)y, Mz(HPO3)y, PH3) [14]. Нами был предложен низкотемпературный способ синтеза Pd–P-частиц, включающий восстановление соединений Pd(II) водородом в мягких условиях в присутствии Р4 [21]. Низкотемпературный метод позволяет получать Pd–P-частицы, обладающие не только высокой селективностью, но и активностью в гидрировании представителей различных классов ненасыщенных соединений: алкенов [21], алкинов [22], моноалкинолов [23] и алкилантрахинонов [24]. Учитывая важность разработки катализаторов гидрирования алкиндиолов с оптимальным соотношением активности и селективности, были изучены свойствах коллоидных растворов Pd–P-частиц в гидрировании бутин-2-диола-1 в мягких условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Для проведения экспериментальных исследований все исходные вещества, газы и растворители подвергали дополнительной очистке по различным методикам, применяемым при работе с металлорганическими соединениями. Газы – водород (особой чистоты, марка 5.0) и аргон (содержание не менее 99.999%) – очищали от примесей кислорода и воды последовательным пропусканием их через колонки, заполненные никель-хромовым катализатором и цеолитами марки СаА в случае водорода или P2O5, гранулированной щелочью, молекулярными ситами СаА и порошком меди, нагретой до 200°С в случае аргона.
AlEt3 фирмы “Sigma-Aldrich” растворяли в толуоле и хранили в запаянных ампулах в атмосфере аргона. Все операции по работе с AlEt3 проводили в сосудах Шленка.
Растворители (бензол, толуол, октанол-1, N,N-диметилформамид) очищали по стандартным методикам [25]. Для более глубокой осушки бензол и толуол подвергали дополнительной перегонке над LiAlH4 на ректификационной колонке и хранили в атмосфере аргона в запаянных ампулах над молекулярными ситами 4 Å.
N,N-диметилформамид (ДМФА) выдерживали над безводным сульфатом меди до получения раствора зеленого цвета с целью обезвоживания и удаления примесей аминов и дважды подвергали вакуумной разгонке (8 мм рт. ст.) при температуре не выше 42°С.
Бис-(ацетилацетонат) палладия (Pd(acac)2) синтезировали согласно методике [26] и перекристаллизовывали из ацетона. Бутин-2-диол-1,4 (BYD) (“Merck”, 99%) применяли без дополнительной очистки.
Белый фосфор непосредственно перед применением механически очищали от поверхностных продуктов окисления и промывали безводным бензолом. Раствор белого фосфора в бензоле готовили и хранили в инертной атмосфере в сосуде типа “палец”, конструкция которого предусматривает вакуумирование и заполнение аргоном. ЯМР 31P: δ = –522 м. д. (с).
Примеры проведения экспериментов
Пример 1 (Pd–P-частицы). Гидрирование бутин-2-диола-1,4 (BYD) проводили в термостатируемом сосуде периодического действия “утка” при 50°C и начальном давлении водорода 2 атм в среде ДМФА в присутствии Pd–P-наночастиц, сформированных in situ. Для этого в предварительно откаченный и заполненный водородом сосуд помещали навеску Pd(acac)2 (0.0152 г, 5 × × 10–5 моль), добавляли растворитель – ДМФА (8 мл) – и перемешивали в течение 5 мин при комнатной температуре до полного растворения Pd(acac)2. Затем в потоке водорода приливали по каплям 0.5 мл раствора фосфора в бензоле (1.5 × × 10–5 моль в расчете на атомную форму фосфора) и дополнительно перемешивали в течение 5 мин при комнатной температуре. Реакционную смесь восстанавливали водородом при 80°C и давлении водорода 2 атм в течение 15 мин до количественного превращения Pd(аcac)2. Контроль осуществляли методом УФ-спектроскопии по полосе поглощения 330 нм. Полученный коллоидный раствор черно-коричневого цвета охлаждали до 50°C, создавали давление водорода 2 атм, шприцом вводили 2 мл раствора BYD в ДМФА (0.5283 г, 6.136 × 10–3 моль). Гидрирование проводили при интенсивном перемешивании, исключающем протекание реакции в диффузионной области. Контроль за реакцией осуществляли по поглощению водорода с помощью манометра, периодически отбирая пробы для ГЖХ-анализа.
Гидрирование бутин-2-диола-1,4 в присутствии Pd–P-наночастиц, стабилизированных поли-N-винилпирролидоном (PVP), выполняли аналогично. PVP вводили на стадии формирования Pd–P-наночастиц.
Пример 2 (системы циглеровского типа). К раствору Pd(аcac)2 (0.0152 г, 5 × 10–5 моль) в 7 мл толуола, помещенному в термостатируемый сосуд “утка”, в токе аргона приливали по каплям 1 мл раствора триэтилалюминия в бензоле (20 × 10–5 – 50 × 10–5 моль) и перемешивали при комнатной температуре в течение 5 мин. Затем заменяли аргон на водород, температуру поднимали до 50°C, создавали давление водорода 2 атм, шприцом вводили 2 мл раствора BYD в ДМФА (0.5283 г, 6.136 × 10–3 моль).
Гидрирование бутин-2-диола-1,4 проходит постадийно. На первой стадии преимущественно образуется цис-бутен-2-диол-1,4. На второй стадии бутен-2-диол-1,4 (BED) восстанавливается преимущественно до бутандиола-1,4 (BAD). Побочный процесс позиционной изомеризации BED протекает без поглощения водорода. Т.к. количество BAD на первой стадии гидрирования не превышало 2%, то скорость гидрирования BYD до BED рассчитывали по углу наклона прямых участков кинетический кривых в диапазоне поглощения водорода 0.1–0.3 моль H2 на моль BYD. Скорость гидрирования BED до бутандиола-1,4 вычисляли по углу наклона прямых участков кинетический кривых в диапазоне поглощения водорода 1.1–1.3 моль H2 на моль BYD.
Для определения размера частиц катализаторов параллельно с каталитическими экспериментами осуществляли анализ аликвоты раствора методом просвечивающей электронной микроскопии (ПЭМ).
Расчет частоты оборотов (TOF) Pd-черни, Pd–P-частиц и циглеровских систем проводили по формулам (1)–(3):
где a – каталитическая активность в расчете на весь палладий (моль субстрата (моль Pdобщий мин)–1), DПЭМ – дисперсность, определенная из данных просвечивающей электронной микроскопии.(2)
${{D}_{{{\text{ПЭМ}}}}} = \frac{{6{{M}_{{{\text{Pd}}}}}}}{{{{\rho }_{{{\text{Pd}}}}}{{d}_{{{\text{ПЭМ}}}}}{{A}_{{{\text{Pd}}}}}{{N}_{{\text{A}}}}}},$Методы исследования
ГЖХ-анализ продуктов гидрирования бутин-2-диола-1,4 проводили на хроматографе “Хроматэк-Кристалл 5000” (“Хроматэк”, Россия), снабженном капиллярной колонкой длиной 30 м (фаза – 5% дифенил, 95% диметилполисилфениленсилоксан) и пламенно-ионизационным детектором (ДИП) по методу внутреннего стандарта, используя температурное программирование: 100°C (1.5 мин), 270°C (10 мин), скорость нагрева 30оC/мин. Давление газа-носителя (азот) – 20 кПа. Дополнительно продукты превращения бутин-2-диола-1,4 анализировали на хромато-масс-спектрометре GCMS-QP2010 Ultra Shimadzu (“Shimadzu”, Япония), снабженном капиллярной колонкой GsBP⋅5MS длиной 30 м с фазой поли(5% дифенил, 95% диметилполисилфениленсилоксан).
УФ-спектры растворов катализатора на стадии формирования снимали на спектрофотометре СФ-2000 (Россия) в кварцевых кюветах с толщиной поглощающего слоя 0.1 см. Контроль за превращением Pd(аcac)2 проводили по полосе поглощения 330 нм (ε330 = 10630 л см–1 моль–1).
Снимки ПЭМ получали на электронном микроскопе Tecnai G2 (“FEI”, США) с ускоряющим напряжением 200 кВ. Каплю реакционного раствора наносили на науглероженную медную сеточку, высушивали в боксе в инертной атмосфере при комнатной температуре. Изображения записывали с помощью CCD-камеры (“Soft Imaging System”, Германия). Для нахождения среднего размера обрабатывали участок, содержащий не менее 50 частиц.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
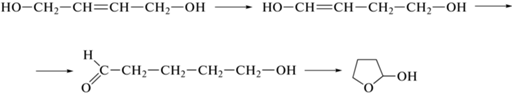
Тестирование суспензии Pd-черни и коллоидных растворов Pd–P-частиц в гидрировании бутин-2-диола-1,4 проведено в среде ДМФА в мягких условиях: при температуре 50°С и давлении водорода 2 атм. Типичный вид кинетической кривой и данные ГЖХ-анализа указывают на последовательность стадий насыщения кратных связей бутин-2-диола-1,4 для всех рассмотренных каталитических систем и вероятное протекание гидрирования BYD по механизму Поляни–Хариути (рис. 1).
Рис. 1.
Кинетические кривые гидрирования BYD (1) и образования BED (2) и BAD (3). Условия процесса: катализатор – Pd–Р-наночастицы (Р : Pd = 0.3); Т = = 50°С; Р(Н2) = 2 атм; растворитель – ДМФА.
Частота оборотов в гидрировании бутин-2-диола-1,4 и хемоселективность по бутен-2-диолу-1,4 для немодифицированных палладиевых катализаторов практически не зависит от размера кристаллитов палладия. Как для Pd-черни, так и циглеровских систем она составляет ≈30 мин—1. Селективность по целевому продукту (BED) для коллоидных растворов Pd не превышает 73–80% при 96–98%-ной конверсии алкиндиола (табл. 1).
Таблица 1.
Активность Pd- и Pd–P-катализаторов в гидрировании бутин-2-диола-1,4 при 50°С и давлении водорода 2 атм
| № | Катализатор | а, мин–1 | d, нм | D | TOF, мин–1 | ||
|---|---|---|---|---|---|---|---|
| С≡С | С=С | С≡С | С=С | ||||
| 1 | Pd-чернь | 0.7 | 0.7 | 48 | 0.022 | 32 | 32 |
| 2 | Pd–PVP | 1.7 | 7.6 | 6.0 | 0.176 | 10 | 43 |
| 3 | Pd–P | 34.8 | 18.2 | 5.9 | 0.179 | 194 | 102 |
| 4 | Pd–P (PVP) | 33.3 | 13.8 | 5.8 | 0.183 | 182 | 75 |
| 5 | Pd(acac)2–4AlEt3* | 13.8 | 83.3 | 2.5 | 0.418 | 33 | 199 |
| 6 | Pd(acac)2–10AlEt3* | 13.3 | 81.1 | 1.6 | 0.604 | 22 | 134 |
Модифицирование палладиевых катализаторов фосфором оказывает промотирующий эффект на их свойства в гидрировании алкиндиола. И по активности, и по частоте оборотов гидрирования бутин-2-диола-1,4 до бутен-2-диола-1,4 частицы Pd–P превосходят не только Pd-чернь, но и высокодисперсные системы циглеровского типа (табл. 1).
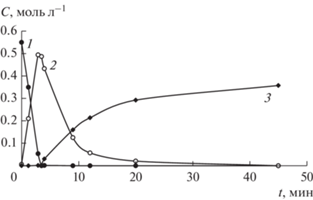
Вхождение фосфора в кристаллическую решетку палладия на стадии формирования Pd–P-частиц повышает не только частоту оборотов, но и селективность в гидрировании бутин-2-диола-1,4 (табл. 2). В отличие от нанокластеров палладия в циглеровских системах селективность по BED для Pd–P-частиц достигает 90–98% при аналогичной степени конверсии бутин-2-диола-1,4. В случае Pd–P-частиц близкая к 100% селективность по BED сохраняется в ходе гидрирования бутин-2-диола-1,4 практически до 90%-ной конверсии алкиндиола (рис. 2). Для немодифицированных палладиевых катализаторов близкая к 100% селективность по BED характерна лишь до 40%-ной конверсии бутин-2-диола-1,4. При более глубоких степенях превращения бутин-2-диола-1,4 этот показатель уменьшается до 73–80%. Следует отметить, что в присутствии практически всех рассмотренных палладиевых катализаторов на начальной стадии гидрирования образуется цис-изомер бутен-2-диола-1,4, и только после практически количественного превращения алкиндиола наряду с гидрированием наблюдается цис–транс-изомеризация BED.
Таблица 2.
Продукты гидрирования бутен-2-диола-1,4, образующегося из бутин-2-диола-1,4 под действием Pd- и Pd–P-катализаторов при 50°С и давлении водорода 2 атм
| № | Катализатор | Конверсия BED, % | Основные продукты, мол. % | ||
|---|---|---|---|---|---|
| BAD | 2-гидрокси-тетрагидрофуран | 2,3-дигидро- фуран | |||
| 1 | Pd-чернь | 88 | 49.8 | 37.5 | 1.4 |
| 2 | Pd-чернь (PVP) | 100 | 65.3 | 23.5 | 3.8 |
| 3 | Pd–P | 92 | 68.8 | 21.2 | 4.8 |
| 4 | Pd–P (PVP) | 100 | 67.9 | 20.9 | 6.7 |
| 5 | Pd(acac)2–4AlEt3* | 100 | 63.6 | 16.2 | 1.3 |
| 6 | Pd(acac)2–10AlEt3* | 100 | 66.4 | 15.6 | 1.2 |
Рис. 2.
Зависимость селективности гидрирования бутин-2-диола-1,4 по BED от глубины превращения алкиндиола под действием Pd–P-частиц, стабилизированных PVP (1), и циглеровской системы (2).
Промотирующее действие фосфора на каталитические свойства палладия в гидрировании бутин-2-диола-1,4 обусловлено рядом причин. Проведенное ранее комплексное исследование процесса взаимодействия Pd(acac)2 c белым фосфором в инертной атмосфере и в водороде с применением методов оптической спектроскопии (ИКС, УФС, ЯМР), ПЭМ и РФА показало, что в результате редокс-процесса между Pd(acac)2 и Р4 на первой стадии при 25°С формируются частицы PdP2 [21]. Дальнейшее восстановление Pd(acac)2 водородом из-за хелатной структуры асас-лигандов протекает в более жестких условиях – при 80°С. Образующиеся при восстановлении Pd(acac)2 водородом атомы Pd(0) могут превращаться по двум основным направлениям: взаимодействовать друг с другом с появлением кластеров палладия и/или реагировать с дифосфидом палладия с возникновением обогащенных палладием Pd–P-частиц. Т.к. гетерогенный механизм зародышеобразования более предпочтителен по сравнению с гомогенным [27], то кластеризация атомов Pd(0) протекает преимущественно на зародышевых частицах PdP2.
Из общего вида рентгеновской дифрактограммы Pd–P-катализатора (P : Pd = 0.3) следует, что максимумы пиков (2.2649, 1.3659 и 1.1820 Å) наиболее близки к рефлексам от плоскостей кристаллитов палладия (111) (d/n = 2.2458 Å; I/I0 = 100), (220) (d/n = 1.37537 Å; I/I0 = 42) и (311) (d/n = = 1.17295 Å; I/I0 = 55) (# 00-046-1043) (рис. 3). Отсутствие пика (I/I0 = 100) в области углов отражения 2θ = 30°, соответствующего плоскости (–110) PdP2, косвенно подтверждает его дальнейшее взаимодействие с образующимися атомами Pd(0). Полуширина пиков изменяется от 5° для максимума в области 39.8° и до ≈8° и ≈12° для максимумов в области 68.7° и 81.4°. Известно [28], что уширение дифракционного рефлекса на рентгенограмме может быть связано с сокращением размера частиц менее 100 нм и микронапряжениями, которые обусловлены химической неоднородностью и дефектностью структуры. Размер области когерентного рассеяния (ОКР), вычисленный по полуширине основного рефлекса (находящегося в области углов отражения 2θ = = 39.8°), не превышает 2.0 нм. Размер ОКР, который, как правило, отождествляют со средним размером кристаллитов, измеряют экспериментально на основании данных об уширении дифракционных отражений. Среднечисленный диаметр Pd–P-частиц (5.5 ± 0.9 нм), рассчитанный из ПЭМ-снимков [21, 22], превышает значение ОКР в 2.75 раза. Т.к. область когерентного рассеяния соответствует внутренней (упорядоченной) области зерна и не включает сильно искаженные границы, то обычно значение ОКР лишь на 10–15% меньше результатов определения размера зерен кристаллита с помощью ПЭМ [28]. Большие различия между размерами базовых частиц, найденными методами РФА и ПЭМ, могут быть связаны с поликристалличностью и/или искажением кристаллической решетки. Образование окружностей на снимках быстрого фурье-преобразования (FFT) указывает на поликристаллический характер отдельных наночастиц Pd–P-катализатора, межплоскостные расстояния которых (2.36, 2.33, 2.05, 1.44 Å) соответствуют плоскостям (211) (d/n = 2.3649 Å), (102) (d/n = = 2.3351 Å) фосфидов палладия состава Pd3P0.8 (# 00-042-0922) и Pd5P2 (d/n = 2.069; 1.434 Å; # 00-019-0887) [22] (рис. 3). Но различие в 1.5–2 раза размеров ОКР, рассчитанных по полуширине основного рефлекса (2θ = 39.59°) и двух других (2θ = = 68.7° или 81.4) свидетельствует о несовершенстве кристаллической решетки частиц Pd–P-катализатора. Снимки ПЭМ ВР разных областей также подтверждают наличие областей низкой упорядоченности Pd–P-частиц. Размер областей упорядоченности в отдельных частицах не превышает 1.0–1.5 нм (рис. 3).
Рис. 3.
Рентгенограмма Pd–P-катализатора (P : Pd = 0.3). Вертикальными линиями показано положение рефлексов кристаллического палладия. На вставках приведены EDX-спектр, снимок ПЭМ ВР и картина FFT.
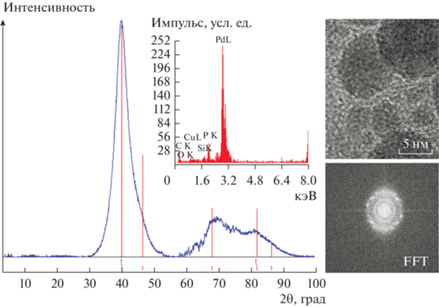
Таким образом, уширение дифракционных максимумов на рентгенограмме обусловлено не только уменьшением размера частиц кристаллитов, но и дефектностью структуры, которое вызвано вхождением фосфора (металлоида) в состав частиц. По данным EDX-анализа, для различных участков Pd–P-катализатора P : Pd = 0.11 : 1, что соответствует брутто-формуле объемной фазы Pd9.2P [22] (рис. 3). Соотношение P : Pd превосходит таковое в самом обогащенном палладием фосфиде, состав которого выражается формулой Pd15P2. Межплоскостные расстояния на дифракционной кривой, наиболее характерные для палладия, и несовершенство кристаллической решетки Pd–P-частиц, возникающее в результате вхождения фосфора в состав частиц, позволяют предполагать образование преимущественно структурно неупорядоченного твердого раствора между палладием и фосфором.
Внедрение фосфора в кристаллическую решетку палладия приводит к изменению электронных свойств палладия. По данным РФЭС [29], при малых отношениях P : Pd (P : Pd = 0.3) в поверхностном слое Pd–P-частиц содержится две химические формы палладия: атомы палладия(0) (Есв(Pd3d5/2) = 334.5 эВ) и связанные с элементным фосфором электронодефицитные атомы палладия (Pdδ+) (условно называемые фосфиды палладия) (Есв(Pd3d5/2) = 336.2 эВ, Есв(Р2р3/2) = = 129.5 эВ) в соотношении 55 : 45, т.е. на поверхности частиц преобладает Pd(0).
Кластеры палладия(0) и связанные с элементным фосфором электронодефицитные атомы палладия (Pdδ+) обладают различной активностью в гидрировании ненасыщенных соединений. Разделить их вклад в катализ реакции гидрирования представляет собой непростую задачу. Из двух активных центров реакция преимущественно протекает на тех, которые характеризуются меньшей энергией активации. Фосфиды d‑металлов в гидрогенизационном катализе обычно менее активны, чем металлические катализаторы, но более устойчивы к дезактивации [23, 30]. Отличие в активностях при близких дисперсиях в зависимости от состава фосфида Pd может достигать 10–100-кратной величины и более [23, 31].
Надежным подходом для различения носителей каталитической активности является анализ дифференциальной селективности (Seldif), т.к. она зависит от природы, а не от количества активных центров. Экспериментальное ее определение – достаточно сложная задача. Однако в качестве метода оценки величины Seldif можно использовать фазовые траектории, которые отражают зависимости концентраций продуктов двух конкурирующих реакций друг от друга [32]. Тангенс угла наклона касательной к любой точке на фазовой траектории конкурирующих реакций равен отношению скоростей образования двух продуктов конкурирующих реакций и однозначно характеризует дифференциальную селективность реакций. Совпадение фазовых траекторий позволяет с большой долей уверенности констатировать идентичность природы каталитически активных центров. Маловероятно, что разные по природе активные центры обладают близкой селективностью. Несовпадение фазовых траекторий указывает на различную природу активных центров. С использованием такого подхода ранее было показано [23], что из двух потенциально активных форм в Pd–P-наночастицах в гидрировании ацетиленовых спиртов участвует только одна – кластеры Pd(0); гидрирование образующихся аллиловых спиртов может проходить и на кластерах Pd(0), и на фосфидах палладия. Принимая во внимание эти результаты, с большой вероятностью можно предполагать, что в мягких условиях гидрирование алкиндиола протекает преимущественно на кластерах Pd(0). Следует отметить, что по данным квантовохимических расчетов [20] P‑содержащие участки на поверхности фосфида никеля обладают очень сильными адсорбционными свойствами и из-за слишком прочной их связи с ацетиленом (Р–СН–СН–Р) не активны в гидрировании алкинов.
Внедрение фосфора в кристаллическую решетку палладия не только влияет на электронное состояние поверхностных атомов палладия, но и снижает концентрацию растворенного “неселективного” (абсорбционного) водорода в Pd–P-частицах [33]. Так называемый растворенный “неселективный” водород, диффундируя на поверхность, способен гидрировать алкиндиол до алкандиола без предварительной стадии десорбции и реадсорбции алкендиола. Кроме того, абсорбированный в Pd–P-частицах водород удерживается более прочно, чем в кристаллическом палладии. Уменьшение доли абсорбционного водорода и увеличение прочности его связывания в объеме является одним из факторов роста селективности по алкенам при гидрировании алкинов [34]. Следует отметить, что при конверсии алкиндиола 96–98% содержание бутандиола-1,4 было не более 1–2.5%. Следовательно, высокая селективность гидрирования бутин-2-диола-1,4 под действием Pd–P-частиц может быть связана не только с характерным для палладия термодинамическим фактором (большим значением соотношения между константами адсорбционного равновесия Pd с BYD (KBYD) и BED (KBED)), но и с падением концентрации “неселективного” водорода и прочности его связывания в объеме из-за внедрения фосфора в кристаллическую решетку палладия [33]. Необходимо учитывать, что аналогично биметаллическим катализаторам [34] фосфор (металлоид) уменьшает размер ансамбля атомов Pd(0). Снижение числа многоатомных ансамблей, состоящих из атомов Pd(0), в Pd–P-частицах, уменьшает вероятность протекания побочных реакций олигомеризации и полного гидрирования в результате сокращения числа мультиплетно адсорбированных интермедиатов.
По данным [20] вхождение фосфора в состав металлических частиц никеля влияет на теплоты адсорбции алкинов и алкенов. Наблюдаемый рост частоты оборотов под действием Pd–P-частиц в сравнении с Pd-чернью и циглеровскими системами также косвенно указывает на изменение энергии связи субстратов с кластерами палладия. Ведь для алкинов, алкиндиолов и диенов характерна высокая адсорбционная способность, приводящая к полному заполнению поверхности катализатора и затрудняющая протекание поверхностной реакции. По данным РФЭС [29] в Pd–P-частицах для атомов Pd(0) наблюдается смещение пика палладия(0) (Есв(Pd3d5/2) = 334.5 эВ) в сторону меньших энергий в сравнении с массивным Pd (Есв(Pd3d5/2) = 335.2 эВ). Причина этого электронного эффекта на данный момент не ясна. Повышение электронной плотности на атомах Pd(0) ухудшает адсорбцию нуклеофильных молекул субстрата. Согласно [34] с ростом электронной плотности адсорбция алкинов снижается в большей степени, чем алкенов.
К основным побочным реакциям, уменьшающим выход бутен-2-диола-1,4 на первой стадии протекания процесса, относятся гидрирование бутен-2-диола-1,4 до бутандиола-1,4 и позиционная изомеризация двойной связи. Из-за неустойчивости енола (бутен-1-диола-1,4) вместо продукта позиционной изомеризации двойной связи методом ГЖХ и хромато-масс-спектрометрии фиксировали 2-гидрокситетрагидрофуран – циклический таутомер полуацеталя 4-гидроксибутаналя [10]. Обращает внимание тот факт, что при гидрировании бутин-2-диола-1,4 в водных средах под действием нанесенных палладиевых катализаторов (Pd/C) в качестве побочных соединений в основном регистрируются линейная форма 4-гид-роксибутаналя, бутаналь и бутанол [8]. Известно, что образование полуацеталей, в отличие от ацеталей, катализируется как кислотами, так и основаниями [35]. Вероятно ДМФА, применяемый в качестве растворителя, являясь слабым основанием, катализирует циклизацию 4-гидроксибутаналя. Образование 2-гидрокситетрагидрофурана можно представить через ряд стадий, включающих позиционную изомеризацию бутен-2-диола-1,4 до бутен-1-диола-1,4, кето-енольную таутомерию бутен-1-диола-1,4, приводящую к 4-гидроксибутаналю, и внутримолекулярную циклизацию 4-гидроксибутаналя:
Важно отметить, что н-бутаналь, н-бутанол, цис- и транс-кротиловый спирт зафиксированы в следовых количествах (менее 1%). Это оказалось неожиданно, т.к. гидрогенолиз связи С–ОН часто наблюдается в ходе гидрирования BYD в водных и спиртовых растворах под действием нанесенных палладиевых катализаторов. Содержание продуктов гидрогенолиза в присутствии Pd-катализаторов может достигать 27% [10].
В качестве побочных продуктов гидрирования алкиндиола под действием коллоидных растворов в ДМФА образуется также 2,3-дигидрофуран. Анализ кинетических кривых накопления 2,3-дигидрофурана показывает, что он появляется параллельно с бутен-2-диолом-1,4 на стадии гидрирования бутин-2-диола-1,4, хотя количество его значительно возрастает после полной конверсии BYD.
Добавление PVP на стадии формирования катализатора повышает активность Pd-черни, но практически не сказывается на активности и селективности Pd–P-частиц в гидрировании бутин-1-диола-1,4 (табл. 1, 2). По данным ПЭМ формирование Pd-черни в присутствии PVP (PVP : Pd = = 0.1) приводит к уменьшению среднего размера кристаллитов палладия от 48 до 6 нм (рис. 4). Следовательно, наблюдаемый рост активности Pd-черни при добавлении PVP обусловлен повышением ее дисперсности. В случае Pd–P-катализатора PVP не влияет на средний размер базовых частиц (5.9 нм без PVP и 5.8 нм – с PVP) (рис. 5), но в отсутствие PVP при увеличении концентрации палладиевого прекурсора от 1 до 5 ммоль/л на ПЭМ-снимках фиксировалось агрегирование Pd–P-частиц. Одинаковые активности катализаторов Pd–P и Pd–P (PVP) в гидрировании бутин-1-диола-1,4 косвенно указывают, что образование агрегатов, регистрируемое на ПЭМ-снимках, происходит на стадии пробоподготовки к ПЭМ-анализу. Следовательно, основная функция PVP в рассматриваемых каталитических системах сводится к стабилизации частиц катализатора и повышению их агрегативной устойчивости в отсутствие алкиндиола. Близкие значения селективности гидрирования бутин-1-диола-1,4 под действием модифицированных PVP и немодифицированных палладиевых и Pd–P-катализаторов косвенно свидетельствуют о неизменности природы активных центров палладия.
Рис. 4.
ПЭМ-снимки Pd-черни, образующейся в результате восстановления Pd(acac)2 водородом в среде ДМФА, без PVP (слева) и в присутствии PVP (справа) при концентрации Pd(acac)2 равной 5 ммоль/л.

Рис. 5.
ПЭМ-снимки Pd–P-частиц, образующихся из Pd(acac)2 и Р4 при P : Pd = 0.3 в среде ДМФА в водороде, без PVP (слева) и в присутствии PVP (справа) при концентрации Pd(acac)2 равной 5 ммоль/л.

Внедрение фосфора в состав кристаллической решетки палладия в Pd–P-частицах влияет не только на активность и селективность гидрирования бутин-2-диола-1,4, но и на соотношение скоростей гидрирования тройной и двойной связи. С термодинамической точки зрения из-за превышения энергии С≡С-связи над энергией С=С-связи скорость насыщения тройной связи должна быть меньше скорости восстановления двойной связи. В то же время в гидрировании алкинов, относящихся к структурно чувствительным реакциям, в зависимости от размера частиц катализатора могут иметь место три частных случая: r(C≡C) < < r(C=C), r(C≡C) ≈ r(C=C) и r(C≡C) > r(C=C) [22, 36]. При гидрировании бутин-2-диола-1,4 под действием циглеровских систем и коллоидных растворов Pd–PVP наблюдается первый вариант: скорость гидрирования тройной связи бутин-2-диола-1,4 практически в 5–6 раз меньше скорости насыщения двойной связи бутен-2-диола-1,4. Для Pd–P-частиц, независимо от условий их формирования, характерен третий случай – скорость гидрирования тройной связи в 2–3 раза превышает скорость гидрирования двойной связи. Дополнительным экспериментом (гидрированием второй порции бутин-2-диола-1,4) показано, что данный результат не связан с дезактивацией Рd–P-частиц. Таким образом, высокой хемоселективности реакции гидрирования бутин-2-диола-1,4 под действием Pd–P-частиц наряду с термодинамическим фактором благоприятствует и кинетический фактор – соотношение констант скоростей гидрирования тройной и двойной связей.
Изменение соотношения скоростей гидрирования в алкиндиоле в присутствии Pd–P-частиц может быть следствием изменения как констант адсорбционных равновесий субстратов с активными центрами палладия при внедрении фосфора в решетку палладия, так и скорости цис–транс-изомеризации бутен-2-диола-1,4. Из-за стерического фактора скорость гидрирования дизамещенных алкенов и алкенолов обычно значительно уступает скорости гидрирования терминальных алкенов или алкинолов. Для Pd–P-частиц после полной конверсии бутин-2-диола-1,4 скорость накопления транс-бутен-2-диола-1,4 на порядок превосходит скорость образования бутандиола-1,4. Для Pd–PVP скорости накопления транс-бутен-2-диола-1,4 и бутандиола-1,4 соизмеримы. Таким образом, быстрая цис–транс-изомеризация бутен-2-диола-1,4 под действием Pd–P-частиц вносит вклад в изменение соотношения скоростей гидрирования тройной и двойной связей бутин-2-диола-1,4.
Свойства коллоидных растворов Pd- и Pd–P-частиц в полном гидрировании бутин-2-диола-1,4 до бутандиола-1,4, за исключением активности и высокой доли 2-гидрокситетрагидрофурана для Pd-черни, отличались незначительно. При 100%-ной или близкой к ней конверсии бутен-2-диола-1,4 выход бутандиола-1,4 достигал 63–68%. Снижение селективности по основному продукту (BAD) связано, преимущественно, с образованием 2-гидрокситетрагидрофурана и 2,3-дигидрофурана.
Таким образом, вхождение фосфора в состав наночастиц палладия оказывает промотирующий эффект как на активность, так и селективность в гидрировании бутин-2-диола-1,4 до бутен-2-диола-1,4. Высокая селективность в хемоселективном гидрировании BYD до BED может быть обусловлена как снижением концентрации “неселективного” водорода, так и термодинамическим фактором (соотношением констант адсорбционного равновесия). С быстрой цис–транс-изомеризацией BED после практически полной конверсии BYD связана меньшая скорость гидрирования двойной связи BED в сравнении с немодифицированными палладиевыми катализаторами.
Список литературы
Анаников В.П., Хемчан Л.Л., Иванова Ю.В., Бухтияров В.И., Сорокин А.М., Просвирин И.П., Вацадзе С.З., Медведько А.В., Нуриев В.Н., Дильман А.Д., Левин В.В., Коптюг И.В., Ковтунов К.В., Живонитко В.В., Лихолобов В.А. и др. // Успехи химии. 2014. Т. 83. № 10. С. 885.
Vile G., Albani D., Almora-Barrios N., Lopez N., Perez-Ramirez J. // ChemCatChem. 2016. V. 8. P. 21.
Kundr M., Sultan B.B.M., Ng D., Wang Y., Alexander D.L.J., Nguyen X., Xie Z., Hornung C.H. // Chem. Eng. Proc.: Process Intensification. 2020. V. 154. P. 108018.
Ge L., Wu X., Chen J., Wu J. // J. Biomater. Nanobiotechnol. 2011. V. 2. P. 335.
Gräfje H., Körnig W., Weitz H.-M., Reiß W., Steffan G., Diehl H., Bosche H., Schneider K., Kieczka H. Butanediols, Butenediol, and Butynediol in Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2000. 180 p.
Huang C.-F., Jiang Y.-F., Guo G.-L., Hwang W.-S. // Biores. Technol. 2013. V. 135. P. 446.
White Wm. C. // Chem. Biol. Interact. 2007. V. 166. № 1–3. P. 10.
Пятницына Е.В., Ельчанинов М.М. // ЖПХ. 2013. Т. 86. Вып. 3. С. 425.
Duncanson I.T., Sutherland I.W., Cullen B., Jackson S.D., Lennon D. // Catal. Lett. 2005. V. 103. № 3–4. P. 195.
Musolino M.G., Cutrupi C.M.S., Donato A., Pietropaolo D., Pietropaolo R. // J. Mol. Catal. A: Chem. 2003. V. 195. № 1–2. P. 147.
Shu M., Shi C., Yu J., Chen X., Liang C., Si R. // Catal. Sci. Technol. 2020. V. 10. № 2. P. 327.
Lara S.A.G., Natividad R., Vilchis-Nestor A.R., Lopez-Castanares R., Garcia-Orozco I., Gonzalez-Pedroza M.G., Morales-Luckie R.A. // Catal. Lett. 2019. V. 149. № 12. P. 3447.
Liu Y., McCue A.J., Miao C., Feng J., Li D., Anderson J.A. // J. Catal. 2018. V. 364. P. 406.
Prins R., Bussell M.E. // Catal. Lett. 2012. V. 142. № 12. P. 1413.
Yang P., Jiang Z., Ying P., Li C. // J. Catal. 2008. V. 253. № 1. P. 66.
Oyama S.T., Gott T., Zhao H., Lee Y.-K.// Catal. Today. 2009. V. 143. P. 94.
Bowker R.H., Smith M.C., Carrillo B.A., Bussell M.E. // Top. Catal. 2012. V. 55. № 14–15. P. 999.
Savithra G.H.L., Bowker R.H., Carrillo B.A., Bussell M.E., Brock S.L. // ACS Appl. Mater. Interf. 2013. V. 5. № 12. P. 5403.
Xiong R., Zhao W., Wang Z., Zhang M. // Mol. Catal. 2021. V. 500. 111332.
Albani D., Karajovic K., Tata B., Li Q., Mitchell S., López N., Pérez-Ramírez J. // ChemCatChem. 2018. V. 10. P. 1.
Белых Л.Б., Скрипов Н.И., Белоногова Л.Н., Уманец В.А., Шмидт Ф.К. // Кинетика и катализ. 2010. Т. 51. № 1. С. 47. (Belykh L.B., Skripov N.I., Belonogova L.N., Umanets V.A., Shmidt F.K. // Kinet. Catal. 2010. V. 51. № 1. P. 42.)
Belykh L.B., Skripov N.I., Sterenchuk T.P., Gvozdovskaya K.L., Sanzhieva S.B., Schmidt F.K. // J. Nanopart. Res. 2019. V. 21. № 9. P. 198.
Скрипов Н.И., Белых Л.Б., Стеренчук Т.П., Гвоздовская К.Л., Жердев В.В., Дашабылова Т.М., Шмидт Ф.К. // Кинетика и катализ. 2020. Т. 61. № 4. С. 526 (Skripov N.I., Belykh L.B., Sterenchuk T.P., Gvozdovskaya K.L., Zherdev V.V., Dashabylova T.M., Schmid F.K. // Kinet. Catal. 2020. V. 61. № 4. P. 575.)
Стеренчук Т.П., Белых Л. Б., Скрипов Н.И., Санжиева С.Б., Гвоздовская К.Л., Шмидт Ф.К. // Кинетика и катализ. 2018. Т. 59. № 5. С. 574. (Sterenchuk T.P., Belykh L.B., Skripov N.I., Sanzhieva S.B., Gvozdovskaya K.L., Schmidt F.K. // Kinet. Catal. 2018. V. 59. № 5. P. 585.)
Гордон А., Форд Р. Спутник химика. Москва: Мир, 1976. 572 с. (Gordon A.J., Ford R.A. The Chemist’s Companion; N.Y.: Wiley & Sons, 1972.)
Matthews J.C., Nashua N.H., Wood L.L., USA, Patent 3.474.464, 1969.
Finney E.E., Finke R.G. // J. Coll. Interf. Sci. 2008. V. 317. P. 351.
Гусев А.И. Наноматериалы, наноструктуры, нанотехнологии. Изд. 2-е, исправленное и дополненное. М.: Изд-во Наука-Физматлит, 2007. 416 с.
Белых Л.Б., Скрипов Н.И., Стеренчук Т.П., Акимов В.В., Таусон В.Л., Шмидт Ф.К. // Журн. общей химии. 2016. Т. 86. № 9. С. 1454. (Belykh L.B., Skripov N.I., Sterenchuk T.P., Akimov V.V., Tauson V.L., Schmidt F.K. // Russ. J. Gen. Chem. 2016. V. 86. № 9. P. 2022.)
Carenco S., Leyva-Perez A., Concepcion P., Boissiere C., Mezailles N., Sanchez C., Corma A. // Nano Today. 2012. V. 7. P. 21.
Liu Y., McCue A.J., Miao C., Feng J., Li D., Anderson J.A. // J. Catal. 2018. V. 364. P. 406.
Шмидт А.Ф., Курохтина А.А., Ларина Е.В. // Кинетика и катализ. 2019. Т. 60. № 5. С. 555. (Shmidt A.F., Kurokhtina A.A., Larina E.V. // Kinet. Catal. 2019. V. 60. № 5. P. 551.)
Stojewski M., Kowalska J., Jurczakowski R. // J. Phys. Chem. C. 2009. V. 113. № 9. P. 3707.
Николаев С.А., Занавескин Л.Н., Смирнов В.В., Аверьянов В.А., Занавескин К.Л. // Успехи химии. 2009. Т. 78. № 3. С. 248. (Nikolaev S.A., Zanaveskin L.N., Smirnov V.V., Averyanov V.A., Zanaveskin K.L. // Russ. Chem. Rev. 2009. V. 78. P. 231.)
Роберто Дж., Касерио М. Основы органической химии. Ч. 1. М.: Мир, 1968. 400 с.
Markov P.V., Mashkovsky I.S., Bragina G.O., Warna J., Gerasimov E.Yu., Bukhtiyarov V.I., Stakheev A.Yu., Murzin D.Yu. // Chem. Eng. J. 2019. V. 358. P. 520.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ