Кинетика и катализ, 2022, T. 63, № 3, стр. 309-319
Агрегационное поведение и каталитическое действие карбаматсодержащих ПАВ в водных средах
А. Б. Миргородская a, *, Р. А. Кушназарова a, Д. М. Кузнецов a, А. А. Тырышкина a, Л. Я. Захарова a
a Институт органической и физической химии им. А.Е. Арбузова ФИЦ Казанский научный центр РАН
420088 Казань, ул. Акад. Арбузова, 8, Россия
* E-mail: mirgoralla@mail.ru
Поступила в редакцию 01.10.2021
После доработки 30.10.2021
Принята к публикации 30.10.2021
- EDN: CQIYUE
- DOI: 10.31857/S0453881122030108
Аннотация
Методами кондуктометрии, спектрофотометрии, флуоресценции и динамического рассеяния света проведено исследование агрегационного поведения в воде новых гексадецильных катионных ПАВ с одним и двумя алкилкарбаматными фрагментами в головной группе, а также изучено их каталитическое действие в гидролитических процессах. В условиях варьирования структуры головной группы ПАВ и рН среды получены кинетические параметры щелочного гидролиза эфиров карбоновых кислот (п-нитрофенилацетата и п-нитрофенилкаприната). Показано, что каталитическое действие мицеллообразующих ПАВ с одним карбаматным фрагментом выше, чем у соответствующих дикарбаматных соединений, и уменьшается по мере роста длины алкильного заместителя в нем. Установлено, что карбаматные ПАВ, способные к образованию везикул, в большей степени ускоряют гидролиз исследуемых эфиров, чем их аналоги, образующие мицеллы: в случае соединения с децильным заместителем в карбаматном фрагменте наблюдаемое ускорение процесса может превышать два порядка.
ВВЕДЕНИЕ
Композиции на основе катионных поверхностно-активных веществ (ПАВ) находят широкое практическое применение в промышленности, сельском хозяйстве и медицине. Они успешно используются в качестве ингибиторов коррозии, моющих и смазочных жидкостей, супрамолекулярных катализаторов, антимикробных и дезинфицирующих агентов, солюбилизаторов и переносчиков лекарственных средств [1–5]. В основе их функциональной активности лежит способность ПАВ к образованию в растворах наноразмерных агрегатов, которые эффективно солюбилизируют гидрофобные соединения и влияют на их реакционную способность, встраиваются в биомембраны, связывают биологически активные вещества и обеспечивают их доставку в живые организмы [6, 7]. Направленный дизайн амфифильных молекул, функционализация их структуры введением заместителей, позволяющих подключать различные механизмы агрегации и связывания соединений-гостей, установление зависимостей структура–свойство – это те пути, которые помогут обеспечить высокий прикладной потенциал систем на основе ПАВ и послужат фундаментом для решения практически значимых задач.
Растворы катионных ПАВ, используемые в качестве реакционной среды, могут сильно влиять на свойства солюбилизированных реагентов, что позволяет направленно управлять скоростью, а в некоторых случаях и механизмом проходящих в них процессов [8–12]. Морфология агрегатов, образующихся в растворах ПАВ, возможность структурных перестроек, индуцируемых изменением концентрации или внешними условиями, оказывают существенное влияние на их функциональные свойства [13, 14].
Катионные ПАВ традиционно применяются в мицеллярном катализе для гидролитического расщепления сложноэфирных связей [15–18]. Каталитический эффект обусловлен нековалентным связыванием реагентов мицеллами, главным образом, за счет гидрофобных и электростатических взаимодействий, приводящих к концентрированию реагирующих частиц в дисперсной фазе и к смене их микроокружения. Наблюдаемое ускорение процесса сильно зависит от строения ПАВ, от наличия в его структуре фрагментов, позволяющих задействовать различные механизмы связывания реагентов.
В настоящей работе продолжен цикл наших исследований катионных ПАВ, содержащих карбаматный фрагмент в головной группе, которые способны к образованию агрегатов различной морфологии в низком концентрационном диапазоне и отличаются высоким солюбилизационным и мембранотропным действием [19–22]. Впервые рассмотрена возможность использования растворов ПАВ этого класса в качестве среды для проведения гидролитических процессов. С целью выявления влияния структуры гексадецильных моно- и дикарбаматных ПАВ на способность оказывать каталитическое действие проведен сопоставительный анализ их агрегационного поведения в водных растворах и кинетических данных, характеризующих протекание в них реакции щелочного гидролиза эфиров карбоновых кислот.
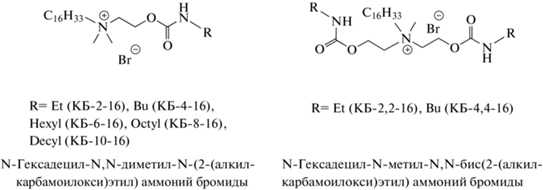
В круг тестированных объектов наряду с новыми ПАВ вошли также некоторые соединения, полученные нами ранее. Структурные формулы исследуемых ПАВ представлены ниже:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез карбаматсодержащих соединений осуществляли путем взаимодействия диметил(2-гидроксиэтил)гексадециламмоний бромида или метил-ди-(2-гидроксиэтил)гексадециламмоний бромида с алкилизоцианатами с применением диазобициклооктана (ДАБКО) в качестве катализатора по методике [19, 21]. Структура соединений подтверждена методами ИК-, ЯМР-спектроскопии и масс-спектрометрии, а также данными элементного анализа. В работе использовали коммерческие образцы п-нитрофенола, п-нитрофенилацетата, п-нитрофенилкаприната, пирена, цетилтриметиламмоний бромида фирмы “Sigma-Aldrich”. Для приготовления растворов применяли воду, очищенную на установке Direct-Q 5 UV (“Merck Millipore”, Франция) (рН 6.8–7.0, χ = 2–3 мкСм/см). Для кинетических экспериментов использовали буферные растворы на основе тетрабората натрия (рН 9.2) с добавлением гидроокиси натрия (до рН 10.0) или соляной кислоты (до рН 8.5). Значения рН исследуемых растворов контролировали с помощью лабораторного рН-метра Hanna 211 (“Hanna”, Германия). Удельную электропроводность образцов измеряли кондуктометром Inolab Cond 720 (“WTW”, Германия).
Размеры полученных агрегатов в растворах определяли на фотонном корреляционном спектрометре динамического и электрофоретического рассеяния света Malvern ZetaSizer Nano (“Malvern Instruments”, Великобритания). Источником лазерного излучения служил He-Ne газовый лазер мощностью 10 мВт и длиной волны 633 нм. Угол рассеяния света составлял 173°. Время накопления импульсов – 5–8 мин. Анализ сигналов осуществляли одноплатным многоканальным коррелятором, сопряженным с IBM PC совместимым компьютером, снабженным пакетом программ для оценки эффективного гидродинамического радиуса диспергированных частиц.
Поверхностный потенциал агрегатов оценивали спектрофотометрическим методом, исследуя изменение кислотно-основных свойств индикатора (п-нитрофенола) в зависимости от концентрации ПАВ в соответствии с [16, 23]. Спектральные измерения проводили с помощью спектрофотометра Specord 250 Plus (“Analytik Jena”, Германия) с использованием кварцевых кювет с толщиной поглощающего слоя 1 см при температуре 25°С.
Наблюдаемое значение рKа, набл вычисляли по уравнению Хендерсона–Хассельбаха (1):
(1)
${\text{p}}{{K}_{{{\text{a,набл}}}}} = {\text{pH}} + \log \frac{{\left[ {{\text{фенол}}} \right]}}{{\left[ {{\text{фенолят}}} \right]}}.$В качестве константы диссоциации п-нитрофенола в мицеллярной фазе (Ka,м) принимали значение наблюдаемой константы диссоциации при СПАВ → ∞.
Полученные значения рKа,м связаны с поверхностным потенциалом мицеллы уравнением (2):
(2)
${\text{p}}{{K}_{{\text{a}}}}_{{{\text{,м}}}} = {\text{p}}{{K}_{{\text{a}}}}_{{{\text{,0}}}}--F\Psi {\text{/}}2.303RT,$Флуоресцентные спектры пирена при концентрации 1 × 10–6 моль/л в растворах ПАВ были записаны с помощью спектрофотометра Cary Eclipse (“Varian”, США) при 25°С. Спектры излучения регистрировали в диапазоне 350–500 нм, при этом возбуждение образца происходило при длине волны 335 нм, толщина поглощающего слоя составляла 1 см, скорость сканирования – 120 нм/мин.
Кинетику щелочного гидролиза эфиров карбоновых кислот исследовали спектрофотометрическим методом на приборе Specord-250 Plus (“Analytik Jena”, (Германия) с использованием термостатируемых кварцевых кювет. За протеканием процесса следили по изменению оптической плотности растворов при длине волны 400 нм, отвечающей максимуму поглощения п‑нитрофенолят-аниона. Начальная концентрация субстрата составляла (2–5) × 10–5 моль/л, степень превращения ‒ более 90%. Наблюдаемые константы скорости (kнабл) определяли из зависимости ln(D∞ ‒ D) = ‒kнаблt + const, где D и D∞ ‒ оптическая плотность раствора в момент времени t и по окончании реакции соответственно. Значения kнабл рассчитывали методом наименьших квадратов.
Погрешность всех измерений не превышала 4%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Первый этап исследований свойств карбаматных ПАВ традиционно включал изучение их поведения в водных растворах, установление концентрационных и температурных границ агрегации, предопределяющих область их функциональной активности. Методами кондуктометрии найдены значения критической концентрации агрегации (ККА) и температуры Крафта (ТКр). В качестве примера на рис. 1 представлены типичные зависимости, позволяющие определить величину ККА исследуемых соединений. Полученные результаты для новых ПАВ приведены в табл. 1 в сопоставлении с данными для соединений, синтезированных нами ранее [15, 19]. В случае, когда в растворах ПАВ образуются мицеллы, термин ККА заменяется более частным определением – критическая концентрация мицеллообразования (ККМ).
Рис. 1.
Концентрационная зависимость удельной электропроводности (χ) водных растворов карбаматсодержащих ПАВ при Т = 25°С.
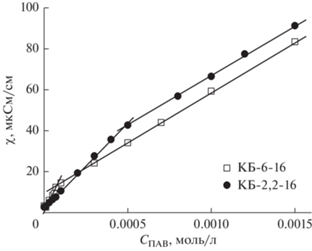
Таблица 1.
Агрегационные характеристики моно- и дикарбаматных гексадецильных ПАВ: ККМ, степень связывания противоионов (β) и точки Крафта (ТКр) исследуемых карбаматных ПАВ
| ПАВ | ККМ × 10–3, моль/л | β |
ТКр |
|
|---|---|---|---|---|
| кондуктометрия | флуориметрия | |||
| КБ-2-16 [19] | 0.62 | 0.71 | 0.54 | 15 |
| КБ-4-16 [19] | 0.32 | 0.34 | 0.51 | 10 |
| КБ-6-16 | 0.07 | 0.10 | 0.51 | 19 |
| КБ-8-16 | 0.05* | 0.06* | 0.36 | ‒ |
| КБ-10-16 | 0.04* | 0.05* | 0.41 | ‒ |
| КБ-2,2-16 | 0.55 | 0.52 | 0.57 | 16 |
| КБ-4,4-16 | 0.13 | 0.10 | 0.45 | 24 |
| ЦТАБ | 0.90 | ‒ | 0.74 | 25 |
Величина ККМ уменьшается по мере роста длины алкильного радикала в карбаматном фрагменте, а также при переходе от моно- к дикарбаматным производным. Найденные для этих соединений значения существенно ниже, чем ККМ их триметиламмониевого аналога – цетилтриметиламмоний бромида (ЦТАБ). Это, вероятно, связано со способностью к образованию водородных связей карбаматными соединениями [24], что облегчает процессы их самоорганизации в водных растворах. Точка Крафта карбаматных ПАВ КБ-2-16, КБ-4-16 и КБ-2,2-16 лежит в диапазоне ниже 15°С (табл. 1), что указывает на возможность работы с этими соединениями в достаточно широком температурном интервале. Соединения КБ-6-16 и КБ-4,4-16 имеют более высокий температурный порог мицеллообразования, однако способны к агрегации при существенно меньших концентрациях, чем их аналоги с коротким алкильным заместителем в головной группе. Ограниченная растворимость соединений КБ-8-16 и КБ-10-16 в воде не позволила достоверно найти для них значения ТКр.
Из концентрационных зависимостей электропроводности карбаматных ПАВ (рис. 1) была рассчитана степень связывания противоионов (β) мицеллами: β = 1 – α, где α – степень диссоциации, определяемая как отношение угловых коэффициентов на линейных участках до и после точки изменения их наклона (табл. 1). Значения β для исследованных ПАВ мало отличаются между собой, однако они существенно ниже, чем в случае референтного соединения – ЦТАБ. Это позволяет предположить, что для карбаматных ПАВ противоионы в меньшей степени компенсируют заряд головных групп, что должно найти отражение в более низких значениях чисел агрегации.
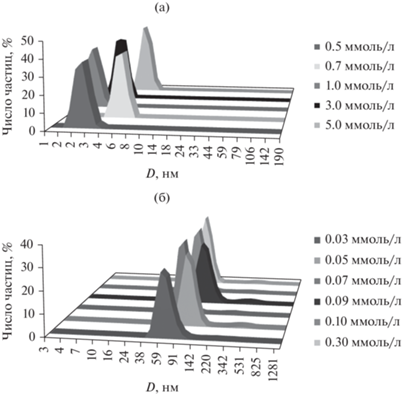
Методом динамического рассеяния света показано, что монокарбаматные ПАВ КБ-2-16, КБ-4-16 и КБ-6-16 в водных растворах выше ККМ образуют агрегаты с гидродинамическим диаметром 3–10 нм, что, как правило, отвечает формированию сферических мицелл (рис. 2а). Аналогичные результаты получены и для дикарбаматных ПАВ КБ-2,2-16, КБ-4,4-16. В случае КБ-10-16 в растворах зафиксированы более крупные агрегаты. Их размер в широком диапазоне концентраций практически не изменяется и составляет 80–110 нм, при этом индекс полидисперсности лежит в интервале от 0.2 до 0.3 (рис. 2б). Размер агрегатов около 100 нм, не зависящий от концентрации ПАВ, является одним из характерных признаков появления в растворах везикул. Ранее спонтанное формирование везикул было зафиксировано нами и для других карбаматных ПАВ с додецильным радикалом в головной группе, а в случае КБ-8-16 было показано, что изменение концентрации этого соединения может инициировать переход от мицелл к везикулам [21]. Можно ожидать, что ПАВ одного семейства, образующие в растворах агрегаты различной морфологии, будут проявлять различное каталитическое действие при их использовании в качестве реакционной среды.
Рис. 2.
Распределение частиц по размерам (усредненное по числу частиц) в растворах КБ-2,2-16 (а) и КБ-10-16 (б).
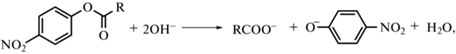
Растворы ПАВ с карбаматным фрагментом были испытаны нами в процессах щелочного гидролиза эфиров карбоновых кислот. Кинетические эксперименты по исследованию гидролиза п-нитрофенилацетата (ПНФА) и п-нитрофенилкаприната (ПНФК) проводили в условиях изменения рН среды, структуры и концентрации ПАВ. Схема изучаемого процесса представлена ниже:
где R= CH3 (ПНФА); C9H19 (ПНФК).Основными факторами, отвечающими за каталитическое действие ПАВ в растворах и общими для мицелл и везикул, являются концентрирование реагентов в зоне реакционного контакта и смена их микроокружения. В процессах щелочного гидролиза фактор концентрирования гидроксид-ионов у положительно заряженной поверхности агрегата зависит, главным образом, от его поверхностного потенциала, тогда как полярность микроокружения – от локализации субстрата и гидрофобности внутреннего ядра. В мицеллярных растворах эти два параметра часто определяют методом спектральных зондов. В первом случае используется п-нитрофенол, значение pKa которого существенно меняется из-за электростатических взаимодействий с мицеллой и избирательной сорбции у ее поверхности анионной формы зонда [23], во втором случае – гидрофобный флуоресцентный зонд пирен, тонко реагирующий на изменение микроокружения в процессе его солюбилизации мицеллами. Подходы, применяемые для характеристики мицеллярных систем, в настоящей работе распространены и на растворы ПАВ, где наблюдается образование везикул. Спектрофотометрическим методом, подробно описанным в экспериментальной части, по аналогии с [23] были найдены значения pKa,мп-нитрофенола в растворах исследуемых карбаматсодержащих ПАВ и с помощью уравнения (2) определены значения поверхностного потенциала агрегатов (табл. 2).
Таблица 2.
Значения pKa,мп-нитрофенола в растворах карбаматных ПАВ и поверхностного потенциала (Ψ) агрегатов исследуемых соединений
| ПАВ | pKa,м | Ψ, мВ |
|---|---|---|
| КБ-2-16 | 5.90 | 100 |
| КБ-4-16 | 5.81 | 106 |
| КБ-6-16 | 6.20 | 83 |
| КБ-8-16 | 6.30 | 77 |
| КБ-10-16 | 6.2 | 83 |
| КБ-2,2-16 | 6.08 | 90 |
| КБ-4,4-16 | 6.30 | 77 |
| ЦТАБ | ‒ | 125 [23] |
Полученные значения Ψ карбаматных ПАВ оказались ниже, чем у нефункционализированного аналога – ЦТАБ, при этом увеличение числа карбаматных фрагментов в головной группе ПАВ приводит к большему снижению поверхностного потенциала. Это должно уменьшать способность карбаматных ПАВ концентрировать гидроксид-ион у поверхности агрегатов и ухудшать их каталитическое действие в процессах щелочного гидролиза по сравнению с мицеллярными растворами ЦТАБ.
Для характеристики микрополярности агрегатов нами были зарегистрированы спектры флуоресценции пирена в растворах карбаматсодержащих ПАВ в условиях варьирования концентрации последних. Параметром, позволяющим оценить влияние среды, служит соотношение интенсивности первого 373 нм (I1) и третьего 384 нм (I3) пиков этого соединения [24–26], которое чувствительно к полярности в зоне локализации зонда. Для пирена, растворенного в воде, величина I1/I3 равна 1.6. Значение I1/I3 < 0.6 отмечается для случаев, когда зонд растворен в неполярных растворителях. Если пирен находится в поверхностном слое мицелл, величина I1/I3 лежит в пределах 1.0–1.4 [26]. Ход зависимости I1/I3 = f(CПАВ) (рис. 3) отражает процесс формирования агрегатов в растворах и характеризуется двумя участками с различным наклоном, точка пересечения которых отвечает значению ККА (или ККМ). Величины, полученные методом флуоресценции, хорошо совпадают с данными кондуктометрии (табл. 1).
Рис. 3.
Зависимость отношения интенсивностей флуоресценции первого (373 нм) и третьего (384 нм) колебательных пиков пирена от концентрации карбаматсодержащих ПАВ, Т = 25°С.
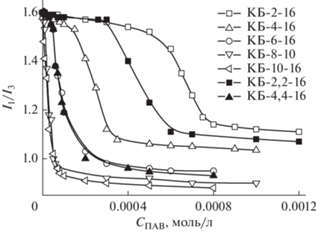
Постепенное снижение значения I1/I3 для монокарбаматных ПАВ, наблюдаемое по мере роста длины алкильного заместителя в головной группе, а также ее падение при переходе к дикарбаматным производным отражает уменьшение полярности микроокружения пирена, солюбилизированного мицеллами (или везикулами). Подобные закономерности изменения полярности агрегатов могут оказать влияние на любое другое солюбилизированное гидрофобное соединение, в частности, на эфиры карбоновых кислот, чью гидролитическую устойчивость предполагалось исследовать в настоящей работе. Можно ожидать, что при переходе от растворов более гидрофильных ПАВ к более гидрофобным будет снижаться полярность микроокружения сложного эфира, что приведет к ослаблению его реакционной способности в процессах нуклеофильного замещения.
Таким образом, характер изменения поверхностного потенциала и микрополярности агрегатов позволяет ожидать, что ПАВ с одним карбаматным фрагментом будут более эффективными катализаторами процессов нуклеофильного замещения, чем дикарбаматные соединения, при этом их действие окажется ниже, чем в случае ЦТАБ.
Результаты кинетического эксперимента представлены в виде графиков, отражающих изменение значений наблюдаемых констант скорости (kнабл) гидролиза эфиров карбоновых кислот от концентрации ПАВ (рис. 4 и 5). Известно, что в водных растворах ПАВ, используемых в качестве реакционной среды, реакция может параллельно протекать как в дисперсной фазе, так и в дисперсионной среде. В зависимости от свойств реагентов может меняться вклад каждого из процессов в наблюдаемую константу скорости. Для ПНФА, являющегося более гидрофильным субстратом, скорость гидролиза в водной среде довольно велика, а ускорения, связанные с присутствием ПАВ, не столь ярко выражены, чтобы делать выводы об особенностях влияния их структуры на реакционную способность этого эфира. Однако на основании полученных кинетических данных (рис. 4а) уже можно говорить о том, что монокарбаматные ПАВ активнее дикарбаматных, а соединение КБ-10-16 проявляет “ранний” каталитический эффект, обеспечивая максимальное ускорение процесса в концентрации 1 × 10–3 моль/л.
Рис. 4.
Концентрационные зависимости наблюдаемой константы скорости гидролиза ПНФА (а) и ПНФК (б) в растворах карбаматсодержащих ПАВ, рН 9.2, Т = 25°С.
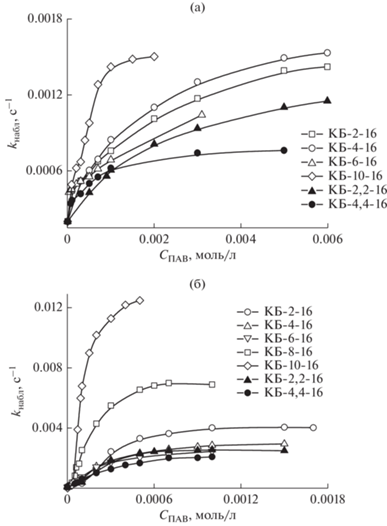
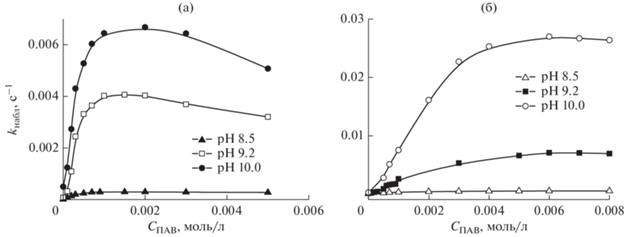
Рис. 5.
Концентрационные зависимости наблюдаемой константы скорости гидролиза ПНФК в водных растворах КБ-2-16 (а) и КБ-8-16 (б) при различных рН, Т = 25°С.
Иная картина наблюдается для ПНФК (рис. 4б), гидролитическая устойчивость которого в существенно большей степени зависит от концентрации и структуры ПАВ. Сильное влияние ПАВ на свойства этого мицеллообразующего субстрата объясняется образованием смешанных агрегатов, в которых ПНФК проявляет повышенную реакционную способность по сравнению с индивидуальными растворами [27]. Как и ожидалось, ПАВ с одним карбаматным фрагментом оказывают большее каталитическое действие, чем соответствующие дизамещенные аналоги. Для мицеллообразующих ПАВ происходит падение каталитического эффекта по мере увеличения длины алкильного заместителя в карбаматном фрагменте, однако ПАВ, способные к образованию везикул, обнаруживают аномально высокую каталитическую активность. Так, например, при концентрации ПАВ 0.5 × 10–3 моль/л и рН 9.2 значение kнабл для КБ-2-16 составляет 0.003 с–1, а при переходе в тех же условиях к КБ-8-16 и КБ-10-16 оно возрастает до 0.007 и 0.011 с–1 соответственно.
Полученные зависимости для всех исследованных ПАВ имеют типичный вид для мицеллярно-катализируемых процессов ‒ довольно резкое увеличение константы скорости с последующим выходом на плато (рис. 4 и 5), что позволяет применить для анализа кинетических данных уравнение псевдофазной модели мицеллярного катализа (уравнение (3)) [28]:
(3)
${{k}_{{{\text{набл}}}}} = \frac{{{{k}_{{\text{m}}}}{{K}_{{\text{S}}}}{{C}_{{{\text{ПАВ}}}}} + {{k}_{0}}}}{{1 + {{K}_{{\text{S}}}}{{C}_{{{\text{ПАВ}}}}}}},$На основании полученных данных можно сделать вывод о том, что, хотя мицеллообразующие монокарбаматные ПАВ почти также связывают субстраты, как и их дикарбаматные аналоги (сравнить значения KS в табл. 3), они значительно эффективнее в реакциях щелочного гидролиза сложных эфиров. Вероятно, это обусловлено их бóльшим поверхностным потенциалом, обеспечивающим концентрирование гидроксид-ионов в зоне реакционного контакта. В растворах, где возможно образование везикул (КБ-8-16 и КБ-10-16), в случае ПНФК наблюдается более сильное связывание субстрата, что, скорее всего, является одной из причин высокого каталитического эффекта. Прослеживается выраженная субстратная специфичность процесса: для ПНФА ускорение в присутствии ПАВ варьируется от 6 до 9 раз, тогда как для ПНФК превышает два порядка.
Таблица 3.
Результаты количественного анализа кинетических данных для гидролиза эфиров карбоновых кислот в растворах исследуемых катионных ПАВ с использованием уравнения (3)
| Система | Субстрат | рН | km, с–1 | КS, л/моль | ККМ, моль/л | km/k0* |
|---|---|---|---|---|---|---|
| КБ-2-16 | ПНФА | 9.2 | 0.00161 | 996 | 2.22 × 10–4 | 8 |
| КБ-4-16 | 0.00180 | 1190 | 1.84 × 10–4 | 9 | ||
| КБ-10-16 | 0.00182 | 3390 | 1.87 × 10–4 | 9 | ||
| КБ-2,2-16 | 0.00122 | 1060 | 3.77 × 10–4 | 6 | ||
| ЦТАБ | 0.00010 | 880 | 5.30 ×10–4 | 5 | ||
| КБ-2-16 | ПНФК | 8.5 | 0.00034 | 5770 | 6.14 × 10–5 | 34 |
| 9.2 | 0.00465 | 5290 | 9.05 ×10–5 | 58 | ||
| 10.0 | 0.00714 | 6920 | 7.64 × 10–5 | 36 | ||
| КБ-4-16 | ПНФК | 9.2 | 0.00337 | 5200 | 6.52 × 10–5 | 42 |
| 10.0 | 0.00710 | 6500 | 1.68 × 10–5 | 36 | ||
| КБ-6-16 | ПНФК | 9.2 | 0.00297 | 5650 | 2.25 × 10–5 | 37 |
| КБ-8-16 | ПНФК | 8.5 | 0.00055 | 9610 | 1.44 × 10–5 | 55 |
| 9.2 | 0.00810 | 10 800 | 9.8 × 10–5 | 101 | ||
| 10.0 | 0.03250 | 9120 | 7.34 × 10–5 | 162 | ||
| КБ-10-16 | ПНФК | 9.2 | 0.01410 | 17 000 | 4.74 × 10–5 | 176 |
| КБ-2,2-16 | ПНФК | 9.2 | 0.00299 | 7450 | 8.36 × 10–5 | 37 |
| КБ-4,4-16 | ПНФК | 9.2 | 0.00213 | 5950 | 4.43 × 10–5 | 27 |
| ЦТАБ | ПНФК | 9.2 | 0.00235 | 4440 | 1.86 × 10–4 | 29 |
Несколько неожиданным было то, что каталитическое действие карбаматсодержащих ПАВ оказалось сильнее, чем у их нефункционализированного аналога ЦТАБ, хотя константы связывания субстрата для них близки, а поверхностный потенциал ниже. Можно предположить, что наличие карбаматных фрагментов в исследуемых ПАВ приводит к возникновению водородных связей между амфифилами и солюбилизированным сложным эфиром, что вызывает перераспределение электронной плотности в молекуле субстрата, увеличивает его реакционную способность и тем самым ускоряет изучаемый процесс. Подобные “аномальные” случаи влияния функционализированных ПАВ на реакционную способность органических соединений наблюдались и ранее [29].
Найденные из кинетического эксперимента значения ККМ (табл. 3) несколько ниже, чем определенные кондуктометрическим методом. В большей степени это прослеживается в случае ПНФК и может быть связанно с возможностью формирования смешанных агрегатов с участием ПАВ и мицеллообразующего субстрата. Еще одной вероятной причиной меньших значений ККМ может быть присутствие щелочи или буферных солей в реакционном растворе, которые способны выступать в качестве противоионов и влиять на процессы мицеллообразования.
Важнейшим фактором, позволяющим воздействовать на скорость реакции в растворах ПАВ, является изменение рН среды. Отклик на изменение этого параметра может зависеть от морфологии агрегатов, существующих в растворе. В связи с этим была изучена кинетика гидролиза ПНФК в растворах КБ-2-16 и КБ-8-16 при варьировании рН (рис. 5, табл. 3).
Установлено, что константа связывания субстрата в случае обоих ПАВ не меняется в исследуемом диапазоне рН (от 8.5 до 10.0), тогда как наблюдаемое ускорение реакции, описываемое соотношением km/k0, зависит от морфологии агрегатов, образующихся в растворе. Так, в случае мицеллообразующего ПАВ КБ-2-16 при гидролизе ПНФК этот показатель остается практически неизменным при всех рН, тогда как в растворах склонного к образованию везикул КБ-8-16 он увеличивается по мере роста щелочности среды. Переходить в область более высоких значений рН мы не стали, так как известно, что соединения с карбаматным фрагментом сами могут гидролитически расщепляться до соответствующей карбаминовой кислоты и четвертичных аммониевых спиртов. Этот процесс быстро протекает под действием ферментов [30]. В лабораторных условиях в отсутствие ферментов процесс гидролиза идет с заметной скоростью лишь в сильно щелочных средах. Так, потенциометрическим методом, фиксируя выделение кислоты в ходе расщепления, на примере КБ-4-16 было показано, что для обеспечения конверсии более 50% его следует нагревать при 70°С в 0.1 н растворе гидроокиси натрия свыше 5 ч. В более мягких условиях щелочного расщепления исследуемых ПАВ в течение длительного времени обнаружить не удалось. Кроме того, мы определяли константу скорости гидролиза ПНФК при рН 9.2 в растворах КБ-4-16, свежеприготовленных и хранящихся сутки, неделю и месяц. Расхождения в полученных значениях наблюдаемой константы скорости процесса было незначительным, лежало в пределах ошибки измерений и не отражало каких-либо систематических тенденций, связанных с нестабильностью ПАВ.
ЗАКЛЮЧЕНИЕ
Таким образом, в результате проделанного исследования расширена научная база, характеризующая свойства растворов катионных карбаматных ПАВ. Установлено что изучаемые новые гексадецильные производные этого класса ПАВ обладают низким порогом агрегации, который снижается по мере роста длины алкильного радикала в карбаматном фрагменте, а также при переходе от моно- к дикарбаматным ПАВ. Выявлена значительная каталитическая активность этих соединений в процессах гидролиза сложных эфиров, которую можно направленно регулировать, варьируя природу ПАВ, а также рН среды. Показано, что карбаматные ПАВ, способные к образованию везикул, в большей степени ускоряют гидролиз исследуемых эфиров, чем их аналоги, образующие мицеллы. Полученные характеристики могут служить основой при создании эффективных нанореакторов, позволяющих проводить химические процессы в водных растворах.
Список литературы
Sanders L. Cationic surfactants: properties, uses and toxicity. Nova Science Publishers Inc., UK, 2016.
Devínsky F., Pisárčik M., Lukáč M. Cationic amphiphiles: Self-assembling systems for biomedicine and biopharmacy. Nova Science Publishers Inc., UK, 2017.
Sar P., Ghosh A., Scarso A., Saha B. // Res. Chem. Intermed. 2019. V. 45. P. 6021. https://doi.org/10.1007/s11164-019-04017-6
Morsy S.M.I. // Int. J. Curr. Microbiol. Appl. Sci. 2014. V. 3. I. 5. P. 237.
Zhu Y., Free M.L., Woollam R., Durnie W. // Prog. Mater. Sci. 2017. V. 90. P. 159. https://doi.org/10.1016/j.pmatsci.2017.07.006
Zakharova L.Ya., Mirgorodskaya A.B., Zhiltsova E.P., Kudryavtseva L.A., Konovalov A.I. / Molecular Encapsulation: Organic Reactions in Constrained Systems. Eds. Brinker U.H., Mieusset J.-L. Chichester. John Willey and Sons, 2010. P. 397.
Rangel-Yagui C.O., Pessoa A., Jr., Tavares L.C. // J. Pharm. Pharm. Sci. 2005. V. 8. P. 147.
Banerjee M., Panjikar P.C., Bhutia Z.T., Bhosle A.A., Chatterjee A. // Tetrahedron. 2021. V. 88. P. 132142. https://doi.org/10.1016/j.tet.2021.132142
Aboudiab B., Tehrani-Bagha A.R., Patra D. // Colloids Surf. A. 2020. V. 592. P. 124602.
Lorenzetto A.T., Berton G., Fabris F., Scarso A. // Catal. Sci. Technol. 2020. V. 10. P. 4492. https://doi.org/10.1039/D0CY01062F
Shen T., Zhou Sh., Ruan J., Chen X., Liu X., Ge X., Qian Ch. // Adv. Colloid Interface Sci. 2021. V. 287. P. 102299. https://doi.org/10.1016/j.cis.2020.102299
Schmidt F., Zehner B., Korth W., Jess A., Cokoja M. // Catal. Sci. Technol. 2020. V. 10. P. 4448. https://doi.org/10.1039/D0CY00673D
Buurma N.J. // Curr. Opin. Colloid Interface Sci. 2017. V. 32. P. 69. https://doi.org/10.1016/j.cocis.2017.10.005
Bélières M., Chouini-Lalanne N., Déjugnat C. // RSC Adv. 2015. V. 5. P. 35830. https://doi.org/10.1039/C5RA02853A
Al-Shamary M.N., Al-Lohedan H.A., Rafiquee M.Z.A., El-Ablack F., Issa Z.A. // J. Saudi Chem. Soc. 2017. V. 21. P. S193. https://doi.org/10.1016/j.jscs.2014.01.002
Миргородская А.Б., Валеева Ф.Г., Кушназарова Р.А., Лукашенко С.С., Захарова Л.Я. // Кинетика и катализ. 2020. Т. 61. № 6. С. 819. (Mirgorodskaya A.B., Valeeva F.G., Kushnazarova R.A., Lukashenko S.S., Zakharova L.Y. // Kinet. Catal. 2021. V. 62. P. 82.)https://doi.org/10.1134/S0023158420060099
Muff J., MacKinnon L., Durant N.D., Bennedsen L.F., Rügge K., Bondgaard M., Pennell K.D. // Environ. Sci. Pollut. Res. 2020. V. 27. P. 3428. https://doi.org/10.1007/s11356-019-07152-0
Жильцова Е.П., Ибатуллина М.Р., Лукашенко С.С., Низамеев И.Р., Кадиров М.К., Захарова Л.Я. // Кинетика и катализ. 2020. Т. 61. № 2. С. 247. (Zhil’tsova E.P., Ibatullina M.R., Lukashenko S.S., Kadirov M.K., Zakharova L.Y. // Kinet. Catal. 2020. V. 61. P. 269. )https://doi.org/10.1134/S0023158420010140
Mirgorodskaya A.B., Kushnazarova R.A., Lukashenko S.S., Voloshina A.D., Lenina O.A, Zakharova L.Ya., Sinyashin O.G. // J. Mol. Liq. 2018. V. 269. P. 203. https://doi.org/10.1016/j.molliq.2018.08.007
Mirgorodskaya A.B., Kushnazarova R.A., Lukashenko S.S., Zakharova L.Ya. // J. Mol. Liq. 2019. V. 292. P. 111407. https://doi.org/10.1016/j.molliq.2019.111407
Kushnazarova R.A., Mirgorodskaya A.B., Lukashenko S.S., Voloshina A.D., Sapunova A.S., Nizameev I.R., Kadirov M.K., Zakharova L.Ya. // J. Mol. Liq. 2020. V. 318. P. 113894. https://doi.org/10.1016/j.molliq.2020.113894
Кушназарова Р.А., Миргородская А.Б., Захарова Л.Я. // Изв. Акад. Наук. Сер. Хим. 2021. № 3. С. 585. (Kushnazarova R.A., Mirgorodskaya A.B., Zakharova L.Y. // Russ. Chem. Bull. 2021. V. 70. P. 585. )https://doi.org/10.1007/s11172-021-3129-z
Mchedlov-Petrossyan N.O. // Pure Appl. Chem. 2008. V. 80. P. 1459.
Bertrand A., Lortie F., Bernard J. // Macromol. Rapid Commun. 2012. V. 33. P. 2062.
Piñeiro L., Novo M., Al-Soufi W. // Adv. Colloid Interface Sci. 2015. V. 215. P. 1.
Lakowicz J.R. Principles of Fluorescence Spectroscopy. N.Y.: Springer, 2006.
Menger F.M., Portnoy C.T. // J. Am. Chem. Soc. 1968. V. 90. P. 1875.
Березин И.В., Мартинек К., Яцимирский А.К. // Успехи химии. 1973. Т. 42. № 10. С. 1729.
Kushnazarova R.A., Mirgorodskaya A.B., Kuznetsov D.M., Tyryshkina A.A., Voloshina A.D., Gumerova S.K., Lenina O.A., Nikitin E.N., Zakharova L.Ya. // J. Mol. Liq. 2021. V. 336. 116318. https://doi.org/10.1016/j.molliq.2021.116318
Mishra S., Pang Sh., Zhang W., Lin Z., Bhatt P., Chen Sh. // Chemosphere. 2021. V. 279. P. 130500. https://doi.org/10.1016/j.chemosphere.2021.130500
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ