Кинетика и катализ, 2022, T. 63, № 3, стр. 294-308
Изучение фотокаталитических и фотогальванических свойств фотокатализаторов на основе нитрида углерода и фосфидов и фосфатов кобальта
А. В. Журенок a, Д. В. Марковская a, *, К. О. Потапенко a, С. В. Черепанова a, А. А. Сараев a, Е. Ю. Герасимов a, Е. А. Козлова a
a ФГБУН ФИЦ Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: madiva@catalysis.ru
Поступила в редакцию 02.12.2021
После доработки 20.12.2021
Принята к публикации 21.12.2021
- EDN: LWQNXZ
- DOI: 10.31857/S0453881122030145
Аннотация
В ходе работы на поверхность нитрида углерода был нанесен сокатализатор тремя различными способами: термическим фосфорилированием, гидротермальным методом и фотохимическим восстановлением. В первом случае сокатализатор представлял собой смесь фосфида и ортофосфата кобальта, по методикам гидротермального и фотохимического синтезов удалось получить ортофосфат кобальта. Дополнительно был синтезирован образец путем гидротермальной обработки предварительно приготовленных нитрида углерода и фосфида кобальта. Приготовленные образцы были изучены комплексом физико-химических методов: рентгенофазовым анализом (РФА), просвечивающей электронной микроскопией (ПЭМ), рентгеновской фотоэлектронной спектроскопией (РФЭС), спектроскопией диффузного отражения. Все синтезированные фотокатализаторы исследовали в реакции фотокаталитического выделения водорода из водно-щелочного раствора триэтаноламина и в фотоэлектрохимической ячейке, содержащей раствор полисульфида натрия. Было показано, что самые высокие показатели целевых характеристик достигаются при использовании смеси фосфида и ортофосфата кобальта по сравнению с ортофосфатом кобальта и нитридом углерода. Максимальная величина каталитической активности была 156 мкмоль ч–1 г–1, что сопоставимо с активностью платинированного нитрида углерода. Наибольшая плотность тока короткого замыкания, полученная при применении фотоэлектрода с фосфидом и фосфатом кобальта, составила 2.4 мА/см2.
ВВЕДЕНИЕ
Одной из важнейших задач современной альтернативной энергетики является разработка материалов, позволяющих эффективно конвертировать энергию солнечного излучения в другие виды энергии [1]. Данное направление достаточно перспективно, поскольку энергия Солнца на несколько порядков превышает энергетические потребности человечества. В настоящее время широко развиваются два научных направления – фотокатализ [1–5], дающий возможность получать химические соединения, например, водород, энергоемкое топливо, и генерирование электрического тока в солнечных элементах и фотоэлектрохимических ячейках [1].
В качестве материалов для преобразования энергии солнечного излучения часто используют полупроводники. Первыми типами катализаторов, применяемых для процессов фотокаталитического выделения водорода под действием видимого излучения, были системы на основе диоксида титана и титанатов, которые сенсибилизировали различными способами [6], и халькогениды переходных металлов [7–9]. В 2000-х гг. начинается активное исследование группы углеродсодержащих материалов для фотокаталитических и фотоэлектрохимических приложений. Особое внимание начали уделять графитоподобному нитриду углерода. Этот материал является термически стабильным, устойчивым к действию кислот и щелочей. Кроме того, положение зоны проводимости позволяет предположить наличие сильной восстановительной способности данного образца [10, 11]. Тем не менее, как и для многих других полупроводников, практическое применение нитрида углерода ограничено высокой скоростью рекомбинации фотогенерированных электронов и дырок. Для уменьшения скорости рекомбинации носителей зарядов и увеличения каталитической активности g-C3N4 на поверхность фотокатализаторов наносят модифицирующие добавки. Наиболее эффективными среди них являются металлы платиновой группы [12], использование которых ограничено значительной стоимостью реагентов. Равноценной заменой этим металлам могут быть вещества с металлоподобным строением, среди которых особое внимание уделяют фосфидам переходных металлов, например, кобальту [13]. Известно, что соединения с более высокими степенями окисления фосфора – например, ортофосфат кобальта [14] или гидроксофосфат кобальта [15] – также обладают способностью повышать фотокаталитическую активность. Закономерно возникает вопрос: какая из этих кобальтовых солей фосфора позволяет с наибольшей эффективностью преобразовывать энергию света в электричество либо в энергию химических связей? Изменится ли каталитическая активность, если на поверхность фотокатализатора нанести одновременно фосфид и ортофосфат кобальта? Сохранятся ли полученные закономерности для фотокаталитического выделения водорода в случае генерирования электрического тока? Изучению этих вопросов посвящена настоящая работа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез фотокатализаторов
Нитрид углерода приготовили путем термической поликонденсации меламина при 600°С в течение 2 ч [16]. Сокатализатор на основе фосфида или фосфата кобальта наносили на поверхность нитрида углерода тремя различными способами: методом термического фосфорилирования [17], гидротермальным методом [18] и методом фотохимического восстановления [19]. В первом случае на поверхность графитоподобного нитрида углерода методом осаждения предварительно наносили 1.03 мас. % гидроксида кобальта. Для этого 396 мг нитрида углерода диспергировали в 10 мл дистиллированной воды, добавляли по каплям 444 мкл 0.1 М раствора хлорида кобальта, перемешали 15 мин, прикапывали 888 мкл 0.1 М раствора гидроксида натрия, перемешивали 20 мин, промывали осадок путем центрифугирования и высушивали при 50°С. Смесь, состоящую из 400 мг 1.03% Co(OH)2/g-C3N4 и 2 г гипофосфита натрия, нагревали в атмосфере азота до 300°С со скоростью 2°С/мин, выдерживали при этой температуре 1 ч и охлаждали до комнатной температуры. Полученную смесь промывали несколько раз и высушили при температуре 50°С. Образец, синтезированный по данной методике, далее в тексте обозначен как Co(ТФ)/g-C3N4. Для сравнения в таких же условиях был синтезирован фосфид кобальта Co(ТФ) из гидроксида кобальта. В рамках гидротермального метода суспензию, состоящую из 10 мл воды и 400 мг нитрида углерода и рассчитанного количества 0.1 М раствора хлорида кобальта и порошка красного фосфора, перемешивали на магнитной мешалке в течение 30 мин. Полученную суспензию помещали в автоклав (фактор заполнения равен 0.8) и нагревали 10 ч при температуре 200°С. Полученную взвесь промывали несколько раз и высушивали при температуре 50°С. Образец, полученный по данной методике, обозначен Co(ГТ)/g-C3N4. В случае метода фотохимического восстановления суспензию, состоящую из 40 мл водно-спиртового раствора (10 об. % этилового спирта), 400 мг нитрида углерода и рассчитанного количества 0.1 М растворов хлорида кобальта и гипофосфита натрия, помещали в реактор, продули аргоном до полного удаления кислорода и освещали светодиодом с длиной волны 380 нм в течение 3 ч. Образовавшуюся взвесь промывали несколько раз и высушивали при температуре 50°С. Образец, приготовленный по этой методике, далее в тексте обозначен как Co(ФВ)/g-C3N4. Для сравнения в таких же условиях был синтезирован фосфид кобальта Co(ФВ) из предварительно полученного гидроксида кобальта(II) и гипофосфита натрия. Композит Co(ТФ)/g-C3N4(ГТ) был приготовлен автоклавированием суспензии, состоящей из 396 мг g-C3N4 и 4 мг Co(ТФ) и предварительно обработанной в ультразвуковой ванне в течение 0.5 ч, при 120°С в течение 2 ч. Образовавшуюся взвесь промывали несколько раз и высушивали при температуре 50°С [17]. Для сравнения методом химического восстановления был синтезирован фотокатализатор 1% Pt/g-C3N4 [16].
Изучение физико-химических свойств образцов
Исследование фазового состава приготовленных катализаторов проводили на рентгеновском дифрактометре Bruker D8 (“Bruker”, Германия), медное излучение CuKα, длина волны λ = 1.5418 Å. Съемку рентгенограмм осуществляли в интервале углов 2θ = 15°–65° методом сканирования по точкам с шагом сканирования 0.05°, время накопления в точке – 10 с. Размер области когерентного рассеивания (ОКР) образцов определяли по уравнению Шеррера. Спектры диффузного отражения образцов регистрировали на спектрофотометре Lambda 35 (“Perkin Elmer”, США) с приставкой для диффузного отражения RSA-PE-20 (“Labsphere”, США). Стандартным образцом служил сульфат бария. Микроструктуру фотокатализаторов изучали методом просвечивающей электронной микроскопии на микроскопе ThemisZ (“Thermo Fisher Scienti”, США) с ускоряющим напряжением 200 кВ. Микрофотографии были записаны с помощью сенсора Ceta 16 CCD (“Thermo Fisher Scientic”, США). Исследование химического состава катализаторов проводили методом рентгеновской фотоэлектронной спектроскопии (РФЭС) на электронном спектрометре фирмы SPECS SurfaceNanoAnalysisGmbH (Германия). Спектрометр оснащен полусферическим анализатором PHOIBOS-150-MCD-9, источником рентгеновского характеристического излучения XR-50 с двойным Al/Mg анодом. Для записи спектров применяли немонохроматизированное излучение AlKα (hν = 1486.61 эВ). Для учета эффекта зарядки образцов использовали положение пика, соответствующего носителю – углероду в структуре C3N4 (E(C1s) = 288.1 эВ). Относительные концентрации элементов в зоне анализа определяли на основании интегральных интенсивностей РФЭС-пиков с учетом сечения фотоионизации соответствующих термов [20]. Для детального анализа спектры разлагали на индивидуальные составляющие. После вычитания фона по методу Ширли [21] экспериментальную кривую раскладывали на ряд линий, соответствующих фотоэмиссии электронов из атомов в различном химическом окружении. Обработку данных производили с помощью пакета программ CasaXPS [22].
Измерение каталитической активности
Каталитическую активность синтезированных фотокатализаторов измеряли в статическом реакторе при освещении светодиодом с длиной волны 450 нм по методике, описанной ранее [16]. В реактор помещали 10 мл триэтаноламина, 90 мл 0.11 М раствора гидроксида натрия и 50 мг фотокатализатора. До начала реакции реактор продували аргоном около 30 мин для удаления кислорода, после чего включали освещение. Количество выделяющегося водорода измеряли на газовом хроматографе (“Хромос”, Россия).
Исследование фотоэлектрохимических свойств
Фотоэлектрохимические характеристики образцов изучали в двухэлектродной ячейке [23]. Рабочим электродом выступал исследуемый фотоэлектрод, противоэлектродом – латунь с предварительно нанесенным слоем сульфида меди(I). Рабочие фотоэлектроды готовили методом капельного нанесения [20]. 30 мг фотокатализатора соответствующего состава добавляли к 600 мкл этилового спирта и обрабатывали в ультразвуковой ванне в течение 6 мин. Полученную взвесь по каплям наносили на токопроводящее стекло FTO до полного покрытия раствором поверхности стекла и сушили при 80°С. Противоэлектрод получали путем тридцатиминутной обработки латуни концентрированной соляной кислотой при 70°С, промывании дистиллированной водой и опускании на 15 мин в 1 М водный раствор сульфида натрия [25]. В качестве электролитов использовали 1 М водный раствор сульфида натрия с растворенной серой (1 М) и хлоридом натрия (0.1 М). Электроды сжимали для оптимизации контакта. Фотогальванические характеристики определяли на потенциостате-гальваностате Р-45Х (Россия) с модулем измерения электрохимического импеданса FRA-24M в диапазоне напряжений от –0.8 до +0.8 В, скорость развертки потенциала составляла 0.02 В/с. Зависимости изменения плотности фототока от времени были записаны при потенциале, равном 0 В. Измерения методом импедансной спектроскопии проводили в диапазоне частот 0.8–105 Гц с амплитудой 10 мВ при постоянном значении потенциала 0.2 В. Зависимости Мотт–Шоттки изучали в диапазоне напряжений от –0.6 до 0.6 В с амплитудой 10 мВ при постоянной частоте 1000 Гц. В качестве источника освещения использовали светодиод с длиной волной 450 нм и мощностью излучения 19.2 мВт/см2. Площадь освещаемой поверхности в элементе составляла 1 см2.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химические свойства приготовленных катализаторов
Фазовый состав всех приготовленных катализаторов изучали методом РФА (рис. 1). Как видно из рис. 1а, на рентгенограммах всех композитных фотокатализаторов присутствуют пики при ~13° и ~27°, которые характерны для граней (100) и (002) нитрида углерода. Поскольку графитоподобный нитрид углерода является слоистым материалом с упорядоченной двумерной структурой, то для его характеризации рассчитывают размер области когерентного рассеяния (ОКР) в двух направлениях: в плоскости двумерных слоев La (фактически показывает расстояние между три-с-триазиновыми единицами [16, 26]) и перпендикулярно 2D-слоям (показывает расстояние Lc между слоями материала). Эти параметры были рассчитаны по уравнению Шеррера и приведены в табл. 1. Отметим, что нанесение сокатализатора на поверхность нитрида углерода приводит к изменению характерного размера ОКР в плоскости слоев La, причем чем выше температура синтеза, тем сильнее возрастает этот параметр. Например, в рамках метода фотохимического восстановления реакция происходит при комнатной температуре, характерный размер La остается практически постоянным. Рост температуры синтеза до 200°С (образец Co(ГТ)/g-C3N4) приводит к увеличению La на 1 нм по сравнению с немодифицированным нитридом углерода. При повышении температуры синтеза до 300°С, при которой было проведено термическое фосфорилирование (образец Co(ТФ)/g-C3N4), расстояние La возрастает до 6.3 нм. В то же время температурный режим получения фосфидов кобальта практически не оказывает влияния на расстояние между слоями в структуре нитрида углерода: параметр Lc составляет 8–9 нм для композитных фотокатализаторов, на которых наносили сокатализатор. Иная тенденция наблюдается в случае образца Co(ТФ)/g-C3N4(ГТ), для приготовления которого предварительно синтезированные фосфид кобальта и нитрид углерода подвергали диспергированию и гидротермальной обработке для формирования межфазного контакта. В этом случае расстояния La и Lc превышают аналогичные параметры для исходного нитрида углерода практически на 2 нм.
Рис. 1.
Рентгенограммы фотокатализаторов: а – g-C3N4, Co(ТФ)/g-C3N4, Co(ФВ)/g-C3N4, Co(ГТ)/g-C3N4, Co(ТФ)/g-C3N4(ГТ); б – Co(ТФ)/g-C3N4 в диапазоне 2θ = 40°–60°; в – Co(ТФ) и Co(ФВ).
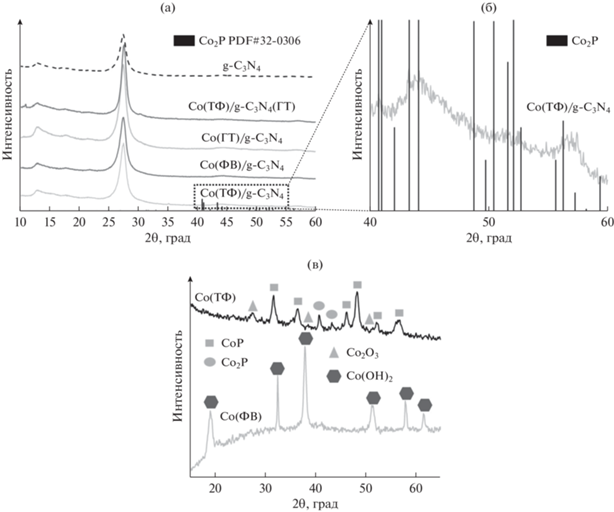
Таблица 1.
Физико-химические каталитические свойства нитрида углерода и приготовленных композитных фотокатализаторов на его основе
| Образцы | La,a нм | Lc,b нм | λc, нм | Egd, эВ | [N]/[C]e | [Co]/[C]e |
|---|---|---|---|---|---|---|
| g-C3N4 | 4.6 | 9.0 | 444 | 2.79 | 1.42 | – |
| Co(ТФ)/g-C3N4 | 6.3 | 9.0 | 454 | 2.73 | 1.20 | 0.0036 |
| Co(ГТ)/g-C3N4 | 5.7 | 8.0 | 448 | 2.77 | 1.16 | 0.0027 |
| Co(ФВ)/g-C3N4 | 4.7 | 8.1 | 450 | 2.75 | 1.40 | 0.0060 |
| Co(ТФ)/g-C3N4(ГТ) | 6.4 | 11.0 | 440 | 2.82 | Нет данных | Нет данных |
Исходя из данных, представленных на рис. 1а и 1б, пики фаз, относящиеся к фосфиду кобальта, были обнаружены только для образца, синтезированного методом термического фосфорилирования. Вероятно, это связано с малым количеством наносимого компонента или его высокой дисперсностью. Для того чтобы предположить, фосфиды какого состава могли сформироваться в рамках термического метода и фотохимического восстановления, была воспроизведена методика синтеза в отсутствие нитрида углерода. Рентгенограммы образцов Co(ТФ) и Co(ФВ) приведены на рис. 1в. Качественный анализ показал, что при использовании термического метода ожидаемо образование смеси фосфидов CoP (PDF 01-089-4862) и Co2P (PDF 04-007-15-24), а также оксида кобальта (PDF 00-002-0770), формирующегося при прокаливании гидроксида кобальта. В случае фотохимического восстановления были обнаружены только пики гидроксида кобальта, что подтверждает необходимость присутствия фотокатализатора для синтеза фосфидов. Сопоставление предположительных результатов с данными, полученными другими методами, и анализ механизмов образования фосфидов и побочных продуктов реакций в рамках различных методик будут представлены ниже.
Фотокатализаторы с нанесенными компонентами изучили методом РФЭС, спектры показаны на рис. 2а–2е. Как видно из рис. 2а, спектр углерода хорошо описывается двумя пиками с энергией связи в районе 284.6–285.1 и 288.1 эВ. Первый пик характерен для углеродсодержащих примесей, присутствующих на поверхности фотокатализаторов, например, вследствие адсорбции углекислого газа из атмосферы. Второй пик соответствует углероду, образующему связи с атомами азота в структуре нитрида углерода [27, 28]. В спектре N1s, приведенном на рис. 2б, наблюдается пик с энергией связи в районе 398.6 эВ, который относится к атому азота, образующему связь C–N=C, пик при 400.0 эВ, соответствующий атому азота, образующему связь с тремя атомами углерода N–(C)3 и пик при 401.0 эВ, подтверждающий наличие терминальных групп N–H [27, 28]. Отношение концентраций атомов углерода к атомам азота на поверхности образцов близко к стехиометрическому (табл. 1). Таким образом, методом РФЭС однозначно подтверждается наличие нитрида углерода в исследуемых фотокатализаторах.
Рис. 2.
РФЭ-спектры фотокатализаторов: g-C3N4, Co(ТФ)/g-C3N4, Co(ФВ)/g-C3N4, Co(ГТ)/g-C3N4, линии C1s (а) и N1s (б); Co(ТФ) и Co(ФВ), линии Co2p (в) и P2p (г); Co(ТФ)/g-C3N4, Co(ФВ)/g-C3N4, Co(ГТ)/g-C3N4, линии Co2p (д); Co(ФВ)/g-C3N4, Co(ГТ)/g-C3N4, линии P2p (е).
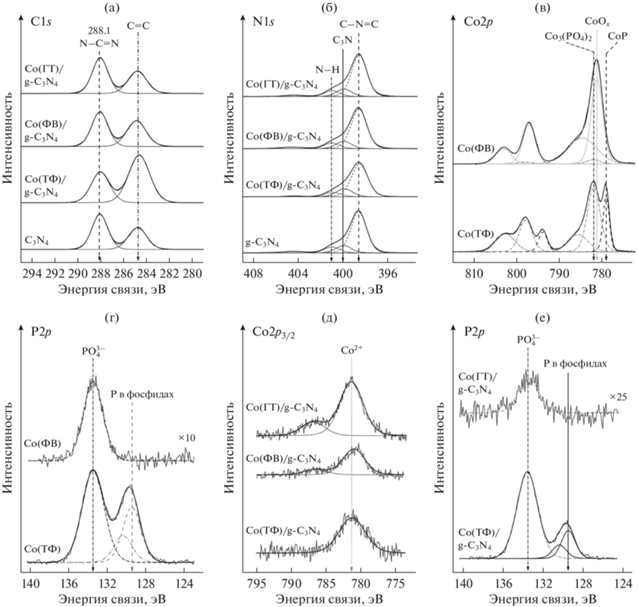
Дополнительно были проанализированы спектры кобальта и фосфора для образцов сравнения Co(ТФ) и Co(ФВ), синтезированных в отсутствие нитрида углерода методами термического фосфорилирования и фотохимического восстановления. Как показано на рис. 2в, спектр кобальта для образца, полученного фотохимическим восстановлением, можно описать двумя дублетами с энергией связи пиков Co2p3/2 в районе 780.1 и 780.9 эВ и соответствующими “shake-up” сателлитами в области 785.5 и 784.5 эВ. Оба этих дублета относятся к кобальту в степени окисления +2. Первый дублет соответствует кобальту в составе фосфата кобальта (6%), второй – оксиду или гидроксиду кобальта (94%). В спектре фосфора для образца Co(ФВ) содержится только один пик с энергией связи 133.5 эВ, что характерно для фосфат-иона [29–31]. Таким образом, в отсутствие носителя методом фотохимического восстановления можно получить только фосфат кобальта. Иная ситуация наблюдается для образца Co(ТФ), синтезированного методом термического фосфорилирования. Как показано на рис. 2в, спектр кобальта для него является суперпозицией двух пиков. Первый имеет энергию связывания 778.9 эВ и соответствует кобальту в форме фосфида [32–35]. Энергия связывания для второго пика с сателлитами составляет 781.8 эВ, что позволяет отнести его к двухвалентному состоянию кобальта в виде фосфата [36, 37]. Атомное соотношение кобальта, находящего в формах фосфида и фосфата, составляет 1 : 4. Присутствие в образце смеси фосфида и фосфата кобальта подтверждается данными, приведенными на рис. 2г.
Композитные катализаторы Co(ТФ)/g-C3N4, Co(ГТ)/g-C3N4 и Co(ФВ)/g-C3N4 были изучены методом РФЭС (рис. 2д и 2е). Для всех исследованных образцов спектр Co2p3/2 описывается широким пиком в районе 780.8–781.2 эВ, что характерно для кобальта в составе оксида и/или фосфата кобальта [32, 33, 35]. Для образца Co(ФВ)/g-C3N4 интенсивность пиков фосфора ниже предела обнаружения методом РФЭС. В случае катализатора Co(ГТ)/g-C3N4 наблюдается фосфор в форме фосфатов. Для образца Co(ТФ)/g-C3N4 дополнительно идентифицируется пик, принадлежащий фосфиду кобальта (рис. 2е). Таким образом, при синтезе фотокатализаторов гидротермальным методом и фотохимическим восстановлением на поверхности нитрида углерода формируется фосфат кобальта. При термическом фосфорилировании не исключено образование смеси фосфата и фосфида кобальта. Следует отметить, что в образцах, приготовленных с использованием разных методик, отличается отношение поверхностных концентраций атомов кобальта к атомам углерода (табл. 1). Учитывая, что во всех образцах массовое количество сокатализаторов одинаковое, вышесказанное может свидетельствовать о разных размерах полученных частиц.
Образец Co(ТФ)/g-C3N4 дополнительно изучили методом ПЭМ, снимки приведены на рис. 3. Как видно из рис. 3а, фотокатализатор состоит из частиц нескольких типов. Первый тип – это частицы носителя нитрида углерода, о чем свидетельствует распределение атомов углерода и азота по поверхности образца, рис. 3б и 3в. Частицы носителя уложены в виде стопок нескольких слоев. На поверхности нитрида углерода присутствуют частицы сферической формы 20–40 нм и агломераты цилиндрической формы размером до 100–200 нм. Для определения химической природы этих агломератов были получены карты распределения элементов по поверхности образцов. Атомы кобальта (рис. 3г) и кислорода (рис. 3е) равномерно размещены по поверхности нитрида углерода. Фосфор находится в виде отдельных скоплений небольших групп атомов и агломератов размером от 20 до 150 нм (рис. 3д). При сопоставлении изображений на рис. 3г–3е можно выделить участки, где одновременно присутствуют атомы кобальта, фосфора и кислорода, кобальта и фосфора, фосфора и кислорода. Это подтверждает наличие на поверхности фосфида и ортофосфата кобальта. Следует отметить, что количество поверхностного фосфора превышает концентрацию кобальта. Аналогичные результаты были получены методом РФЭС: [P]/[Co] = 47.7. Возможно, часть фосфора остается на поверхности после промывки катализатора, синтез которого проводили в избытке гипофосфита натрия.
Рис. 3.
а – Изображение ПЭМ образца Co(ТФ)/g-C3N4; б–е – элементное картирование ПЭМ-изображения образца Co(ТФ)/g-C3N4.

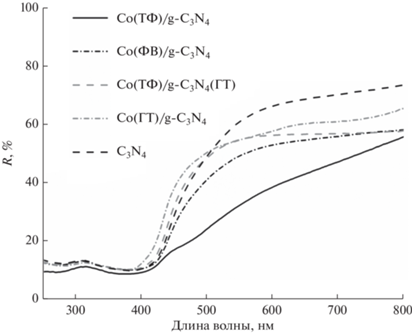
Оптические свойства приготовленных фотокатализаторов изучали методом спектроскопии диффузного отражения (рис. 4). Общий вид спектров схож для всех образцов, кроме Co(ТФ)/g-C3N4. Это может быть связано с присутствием в образце фосфида кобальта. Из спектров отражения была рассчитана функция Таука и определены края поглощения, данные суммированы в табл. 1. Край поглощения нитрида углерода составляет 444 нм. При нанесении на поверхность образца сокатализаторов наблюдается сдвиг этого показателя на величину менее 10 нм. Как правило, смещение края поглощения образцов связано с переносом электронной плотности с нитрида углерода на частицы фосфида либо фосфата кобальта. Следует отметить, что все синтезированные катализаторы поглощают излучение видимого диапазона и потенциально пригодны для применения в фотокаталитических и фотогальванических процессах.
Механизм формирования сокатализаторов в рамках рассматриваемых методик
В работе рассматривали три разных метода формирования солей кобальта на поверхности нитрида углерода: термическое фосфорилирование, фотохимическое восстановление и гидротермальный метод. Согласно литературным данным в основе термического фосфорилирования лежат два последовательных процесса: разложение гипофосфита натрия с образование фосфина (при этом в качестве твердофазного продукта разложения выступают различные соли кислородсодержащих фосфорных кислот [17, 38], уравнения (I)–(III)) и взаимодействие фосфина с гидроксидом кобальта (уравнение (IV)). Процесс протекает при 300°С, что исключает реализацию твердофазных превращений.
(I)
$2{\text{Na}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{2}} \to {\text{P}}{{{\text{H}}}_{3}} + {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{HP}}{{{\text{O}}}_{4}},$(II)
$4{\text{Na}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{{\text{2}}}} \to 2{\text{P}}{{{\text{H}}}_{3}} + {\text{N}}{{{\text{a}}}_{{\text{4}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(III)
$5{\text{Na}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{2}} \to 2{\text{P}}{{{\text{H}}}_{3}} + {\text{N}}{{{\text{a}}}_{{\text{5}}}}{{{\text{P}}}_{{\text{3}}}}{{{\text{O}}}_{{{\text{10}}}}} + 2{{{\text{H}}}_{2}},$(IV)
$3{\text{Co}}{{\left( {{\text{OH}}} \right)}_{2}} + 2{\text{P}}{{{\text{H}}}_{3}} \to {\text{CoP}} + {\text{C}}{{{\text{o}}}_{{\text{2}}}}{\text{P}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Как показали данные РФА, в случае образца Co(ТФ), полученного вышеуказанным методом, действительно образуется смесь фосфидов кобальта. Однако результаты изучения Co(ТФ) методом РФЭС говорят о присутствии смеси фосфида и фосфата кобальта на поверхности. Вероятно, в процессе хранения фотокатализаторов высокодисперсные частицы фосфида кобальта окисляются кислородом воздуха.
В рамках гидротермального синтеза происходит взаимодействие фосфора, воды и гидроксида кобальта. В условиях автоклавирования возможно диспропорционирование фосфора (уравнение (V)) и последующее взаимодействие продуктов диспропорционирования с гидроксидом кобальта (уравнения (IV) и (VI)). Следует отметить, что побочным продуктом диспропорционирования является фосфорная кислота, вследствие этого в системе образуется фосфат кобальта. Как показал анализ РФЭС образца Co(ГТ)/g-C3N4, на поверхности присутствует только ортофосфат кобальта. Возможно, что взаимодействие фосфина с гидроксидом кобальта протекает медленнее, чем образование фосфата, или что образовавшиеся частицы фосфида кобальта при хранении окисляются кислородом воздуха. Для повышения выхода фосфидов по данному методу, вероятно, следует использовать предшественники фосфора более сложного состава.
(V)
$8{\text{P}} + 12{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to 5{\text{P}}{{{\text{H}}}_{3}} + 3{{{\text{Н}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{4}},$(VI)
$3{\text{Co}}{{\left( {{\text{OH}}} \right)}_{2}} + 2{{{\text{Н}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{4}} \to {\text{C}}{{{\text{o}}}_{{\text{3}}}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{2}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$Способ приготовления сокатализаторов путем проведения фотохимического восстановления предшественников электронами, образующимися при освещении полупроводника, ранее успешно был применен для получения частиц благородных металлов [39]. В случае с фосфидами ситуация сложнее: происходит восстановление и кобальта, и фосфора (уравнения (VII) и (VIII)). Основные продукты вышеуказанной реакции, в соответствии с литературными данными, – смесь CoP и Co2P [19]. Одна из главных проблем, возникающих при использовании метода фотохимического восстановления, – это низкий выход продуктов реакции из-за рекомбинации электрон-дырочных пар. Поскольку побочным процессом с участием дырок является образование фосфатов (уравнение (IX)), то было принято решение проводить процесс не в воде, а в водно-спиртовом растворе. В этом случае фотогенeрированные дырки будут частично окислять этанол. Анализ образца Co(ФВ), приготовленного освещением смеси гидроксида кобальта и водно-спиртового раствора гипофосфита натрия светодиодом, показал формирование ортофосфата кобальта в данных условиях. Тогда методику дополнили введением в реакционную смесь пятикратного избытка ионов бария, которые способны осаждать ортофосфат-ион и при этом не образуют нерастворимых гипофосфитов. Но и тогда не удалось идентифицировать фосфид кобальта. Таким образом, с помощью метода фотохимического восстановления можно получить только ортофосфат кобальта.
(VII)
${\text{C}}{{{\text{o}}}^{{2 + }}} + {{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{2}^{ - } + 2{{{\text{H}}}^{ + }} + 3{{{\text{e}}}^{ - }} \to {\text{CoP}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}},$Фотокаталитическая активность и фотоэлектрохимические свойства приготовленных фотокатализаторов
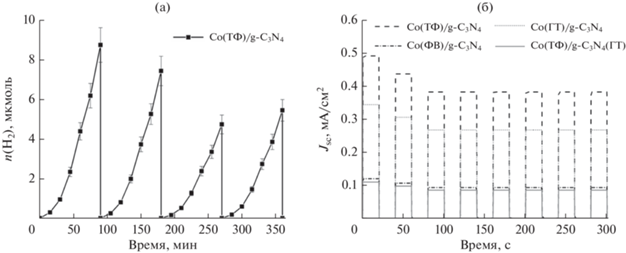
Фотокаталитическую активность катализаторов на основе графитоподобного нитрида углерода чаще всего исследуют в водно-щелочных растворах триэтаноламина. Данный реагент, адсорбируясь на поверхности, защищает материал от процессов фотокоррозии, что позволяет нитриду углерода дольше сохранять каталитические свойства [16]. Однако немодифицированный нитрид углерода не проявляет каталитических свойств. На его поверхность были нанесены сокатализаторы – фосфид и ортофосфат кобальта. Кинетические кривые, полученные для исследованных образцов, показаны на рис. 5, для сравнения там же приведена кинетическая кривая выделения водорода, снятая в присутствии фотокатализатора 1% Pt/g-C3N4. Из рис. 5 видно, что в случае фотокаталитического выделения водорода на изученных катализаторах присутствует период индукции длительностью 45–60 мин, после которого количество водорода линейно зависит от времени. Линейный участок полученных кривых в дальнейшем использовали для вычисления скорости реакции. Следует отметить, что индукционный период в присутствии фотокатализаторов с нанесенными солями металлов ранее описан в литературе [40, 41] и связан с частичным восстановлением сокатализатора до металлического состояния [41]. Аналогичный эффект может возникать для платины, поскольку нанесение методом восстановления боргидридом натрия приводит к образованию на поверхности частиц платины в степени окисления 0 и +2, причем металлическое состояние более предпочтительно для выделения водорода [39].
Рис. 5.
Зависимости количества выделяющего водорода от времени, полученные в присутствии фотокатализаторов Co(ТФ)/g-C3N4, Co(ФВ)/g-C3N4, Co(ГТ)/g-C3N4, Co(ТФ)/g-C3N4(ГТ), 1% Pt/g-C3N4.
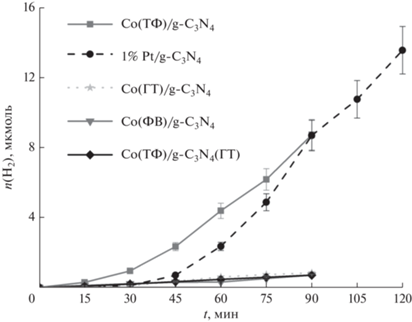
Анализ данных, представленных на рис. 5, показывает, что ненулевые значения скорости реакции были получены для Co(ТФ)/g-C3N4, приготовленного методом термического фосфорилирования, и образца сравнения, содержащего платину. Вероятно, наличие небольшого количества фосфида кобальта в составе сокатализатора благоприятно сказывается на скорости реакции из-за способности CoP, подобно благородным металлам, стягивать на себя электронную плотность, что позволяет улучшить степень пространственного разделения зарядов полупроводника. Следует отметить, что активность катализатора Co(ТФ)/g-C3N4 (156 мкмоль ч–1 г–1) сопоставима с активностью платинированного нитрида углерода 1% Pt/g-C3N4 (216 мкмоль ч–1 г–1).
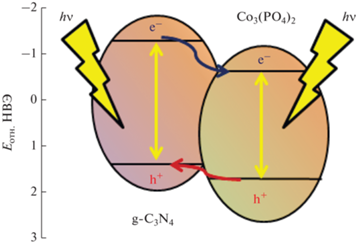
Образцы, полученные гидротермальным методом и фотохимическим восстановлением, в которых кобальт присутствует только в форме ортофосфата, не проявляют активности в целевой реакции. Известно, что ортофосфат кобальта является полупроводником, потенциал края зоны проводимости составляет –0.73 В, валентной зоны – 1.62 В [42]. Поскольку потенциал зоны проводимости ортофосфата кобальта меньше 0 В, то данный полупроводник теоретически может быть использован в качестве фотокатализатора для выделения водорода [43]. Вероятно, в композитном фотокатализаторе, состоящем из ортофосфата кобальта и графитоподобного нитрида углерода, возможно возникновение гетеропереходов. При освещении такого образца внутри частиц обоих полупроводников образуются электрон-дырочные пары. Поскольку потенциалы зоны проводимости (–1.3 В) и валентной зоны (1.46 В) [44] нитрида углерода выше, чем у фосфата кобальта, то термодинамически наиболее выгодным является нахождение электронов в зоне проводимости ортофосфата кобальта, а дырок – в валентной зоне нитрида углерода. Перенос фотогенерированных зарядов на частицы полупроводников в соответствии со схемой, показанной на рис. 6, позволяет увеличить время жизни электронов и дырок, степень пространственного разделения носителей зарядов и улучшить каталитическую активность нитрида углерода. Однако для полноценного проявления данного эффекта количество наносимого ортофосфата кобальта слишком мало, вследствие чего каталитическая активность таких образцов не превышает 1 мкмоль ч–1 г–1. В качестве примера, подтверждающего справедливость этого суждения, можно привести систему полупроводников, состоящих из твердого раствора сульфидов кадмия и цинка Cd0.3Zn0.7S и Zn(OH)2, внутри которых реализуются гетеропереходы: нанесение 1 мас. % гидроксида цинка приводит к изменению каталитической активности на 10%, а значительный эффект проявляется при нанесении 10–30 мас. % сокатализатора [45]. Таким образом, для получения активных фотокатализаторов необходимо либо повышать долю фосфида кобальта в сокатализаторе, либо увеличивать количество наносимого ортофосфата кобальта.
Рис. 6.
Схема переноса зарядов, возникающего при освещении композитного фотокатализатора, состоящего из нитрида углерода и ортофосфата кобальта.
В настоящей работе дополнительно был синтезирован фотокатализатор Co(ТФ)/g-C3N4(ГТ) путем гидротермальной обработки предварительно приготовленной смеси ортофосфата кобальта и фосфида кобальта (образец Co(ТФ)) и графитоподобного нитрида углерода, который не продемонстрировал каталитической активности в реакции выделения водорода. Возможно, формирование композитного образца из отдельных фаз нитрида углерода и смеси фосфата и фосфида кобальта не позволяет сформировать достаточно плотных контактов между фазами, достигаемых при фосфорилировании образцов с предварительно адсорбированным на поверхности гидроксидом кобальта.
Все фотокатализаторы, содержащие фосфид и фосфат кобальта, дополнительно исследовали электрохимическими методами. Основные фотогальванические характеристики были рассчитаны из данных вольтамперометрии и сведены в табл. 2. Как видно из табл. 2, плотность тока короткого замыкания для образца, полученного методом термического фосфорилирования, наибольшая по сравнению с остальными катализаторами. Величина фототока снижается при использовании гидротермального метода. При применении методик фотонанесения и сборки композита из заранее приготовленных фотокатализаторов результаты более низкие: плотность тока короткого замыкания в три раза меньше, чем для образцов, приготовленных гидротермальным методом. Расчет коэффициента полезного действия подтверждает, что самой эффективной методикой из представленных является термическое фосфорилирование. Анализ данных вольтамперометрии показал, что для образца Co(ТФ), полученного методом термического фосфорилирования, достигаются повышенные значения плотности тока короткого замыкания и КПД по сравнению с тем, что был приготовлен методом фотохимического восстановления. Вероятно, наличие в образце небольшого количества фосфида кобальта позволяет значительно улучшить фотогальванические характеристики.
Таблица 2.
Фотогальванические свойства и результаты измерений спектроскопией импеданса фосфорсодержащих образцов
| Образец | Плотность тока короткого замыкания, мА/см2 | КПДa, % | Время жизни электронов, мс | Потенциал плоских зон VFB, мВ | Nb × εc, м–3 |
|---|---|---|---|---|---|
| Co(ТФ)/g-C3N4 | 0.492 | 0.35 | 0.25 | –317 | 8.96 × 1018 |
| Co(ГТ)/g-C3N4 | 0.343 | 0.03 | 0.20 | –325 | 5.91 × 1018 |
| Co(ФВ)/g-C3N4 | 0.120 | 0.02 | 0.15 | –258 | 1.64 × 1018 |
| Co(ТФ)/g-C3N4(ГТ) | 0.110 | 0.04 | 0.09 | –321 | 1.42 × 1018 |
| Co(ТФ) | 2.406 | 0.44 | 29 | –362 | 6.20 × 1016 |
| Co(ФВ) | 1.320 | 0.37 | 2.7 | –293 | 5.98 × 1016 |
a Коэффициент полезного действия фотоэлектрохимической ячейки, отношение количества квантов света, энергия которых была преобразована в электричество, к числу квантов света, падающих на ячейку. bКонцентрация электронов, перемещающихся между электродами фотоэлектрохимической ячейки. cДиэлектрическая проницаемость фотокатализатора.
Для более глубокого понимания причин изменений ключевых характеристик фотоэлектродов образцы были изучены методом импедансной спектроскопии. На рис. 7 показаны графики в координатах Найквиста. Видно, что тип методики получения сокатализатора не влияет на общий вид зависимости мнимой части импеданса от действительной. Более того, сопротивление в системе снижается в том же ряду, что и возрастает плотность тока короткого замыкания. Таким образом, результаты, полученные методами спектроскопии импеданса и вольтамперометрии, находятся в согласии между собой. Дополнительно из данных импеданса были рассчитаны времена жизни электронов, табл. 2. Следует отметить, что значения этой величины уменьшаются в том же ряду, что и плотность тока короткого замыкания. Для образцов Co(ТФ) и Co(ФВ), приготовленных методами термического фосфорилирования и фотонанесения, время жизни электронов больше, чем у композитных фотокатализаторов, нанесенных на токопроводящее стекло. Для этих же образцов были достигнуты более высокие значения плотности тока короткого замыкания.
Для определения типа проводимости синтезированных образцов были построены графики Мотт–Шоттки, приведенные на рис. 8а. Положительный наклон прямой свидетельствует о том, что полученные композитные фотокатализаторы относятся к полупроводникам n-типа, как и графитоподобный нитрид углерода [46]. Таким образом, нанесение 1 мас. % сокатализатора не изменяет тип проводимости материала. Исходя из графика Мотт–Шоттки можно рассчитать потенциал плоских зон исследуемых образцов. Для этого линейный участок полученных зависимостей аппроксимировали прямой и вычисляли величину потенциала плоских зон, исходя из следующего уравнения [47]:
(1)
$\frac{1}{{{{C}^{2}}}} = \frac{2}{{e\varepsilon {{\varepsilon }_{0}}N{{S}^{2}}}}V - \frac{2}{{e\varepsilon {{\varepsilon }_{0}}N{{S}^{2}}}}\left( {{{V}_{{{\text{FB}}}}} + \frac{{kT}}{e}} \right),$Рис. 8.
Графики Мотт–Шоттки, построенные для композитных фотокатализаторов (а) и образцов сравнения Co(ТФ) и Co(ФВ) (б).
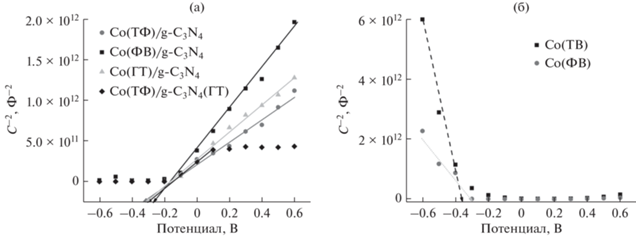
Как показано в табл. 2, потенциал плоских зон композитных фотокатализаторов находится в диапазоне от –258 до –325 мВ, причем для всех образцов, кроме полученного методом фотонанесения, эта показатель составляет около –320 мВ. Поскольку величина потенциала плоских зон практически не меняется при изменении метода приготовления сокатализатора, можно заключить, что в рассматриваемом случае VFB не оказывает значительного влияния на каталитическую и электрохимическую активность приготовленных образцов.
Аналогичные зависимости были построены для образцов, приготовленных методами термического фосфорилирования и фотонанесения, рис. 8б. В отличие от нитрида углерода и композитных фотокатализаторов на его основе, фосфид и фосфат кобальта являются полупроводниками p-типа, что согласуется с литературными данными [48]. Потенциал плоских зон образцов, полученных методами термического фосфорилирования и фотонанесения, составляет –362 и –293 мВ соответственно. Различия между этими величинами связаны с разным фазовым составом синтезированных образцов. Следует отметить, что образование композитных фотокатализаторов приводит к смещению потенциала плоских зон сокатализаторов почти на 40 мВ вне зависимости от метода приготовления.
Другим параметром, который можно рассчитать из графика Мотт–Шоттки, является концентрация носителей зарядов. Поскольку диэлектрическая проницаемость композитных фотокатализаторов неизвестна, то для оценок было найдено произведение концентрации электронов на диэлектрическую проницаемость среды, табл. 2. Сравнение этих величин предполагается разумным, так как различие фазового состава наносимого компонента в количестве 1 мас. % с малой вероятностью может существенно изменять диэлектрическую проницаемость материала. Из табл. 2 видно, что произведения концентрации носителей зарядов на диэлектрическую проницаемость фотокатализаторов N × ε для полученных образцов – величины одного порядка и уменьшаются в том же ряду, что и время жизни электронов и плотность тока короткого замыкания.
Стабильность приготовленных фотокатализаторов и фотоэлектродов
Известно, что одним из требований к фотокатализаторам и фотоэлектродам является сохранение их активности в течение нескольких циклов освещения. На рис. 9а приведены кинетические кривые образца Co(ТФ)/g-C3N4, полученные в течение четырех полуторачасовых циклов освещения. Отметим, что в процессе шестичасового освещения фотокатализатора его начальная каталитическая активность снижается на 38%. Изменение максимального количества генерируемого фототока во времени демонстрирует рис. 9б. В процессе первых трех циклов включения–выключения освещения плотность тока короткого замыкания уменьшается и достигает постоянной величины, не меняющейся при последующих шести циклах. Такая тенденция характерна для всех изученных фотоэлектродов в системе. В целом после восьми циклов включения–выключения освещения плотность тока короткого замыкания падает на 20–25%.
ЗАКЛЮЧЕНИЕ
В ходе настоящей работы на поверхность нитрида углерода был нанесен сокатализатор тремя различными способами: термическим фосфорилированием, гидротермальным методом и фотохимическим восстановлением. В первом случае сокатализатор представлял собой смесь фосфида и ортофосфата кобальта, по методикам гидротермального и фотохимического синтезов удалось получить ортофосфат кобальта. Дополнительно был синтезирован образец путем гидротермальной обработки предварительно приготовленных нитрида углерода и фосфида кобальта. В реакции фотокаталитического выделения водорода из водно-щелочного раствора триэтаноламина каталитическую активность продемонстрировал только один образец, полученный методом термического фосфорилирования. Его каталитическая активность составила 156 мкмоль ч–1 г–1, что сопоставимо с таковой платинированного нитрида углерода 1% Pt/g-C3N4 (216 мкмоль ч–1 г–1). Фотоэлектрохимические эксперименты продемонстрировали, что все приготовленные фотоэлектроды способны генерировать фототок. Наибольшую величину фототока удалось зарегистрировать для образца, содержащего фосфид кобальта и приготовленного путем термического фосфорилирования. Дополнительные эксперименты показали, что плотность тока фотоэлектрода, в состав которого входит 20 мол. % кобальта (от общего числа кобальта) в форме CoP, в 1.8 раза превышает эту величину для образца, включающего только ортофосфат кобальта. Таким образом, эффективая система для фотокаталитических и фотогальванических приложений должна содержать сокатализатор с максимальной долей фосфида кобальта.
Список литературы
Козлова Е.А., Пармон В.Н. // Успехи химии. 2017. Т. 86. № 9. С. 870. (Kozlova E.A., Parmon V.N. // Russ. Chem. Revs. 2017. V. 86. № 9. P. 870.)https://doi.org/10.1070/RCR4739
Марковская Д.В., Люлюкин М.Н., Журенок А.В., Козлова Е.А. // Кинетика и катализ. 2021. Т. 62. № 4. С. 437. (Markovskaya D.V., Lyulyukin M.N., Zhurenok A.V., Kozlova E.A. // Kinetics and Catalysis. 2021. V. 62. № 4. P. 488.)https://doi.org/10.1134/s002315842104008x
An C.W., Liu T., Zhang D.F., Yan J.S. // Кинетика и катализ. 2020. Т. 61. № 6. С. 818.
Jain A., Ameta C. // Кинетика и катализ. 2020. Т. 61. № 2. С. 246.
Краснякова Т.В., Юрчило С.А., Моренко В.В., Носолев И.К., Глазунова Е.В., Хасбулатов С.В., Вербенко И.А., Митченко С.А. // Кинетика и катализ. 2020. Т. 61. № 3. С. 359.
Carp O., Huisman C.L., Reller A. // Prog. Solid State Chem. 2004. V. 32. P. 33.
Ran J., Zhang J., Yu J., Qiao S.Z. // ChemSusChem. 2014. V. 7. P. 3426.
Huan, Q.-Z., Tao Z.-J., Ye L.Q., Yao H.-C., Li Z.-J. // Appl. Catal. B: Env. 2018. V. 237. P. 689.
Mansour A.S., Gaddalah A.-S., Al-Sherbini A.-S., Youssef T., Mohamed M.B. // J. Mol. Struct. 2017. V. 1149. P. 626.
Cao S., Yu J. // J. Photochem. Photobio. C. 2016. V. 27. P. 72.
Kahng S., Yoo H., Kim H. // Adv. Powder. Technol. 2020. V. 31. P. 11.
Wen J., Xie J., Chen X., Li X. // Appl. Surf. Sci. 2017. V. 391. P. 72.
Xu J., Qi Y., Wang W., Wang L. // Int. J. Hydrogen Energy. 2019. V. 44. P. 4114.
Ge L., Han C., Xiao X., Guo L. // Appl. Catal. B: Env. 2013. V. 142–143. P. 414.
Lakhera S.K., Vijayarajan V.S., Krishna B.S.R., Veluswamy P., Neppolian B. // Int. J. Hydrogen Energy. 2020. V. 45. P. 7562.
Zhurenok A.V., Larina T.V., Markovskaya D.V., Cherepanova S.V., Mel’gunova E.A., Kozlova E.A. // Mendeleev Commun. 2021. V. 31. P. 157.
Li H., Zhao J., Geng Y., Li Z., Li Y., Wang J. // Appl. Surf. Sci. 2019. V. 496. P. 143738.
Wang B., Huang X., Zhu Z., Huang H., Dai J. // Appl. Nanosci. 2012. V. 2. P. 481.
Dong Y., Kong L., Wang G., Jiang P., Zhao N., Zhang H. // Appl. Catal. B: Env. 2017. V. 211. P. 245.
Scofield J.H. // J. Electron Spectrosc. Relat. Phenom. 1976. V. 8. P. 129.
Shirley D.A. // Phys. Rev. B. 1972. V. 5. P. 4709.
N. Fairley, www.casaxps.com
Markovskaya D.V., Zhurenok A.V., Cherepanova S.V., Kozlova E.A. // Appl. Surf. Sci. Adv. 2021. V. 4. P. 100076:1.
Markovskaya D.V., Gribov E.N., Kozlova E.A., Kozlov D.V., Parmon V.N. // Renew. Energy. 2020. V. 151. P. 286.
Kamaja C.K., Devarapalli R.R., Dave Y., Debgupta J., Shelke M.V. // J. Power Sources. 2016. V. 315. P. 277.
Wang X., Maeda K., Thomas A., Takanabe K., Xin G., Carlsson J.M., Domen K., Antonietti M. // Nature Mater. 2009. V. 8. P. 76.
Dong F., Zhao Z., Xiong T., Ni Z., Zhang W., Sun Y., Ho W.K. // ACS Appl. Mater. Int. 2013. V. 5. P. 11392.
Liu H., Chen D., Wang Z., Jing H., Zhang R. // Appl. Catal. B: Env. 2017. V. 203. P. 300.
Guo L., Zhao Y., Yao Z. // Dalton T. 2016. V. 45. P. 1225.
Yao Z., Wang G., Shi Y., Zhao Y., Jiang J., Zhang Y., Wang H. // Dalton T. 2015. V. 44. P. 14122.
Burns A.W., Gaudette A.F., Bussell M.E. // J. Catal. 2008. V. 260. P. 262.
Khassin A.A., Yurieva T.M., Kaichev V.V., Bukhtiyarov V.I., Budneva A.A., Paukshtis E.A., Parmon V.N. // J. Mol. Catal. A. Chem. 2001. V. 175. P. 189.
Biesinger M.C., Payne B.P., Grosvenor A.P., Lau L.W.M., Gerson A.R., Smart R.S.C. // Appl. Surf. Sci. 2011. V. 257. P. 2717.
Venezia A.M., Murania R., Pantaleo G., Deganello G. // J. Mol. Catal. A.Chem. 2007. V. 271. P. 238.
Kosova N.V., Devyatkina E.T., Kaichev V.V. // J. Power Sources. 2007. V. 174. P. 965.
Liu B., Chai Y., Li Y., Wang A., Liu Y., Liu C. // Appl. Catal. A: Gen. 2014. V. 471. P. 70.
Guan Q., Cheng J., Li X., Wang B., Huang L., Nie F., Ni W. // Sci. Rep.–UK. 2015. V. 5. P. 10017.
Liu D., Li X., Wei L., Zhang T., Wang A., Liu C., Prins R. // Dalton T. 2017. V. 46. P. 6366.
Kozlova E.A., Markovskaya D.V., Cherepanova S.V., Saraev A.A., Gerasimov E.Y., Perevalov T.V., Kaichev V.V., Parmon V.N. // Int. J. Hydrogen Energy. 2014. V. 39. P. 18758.
Alam K.M., Kumar P., Kar P., Thakur U.K., Zeng S., Cui K., Shankar K. // Nanoscale Adv. 2019. V. 1. P. 1460.
Jones W., Martin D.J., Caravaca A., Beale A.M., Bowker M., Maschmeyer T., Hartley G., Masters A. // Appl. Catal. B: Env. 2019. V. 240. P. 373.
Kalousek V., Kikuta K., Vagvala T.C., Ikeue K. // Mater. Lett. 2017. V. 199. P. 65.
Samal A., Swain S., Satpati B., Das D.P., Mishra B.K. // ChemSusChem. 2016. V. 9. P. 3150.
Liu X., Lai H., Li J., Peng G., Zeng R. // Photochem. Photobiol. Sci. 2021. Article in press. https://doi.org/10.1007/s43630-021-00139-2
Guo F., Shi W., Wang H., Han M., Li H., Huang H., Liu Y., Kang Z. // Catal. Sci. Technol. 2017. V. 7. P. 3325.
Markovskaya D.V., Kozlova E.A., Cherepanova S.V., Saraev A.A., Gerasimov E.Yu., Parmon V.N. // Top. Catal. 2016. V. 59. P. 1297.
Liu Y., Yu Y.-X., Zhang W.-D. // J. Phys. Chem. C. 2013. V. 117. P. 29549.
Liang R., Wang Y., Qin C., Chen X., Chen X. // Langmuir. 2021. V. 37. P. 3321.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ