Кинетика и катализ, 2022, T. 63, № 4, стр. 491-495
Кинетика абсорбции диоксидов углерода и серы во фторсодержащих средах
М. С. Иванова a, *, М. В. Вишнецкая b, К. О. Томский a, С. М. Зайнулин a
a ФГАОУ ВО Политехнический институт (филиал) Северо-Восточного федерального университета
имени М.К. Аммосова
678170 Мирный, Тихонова, 5, корп. 1, Россия
b ФГАОУ ВО РГУ нефти и газа (НИУ) имени И.М. Губкина
119991 Москва, Ленинский просп., 65, Россия
* E-mail: ims.06@mail.ru
Поступила в редакцию 01.03.2022
После доработки 15.03.2022
Принята к публикации 15.03.2022
- EDN: MXLJMM
- DOI: 10.31857/S0453881122040049
Аннотация
Установлено, что в водных суспензиях фторида кальция при комнатной температуре и атмосферном давлении протекают реакции окисления диоксидов серы и превращения диоксида углерода. Определены оптимальные скорости подачи газов и концентрация суспензии фторида кальция для их максимального поглощения. Показано, что суспензию CaF2 можно многократно использовать после ее регенерации кислородом воздуха.
ВВЕДЕНИЕ
Одной из наиболее актуальных проблем современной промышленности является утилизация парниковых газов, таких как диоксиды углерода и серы. Наибольший интерес из известных сегодня способов их утилизации представляют каталитические способы поглощения с возможностью дальнейшего использования продуктов реакции.
Ранее было показано [1], что растворы фторида натрия и суспензии фторидов кальция различных концентраций в результате поглощения ими кислорода и перевода его в активное состояние способны абсорбировать диоксид серы. Отработанные растворы и суспензии полностью повторно активировались при пропускании через них кислорода воздуха.
Квантово-химические расчеты [2–8] механизмов реакций диоксидов серы и углерода во фторсодержащих средах показывают, что активными интермедиатами могут быть гидропероксидные радикалы ${\text{НО}}_{2}^{\centerdot }$.
Образовавшийся гидропероксидный радикал взаимодействует с диоксидом серы или углерода. Эти реакции приводят к появлению кислородсодержащих соединений или к увеличению числа атомов кислорода в исходной молекуле, например, SO2 превращается в SO3.
Исследованные ранее [6–8] фторсодержащие соединения растворимы в воде. Дальнейшее выделение образовавшихся продуктов реакции является достаточно сложной задачей. При этом использование суспензий фторидов кальция в качестве окислителя является наиболее выгодным с точки зрения отделения продуктов реакции.
В настоящей работе изучена кинетика абсорбции диоксидов серы и углерода в суспензиях фторида кальция при разных концентрациях CaF2 и различных скоростях подачи газа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реакции диоксида углерода и диоксида серы в суспензиях фторида кальция вели при температуре 25°С и атмосферном давлении. Эксперименты выполняли с разными концентрациями солей (от 0.02 до 2 М) при различных скоростях подачи диоксида углерода. Используемые для реакций растворы подкисляли разбавленной HCl до значений рН 1.90–2.00.
Установка для проведения эксперимента по окислению диоксидов углерода и серы состояла из системы для получения SO2 и баллона с СО2, барботера с раствором исследуемой соли и ловушки с раствором бихромата калия в концентрациях 10–4 моль/л для определения количества диоксида серы, не окисленного в реакторе, и 0.4 моль/л NaOH для определения непоглощенного СО2.
Диоксид углерода пропускали через суспензии фторида кальция со скоростями от 30 до 118 мл/мин. Для поддержания равномерности распределения фторида кальция в суспензии применяли магнитную мешалку.
Непрореагировавший SO2 фиксировали на выходе из системы по изменению окраски водного раствора бихромата калия. Измерения концентрации K2Cr2O7 проводили на анализаторе Эксперт-001 (ООО “Эконикс-Эксперт”, Россия) с помощью халькогенидного стеклянного хромселективного электрода типа ХС-Cr-001 и хлорсеребряного электрода ЭВЛ-1М3.1. Содержание сульфат-иона находили методом потенциометрического титрования на анализаторе Эксперт-001 с помощью ионоселективного электрода ЭЛИТ-081 (ООО “Нико Аналит”, Россия) путем осаждения сульфата бария. Для этого из барботера отбирали 5–20 мл раствора, величину pH доводили до 4 и нагревали при 50°С в течение 20–40 мин. Нагревание было необходимо для разрушения пероксокомплексов сульфат-иона, которые препятствуют осаждению BaSO4. Пероксосоединения образуются при взаимодействии активного кислорода с диоксидом серы, что было установлено методом ИК-спектроскопии [9, 10]. Анализ содержимого барботера показал полное отсутствие S(IV) в растворе и присутствие S(VI), количество которой почти полностью совпадало с количеством поглощенного SO2, т.е. поглощенный SO2 количественно превращался в сульфат-ион.
Непрореагировавщий СO2 на выходе из системы поглощали в съемных ловушках с 0.4 M раствором NaOH, рН которого непрерывно контролировали с помощью стеклянного электрода. Количество гидрокарбоната и карбоната натрия, образующихся при взаимодействии СО2 с раствором NaOH, находили путем потенциометрического титрования 1 M раствором НСl на приборе рН-150МИ (ООО “Измерительная техника”, Россия) с помощью рабочего pH-электрода и стеклянного электрода сравнения. Ошибка определения составляла ±0.03%.
Количество прореагировавшего СO2 рассчитывали по результатам титрования за время пропускания отходящего газа через ловушку. Специфика такой методики определения абсорбции диоксида углерода фторидом кальция заключается в том, что поскольку в реакционную систему подается чистый СО2, то в зависимости от скорости подачи (от 30 до 118 мл/мин) при полной абсорбции диоксида в барботере газовый поток в течение 1–14 мин на выходе из системы вообще не регистрируется.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 показано, как концентрация суспензии фторида кальция с объемом 200 мл влияет на абсорбцию диоксида углерода. В начальный период поглощения диоксида углерода суспензией фторида кальция, первые 2–5 мин с момента подачи газа, кривая имеет линейный характер, при этом скорость абсорбции пропускаемого газа равна скорости подачи диоксида углерода в систему. В зависимости от концентрации суспензии полная абсорбция диоксида углерода происходит в течение 3–10 мин. Система поглощает газ сразу и полностью, на что указывает равенство величин скоростей подачи и поглощения СО2.
Рис. 1.
Зависимости скорости поглощения СO2 водными суспензиями CaF2 от времени при различных концентрациях CaF2.
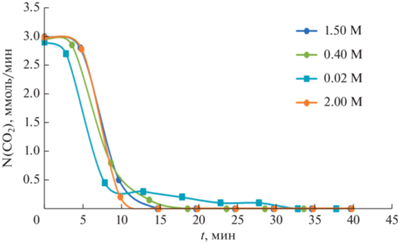
Общее количество поглощенного диоксида углерода, рассчитанное как площадь под кривыми, представленными на рис. 1, показано на рис. 2. Видно, что наибольшее количество диоксида углерода поглощается при концентрации CaF2 равной 2 моль/л.
Рис. 2.
Зависимости абсорбции СO2 водными суспензиями CaF2 при различных концентрациях CaF2 (в расчете на 1000 мл суспензии).

В целом увеличение концентрации фторида кальция приводит к повышению количества абсорбированного СО2.
Исходя из представленных выше результатов для определения влияния скорости подачи газа на абсорбцию диоксида углерода суспензией фторида кальция использовали 1.5 М суспензию CaF2. Полученные зависимости приведены на рис. 3. Как следует из рисунка, поглощение диоксида углерода, даже при увеличении скорости подачи газа более чем в 14 раз, остается мгновенным, на что указывают начальные линейные участки на кривых абсорбции, соответствующие скорости подачи газа.
Рис. 3.
Зависимости абсорбции СO2 водными суспензиями CaF2 от времени при различных скоростях подачи диоксида углерода.

На основании данных, представленных на рис. 3, были определены количества абсорбированных газов в расчете на 1000 мл суспензии. Полученные результаты показаны на рис. 4. Видно, что с увеличением скорости подачи СО2 его абсорбция суспензией фторида кальция повышается. Вероятнее всего, это обусловлено большей интенсивностью перемешивания системы. Максимальное количество абсорбированного диоксида углерода зафиксировано при скорости подачи газа 100 мл/мин. Дальнейшее увеличение этого параметра приводит к резкому снижению абсорбции, что связано с уменьшением времени взаимодействия реагентов.
Рис. 4.
Зависимость абсорбции СO2 водными суспензиями CaF2 от скорости подачи газа (в расчете на 1000 мл суспензии).

В случае диоксида серы было показано, что его максимальное количество может быть поглощено 0.4 М суспензией CaF2 (рис. 5).
Ранее [11–13] было установлено, что трифторуксусная кислота и трифторацетаты могут многократно использоваться при условии регенерации их растворов кислородом, поэтому была исследована такая возможность и для фторида кальция.
Диоксиды серы и углерода пропускали через суспензии фторидов кальция в воде до тех пор, пока непревращенные диоксиды не фиксировались на выходе из системы. Затем через систему продували кислород воздуха в течение 1 ч, после чего растворы фторида полностью восстанавливали свои окислительные способности.
ЗАКЛЮЧЕНИЕ
Экспериментальные данные показали, что растворы фторидов кальция способны растворять и активировать молекулярный кислород, что делает возможным использование их для окисления как диоксида серы, так и диоксида углерода при стандартных условиях.
Поскольку рассматриваемые газы являются основными компонентами парниковых газов, их утилизация представляет наибольший интерес. Применение суспензий фторида кальция интересно тем, что эти системы гетерогенны в отличие от других фторсодержащих систем, проявляющих окислительные способности.
Список литературы
Вишнецкая М.В., Савицкая Ю.В., Скреплева И.Ю. // Защита окружающей среды в нефтегазовом комплексе. 2010. № 1. С. 32.
Масоуд С.М., Акмалов Т.Р, Артюшин О.И., Бруно К., Осипов С.Н. // Изв. Акад. наук. Сер. хим. 2017. № 9. С. 1601.
Шокова Э.А., Тафеенко В.А., Ковалев В.В. // Журн. орг. химии. 2020. Т. 56. № 10. С. 1605.
Гехман А.Е., Столяров И.П., Ершова Н.В., Моисеева Н.И., Моисеев И.И. // Кинетика и катализ. 2004. Т. 45. № 1. С. 45.
Бучаченко А.Л. // Успехи химии. 1985. Т. 54. № 2. С. 195.
Вишнецкая М.В., Иванова М.С., Солкан В.Н., Жидомиров Г.М., Мельников М.Я. // Журн. физ. химии. 2012. Т. 86. № 5. С. 889.
Вишнецкая М.В., Иванова М.С., Свичкарев О.М., Будынина Е.М., Мельников М.Я. // Журн. физ. химии. 2013. Т. 87. № 5. С.742.
Вишнецкая М.В., Мельников М.Я. // Журн. физ. химии. 2016. Т. 90. № 9. С.1434.
Вишнецкая М.В., Якимова И.Ю., Сидоренкова И.А. // Журн. физ. химии. 2006. № 2. С. 236.
Вишнецкая М.В., Якимова И.Ю., Сидоренкова И.А. // Журн. физ. химии. 2006. № 2. С. 239.
Солкан В.Н., Жидомиров Г.М., Мельников М.Я. // Журн. Хим. физика. 2010. Т. 29. № 10. С. 14.
Скреплева И.Ю., Волошенко Г.И., Либрович Н.Б., Майоров В.Д., Вишнецкая М.В., Мельников М.Я. // Вестник Московского университета. Серия 2. Химия. 2011. Т. 52. № 4. С. 281.
Антропов Л.И. Теоретическая электрохимия. Москва: Высшая школа, 1975. 568 с.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ



