Кинетика и катализ, 2022, T. 63, № 5, стр. 669-675
Кинетические закономерности реакции Кабачника–Филдса при катализе сульфокатионитами на основе нефтяных асфальтенов
Л. Е. Фосс a, *, К. В. Шабалин a, М. Р. Якубов a, Д. Н. Борисов a
a Институт органической и физической химии им. А.Е. Арбузова ФИЦ Казанский научный центр РАН
420088 Казань, ул. Академика Арбузова, 8, Россия
* E-mail: iacw212@gmail.com
Поступила в редакцию 22.04.2022
После доработки 16.05.2022
Принята к публикации 16.05.2022
- EDN: CJBBPD
- DOI: 10.31857/S0453881122050033
Аннотация
Получены сильнокислотные катиониты путем сульфирования и последовательного сульфирования и нитрования нефтяных асфальтенов. Катиониты охарактеризованы методами ИК-спектроскопии, кислотно-щелочным обратным титрованием, морфология поверхности исследована методом сканирующей электронной микроскопии. Кинетические закономерности реакции Кабачника–Филдса исследованы при различных температурах при катализе катионитами на основе асфальтенов и в отсутствие катализатора.
ВВЕДЕНИЕ
В настоящее время разработка эффективных твердых кислотных катализаторов вызывает все больший интерес при проведении различных химических реакций, таких как этерификация, ацетализация, Кабачника–Филдса и др. [1]. В частности, использование твердокислотных сульфокатионитов в кислотно-катализируемых реакциях позволяет избежать ряда существенных проблем – коррозии оборудования, образования кислых стоков и стоков нейтрализации, осмоления продукта. Наиболее распространенные гетерогенные катализаторы получают полимеризацией или поликонденсацией исходных мономерных соединений, содержащих в молекулах ионогенные группы. К ним относятся как отечественные, так и зарубежные ионообменные материалы различных марок (КУ, КФ, Amberlite, Dowex, Resinexm, Purolite и др.) [2]. Альтернативой промышленным кислотным катализаторам могут выступать катализаторы на основе нефтяных асфальтенов, имеющие полиароматический каркас c реакционноспособными центрами [3–6].
Ранее было показано, что сульфокатиониты на основе нефтяных асфальтенов проявляют высокую каталитическую активность в реакциях синтеза ацеталей [7, 8]. Механизм действия гетерогенного кислотного катализатора аналогичен, например, действию серной кислоты, и включает несколько стадий: образование комплекса с водородной связью, перенос протона к субстрату, диссоциация новообразованного комплекса с регенерацией катализатора и образование продукта реакции. Протонодонорность катализатора может быть увеличена введением электроноакцепторных заместителей в его структуру, например, нитрогрупп [9].
Для изучения каталитической активности сульфокатионитов на основе асфальтенов выбрана реакция Кабачника–Филдса. Значимость этой реакции для химической и биологической промышленности показана во многих работах [10–12]. Для ее осуществления применяют различные катализаторы, содержащие в большинстве случаев кислотные центры Льюиса и Бренстеда. Катализаторами реакции Кабачника–Филдса также являются перхлораты металлов; соли цинка, железа и ниобия; трифлаты лантанидов; эфират трехфтористого бора; диоксид титана и др. [13]. В ряде работ [14–16] для интенсификации реакции использовали микроволновое излучение. Данная реакция необратима, а ее кинетические закономерности могут быть изучены методом ЯМР.
Целью настоящей работы является исследование кинетических закономерностей протекания реакции Кабачника–Филдса в присутствии сульфокатионитов на основе нефтяных асфальтенов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сырьем для получения сульфокатионитов служили асфальтены гудрона (АО “ТАНЕКО”), выделенные по методике ASTM D4124-09.
В качестве сульфирующего реагента использовали серную кислоту (95.6%, “Sigma Aldrich”), в качестве нитрующего реагента – азотную кислоту (65%, “Sigma Aldrich”). Бензол (99.8%), циклогексанон (99.5%), анилин (99%), диэтилфосфит (98%) приобретены в “Sigma Aldrich” и применялись без предварительной очистки.
Сульфокатионит синтезирован сульфированием нефтяных асфальтенов по следующей методике: к 40 г серной кислоты при постоянном перемешивании добавляли 2 г асфальтенов фракции 0.2–0.3 мм, полученной при рассеве. Реакцию проводили в круглодонной колбе с обратным холодильником при температуре 120°С в течение 2 ч. По окончании реакции реакционную массу разбавляли 3 л дистиллированной воды, осадок отфильтровывали на воронке Бюхнера и промывали дистиллированной водой до нейтральной реакции на лакмус.
Нитрование сульфокатионита осуществляли обработкой 1 г сульфированных асфальтенов 10 мл азотной кислоты. Реакцию вели при температуре 20°С в течении 24 ч. Продукт выделяли аналогично процессу, описанному выше.
ИК-спектры сульфокатионитов регистрировали на ИК-спектрометре Vector-22 (“Bruker”, Германия) в диапазоне 4000–400 см–1 с разрешением 4 см–1.
Статическую обменную емкость (СОЕ) определяли согласно ASTM D 2187–94.
Морфологию поверхности сульфокатионитов исследовали с помощью сканирующего растрового электронного микроскопа Hitachi ТМ-1000.
Спектры ЯМР 31Р реакционной массы регистрировали на спектрометре Avance-400 (“Bruker”, Германия, 161.9 МГц).
Диэтил[1-(фениламино)циклогексил]фосфонат получен при взаимодействии анилина, диэтилфосфита и циклогексанона (схема 1 ). Реакцию проводили в присутствии и в отсутствие катализатора при температурах 20, 40, 60 и 80°С. Количество катализатора составляло 1% от массы всех реагентов, в качестве растворителя использовали бензол. Пробы на регистрацию ЯМР 31Р спектра отбирали через 10, 20, 30, 60, 120, 180, 240 и 360 мин. Прохождение реакции фиксировали измерением интегральной интенсивности фосфорсодержащих соединений (δР 7.6–8.1 ppm диэтилфосфит (ДЭФ); δР 28.25–28.45 ppm диэтил[1-(фениламино)циклогексил]фосфонат (ДАФ).
Схема 1 . Реакция Кабачника–Филдса.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Одним из распространенных физико-химических методов, позволяющих установить наличие структурных изменений в исследуемом продукте, является ИК-спектроскопия. ИК-спектры исходных асфальтенов, сульфокатионита и нитрованного сульфокатионита представлены на рис. 1. В продукте сульфирования асфальтенов установлено наличие полос средней интенсивности: 1700 см–1 (валентные колебания карбонильной группы С=О); 1609 см–1 (валентные колебания ароматического кольца С=С), и сильной интенсивности: 1159 см‑1 (валентные колебания SO2); 1034 см–1 (валентные колебания S=O) (рис. 1).
Образование карбоксильных групп происходит при окислении α-углеродного атома ароматического кольца, о чем свидетельствует уменьшение интенсивности колебания С–Н-связи в алканах (2929 и 2850 см–1) (рис. 1б). Дальнейшее нитрование сульфокатионита приводит к появлению нитрогрупп, а также увеличивает интенсивность карбонильных групп (1718 см–1). Полосы поглощения 1534 и 1339 см–1 соответствуют асимметричным и симметричным валентным колебаниям группы C–NO2 при ароматическом кольце. Полоса 1339 см–1 характерна для валентных колебаний –ОН-группы в фенолах.
Оценка относительного содержания кислотных центров проведена с определением значения СОЕ. Так, для сульфокатионита СОЕ составило 3.2 мг-экв/г, а для нитрованного сульфокатионита – 4.0 мг-экв/г.
Микрофотографии поверхности модифицированных асфальтенов свидетельствуют, что их сульфирование или нитрование не приводит к образованию пор (рис. 2).
Рис. 2.
Микрофотографии поверхности сульфокатионита (верхний ряд) и нитрованного сульфокатионита (нижний ряд). Увеличение: 200 (а), 400 (б), 600 (в), 1000 (г).

Полученные сульфокатиониты на основе асфальтенов исследованы в реакции Кабачника–Филдса. Известно, что аминофосфонаты могут быть получены при непродолжительном нагревании компонентов в различных растворителях или без них. Выходы аминофосфонатов колеблются в широких пределах и зависят от строения исходных реагентов [17, 18]. Такие компоненты как циклогексанон и анилин не вызывают значительных стерических затруднений, и реакция Кабачника–Филдса проходит уже при небольшом нагревании без катализатора (рис. 3). При температуре 20°С за 6 ч в реакционной массе практически не наблюдается целевого аминофосфаната. С повышением температуры фиксируется рост концентрации продукта реакции и снижение концентрации исходных реагентов. При 40°С за 6 ч ДАФ достигает концентрации 11%, при 60°С – 86%, при 80°С за 2 ч – 92%.
Рис. 3.
Кинетические кривые для ДЭФ (1) и ДАФ (2) в реакции Кабачника–Филдса без катализатора: 20 (а), 40 (б), 60 (в), 80°С (г).

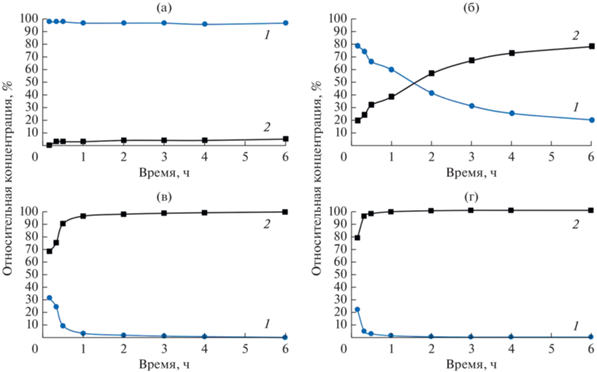
Заметные изменения в кинетике реакции происходят при добавлении сульфокатионита (рис. 4). При 20°С концентрация целевого продукта в реакционной смеси за 6 ч составляет 5%. Концентрация ДАФ в 37.5% наблюдается уже при 40°С за 6 ч, что почти в 3 раза больше, чем в реакции без катализатора. Дальнейшее повышение температуры приводит к преобладанию в реакционной массе ДАФ: при 60°С концентрация в 98% достигается за 6 ч, а при 80°С – за 1 ч.
Рис. 4.
Кинетические кривые для ДЭФ (1) и ДАФ (2) в реакции Кабачника–Филдса в присутствии сульфокатионита: 20 (а), 40 (б), 60 (в), 80°С (г).

Введение в структуру сульфокатионита на основе асфальтенов дополнительно нитрогрупп может усилить протонодонорность сульфогрупп, что будет способствовать ускоренному прохождению реакции. Кинетические закономерности протекания реакции в присутствии нитрованного сульфокатионита свидетельствуют, что заметный эффект проявляется уже при 40°С – за 4 ч концентрация ДАФ в реакционной массе составляет около 73%, за 6 ч – около 79% (рис. 5). Повышение температуры до 60 и 80°С приводит к увеличению скорости реакции, что позволяет наблюдать резкой скачок концентрации ДАФ в реакционной массе. Относительная концентрация ДАФ более чем в 90% достигается за 30 мин при 60°С, а за 20 мин – при 80°С.
ЗАКЛЮЧЕНИЕ
Таким образом, установлено, что твердый катализатор на основе нефтяных асфальтенов, содержащий как сульфокислотные, так и нитрогруппы, обладает высокой каталитической активностью, и позволяет получить диэтил[1-(фениламино)циклогексил]фосфонат с концентрацией 90% в реакционной массе за 30 мин при 60°С, что в 2.8 раза выше, чем в реакции без катализатора. Приготовленные таким образом катализаторы на основе нефтяных асфальтенов могут найти широкое распространение в качестве замены дорогим импортным аналогам.
Список литературы
Полянский Н.Г. Катализ ионитами. Москва: Химия, 1973. 216 с.
Новый справочник химика и технолога: справочное издание, Ч. 2: Сырье и продукты промышленности органических и неорганических веществ. Под ред. Столярова В.А. Санкт-Петербург: Профессионал, 2006. 1142 с.
Yakubov M.R., Gryaznov P.I., Yakubova S.G., Tazeeva E.G., Mironov N.A., Milordov D.V. // Petrol. Sci. Technol. 2016. V. 34. № 22. P. 1805.
Shabalin K.V., Musin L.I., Foss L.E., Nagornova O.A., Morozov V.I., Borisov D.N., Yakubov M.R. // Petrol. Chem. 2022. V. 62. № 2. P. 222.
Nagornova O.A., Foss L.E., Shabalin K.V., Musin L.I., Borisov D.N., Yakubov M.R. // Chem. Technol. Fuels Oils. 2021. V. 57. № 4. P. 645.
Шабалин К.В., Фосс Л.Е., Мусин Л.И., Нагорнова О.А., Губайдуллин А.Т., Сайфина А.Ф., Ханнанов А.А., Вахитов И.Р., Борисов Д.Н. // ХТТМ. 2020. № 4. С. 33. (Shabalin K.V., Foss L.E., Musin L.I., Nagornova O.A., Gubaidullin A.T., Saifina A.F., Khannanov A.A., Vakhitov I.R., Borisov D.N. // Chemistry and Technology of Fuels and Oils. 2020. V. 56. №. 4. P. 558.)
Foss L.E., Shabalin K.V., Musin L.I., Nagornova O.A., Salikhov R.Z., Borisov D.N., Musin R.Z., Yakubov M.R. // Petrol. Chem. 2020. T. 60. № 6. C. 709.
Samoilov V., Kniazeva M., Kuchinskaya T., Maximov A., Foss L., Borisov D., Yakubov M. // Catalysts. 2021. V. 11. № 7. P. 776.
Смит М. Органическая химия Марча. Реакции, механизмы, строение. Углубленный курс. В 4-х томах. Том 1. Москва: Лаборатория знаний, 2020. 458 с. (Smith M.B. March’s advanced organic chemistry: reactions, mechanisms, and structure. – John Wiley & Sons, 2020. 2144 р.). Подробнее: https://www.labirint.ru/books/708200/
Черкасов Р.А., Галкин В.И. // Успехи химии. 1998. Т. 67. № 10. С. 940.
Губницкая Е.С., Пересыпкина Л.П., Самарай Л.И. // Успехи химии. 1990. Т. 59. № 8. С. 1386.
Moonen K., Laureyn I., Stevens C.V. // Chem. Rev. 2004. V. 104. № 12. P. 6177.
Kafarski P., Górniak M.G., Andrasiak I. // Curr. Green Chem. 2015. V. 2. P. 218.
Gangireddy C.S.R., Chinthaparthi R.R., Mudumala V.R., Mamilla M., Arigala U.R.S // Heteroatom Chem. 2014. V. 25. № 3. P. 147.
Nadiveedhi M.R., Nuthalapati P., Gundluru M., Yanamula M.R., Kallimakula S.V., Pasupuleti V.R., Avula V.K.R., Vallela S., Zyryanov G.V., Balam S.K., Cirandur S.R. // ACS omega. 2021. V. 6. № 4. P. 2934.
Bálint E., Tóth R.E., Keglevich G. // Heteroatom Chem. 2016. T. 27. № 5. P. 323.
Varga P.R., Keglevich G. // Molecules. 2021. V. 26. № 9. P. 2511.
Петров К.А., Чаузов В.А., Ерохина Т.С. // Успехи химии. 1974. Т. 43. № 11. С. 2045.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ