Кинетика и катализ, 2022, T. 63, № 5, стр. 661-668
Особенности гидролиза концентрированных водно-щелочных растворов NaBH4 на катализаторе Co/TiO2
С. И. Шабуня a, В. Г. Минкина a, *, В. И. Калинин a
a Институт тепло- и массообмена имени А.В. Лыкова Национальной академии наук Беларуси
220072 Минск, ул. П. Бровки, 15, Республика Беларусь
* E-mail: minkina@dnp.itmo.by
Поступила в редакцию 01.03.2022
После доработки 25.03.2022
Принята к публикации 14.04.2022
- EDN: NTSWQO
- DOI: 10.31857/S0453881122050112
Аннотация
Представлены результаты кинетических экспериментов гидролиза концентрированных водных и водно-щелочными растворов NaBH4 с катализатором Co/TiO2. Эксперименты в водных растворах NaBH4 проведены с моляльными концентрациями 0.25, 1 и 4 моль/кг. В водно-щелочных растворах с моляльными концентрациями NaBH4 0.25 и 1 моль/кг моляльные концентрации NaOH варьировали в интервале 0.05–8 моль/кг. Определены энергии активации в водном (64.3 кДж/моль) и водно-щелочном (53.6 кДж/моль) растворах. Обсуждаются особенности кинетических кривых и возможные кинетические схемы.
ВВЕДЕНИЕ
Внимание к гидролизу щелочных растворов борогидрида натрия (NaBH4) на кобальтовых катализаторах объясняется неожиданным и пока необъясненным эффектом – возрастанием скорости генерации водорода при добавлении щелочи в водный раствор NaBH4 [1, 2]. Еще интереснее, что зависимость от концентрации щелочи немонотонная, максимальные значения скорости генерации водорода наблюдаются при моляльной концентрации NaOH 0.5–3 моль/кг, a дальнейшее увеличение концентрации ведет к уменьшению этой величины [3–10]. В то же время, в случае гомогенного гидролиза и каталитического гидролиза на основе благородных металлов Pt, Ru добавление щелочи приводит к монотонному понижению скорости генерирования водорода [11–13].
Диапазон моляльных концентраций растворов NaBH4 1–4 моль/кг, использованных в настоящей работе, объясняется ориентацией исследований на прикладные задачи, предусматривающие применение NaBH4 в качестве источника водорода для топливных элементов. Моляльные концентрации NaOH варьировали от 0.05 до 8 моль/кг, чтобы охватить режимы и с ростом, и с падением скорости генерации водорода. Растворы с таким составом относятся к электролитам высокой концентрации, что является дополнительной особенностью при построении кинетических схем их гидролиза. В настоящее время отсутствуют не только кинетические схемы для таких процессов, сформулированные в виде математических соотношений, но и качественные объяснения, интерпретирующие все наблюдаемые эффекты с единой позиции [7, 14–16]. Авторы представленной статьи обсуждают возможные схемы сорбционных и кинетических процессов для описания каталитического гидролиза концентрированных водно-щелочных растворов NaBH4.
В качестве косвенного подтверждения роли сорбционных процессов проведены эксперименты и найдены энергии активации для водного раствора и водно-щелочного раствора NaBH4. Значительное уменьшение этой величины в водно-щелочном растворе трактуется как эффект сорбционных характеристик катализатора. Определение энергии активации собственно гетерогенной реакции невозможно без учета процессов сорбции.
Целью настоящей работы является представление экспериментальных данных по каталитическому гидролизу водно-щелочных растворов NaBH4, анализ специфики поведения кинетических кривых и обсуждение возможных механизмов процесса каталитического гидролиза для исследуемого типа катализатора.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходного компонента использовали гранулированный порошок NaBH4 (“Sigma-Aldrich”), содержание основного вещества – 98%.
Катализатор Co был синтезирован методом химического восстановления и нанесен методом пропитки на микронный порошок TiO2 (“Nanography Nano Technology”) с чистотой 99.99%, размер частиц – 325 меш. [17]. Содержание кобальта на поверхности TiO2 составляет 3.4 вес. %.
Эксперименты проводили в реакторе с максимальной герметичностью, все узлы и детали изготовлены из нержавеющей стали. Объем реактора составляет 182.5 см3, диаметр – 5 см. Температуру раствора в реакторе регистрировали датчиком с платиновым термосопротивлением Pt100 (“Autonics Corporation”, Корея). В качестве измерителя давления использовали электронные датчики фирмы “Keller” (Швейцария) на рабочие давления 2.5 и 10 бар. Давление в реакторе изменяли от атмосферного до максимального, которое определяется количеством NaBH4 в растворе. Ориентируясь на максимальное значение, выбирали датчик с соответствующим диапазоном измерения.
Эксперименты проводили в термостате, в котором устанавливали заданную температуру и помещали в него реактор с сухим порошком NaBH4 и катализатором. После нагрева реактора до заданной температуры в него заливали необходимый объем дистиллированной воды или щелочного раствора и реактор герметизировали. Перемешивание реакционной смеси не применяли, так как раствор интенсивно перемешивается всплывающими пузырьками водорода. С момента заливки воды и до окончания гидролиза измеряли две функции – давление в реакторе, пропорциональное количеству выделяющегося водорода, и температура раствора, с помощью которых рассчитывали экспериментальные значения степени разложения $\xi $ и объем генерируемого водорода. Во всех экспериментах использовали 0.05 г катализатора.
Три серии экспериментов по влиянию щелочи на скорость генерирования водорода выполнены при одной температуре 30°С, что упрощает первичный анализ, поскольку в таком случае кинетические характеристики являются просто константами.
Компоненты раствора характеризуем количествами частиц Ni (молей), при этом начальное количество воды всегда 1 кг, т.е. $N_{{{{H}_{2}}O}}^{0}$≡ 1000/18. Начальный трехкомпонентный раствор описывается числами – $N_{{{{H}_{2}}O}}^{0},$ $N_{{NaB{{H}_{4}}}}^{0},$ $N_{{NaOH}}^{0}$, т.е. $N_{{NaB{{H}_{4}}}}^{0}$ и $N_{{NaOH}}^{0}$ являются моляльными концентрациями NaBH4 и NaOH в исходном растворе. По мере гидролиза происходит изменение количества не только разных ионов, содержащих бор, но и молекул воды, т.е. текущие числа Ni будут несколько отличаться от строгого определения моляльных концентраций.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ В ВОДНЫХ РАСТВОРАХ
На рис. 1 приведены графики скорости генерации водорода ${{Q}_{{{{H}_{2}}}}}$ в экспериментах с водными растворами в зависимости от степени гидролиза $\xi $. Использование степени гидролиза вместо времени позволяет удобно сопоставлять результаты разных экспериментов, гидролиз которых занимает разное время.
Рис. 1.
Скорость генерирования водорода при 30°С в присутствии 0.05 г Со/TiO2 в водных растворах c различной моляльной концентрацией NaBH4: 0.25 (1), 1.0 (2) и 4.0 моль/кг (3).

Область $0 \leqslant \xi \leqslant 1$ на рис. 1 можно условно разделить на три подобласти: $\xi < 0.2$, $0.2 < \xi < 0.9$ и $\xi > 0.9$. В центральной области (основная часть гидролиза) скорость генерации водорода почти постоянная, а наблюдаемые отклонения от константы наиболее заметны для раствора с 4 молями NaBH4, но и они небольшие. Падение скорости генерации водорода на конечной стадии гидролиза можно связать с переходом процесса из кинетического в диффузионный режим. Особенности кинетики гидролиза растворов разной концентрации в наибольшей степени проявляются на начальном участке гидролиза.
В точке $\xi $ ≈ 0 измеренная скорость генерации водорода ${{Q}_{{{{H}_{2}}}}}$ отражает не только кинетические особенности гидролиза, но и специфику методики наших экспериментов, поскольку в начальный момент идет растворение порошка NaBH4 и установление циркуляции частиц катализатора в объеме раствора. С учетом сказанного, сравним измеренные значения ${{Q}_{{{{H}_{2}}}}}$ (97, 350 и 1250 мл мин–1 ${\text{г}}_{{{\text{cat}}}}^{{ - 1}}$) с отношениями соответствующих концентраций. Отношение концентраций равно 4, а отношение скоростей ~3.6. Это дает основание предполагать, что в водных растворах в нулевом приближении ${{Q}_{{{{H}_{2}}}}}\left( 0 \right)$ ~ $N_{{NaB{{H}_{4}}}}^{0}$.
Граница перехода от начального участка к “плато” $\xi $ = 0.2–0.3 интересна тем, что три раствора в этой точке имеют разные концентрации, т.е. изменение режима генерации водорода обусловлено не общей концентрацией, а некоторой более тонкой характеристикой раствора. Значение $\xi $ близкое к 0.25 дает основание предполагать, что точка перехода может быть связана с почти полным гидролизом иона $BH_{4}^{ - }$. Схема гидролиза NaBH4 предполагает последовательность четырех необратимых реакций [18, 19]:
(I)
$\begin{gathered} {\text{BH}}_{4}^{ - }\xrightarrow{{ \uparrow {{{\text{H}}}_{{\text{2}}}}}}{\text{B}}{{{\text{H}}}_{{\text{3}}}}{\text{O}}{{{\text{H}}}^{ - }}\xrightarrow{{ \uparrow {{{\text{H}}}_{2}}}} \\ \to {\text{B}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} \left( {{\text{OH}}} \right)_{2}^{ - }\xrightarrow{{ \uparrow {{{\text{H}}}_{2}}}}{\kern 1pt} \\ \to \,\,{\text{BH}}{\kern 1pt} \left( {{\text{OH}}} \right)_{3}^{ - }\xrightarrow{{ \uparrow {{{\text{H}}}_{2}}}}{\text{B}}{\kern 1pt} \left( {{\text{OH}}} \right)_{4}^{ - }. \\ \end{gathered} $Конечным продуктом гидролиза является раствор $NaB{{\left( {OH} \right)}_{4}}$.
Широко распространена гипотеза, что в гомогенном процессе самая медленная первая стадия: ${\text{BH}}_{4}^{ - }\xrightarrow{{ \uparrow {{{\text{H}}}_{{\text{2}}}}}}{\text{B}}{{{\text{H}}}_{{\text{3}}}}{\text{O}}{{{\text{H}}}^{ - }}$. Согласно данным [18] скорость третьей стадии примерно в 2 раза больше скорости гидролиза главного иона, а скорости второй и четвертой стадий примерно в 1000 раз больше первой. В большинстве предлагаемых кинетических моделей стадии 2–4 считаются быстрыми, т.е. мгновенными. В таком приближении гомогенный процесс после начального периода установления квазистационарного распределения компонент раствора протекает с самосогласованным монотонным уменьшением количества четырех ионов, содержащих бор: ${{N}_{{BH_{4}^{ - }}}}$, ${{N}_{{B{{H}_{3}}OH_{{}}^{ - }}}}$, ${{N}_{{B{{H}_{2}}\left( {OH} \right)_{2}^{ - }}}}$, ${{N}_{{BH\left( {OH} \right)_{3}^{ - }}}}$.
Можно предположить, что соотношение скоростей, характерное для гомогенного гидролиза, изменяется в случае гетерогенных реакций на рассматриваемом катализаторе Со/TiO2. Самой медленной гетерогенной стадией может стать, например, третья: ${\text{B}}{{{\text{H}}}_{{\text{2}}}}\left( {{\text{OH}}} \right)_{2}^{ - }\xrightarrow{{ \uparrow {{{\text{H}}}_{2}}}}{\text{BH}}\left( {{\text{OH}}} \right)_{3}^{ - }$. В таком случае до момента почти полного гидролиза иона $BH_{4}^{ - }$ скорость генерации водорода будет понижаться, а затем стабилизируется на значении, определяемом самой медленной стадией.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ В ВОДНО-ЩЕЛОЧНЫХ РАСТВОРАХ
На рис. 2 приведены графики изменения скорости генерации водорода ${{Q}_{{{{H}_{2}}}}}$ в экспериментах с водно-щелочными растворами в зависимости от степени гидролиза $\xi $. Числа на линиях указывают моляльную концентрацию $N_{{NaOH}}^{0}$.
Рис. 2.
Скорость генерирования водорода при 30°С в присутствии 0.05 г Со/TiO2 в водно-щелочных растворах c моляльной концентрацией NaBH4 равной 0.25 (a) и 1.0 моль/кг (б). Цифры на линиях указывают моляльную концентрацию NaOH. Пунктиром на графиках изображены кривые с рис. 1 (${{N}_{{NaOH}}}$ = 0).

Графики ${{Q}_{{{{H}_{2}}}}}$ демонстрируют немонотонную зависимость как от $N_{{NaOH}}^{0}$, так и от $\xi $. Максимальные значения ${{Q}_{{{{H}_{2}}}}}$ наблюдаются при $N_{{NaOH}}^{0}$ ≈1–2 моля. Анализ кинетических кривых на рис. 2 можно разделить на три подобласти: $\xi < 0.1$, $0.1 < \xi < 0.8$ и $\xi > 0.8$. Поведение кинетических кривых в области начала гидролиза на рис. 2 принципиально отличается от поведения кривых на рис. 1 – рост против падения. Объяснение этому можно искать в особенностях процессов сорбции/десорбции в сильнощелочных растворах, но можно предположить и физическую причину. В рамках такой гипотезы наблюдаемый рост скорости генерации водорода в области $\xi < 0.1$ в большей мере связан с процессами растворения и формирования начальной циркуляции в растворе. Дело в том, что с увеличением концентрации щелочи растет вязкость раствора, в результате чего замедляются и растворение, и конвекция.
В области $0.1 < \xi < 0.8$ можно отметить общую тенденцию поведения функций ${{Q}_{{{{H}_{2}}}}}\left( \xi \right)$ для растворов с $N_{{NaOH}}^{0}$ > 2 – уменьшение генерации водорода с ростом $\xi $. Для растворов с $N_{{NaOH}}^{0}$ < 1, наоборот, функции ${{Q}_{{{{H}_{2}}}}}\left( \xi \right)$ или растут, или близки к константе. Поведение функций ${{Q}_{{{{H}_{2}}}}}\left( \xi \right)$ в области $\xi > 0.8$ мы по-прежнему склонны объяснять переходом гидролиза в диффузионный режим.
Выявленные экспериментально особенности гидролиза водных и водно-щелочных растворов NaBH4 являются материалом для построения кинетических схем процесса на исследуемом катализаторе.
ОБСУЖДЕНИЕ ВОЗМОЖНЫХ СХЕМ КИНЕТИЧЕСКИХ ПРОЦЕССОВ
Ускорение каталитического гидролиза на кобальтовых катализаторах при добавлении щелочи – неожиданный факт, поскольку при гомогенном гидролизе добавление щелочи к водному раствору всегда замедляет процесс. Введение NaOH в водный раствор NaBH4 не изменяет список компонент раствора, но увеличивает количество ионов $N{{a}^{ + }}$ и $O{{H}^{ - }}$. В водных растворах NaBH4 концентрация ионов $O{{H}^{ - }}$ устанавливается самосогласованно с химическими процессами гидролиза и изменяется с изменением $\xi $. В водно-щелочных растворах в рассматриваемом диапазоне $N_{{NaOH}}^{0}$ (0.05–8 моль) количество ионов $O{{H}^{ - }}$ практически равно количеству исходных молей NaOH, что влияет на равновесие обратимых реакций в растворе.
Главная гомогенная обратимая реакция в растворах NaBH4 – это образование и разрушение метастабильного нейтрального комплекса $\left[ {BH_{4}^{ - } \cdot {{H}^{ + }}} \right]$. Прямую реакцию можно записать двумя способами:
(III)
$BH_{4}^{ - } + {{H}_{2}}O\xrightarrow{{}}\left[ {BH_{4}^{ - } \cdot {{H}^{ + }}} \right] + O{{H}^{ - }}.$Аналогично, обратные процессы могут иметь два канала:
(IV)
$\left[ {BH_{4}^{ - } \cdot {{H}^{ + }}} \right] + {{H}_{2}}O\xrightarrow{{}}BH_{4}^{ - } + {{H}_{3}}{{O}^{ + }},$(V)
$\left[ {BH_{4}^{ - } \cdot {{H}^{ + }}} \right] + O{{H}^{ - }}\xrightarrow{{}}BH_{4}^{ - } + {{H}_{2}}O.$Для сокращения записи далее будем использовать обозначение $\left[ {Comp} \right] \equiv \left[ {BH_{4}^{ - } \cdot {{H}^{ + }}} \right]$. При записи равновесия реакций (II)–(V) количество комплексов ${{N}_{{\left[ {Comp} \right]}}}$ будет пропорционально количеству ионов ${{N}_{{BH_{4}^{ - }}}}$, а вот функциональная зависимость от количества ионов ${{N}_{{O{{H}^{ - }}}}}$ определяется соотношением скоростей реакций (II)–(V). Можно выделить три варианта:
– в случае преобладания реакций (III), (IV) зависимости ${{N}_{{\left[ {Comp} \right]}}}$ от ${{N}_{{O{{H}^{ - }}}}}$ нет;
– в случае преобладания реакций (II), (IV) или (III), (V) ${{N}_{{\left[ {Comp} \right]}}}$~${{N}_{{H_{2}^{{}}O}}}{\text{/}}{{N}_{{O{{H}^{ - }}}}}$;
– в случае преобладания реакций (II), (V) ${{N}_{{\left[ {Comp} \right]}}}$ ~ ${{\left( {{{N}_{{H_{2}^{{}}O}}}{\text{/}}{{N}_{{O{{H}^{ - }}}}}} \right)}^{2}}$.
При гидролизе водных растворов NaBH4 количество ионов ${{N}_{{O{{H}^{ - }}}}}$ устанавливается самосогласованно с количеством комплексов $\left[ {Comp} \right]$ и молекул борной кислоты, которая образуется в результате реакции диссоциации:
В начале гидролиза при $\xi $ ≈ 0 борной кислоты нет, и количество ионов ${{N}_{{O{{H}^{ - }}}}}$ приблизительно равно количеству комплекса ${{N}_{{\left[ {Comp} \right]}}}$. Соответственно, получаем три асимптотики: ${{N}_{{O{{H}^{ - }}}}}$ ≈ ≈ ${{N}_{{\left[ {Comp} \right]}}}$ ~ $N_{{NaB{{H}_{4}}}}^{0}$, ${{N}_{{O{{H}^{ - }}}}}$ ≈ ${{N}_{{\left[ {Comp} \right]}}}$ ~ $\sqrt {N_{{NaB{{H}_{4}}}}^{0}} $ и ${{N}_{{O{{H}^{ - }}}}}$ ≈ ${{N}_{{\left[ {Comp} \right]}}}$ ~ $\sqrt[3]{{N_{{NaB{{H}_{4}}}}^{0}}}$. В экспериментах, которые демонстрирует рис. 1, скорость генерации водорода при $\xi $ ≈ 0 возрастала в 3.6 раз при увеличении $N_{{NaB{{H}_{4}}}}^{0}$ в 4 раза. Такой факт порождает гипотезу, что для расчета ${{N}_{{\left[ {Comp} \right]}}}$ надо использовать уравнения (III)–(V), причем процесс (IV) интенсивнее процесса (V). С другой стороны, специфика использованной методики экспериментов, обсуждавшаяся выше, может сильно сказываться на значениях ${{Q}_{{{{H}_{2}}}}}\left( 0 \right)$, т.е. “маскировать” реальную асимптотику. Дополнительную информацию о поведении ${{N}_{{\left[ {Comp} \right]}}}$ при гидролизе водных растворов можно попытаться получить, разработав методику измерения рН этих растворов во время гидролиза.
В водно-щелочных растворах ${{N}_{{O{{H}^{ - }}}}} \approx N_{{NaOH}}^{0},$ и это означает уменьшение ${{N}_{{\left[ {Comp} \right]}}}$ с ростом $N_{{NaOH}}^{0}$, исключая случай преобладания реакций (III), (IV), когда ${{N}_{{\left[ {Comp} \right]}}}$ не зависит от $N_{{NaOH}}^{0}$. Если количество комплексов в растворе уменьшается, то снижается их роль в процессах сорбции/десорбции.
Гетерогенные реакции протекают на адсорбированных катализатором нейтральных частицах раствора. Частицы различных сортов могут конкурировать друг с другом за адсорбционные центры. Увеличение начальной концентрации $N_{{NaB{{H}_{4}}}}^{0}$ и/или $N_{{NaOH}}^{0}$ ведет к изменению концентраций компонент раствора, и соответственно, изменению долей адсорбированных частиц разного сорта. В водно-щелочных растворах NaBH4 нейтральные частицы – это молекулы воды и борной кислоты, а также комплекс $\left[ {Comp} \right]$. В ходе гидролиза с ростом $\xi $ уменьшается количество комплексов ${{N}_{{\left[ {Comp} \right]}}}$ и увеличивается количество борной кислоты ${{N}_{{B{{{\left( {OH} \right)}}_{3}}}}}$. Количество молекул воды тоже немного снижается. Хотя в растворе ${{N}_{{\left[ {Comp} \right]}}}$ $ \ll $ ${{N}_{{BH_{4}^{ - }}}}$ $ \ll $ $N_{{{{H}_{2}}O}}^{0},$ в адсорбированном состоянии комплекс ${{\left[ {Comp} \right]}^{S}}$ может быть достаточно устойчивым и активным, чтобы воздействовать на гидролиз.
Для необратимых гетерогенных реакций можно предложить несколько вариантов реакций на адсорбированных молекулах воды ${{H}_{2}}{{O}^{S}}$ и комплексах ${{\left[ {Comp} \right]}^{S}}$, но нет вариантов реакций с участием молекул $B\left( {OH} \right)_{3}^{S}$, которые могут влиять на гидролиз пассивным образом – занимая адсорбционные центры катализатора. Для описания процессов сорбции/десорбции введем обозначения: ${{\varepsilon }_{{empt}}}$ – доля свободной поверхности, ${{\varepsilon }_{{{{H}_{2}}O}}}$ – доля поверхности, занятой молекулами ${{H}_{2}}{{O}^{S}},$ ${{\varepsilon }_{{B{{{\left( {OH} \right)}}_{3}}}}}$ – доля поверхности, занятой молекулами $B\left( {OH} \right)_{3}^{S}$, ${{\varepsilon }_{{\left[ {Comp} \right]}}}$ – доля поверхности, занятой комплексом ${{\left[ {Comp} \right]}^{S}}$.
(1)
${{\varepsilon }_{{{{H}_{2}}O}}} + {{\varepsilon }_{{\left[ {Comp} \right]}}} + {{\varepsilon }_{{B{{{\left( {OH} \right)}}_{3}}}}} + {{\varepsilon }_{{empt}}} = 1.$В случае, когда самая медленная реакция в цепочке (I) первая, достаточно рассматривать только гетерогенные процессы, связанные с ионом ${\text{BH}}_{4}^{ - }$ (остальные три реакции – быстрые). Необратимые реакции на ${{H}_{2}}{{O}^{S}}$ и ${{\left[ {Comp} \right]}^{S}}$ можно записать в следующем виде:
(VII)
$\begin{gathered} {{H}_{2}}{{O}^{S}} + BH_{4}^{ - } \to {{H}_{2}} + B{{H}_{3}}O{{H}^{ - }}, \\ {{H}_{2}}{{O}^{S}} + \left[ {BH_{4}^{ - } \cdot {{H}^{ + }}} \right] \to {{H}_{2}} + \left[ {B{{H}_{3}}O{{H}^{ - }} \cdot {{H}^{ + }}} \right]; \\ \end{gathered} $(VIII)
$\begin{gathered} {{\left[ {BH_{4}^{ - } \cdot {{H}^{ + }}} \right]}^{S}} + O{{H}^{ - }} \to {{H}_{2}} + B{{H}_{3}}O{{H}^{ - }}, \\ {{\left[ {BH_{4}^{ - } \cdot {{H}^{ + }}} \right]}^{S}} + {{H}_{2}}O \to {{H}_{2}} + \left[ {B{{H}_{3}}O{{H}^{ - }} \cdot {{H}^{ + }}} \right]. \\ \end{gathered} $В такой модели и ионы ${\text{BH}}_{4}^{ - },$ и комплексы $\left[ {Comp} \right]$ существуют все время гидролиза, асимптотически стремясь к нулю в его конце. Скорость реакций (VII) пропорциональна количеству ${{\varepsilon }_{{{{H}_{2}}O}}}$ и потоку ионов ${\text{BH}}_{4}^{ - }$ или комплексов $\left[ {Comp} \right]$ из раствора на катализатор. До тех пор, пока поток скорости гетерогенной реакции ${{R}_{{{{H}_{2}}O}}}$ будет меньше диффузионного потока инициирующих реакцию частиц (${\text{BH}}_{4}^{ - }$ или $\left[ {Comp} \right]$), реакция будет проходить в кинетическом режиме ${{Q}_{{{{H}_{2}}}}}$~${{\varepsilon }_{{{{H}_{2}}O}}}{{R}_{{{{H}_{2}}O}}}$. Если же соотношение скоростей обратное, то процесс с самого начала будет идти в диффузионном режиме, тогда ${{Q}_{{{{H}_{2}}}}}$~${{\varepsilon }_{{{{H}_{2}}O}}}{{R}_{{{{H}_{2}}O}}}{{N}_{{{\text{BH}}_{4}^{ - }}}}$. В любом случае завершение гидролиза по реакции (VII) будет протекать в диффузионном режиме. Скорость гетерогенной реакции ${{R}_{{{{H}_{2}}O}}}$ является функцией только температуры, и в изотермическом процессе это константа. Сорбционная характеристика ${{\varepsilon }_{{{{H}_{2}}O}}}$ кроме температуры зависит и от соотношения сорбирующихся компонент раствора, т.е. и от начального состава раствора, и от степени гидролиза. Отметим также, что зависимости от температуры у ${{R}_{{{{H}_{2}}O}}}$ и ${{\varepsilon }_{{{{H}_{2}}O}}}$ противоположные – с повышением температуры скорость растет, а адсорбция падает, т.е. влияние характеристики ${{\varepsilon }_{{{{H}_{2}}O}}}$ будет выражаться в уменьшении энергии активации, определяемой по скорости выделения водорода.
В случае реакций (VIII) количество ионов $O{{H}^{ - }}$ и молекул ${{H}_{2}}O$ слабо изменяется в ходе гидролиза и не стремится к нулю, в то время как ${{\varepsilon }_{{\left[ {Comp} \right]}}}$ падает, стремясь к нулю по мере роста степени гидролиза. Это значит, что генерация водорода по этому каналу, скорее всего, будет протекать в кинетическом режиме ${{Q}_{{{{H}_{2}}}}}$ ~ ${{\varepsilon }_{{\left[ {Comp} \right]}}}{{R}_{{\left[ {Comp} \right]}}}$, но со скоростью, постоянно снижающейся пропорционально уменьшению ${{\varepsilon }_{{\left[ {Comp} \right]}}}$, что будет выглядеть как реакция первого порядка.
Если же предположить, что в некотором интервале степеней гидролиза скорость третьей реакции в цепочке (I) меньше первой, то кинетическая схема усложняется, и необходимо моделировать эволюцию и иона ${\text{BH}}_{4}^{ - }$, и иона ${\text{B}}{{{\text{H}}}_{2}}\left( {{\text{OH}}} \right)_{2}^{ - }$. Ионы ${\text{B}}{{{\text{H}}}_{3}}{\text{O}}{{{\text{H}}}^{ - }}$ и ${\text{BH}}\left( {{\text{OH}}} \right)_{3}^{ - }$ по-прежнему можно считать короткоживущими. Наиболее вероятным каналом гидролиза для иона ${\text{B}}{{{\text{H}}}_{2}}\left( {{\text{OH}}} \right)_{2}^{ - }$ является (VII), т.е. на адсорбированных молекулах воды. Количество неизвестных кинетических констант увеличивается, и, соответственно, растет трудность настройки модели такого сорта. В любом случае, для моделирования каталитического гидролиза необходимо описывать процессы сорбции/десорбции, которые запишем в виде:
(IX)
$\begin{gathered} {{H}_{2}}O + {{\varepsilon }_{{empt}}} \to {{H}_{2}}{{O}^{S}}, \\ {{H}_{2}}{{O}^{S}} + {{M}_{{{{H}_{2}}O}}} \to {{H}_{2}}O + {{M}_{{{{H}_{2}}O}}} + {{\varepsilon }_{{empt}}}, \\ \left[ {Comp} \right] + {{\varepsilon }_{{empt}}} \to {{\left[ {Comp} \right]}^{S}}, \\ {{\left[ {Comp} \right]}^{S}} + {{M}_{{\left[ {Comp} \right]}}} \to \left[ {Comp} \right] + {{M}_{{\left[ {Comp} \right]}}} + {{\varepsilon }_{{empt}}}, \\ B{{\left( {OH} \right)}_{3}} + {{\varepsilon }_{{empt}}} \to B\left( {OH} \right)_{3}^{S}, \\ B\left( {OH} \right)_{3}^{S} + {{M}_{{B{{{\left( {OH} \right)}}_{3}}}}} \to \\ \to B{{\left( {OH} \right)}_{3}} + {{M}_{{B{{{\left( {OH} \right)}}_{3}}}}} + {{\varepsilon }_{{empt}}}, \\ \end{gathered} $Десорбция происходит в результате столкновения адсорбированных частиц с частицами раствора, причем вероятность десорбции будет зависеть от сорта частиц. Основные частицы – это молекулы воды. Роль ионов, содержащих бор, как инициаторов десорбции будем считать незначительной. В электролитах в результате гидратации ионов молекулы воды делятся на “свободные” ${{H}_{2}}{{O}^{F}}$ и ассоциированные с ионами $N{{a}^{ + }}$ и $O{{H}^{ - }}$, для которых примем обозначение ${{H}_{2}}{{O}^{I}}$. Такое деление молекул воды является способом учета специфики электролитов высокой концентрации без помощи модели “активностей”. Подобный подход применялся нами в [20] для расчета рН растворов метабората натрия. Количество молекул ${{H}_{2}}{{O}^{I}}$ зависит от количества ионов $N{{a}^{ + }}$ и $O{{H}^{ - }}$. Для упрощения модели можно использовать единое гидратационное число $k$:
(2)
$\begin{gathered} {{N}_{{{{H}_{2}}O}}} = {{N}_{{{{H}_{2}}{{O}^{F}}}}} + {{N}_{{{{H}_{2}}{{O}^{I}}}}} \\ {{N}_{{{{H}_{2}}{{O}^{I}}}}} = Min\left[ {{{N}_{{{{H}_{2}}O}}},\;k\left( {{{N}_{{N{{a}^{ + }}}}} + {{N}_{{O{{H}^{ - }}}}}} \right)} \right] \equiv \\ \equiv Min\left[ {{{N}_{{{{H}_{2}}O}}},\;k\left( {N_{{NaB{{H}_{4}}}}^{0} + 2N_{{NaOH}}^{0}} \right)} \right], \\ \end{gathered} $В (IX) для частиц инициаторов десорбции использованы обозначения ${{M}_{{{{H}_{2}}O}}}$, ${{M}_{{\left[ {Comp} \right]}}}$ и ${{M}_{{B{{{\left( {OH} \right)}}_{3}}}}}$, которые могут являться индивидуальными комбинациями ${{H}_{2}}{{O}^{F}}$ и ${{H}_{2}}{{O}^{I}}$. Простейший вариант – это для всех ${{M}_{i}}$ принять единое выражение:
(3)
${{N}_{{{{M}_{i}}}}} = {{N}_{{{{H}_{2}}{{O}^{F}}}}} + \beta {{N}_{{{{H}_{2}}{{O}^{I}}}}} = {{N}_{{{{H}_{2}}O}}} + \left( {\beta - 1} \right){{N}_{{{{H}_{2}}{{O}^{I}}}}},$Уравнения сорбционных процессов (1) и (IX) представляют общий случай, описывающий все возможные комбинации интенсивностей этих процессов. В то же время существуют два предельных варианта, которые сокращают число неизвестных констант. Самый простой вариант – это ситуация относительно малого заполнения поверхности катализатора активными частицами:
(4)
${{\varepsilon }_{{{{H}_{2}}O}}} + {{\varepsilon }_{{\left[ {Comp} \right]}}} + {{\varepsilon }_{{B{{{\left( {OH} \right)}}_{3}}}}} \ll {{\varepsilon }_{{empt}}} \Rightarrow {{\varepsilon }_{{empt}}} \approx 1.$В таком случае частицы не конкурируют между собой. Обратный случай – это максимальная конкуренция, когда свободных сайтов почти нет:
(5)
${{\varepsilon }_{{{{H}_{2}}O}}} + {{\varepsilon }_{{\left[ {Comp} \right]}}} + {{\varepsilon }_{{B{{{\left( {OH} \right)}}_{3}}}}} \gg {{\varepsilon }_{{empt}}} \Rightarrow {{\varepsilon }_{{empt}}} \approx 0.$Приведенные выше принципы построения модели каталитического гидролиза отражают наш подход к этой проблеме.
Гетерогенные реакции протекают на поверхности катализатора, а точнее, на адсорбированных из раствора частицах определенного сорта. На активных центрах катализатора могут сорбироваться разные частицы, т.е. существует конкуренция между частицами – инициаторами реакций и “инертными”. Общепринятой практикой обобщения данных серии изотермических экспериментов является определение энергии активации (Ea) для модели Аррениуса скорости химической реакции $R = A\exp \left( { - {{E}_{a}}{\text{/}}{{R}_{g}}{\text{/}}T} \right)$, где Rg – универсальная газовая постоянная. В гомогенных процессах параметр Ea характеризует энергетический барьер реакции. В случае каталитических гетерогенных реакций формальное определение энергии активации по выходу продукта не учитывает тот факт, что скорость выхода продукта $R$ есть произведение поверхности, занятой “активными” частицами $({{\varepsilon }_{{\text{a}}}}),$ на собственно вероятность химической реакции, т.е. $R = \varepsilon \exp \left( { - {{E}_{a}}{\text{/}}{{R}_{g}}{\text{/}}T} \right)$. И если скорость гетерогенной реакции зависит только от температуры, то $\varepsilon $ является функцией не только температуры, но и состава раствора (концентраций компонент).
При традиционной обработке кинетических данных с целью определения энергии активации принимается, что R – это функция только температуры. Понятно, что такая энергия активации скрытым образом зависит от сорбционных свойств поверхности и концентрации раствора.
Это означает, что при использовании брутто-подхода, т.е. без разделения характеристик сорбции и реакции, энергия активации будет разной для разных концентраций $N_{{NaB{{H}_{4}}}}^{0}$ и $N_{{NaOH}}^{0}$.
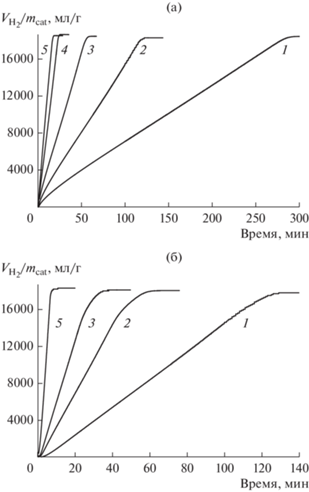
Для демонстрации этого факта были проведены эксперименты в интервале температур 293–333 K в водном и водно-щелочном растворе NaBH4 с моляльной концентрацией 1.0 моль/кг. Моляльная концентрация щелочи – 1.0 моль/кг. Энергию активации определяли с помощью линейных аппроксимаций кинетических кривых на участке $\xi $ = 0.1–0.9 (рис. 3). Рассчитанные скорости генерирования водорода использовали для получения аппроксимации коэффициентов Аррениуса (рис. 4). Значения энергии активации для водного и водно-щелочного растворов составили 64.3 и 53.6 кДж/моль соответственно. Как и ожидалось, имеет место зависимость энергии активации от состава раствора.
ЗАКЛЮЧЕНИЕ
Полученные зависимости скорости генерирования водорода от добавляемой щелочи демонстрируют немонотонный характер, как от концентрации щелочи, так и от степени разложения NaBH4. Максимальные значения скорости генерирования водорода наблюдаются при $N_{{NaOH}}^{0}$ ≈ 1–2 моля, что согласуется с существующими оценками этой величины для ряда катализаторов на основе кобальта [10, 21].
Представлена схема сорбционных и кинетических процессов для описания каталитического гидролиза концентрированных водно-щелочных растворов NaBH4.
Найденные значения энергии активации, определяемые по скорости выделения водорода, являются брутто-характеристиками, поскольку не различают скорость гетерогенной реакции и сорбционные свойства поверхности катализатора. Степень заполнения поверхности катализатора активными частицами зависит не только от температуры, но и от состава раствора. В результате, в брутто-аппроксимации Аррениуса оба коэффициента оказываются функциями концентрации раствора. Определение энергии активации собственно гетерогенной реакции невозможно без учета процессов сорбции.
Список литературы
Li Q., Hern Kim H. // Fuel Processing Technology. 2012. V. 100. P. 43.
Chou C.C., Hsieh C.H., Chen B.H. // Energy. 2015. V. 90. № 2. P. 1973.
Metin O., Ozkar S. // Energy & Fuels. 2009. V. 23. P. 3517.
Ingersoll J.C., Mani N., Thenmozhiyal J.C., Muthaiah A. // J. Power Sources. 2007. V. 173. № 1. P. 450.
Li Q., Kim H. // Fuel Proc. Technol. 2012. V. 100. P. 43.
Hansu T.A., Caglar A., Sahin O., Kivrak H. // Mater. Chem. Phys. 2020. V. 239. P. 122031.
Ekinci A., Horoz S., Baytar O., Şahin Ö. // J. Optoelectron. Biomed. Mater. 2020. V. 12. № 2. P. 25.
Didehban A., Zabihi M., Shahrouzi J.R. // Int. J. Hydrogen Energy. 2018. V. 43. № 45. P. 20645.
Xu J., Du X., Wei Q., Huang Y. // ChemistrySelect. 2020. V. 5. P. 6683.
Wang L., Li Z., Zhang Y., Zhang T., Xie G. // J. Alloys Compds. 2017. V. 702. P. 649.
Shang Y., Chen R., Jiang G. // Int. J. Hydrogen Energy. 2008. V. 33. № 22. P. 6719.
Huang Y.-H., Su C.-C., Wang S.-C., Lu M.-C. // Energy. 2012. V. 46. P. 242.
Demirci U.B., Garin F. // J. Alloys Compds. 2008. V. 463. P. 107.
Zhang Q., Wu Y., Sun X., Ortega J. // Ind. Eng. Chem. Res. 2007. V. 46. P. 1120.
Shen X., Wang Q., Wu Q., Guo S., Zhang Z., Sun Z., Liu B., Wang Z., Zhao B., Ding W. // Energy. 2015. V. 90. № 1. P. 464.
Xie L., Wang K., Du G., Asiri A.M., Sun X. // Int. J. Hydrogen Energy. 2017. V. 42. № 2. P. 30639.
Шабуня С.И., Минкина В.Г., Калинин В.И., Санкир Н.Д., Алтаф С.Т. // Кинетика и катализ. 2021. Т. 62. № 3. С. 305.
Мочалов К.Н., Хаин В.С. // Кинетика и катализ. 1965. Т. 6. № 4. С. 541.
Kreevoy M.M., Hutchins J.E.C. // J. Am. Chem. Soc. 1972. V. 94. P. 6371.
Шабуня С.И., Минкина В.Г., Мартыненко В.В., Калинин В.И. // Изв. Акад. наук. Сер. хим. 2019. № 6. С. 1183.
Wei Y., Wang R., Meng L., Wang Y., Li G., Xin S., Zhao X., Zhang K. // Int. J. Hydrogen Energy. 2017. V. 42. № 15. P. 9945.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ