Кинетика и катализ, 2022, T. 63, № 5, стр. 584-591
Марганцевые катализаторы окисления летучих органических соединений с участием озона: влияние соотношения Mn3+/Mn4+ активных центров на каталитические свойства
А. И. Мытарева a, *, А. С. Гилёв b, И. С. Машковский a, Д. А. Бокарев a, Г. Н. Баева a, С. А. Канаев a, А. В. Казаков a, А. Ю. Стахеев a
a ФГБУН Институт органической химии им. Н.Д. Зелинского РАН
119991 Москва, Ленинский просп., 47, Россия
b Высший химический колледж РАН РХТУ им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: aim@ioc.ac.ru
Поступила в редакцию 02.03.2022
После доработки 30.05.2022
Принята к публикации 31.05.2022
- EDN: DRIOEB
- DOI: 10.31857/S0453881122050094
Аннотация
Изучены каталитические свойства нанесенных катализаторов Mn/носитель (носитель: Al2O3, SiO2, SiO2–Al2O3) в реакции окисления летучих органических соединений (на примере н-С4Н10) с участием озона в интервале температур 25–350°С. Методами РФА и ТПВ-Н2 показано, что носитель оказывает существенное влияние на валентное состояние марганца в нанесенном оксиде: на поверхности SiO2 марганец находится преимущественно в виде Mn3+ (Mn2O3 и Mn3O4), в то время как в катализаторах Mn/Al2O3, Mn/SiO2–Al2O3 преобладает Mn4+ (MnO2) форма. Сопоставление данных о составе активных фаз MnOx и каталитических свойствах в реакции окисления н-С4Н10 с участием озона позволило установить, что увеличение содержания Mn3+ центров способствует повышению каталитической активности Mn/носитель. Однако избыточное количество Mn3+ приводит к расходованию озона в побочной реакции с образованием О2, вследствие чего заметно снижается эффективность окисления н-С4Н10. Полученные данные позволяют сделать вывод, что для достижения максимальной активности катализатора в окислении н-C4H10 с участием озона необходимо обеспечить оптимальное соотношение Mn3+/Mn4+.
ВВЕДЕНИЕ
Очистка отходящих газов промышленных предприятий и выхлопных газов автотранспорта от примесей летучих органических соединений (ЛОС) является одной из важнейших задач в области охраны окружающей среды. ЛОС участвуют в атмосферных фотохимических реакциях, приводящих к образованию смога, кроме того, большинство из них токсичны, обладают мутагенным и канцерогенным действием [1–3]. К числу наиболее опасных ЛОС, в отношении которых в Российской Федерации применяются меры государственного регулирования в области охраны окружающей среды, относят алканы С2–С19, алкены С2–С6, ксилол, кумол, бензол, фенол, стирол и др. [4].
Для нейтрализации ЛОС наиболее широко используются процессы термического [3, 5] и каталитического [6–8] окисления молекулярным кислородом до СО2 и воды. Однако эти процессы в ряде случаев имеют недостаточную селективность и низкую энергоэффективность, поскольку для их проведения требуются высокие температуры. В последние несколько лет значительное внимание уделяется разработке метода каталитического окисления с участием озона, позволяющего удалять ЛОС даже при комнатной температуре [9–12]. Суть метода заключается в окислении ЛОС высоко реакционноспособным атомарным кислородом, образующимся в результате каталитического разложения молекулы О3, механизм которого включает в себя следующие основные стадии [13–15]:
Символом “*” обозначен активный центр на поверхности катализатора.
Анализ литературы показал, что каталитическое окисление ЛОС с участием озона является перспективным методом для нейтрализации толуола, бензола, формальдегида, ацетона и т.д. Кроме того, он может быть с высокой эффективностью использован даже для удаления алканов, например, метана и н-бутана, реакционная способность которых заметно ниже по сравнению с алкенами или ароматическими углеводородами [16, 17]. Так, в работе [17] установлено, что добавление озона позволяет снизить температуру каталитического окисления н-С4Н10 с 225 до 25°C, при этом полной конверсии углеводорода удается достичь уже при 125°C.
Среди предложенных в литературе катализаторов для реакции окисления ЛОС с участием озона наиболее высокой эффективностью обладают Mn-содержащие системы, нанесенные на оксидные и цеолитные носители. При исследовании каталитических свойств серии катализаторов M/SiO2 (M = Mn, Fe, Co, Ni, Cu) в окислении бензола было обнаружено, что максимальную активность и селективность по CO2 проявляет Mn/SiO2 [18]. Схожие результаты получены в работе [19], посвященной изучению реакции окисления толуола в присутствии озона на цеолитных катализаторах M/13X (M = Mn, Ce, Cu, Ag, Co; 13X – цеолит NaX). Авторами установлено, что каталитическая активность увеличивается в ряду: Co/13X < Ag/13X < Cu/13X < Ce/13X < Mn/13X.
Высокая активность Mn-катализаторов обусловлена протеканием на наночастицах MnOx реакции разложения молекулы О3 (ключевой стадии процесса окисления ЛОС с участием озона) и образованием активных форм кислорода [13, 14]. Показано, что ускорять эту реакцию способны как центры Mn3+ (наночастицы фазы Mn2O3, Mn3O4), так и Mn4+ (наночастицы фазы MnO2) за счет дефектов в кристаллической структуре (например, кислородных вакансий) [8, 20, 21]. Однако какие-либо прямые указания на существование корреляции между соотношением Mn3+/Mn4+ и каталитическими свойствами нанесенных Mn-содержащих катализаторов в реакции окисления ЛОС с участием озона в литературе отсутствуют.
Настоящая работа посвящена исследованию влияния природы активных центров, в частности, соотношения Mn3+/Mn4+, на активность Mn-катализаторов в реакции окисления ЛОС с участием озона. В качестве модельного ЛОС был выбран малореакционноспособный алкан н-С4Н10. Mn-катализаторы с различным соотношением Mn3+/Mn4+ активных центров получали нанесением марганца на различные носители (SiO2, Al2O3, SiO2-Al2O3), поскольку, как известно из литературы [22], природа носителя, наряду с выбором соли-предшественника Mn, метода нанесения и условий прокаливания, оказывает заметное влияние на фазовый состав нанесенных Mn-содержащих систем. Состав фаз марганца, образующихся в результате нанесения, а также их окислительно-восстановительные свойства исследовали методами РФА и ТПВ-Н2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализаторов
Носители. Для приготовления катализаторов на основе MnOx использовали следующие носители: 1) SiO2 Силохром C-80 (ООО “ХромЛаб”, Россия, Sпов = 80 м2/г), обозначаемый далее как SiO2, 2) Al2O3 PURALOX® NWa155 (“Sasol”, Германия, Sпов = 150 м2/г), обозначаемый далее как Al2O3, 3) SiO2–Al2O3 SIRAL® 30 (“Sasol”, Германия, Sпов = 450 м2/г, Al2O3/SiO2 = 70/30), обозначаемый далее как SiO2–Al2O3. Перед нанесением активного компонента носители прокаливали в токе воздуха (300 мл/мин) при 550°C в течение 4 ч.
Катализаторы. Катализаторы Mn/SiO2, Mn/Al2O3 и Mn/SiO2–Al2O3 готовили методом пропитки носителей по влагоемкости водным раствором Mn(NO3)2 · 4H2O (≥97%, “Sigma Aldrich”, США). Пропитанный материал сушили на воздухе в течение 12 ч, а затем прокаливали при температуре 500°С в течение 2 ч. Содержание металла в готовых катализаторах составило 8 вес. %.
Методики проведения физико-химических исследований и каталитических тестов
Рентгенофазовый анализ. Фазовый состав синтезированных катализаторов исследовали методом рентгенофазового анализа (РФА). Дифрактограммы катализаторов и исходных носителей получены на дифрактометре ДРОН-4 (НПП “Буревестник”, Россия) с использованием излучения СuKα (Ni-фильтр, длина волны λ = 1.54059 нм). Съемку вели в диапазоне углов 15°–75° (2θ) с шагом 0.02° (2θ) и выдержкой в точке 3 с.
Средний размер кристаллитов MnOx рассчитывали по формуле Шеррера:
где 0.9 – коэффициент формы (константа Шеррера), λ – длина волны рентгеновского излучения, β – ширина дифракционного рефлекса на полувысоте, θ – угол диффракции.Температурно-программированное восстановление водородом. Окислительно-восстановительные свойства катализаторов Mn/носитель исследовали методом температурно-программированного восстановления водородом (ТПВ-Н2) с применением полуавтоматической проточной установки УСГА-101 (ООО “Унисит”, Россия), снабженной детектором по теплопроводности (катарометром). Калибровку катарометра проводили по восстановлению NiO (99.99%, “Sigma Aldrich”, США). Для проведения ТПВ-исследования навеску катализатора (0.1 г), загружали в U-образный кварцевый реактор, по центру которого находилась термопара хромель–алюмель. Образец предварительно отдували в токе Ar (99.999%, “Линде Газ Рус”, Россия) (30 мл/мин), нагревая от комнатной температуры до 150°С со скоростью 10°С/мин, после чего выдерживали при заданной температуре в течение 1 ч. Затем образец охлаждали в токе Ar до 50°С и выдерживали при этой температуре в токе 5% H2/Ar (“Линде Газ Рус”, Россия) (30 мл/мин) до установления стабильной нулевой линии (~20–30 мин). Восстановление образца катализатора осуществляли в токе 5% H2/Ar (30 мл/мин) в режиме нагрева до 650°С со скоростью 10°С/мин. Для удаления из газовой фазы паров воды, образующихся в ходе реакции восстановления, между реактором и детектором устанавливали элемент Пельтье, охлаждающий газовую смесь до –20°С. Деконволюцию профилей ТПВ-Н2 на отдельные гауссовы компоненты проводили с помощью программы OriginPro 2016 с учетом имеющихся в литературе данных о температурных интервалах восстановления различных оксидов марганца.
Содержание различных фаз марганца оценивали путем сопоставления теоретического (рассчитанного исходя из предположения о полном восстановлении MnO2 или Mn2O3 до MnO) и экспериментально полученного поглощения водорода с учетом данных о количестве марганца в составе катализаторов Mn/носитель.
Оценка каталитической активности. Каталитическую активность исходных носителей и Mn/носитель катализаторов исследовали в следующих реакциях:
1) окисление н-C4H10 кислородом воздуха;
2) окисление н-C4H10 смесью воздуха и O3;
3) разложение О3.
Для оценки вклада газофазных реакций каталитические тесты также выполняли в пустом реакторе (без катализатора).
Каталитические тесты проводили на установке, оснащенной трубчатым кварцевым реактором проточного типа (внутренний диаметр – 10 мм) с неподвижным слоем катализатора (0.2 г; фракция 0.4–1.0 мм), разбавленного кварцем (0.2 г; фракция 0.4–1.0 мм). Углеводород (н-С4Н10) подавали из баллона 0.98% н‑C4H10/N2 (“Линде Газ Рус”, Россия). Озон генерировали из О2 (99.999%, “Линде Газ Рус”, Россия) с помощью генератора озона YOTA-60-01 (“МедОзон”, Россия). В зависимости от исследуемой реакции в реактор направляли газовую смесь состава 100 ppm н‑С4Н10, 450 ppm O3, 20% О2 в N2. Общий расход смеси составлял 750 мл/мин. Тесты осуществляли при атмосферном давлении в режиме ступенчатого повышения температуры (от 25 до 350°С, с шагом 25°С), ожидая на каждой ступени установления постоянных величин конверсий н-С4Н10 и О3 (изменение не более 2% при заданной температуре).
Концентрацию озона до и после реактора измеряли анализатором озона МедОзон-254/5 (“МедОзон”, Россия) в диапазоне 0–999 ppm с точностью 2%. Для определения концентрации н-C4H10 использовали Фурье–ИК-спектрометр Gasmet DX4000 (“Temet Instruments Oy”, Финляндия). Во избежание попадания остаточного озона в ячейку спектрометра на выходе из реактора установили ловушку с насыщенным водным раствором йодида калия.
Активность катализаторов оценивали по значениям конверсии (Х) н-C4H10 и O3, рассчитанным в соответствии со следующим уравнением (2):
где Cin и Cout – концентрации н-C4H10 или O3 на входе и выходе соответственно.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химическое исследование образцов
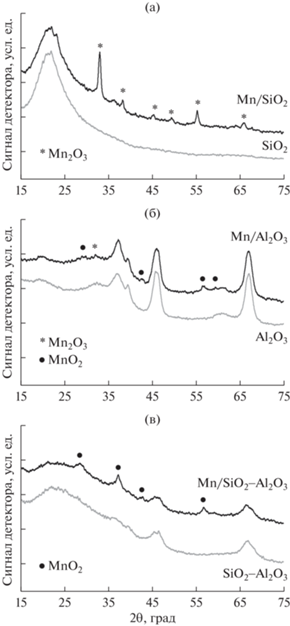
Рентгенофазовый анализ. Для определения фазового состава катализаторов Mn/носитель использовали метод РФА. Дифрактограммы, полученные для носителей и Mn-катализаторов на их основе, показаны на рис. 1. Размеры кристаллитов MnOx (область когерентного рассеяния, ОКР), рассчитанные по соответствующим рефлексам с использованием формулы Шеррера, приведены в табл. 1.
Таблица 1.
Предполагаемый состав и содержание отдельных фаз MnOx в Mn/носитель катализаторах
| Катализатор | Данные РФА | Данные ТПВ-Н2 | |||
|---|---|---|---|---|---|
| фаза MnOx | размер частиц1 MnOx, нм | поглощение Н2, ммоль/гкат | фазы MnOx и их дальнейшие превращения | ||
| теор. | эксп. | ||||
| Mn/SiO2 | Mn2O3 | 17 | 0.732 | 0.72 | 64% Mn2O3 (→ Mn3O4 → MnO) 36% Mn3O4 (→ MnO) |
| Mn/Al2O3 | MnO2 | 13 | 1.463 | 1.18 | 63% MnO2 (→ Mn3O4 → MnO) 36% Mn2O3 (→ MnO) 1% Mn4+,3+ с сильным взаимодействием с носителем |
| Mn/SiO2–Al2O3 | MnO2 | 11 | 1.463 | 1.10 | 63% MnO2 (→ Mn3O4 → MnO) 37% Mn3O4 (→ MnO) |
1 Средний размер частиц рассчитывали по рефлексам, соответствующим Mn2O3 (222) при 2θ = 33° и MnO2 (101) при 2θ = 37°. 2 Рассчитано в предположении, что в результате прокаливания катализатора образуется только фаза Mn2O3. 3 Рассчитано в предположении, что в результате прокаливания катализатора образуется только фаза MnO2.
Анализ данных позволяет заключить, что природа носителя оказывает заметное влияние на формирование фазы MnOx на его поверхности. Так, в дифрактограмме катализатора Mn/SiO2 (рис. 1а) проявляются рефлексы в области углов 2θ = 32.9°, 38.2°, 45.1°, 49.3°, 55.1°, 65.8°, соответствующие отражениям от плоскостей (222), (400), (332), (431), (440), (622) кубической решетки Mn2O3 (биксбит, PDF #00-024-0508).
В дифрактограмме образца Mn/Al2O3 (рис. 1б) фазе Mn2O3 отвечает лишь слабый сигнал (2θ = = 32.9°), при этом наблюдаются четкие рефлексы (110), (101), (111), (211) и (220) в области углов отражения 2θ = 28.5°, 37.5°; 42.5°, 56.5°, 59.4°, указывающие на наличие фазы β-MnO2 (пиролюзит, PDF #01-081-2261).
В дифрактограмме катализатора Mn/SiO2–Al2O3 (рис. 1в) присутствуют только рефлексы, относящиеся к фазе β-MnO2 (пиролюзит, PDF #01-081-2261). Однако необходимо отметить, что отсутствие указаний на наличие других фаз MnOx может быть обусловлено их рентгеноаморфностью и/или чрезвычайно малым размером образующихся кристаллитов.
Температурно-программированное восстановление. Состав каталитически активных фаз в катализаторах Mn/носитель и их окислительно-восстановительные свойства дополнительно изучали методом ТПВ-Н2 (рис. 2, табл. 1). В профиле ТПВ-Н2 образца Mn/SiO2 наблюдается три плохо разрешенных пика поглощения водорода с максимумами при 290, 340 и 407°С и небольшим плечом при 240°С. Путем деконволюции удалось получить четыре компоненты при 282 (Т1), 287 (Т2), 357 (Т3) и 411°С (Т4). Величина полного поглощения водорода (табл. 1), а также особенность профиля Н2-ТПВ указывают на то, что в составе катализатора почти весь марганец находится в виде частиц Mn2O3 различной дисперсности, которые восстанавливаются до MnO через образование Mn3O4 (Т1, Т2 и Т4). Кроме того, в составе катализатора изначально присутствует Mn3O4 (Т3) [23].
Профиль ТПВ-Н2 образца Mn/Al2O3 (рис. 2б) содержит два пика поглощения водорода. Наиболее интенсивный пик (Тмакс = 340–350°С) имеет ассиметричную форму и может быть описан двумя компонентами с максимумами при 312°С (Т1) и 338°С (Т2) соответственно. Сопоставление полученных данных с результатами РФА позволяет сделать вывод, что пики с максимумами при 312 (Т1) и 431°С (Т3) соответствуют восстановлению MnO2 → Mn3O4 → MnO. На формирование Mn3O4 указывает соотношение количеств поглощенного водорода в этих пиках (Т1/Т3 = 2/1). Пик Т2 характеризует восстановление частиц Mn2O3, образовавшихся в результате прокаливания катализатора [24].
В профиле H2-ТПВ катализатора Mn/SiO2–Al2O3 также наблюдается 2 пика, которые можно разложить на 3 компоненты с максимумами при 342 (Т1), 352 (Т2) и 444°С (Т3) соответственно. Судя по соотношению количеств поглощенного водорода в первом и третьем пиках (Т1/Т3 = 1/1), они характеризуют последовательное восстановление MnO2 → Mn2O3 → MnO. Пик Т2 соответствует восстановлению частиц Mn3O4, образованных в результате прокаливания катализатора [23, 24]. Высокие температуры восстановления могут быть обусловлены тем, что фазы MnOx более прочно связаны с поверхностью SiO2–Al2O3 по сравнению с Al2O3 и SiO2 [25].
Процентное содержание фаз MnOx в образцах приведено в табл. 1. На основании полученных данных можно сделать вывод, что в катализаторе Mn/SiO2 марганец преимущественно находится в форме Mn3+, в то время как в образцах Mn/Al2O3 и Mn/SiO2–Al2O3 преобладает форма Mn4+. Данные ТПВ-Н2 хорошо согласуются с результатами РФА.
Окисление н-С4Н10
Каталитическое окисление с участием молекулярного кислорода. Активность катализаторов Mn/носитель исследована в реакции окисления н‑С4Н10 молекулярным кислородом. Из рис. 3 видно, что окисление протекает на катализаторах только при температуре выше 250°C. Максимальная конверсия н-С4Н10 при 350°С достигается на Mn/SiO2 и составляет 70%, тогда как на Mn/Al2O3 и Mn/SiO2–Al2O3 ее значение не превышает 20%.
Рис. 3.
Температурные зависимости конверсии н‑С4Н10 в ходе каталитического окисления молекулярным кислородом (пустые символы) и озоном (закрашенный символы) в присутствии катализаторов Mn/носитель.

Поскольку исходные носители SiO2, Al2O3 и SiO2–Al2O3 не обладают каталитическими свойствами в выбранных условиях (рис. 4), можно заключить, что за протекание реакции окисления н-С4Н10 молекулярным кислородом отвечают MnOx-центры. Так, бóльшая активность Mn/SiO2 по сравнению с остальными катализаторами, по-видимому, связана с тем, что в его составе преобладает активная в окислении фаза Mn2O3.
Рис. 4.
Температурная зависимость конверсии н‑С4Н10 в ходе его окисления молекулярным кислородом (пустые символы) и озоном (закрашенные символы) в присутствии носителей. Пунктиром показаны газофазные процессы окисления (пустой реактор).
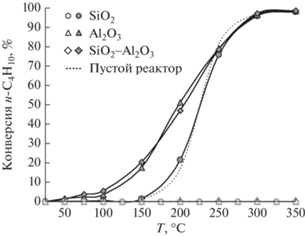
Каталитическое окисление с участием озона. Добавление в газовый поток озона кардинальным образом меняет ход процесса (рис. 3). В присутствии озона реакция протекает на катализаторах Mn/носитель уже при 25°С, а при 100°С конверсия н-С4Н10 составляет более 80%.
Зависимости конверсии от температуры для Mn/Al2O3 и Mn/SiO2-Al2O3 имеют Г-образную форму с небольшим прогибом при 150–250°С. Самой высокой активностью в реакции окисления с участием озона обладает Mn/SiO2–Al2O3: на этом катализаторе удаляется свыше 95–98% н-С4Н10 в широком интервале температур (100–350°С). Mn/Al2O3 уступает Mn/SiO2–Al2O3 по эффективности: конверсия н-С4Н10 на нем при 100–200°С не превышает 85%, а значения 98% удается достичь только при 300–350°С.
Иной характер зависимости получен для образца Mn/SiO2. По мере нагрева конверсия н-С4Н10 увеличивается до 95%, но при 100–200°С она резко снижается до 55%. При более высокой температуре снова наблюдается рост конверсии, и уже при 300–350°С она составляет 98%.
В реакции окисления н-С4Н10 с участием озона также был оценен вклад исходных носителей (SiO2, Al2O3 и SiO2–Al2O3) и газофазного процесса (в пустом реакторе). Как показано на рис. 4, в газовой фазе процесс начинает протекать при 150°С, а максимальной конверсии удается достичь лишь при 300°С. Носитель SiO2 не обладает активностью в окислении с участием озона: температурная зависимость конверсии н-С4Н10 для этого носителя полностью совпадает с той, что была получена в пустом реакторе. Носители Al2O3 и SiO2–Al2O3, напротив, вносят вклад в процесс уже при 100–250°С, однако их активность в указанном интервале температур существенно ниже, чем у катализаторов Mn/носитель (рис. 3 и 4).
Анализ данных позволяет сделать вывод, что в интервале от 25 до 150°С реакция окисления н-С4Н10 с участием озона протекает исключительно на Mn-содержащих активных центрах катализаторов. Вклад каталитического окисления с участием молекулярного кислорода, окисления в газовой фазе, а также активности носителей в этих процессах незначителен.
Взаимосвязь между реакцией каталитического окисления н-С4Н10 с участием озона и разложением озона на поверхности катализаторов Mn/носитель. В литературе [26] высказывается предположение, что реакция разложения озона играет ключевую роль в процессе каталитического окисления углеводородов с его участием, поскольку является первой стадией процесса, приводящей к появлению высокореакционноспособного атомарного кислорода. Атомарный кислород в свою очередь взаимодействует с активированной на поверхности катализатора молекулой углеводорода с образованием СОх (CO, СО2) и воды. Для подтверждения этого предположения проведены эксперименты по разложению озона на катализаторах Mn/носитель и в газовой фазе.
Как показано на рис. 5, разложение озона в газовой фазе протекает при температурах выше 150°С, при этом полного превращения удается достичь только при 300°С. Каталитическое разложение озона начинается уже при 25°C. Зависимости конверсии озона от температур для образцов Mn/носитель имеют схожий S-образный профиль. Практически полное разложение озона наблюдается при температурах ниже 150°С на всех трех катализаторах, однако наибольшей активностью обладает Mn/SiO2, для которого 100% конверсия озона зафиксирована уже при 100°С.
Рис. 5.
Конверсия озона в ходе реакции разложения в пустом реакторе и в присутствии катализаторов Mn/носитель.
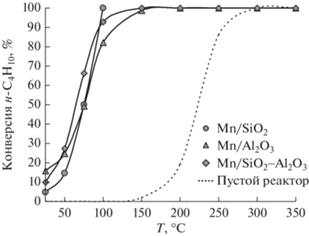
На основании данных, полученных в ходе газофазного и каталитического разложения озона, можно сделать вывод, что использование катализаторов Mn/носитель позволяет существенно снизить температуру реакции (со 150 до 25°С). Детальный анализ температурных зависимостей конверсии н-С4Н10 и разложения озона (рис. 3 и 5) выявил тесную взаимосвязь между этими процессами. Так, обнаружено, что температуры начала разложения озона и окисления н-С4Н10 близки, причем как в газовой фазе, так и при протекании этих реакций на поверхности катализаторов Mn/носитель. Экспериментальные данные хорошо согласуются с литературными [26] и подтверждают предположение о том, что реакция разложения озона является ключевой стадией окисления углеводородов с участием озона.
Влияние соотношения Mn3+/Mn4+ активных центров на каталитические свойства Mn/носитель в реакциях окисления н-С4Н10 и разложения озона. Процесс разложения озона напрямую зависит от структуры активных центров катализатора. Существует предположение, что наибольшей активностью в этом процессе обладают центры Mn3+ [13, 14]. Для того чтобы выявить корреляцию между содержанием Mn3+ и активностью образцов Mn/носитель в реакциях разложения озона и окисления н-С4Н10, каталитические данные были сопоставлены с результатами физико-химического исследования природы активной фазы MnOx (рис. 4, 5 и табл. 1).
Хорошо видно, что количество Mn+3-центров (Mn2O3 и Mn3O4) увеличивается в ряду Mn/Al2O3 < < Mn/SiO2–Al2O3 < Mn/SiO2 (табл. 1). В этом же ряду возрастает активность катализаторов в реакции разложения озона (рис. 5). Полученные данные хорошо согласуются с результатами, опубликованными в литературе, и указывают на то, что озон разлагается именно на Mn3+-центрах.
Иная зависимость обнаружена при исследовании реакции окисления н-С4Н10 с участием озона. Активность в этой реакции в интервале температур 25–150°С, где газофазные процессы еще не вносят свой вклад, повышается в ряду Mn/SiO2 < < Mn/Al2O3 < Mn/SiO2–Al2O3. В данном случае корреляция с количеством Mn3+ прослеживается только для Mn/Al2O3 и Mn/SiO2–Al2O3.
Mn/SiO2, по-видимому, обладает избыточной активностью в разложении озона, что способствует расходованию атомарного кислорода в побочной реакции (II) с образованием молекулярного кислорода. Уменьшение концентрации атомарного кислорода неизбежно приводит к снижению эффективности процесса окисления н-С4Н10 при 100–200°С, что хорошо демонстрирует рис. 4.
На основании полученных данных можно заключить, что для достижения максимальной эффективности катализатора необходимо оптимизировать соотношение активных центров Mn3+/Mn4+.
ЗАКЛЮЧЕНИЕ
Исследованы каталитические свойства образцов Mn/носитель (носитель: SiO2, Al2O3, SiO2–Al2O3) в реакции окисления н-С4Н10. Показано, что реакция с участием озона протекает при значительно более низких температурах по сравнению с традиционным окислением молекулярным кислородом (25°С вместо 200–250°С соответственно). Установлено, что в области температур 25–150°С н-С4Н10 окисляется озоном исключительно на частицах фазы MnOx. При температуре выше 200°С существенный вклад начинает вносить окисление н-С4Н10 с участием озона в газовой фазе. При дальнейшем повышении температуры до 250–350°С в процесс также вовлекается реакция окисления молекулярным кислородом на MnOx.
Состав фаз MnOx, образованных на поверхности носителей, а также их окислительно-восстановительные свойства охарактеризованы методами РФА и ТПВ-Н2. Установлено, что носитель оказывает существенное влияние на валентное состояние марганца в нанесенном оксиде: так, на поверхности SiO2 марганец находится преимущественно в виде Mn3+ (Mn2O3 и Mn3O4), в то время как в катализаторах Mn/Al2O3 и Mn/SiO2–Al2O3 преобладает Mn4+ (MnO2).
Сопоставление данных о составе активных фаз MnOx и каталитических свойствах позволило установить, что увеличение содержания Mn3+ способствует более высокой активности катализаторов Mn/носитель в реакциях разложения озона и окисления н-С4Н10 с участием озона. Однако избыточное количество Mn3+, как в случае Mn/SiO2, приводит к расходованию озона в побочной реакции с образованием молекулярного кислорода, вследствие чего заметно снижается эффективность окисления н-С4Н10, в особенности в области температур 100–200°С.
Полученные результаты позволяют сделать вывод о том, что для достижения максимальной активности катализатора в окислении н-C4H10 в присутствии озона необходимо обеспечить оптимальное соотношение Mn3+/Mn4+.
Список литературы
Okal J., Zawadzki M. // Appl. Catal. B: Env. 2009. V. 89. P. 22.
He C., Cheng J., Zhang X., Douthwaite M., Pattisson S., Hao Z. // Chem. Rev. 2019. V. 119. P. 4471.
Shah K.W., Li W. // Nanomater. 2019. V. 9. № 910.
Распоряжение Правительства РФ от 08.07.2015 N 1316-р (ред. от 10.05.2019) “Об утверждении перечня загрязняющих веществ, в отношении которых применяются меры государственного регулирования в области охраны окружающей среды”.
Yang C., Miao G., Pi Y., Xia Q., Wu J., Li Z., Xiao J. // Chem. Eng. J. 2019. V. 370. P. 1128.
Huang H., Xu Y., Feng Q., Leung D.Y.C. // Catal. Sci. Technol. 2015. V. 5. P. 2649.
Kamal M.S., Razzak S.A., Hossain M.M. // Atmos. Env. 2016. V. 140. P. 117.
Liu B., Ji J., Zhang B., Huang W., Gan Y., Leung D.Y.C., Huang H. // J. Hazard. Mater. 2022. V. 422. № 126847.
Рогачева А.О., Бузаев А.А., Бричков А.С., Халипова О.С., Клестов С.А., Паукштис Е.А., Козикa В.В. // Кинетика и катализ. 2019. Т. 60. № 4. С. 520.
Fang R., Huang H., Huang W., Ji J., Feng Q., Shu Y., Zhan Y., Liu G., Xie R. // Appl. Surf. Sci. 2017. V. 420. P. 905.
Einaga H., Futamura S. // React. Kinet. Catal. Lett. 2004. V. 81. P. 121.
Reed C., Xi Y., Oyama S.T. // J. Catal. 2005. V. 235. P. 378.
Li W., Gibbs G.V., Oyama S.T. // J. Am. Chem. Soc. 1998. V. 120. P. 9041.
Li W., Oyama S.T. // J. Am. Chem. Soc. 1998. V. 120. P. 9047.
Li X., Ma J., He H. // J. Environ. Sci. 2020. V. 94. P. 14.
Wan M.P., Hui K.S., Chao C.Y.H., Kwong C.W. // Combust. Sci. Technol. 2010. V. 182. P. 1429.
Mytareva A.I., Mashkovsky I.S., Kanaev S.A., Bokarev D.A., Baeva G.N., Kazakov A.V., Stakheev A.Y. // Catalysts. V. 11. № 506.
Einaga H., Maeda N., Nagai Y. // Catal. Sci. Technol. 2015. V. 5. P. 3147.
Gopi T., Swetha G., Chandra Shekar S., Krishna R., Ramakrishna C., Saini B., Rao P.V.L. // Arab. J. Chem. 2019. V. 12. P. 4502.
Zhu B., Li X.-S., Sun P., Liu J.-L., Ma X.-Y., Zhu X., Zhu A.-M. // Chin. J. Catal. 2017. V. 38. P. 1759.
Li X., Ma J., Yang L., He G., Zhang C., Zhang R., He H. // Env. Sci. Technol. 2018. V. 52. P. 12685.
Trawczyński J., Bielak B., Miśta W. // Appl. Catal. B: Env. 2005. V. 5. P. 277.
Яшник С.А., Гаврилова А.А., Суровцова Т.А., Шикина Н.В. // Вестник ТГУ. Химия. 2017. № 10. С. 45.
Averlant R., Royer S., Giraudon J.-M., Bellat J.-P., Bezverkhyy I., Weber G., Lamonier J.-F. // ChemCatChem. 2014. V. 6. P. 152.
Ryu H.W., Song M.Y., Park J.S., Kim J.M., Jung S.-C., Song J., Kim B.-J., Park Y.-K. // Env. Res. 2019. V. 172. P. 649.
Naydenov A., Mehandjiev D. // Appl. Catal. A: Gen. 1993. V. 97. P. 17.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ