Кинетика и катализ, 2022, T. 63, № 5, стр. 602-613
Исследование методом РФЭС взаимодействия NO2 с сибунитом в присутствии частиц нанесенного палладия
М. Ю. Смирнов a, *, А. В. Калинкин a, П. А. Симонов b, В. И. Бухтияров a
a ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
b ФГАОУ ВО Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 1, Россия
* E-mail: smirnov@catalysis.ru
Поступила в редакцию 23.03.2022
После доработки 12.05.2022
Принята к публикации 24.05.2022
- EDN: TBTWHY
- DOI: 10.31857/S0453881122050124
Аннотация
Методом рентгеновской фотоэлектронной спектроскопии (РФЭС) исследовано взаимодействие NO2 с углеродным материалом из семейства Сибунит с нанесенными на его поверхность частицами металлического палладия при давлении 10−6 мбар в интервале температур от комнатной до 300°С. Были изучены два образца Pd/Сибунит, один из которых приготовлен химическим осаждением палладия (образец Pd/C-HP), а другой – вакуумным напылением металла на носитель (образец Pd/C-VE). Оба образца демонстрировали похожее поведение при взаимодействии с NO2. Во всем интервале температур спектр C1s образцов был представлен единственным пиком с энергией связи 284.4 эВ от атомов углерода в sp2-гибридном состоянии, что указывает на слабое воздействие NO2 на Сибунит. При температурах от комнатной до 150°С состояние палладия, нанесенного на поверхность Сибунита, также не изменялось, но в интервале от 200 до 300°С происходило его частичное окисление с образованием PdO.
ВВЕДЕНИЕ
Платиновые металлы, нанесенные на углерод, нашли широкое применение в качестве катализаторов различных химических процессов [1–6], в том числе, протекающих в окислительной среде [7–12]. Среди многочисленных углеродных носителей хорошо зарекомендовал себя мезопористый углерод марки Сибунит, получаемый пиролизом углеводородов на поверхности сажевых частиц с последующей активацией [13]. Удельная поверхность материалов семейства Сибунит варьируется от 0.1 до 800 м2/г в зависимости от степени обгара пироуглерод-сажевого композита [14]. При этом они обладают высокой степенью графитизации, которая обуславливает их высокую механическую прочность и химическую стойкость к агрессивным средам. Катализаторы, приготовленные нанесением платиновых металлов на Сибунит, широко используются для проведения процессов гидрирования [15–21], дегидрохлорирования [22], в синтезе пероксида водорода из H2 и O2 [23], производстве водорода из муравьиной кислоты [24] и многих других [25–27].
Однако при применении углеродных материалов в составе катализаторов для проведения процессов в окислительной среде существует опасность окисления самого носителя. Так, с помощью метода рентгеновской фотоэлектронной спектроскопии (РФЭС) нами было показано, что при взаимодействии с NO2 модельной системы Pd/ВОПГ, приготовленной вакуумным напылением палладия на поверхность высоко ориентированного пиролитического графита (ВОПГ), уже при комнатной температуре происходит окисление углерода, приводящее к разрушению 10–15 и более графеновых слоев и образованию поверхностных кислородсодержащих соединений различной природы (с гидроксильными, эфирными, сложноэфирными и карбонильными группами) [28, 29]. В ходе этого процесса частицы палладия сохраняют металлическое состояние и внедряются в приповерхностный слой графита. В настоящей работе была поставлена задача выяснить, будет ли в этих условиях происходить окисление Сибунита, широко применяемого в качестве углеродного носителя для приготовления палладиевых катализаторов. С этой целью было исследовано взаимодействие NO2 с реальным катализатором Pd/Сибунит в условиях, подобных использованным нами ранее для модельной системы Pd/ВОПГ. Для сравнения был также изучен Сибунит без палладия и образец, полученный вакуумным напылением палладия на Сибунит.
Ранее нами было проведено взаимодействие NO2 с реальным катализатором Pt/Сибунит при комнатной температуре и давлении 3 × 10–6 мбар и показано, что в этих условиях углеродный носитель существенных изменений не претерпевает, но происходит частичное окисление нанесенной платины с образованием смеси оксидов PtO и PtO2 [30]. Работы по взаимодействию NO2 с Сибунитом, равно как и с палладием, нанесенным на Сибунит, нам не известны.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В исследованиях использовали мезопористый углеродный материал Сибунит (лабораторная партия 15-Н-14), (SBET = 15.6 м2/г, Vмезо = 0.07 см3/г, Vмикро = 0.00 см3/г, фракция частиц меньше 40 мкм). На его основе были получены два образца Pd/Сибунит. Первый образец, обозначенный Pd/C-HC, был приготовлен по методике, описанной в [25, 31], путем нанесения полиядерных гидроксокомплексов (Hydroxo Complexes, HC) палладия(II) на носитель при добавлении Na2CO3 к суспензии угля в растворе H2PdCl4. С этой целью к навеске носителя при интенсивном перемешивании на воздухе приливали водный раствор H2PdCl4 в количестве, необходимом для достижения требуемого весового содержания металла в катализаторе; конечное соотношение масс твердой и жидкой фаз составляло 1 : 10. Суспензию перемешивали 20 мин при комнатной температуре, затем по каплям приливали раствор Na2CO3 в течение 15 мин до конечного мольного соотношения H2PdCl4 : Na2CO3 = 1 : 2 и после этого перемешивали еще 30 мин. После того как по капельной реакции с раствором 2% SnCl2 в 4 М HCl было установлено отсутствие ионов палладия в рассоле, суспензию нагревали до 80°С и перемешивали дополнительно 30 мин. Полученный образец катализатора отфильтровывали, промывали дистиллированной водой до нейтральной реакции элюата по индикаторной бумаге и отсутствия остаточных ионов Cl– по реакции с AgNO3, сушили при 80°С на воздухе в течение ночи, прокаливали в токе азота (1 атм, 150°C, 20 мин), а затем восстанавливали в токе водорода (1 атм, 150°С, 1 ч). По окончании процесса восстановления образец охлаждали до комнатной температуры, продували азотом, а потом пассивировали небольшими порциями воздуха, добавляемыми в газовый поток. Количество нанесенного палладия составляло 3 вес. %. На рис. 1 приведено изображение, полученное для данного образца методом просвечивающей электронной микроскопии (ПЭМ) на приборе JEM-2010 (“JEOL”, Япония) при ускоряющем напряжении 200 кВ и разрешении по решетке 0.14 нм, из которого следует, что размер частиц палладия варьирует от 1.5 до 5 нм. Дисперсность частиц металла, определенная методом импульсной хемосорбции СО, составляет 0.24, что соответствует средне-поверхностному размеру частиц 4.4 нм.
Второй образец – Pd/C-VE – был приготовлен вакуумным напылением (Vacuum Evaporation, VE) металлического палладия на Сибунит по методике, использованной ранее для получения образцов Pd/ВОПГ [28, 29].
Взаимодействие исходного Сибунита и образцов Pd/Сибунит с диоксидом азота проводили в камере подготовки РФЭ-спектрометра, используя источник, принцип работы которого, основанный на термическом разложении нитрата свинца в вакууме, подробно описан в [32]. Источник представлял собой запаянную с одного конца тонкостенную трубку из нержавеющей стали, на внешнюю поверхность которой навита спираль из нихромовой проволоки. При пропускании тока через спираль внутри трубки, наполненной кристаллами Pb(NO3)2, достигалась температура (вплоть до 400°C), достаточная для протекания реакции:
(I)
$2{\text{Pb}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{2}} = 2{\text{PbO}} + 4{\text{N}}{{{\text{O}}}_{2}} + {{{\text{O}}}_{2}}.$Перед работой нитрат свинца в течение нескольких часов прогревали при температурах ниже необходимых для реакции (I) с целью удаления следов воды. В процессе обработки в NO2 выходное отверстие трубки источника располагали на расстоянии 20 мм от образца. Температура образца была близка к комнатной. Состав газовой фазы контролировали при помощи масс-спектрометра PrismaPlus QMG 220 (“Pfeiffer”, Германия); он соответствовал стехиометрии реакции (I). Принимая во внимание тот факт, что парциальное давление NO2 в 4 раза превышает давление кислорода, а его окислительная способность намного выше, воздействие O2 на исследуемые образцы не учитывали. Обработку образцов в NO2 осуществляли при давлении 10–6 мбар в течение 30 мин.
РФЭ-спектры регистрировали с помощью спектрометра SPECS (Германия), снабженного 9-канальным детектором и анализатором PHOIBOS-150. Фотоэмиссию возбуждали немонохроматизированным излучением AlKα с энергией квантов hν = 1486.6 эВ. Перед проведением измерений спектрометр калибровали по линиям Au4f7/2 и Cu2p3/2, энергии связи (Eсв) которых для фольг соответствующих металлов равны 84.0 и 932.7 эВ. Анализ спектральных линий с разложением на отдельные компоненты выполняли с помощью программы XPSPeak [33]. Линию фона задавали функцией Ширли. При нанесении на держатель обеспечивался хороший электрический контакт образцов с землей, что исключало их зарядку, и, как следствие, устраняло необходимость корректировки значений Eсв.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
Сибунит + NO2
Перед рассмотрением поведения образцов Pd/Сибунит было исследовано взаимодействие с NO2 исходного Сибунита, предварительно отожженного в вакууме при 300°С в течение 30 мин. Из спектра C1s Сибунита до взаимодействия с NO2 (рис. 2а, спектр 1) следует, что энергия связи линии C1s составляет 284.4 эВ. Это с хорошей точностью совпадает с Eсв для графита [28, 29] и согласуется с величинами, опубликованными для Сибунита в других работах [34–38]. Также как и в случае графита, линия C1s обладает асимметричной формой с “хвостом”, вытянутым в направлении бóльших энергий связи, на котором регистрируется пик плазмонных потерь в области Eсв ∼ 290 эВ [35].
Рис. 2.
Спектры C1s (а) и O1s (б) Сибунита, отожженного в вакууме при 300°С в течение 30 мин, до (1) и после взаимодействия с NO2 при комнатной температуре (2) и 200°С (3).
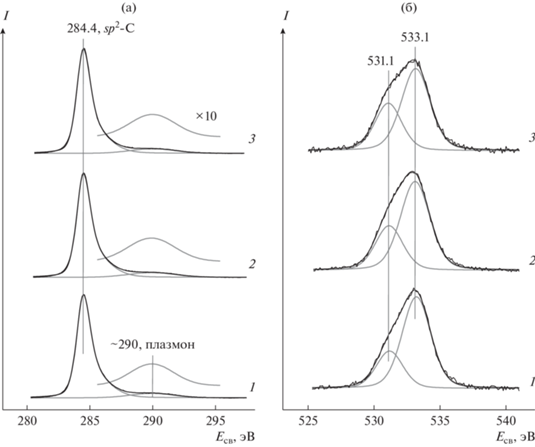
В спектре O1s исходного Сибунита присутствуют две линии с энергиями связи 531.1 и 533.1 эВ (рис. 2б, спектр 1), которые можно отнести, соответственно, карбонильным [27, 39–44] и эфирным или фенольным группам [27, 41–43, 45–48] на поверхности углеродного материала. По данным [49] эти функциональные группы вносят основной вклад в спектр O1s Сибунита. Линии O1s гидроксильных групп (∼534.8 эВ) и адсорбированных молекул воды (∼536 эВ), также обнаруживаемые в спектрах Сибунита в работах [49, 50], нами не наблюдаются, видимо, по причине того, что регистрации спектра предшествовал отжиг образца в вакууме. Атомное отношение [O]/[C] в исследованных образцах изменяется в пределах от 0.06 до 0.08.
Спектры 2 и 3 получены после обработки образца Сибунита в NO2 при комнатной температуре и при 200°С соответственно. Взаимодействие не сказывается на параметрах линии C1s и пика плазмонных потерь, что указывает на незначительные изменения в состоянии образца и хорошо согласуется с установленной для данного углеродного материала высокой термической и химической устойчивостью [17, 18, 23, 51]. В спектрах O1s (рис. 2б, спектры 2 и 3), записанных после взаимодействия с NO2, наблюдается рост интенсивности линии, отнесенной карбонильным группам (Eсв ∼ 531 эВ); после обработки при 200°С она увеличивается в 1.3 раза по сравнению с исходной величиной. В этих условиях интенсивность линии эфирных и/или фенольных групп (Eсв ∼ 533 эВ) сохраняется на первоначальном уровне.
Pd/C-HC + NO2
На рис. 3 приведена серия спектров C1s, записанных в процессе взаимодействия образца Pd/C-HC с NO2 при температурах от комнатной до 300°С. Спектр 1 образца в исходном состоянии выглядит так же, как и у Сибунита без нанесенного металла. После взаимодействия с NO2 спектр Pd/C-HC изменяется незначительно: после обработки в NO2, проведенной при комнатной температуре, интенсивность пика плазмона уменьшается на ∼10%, но при более высоких температурах возвращается на первоначальный уровень.
Рис. 3.
Спектры C1s образца Pd/C-HC до (1) и после взаимодействия с NO2 при комнатной температуре (2), 150 (3), 200 (4) и 300°С (5).

На рис. 4 показаны спектры образца Pd/C-HC, в которых регистрируются фотоэмиссионные Pd3d (рис. 4а) и Оже-линии Pd-M45VV (рис. 4б) до и после взаимодействия с NO2 при комнатной и более высоких температурах. Из рис. 4 видно, что в исходном образце палладий находится в металлическом состоянии (рис. 4, спектр 1). Энергия связи Eсв(Pd3d5/2) = 335.4 эВ, что на ∼0.2–0.3 эВ выше, чем у массивного металлического палладия [52]. Следует отметить, что такое же значение (335.4 эВ) было зарегистрировано нами для наночастиц палладия со средним размером dср ∼ 4 нм, нанесенных на поверхность ВОПГ с совершенной структурой базальной плоскости графита [29]. Для частиц палладия близкого размера, напыленных на графит, активированный ионным травлением, было получено более высокое значение Eсв = 335.7 эВ [28]. В литературе частицы металлического палладия, нанесенные на Сибунит, характеризуются линией Pd3d с энергий связи Eсв(Pd3d5/2) в интервале от 335.5 до 336.3 эВ [24, 27, 38, 53, 54]. Причины, по которым в ряде случаев зарегистрированы значения Eсв заметно более высокие, чем в настоящей работе, могут быть следующие. Во-первых, часто перед нанесением металла на Сибунит последний подвергали воздействию сильных окислителей (растворы HNO3, KMnO4, H2O2) с целью ввести в его состав кислородсодержащие группы. По мнению авторов, это способствует прочному закреплению частиц металла на поверхности носителя благодаря их взаимодействию с указанными группами [27, 53]. Не исключено, что при таком способе синтеза линия Pd3d частиц палладия, химически связанных с атомами кислорода на поверхности носителя, имеет иное значение Eсв по сравнению с величинами, полученными в настоящей работе. Во-вторых, определенную роль может играть и методический фактор. Так, в некоторых случаях авторы при калибровке спектра в качестве внутреннего стандарта использовали линию C1s, энергию связи которой условно принимали равной 284.8–285.0 эВ [24, 27, 53]. Очевидно, что такая калибровка должна приводить к величинам Eсв(Pd3d5/2) на ∼0.4–0.6 эВ более высоким, чем в настоящей работе.
Рис. 4.
Спектры Pd3d (а) и Pd-M45VV (б) образца Pd/C-HC до (1) и после взаимодействия с NO2 при комнатной температуре (2), 150 (3), 200 (4) и 300°С (5).
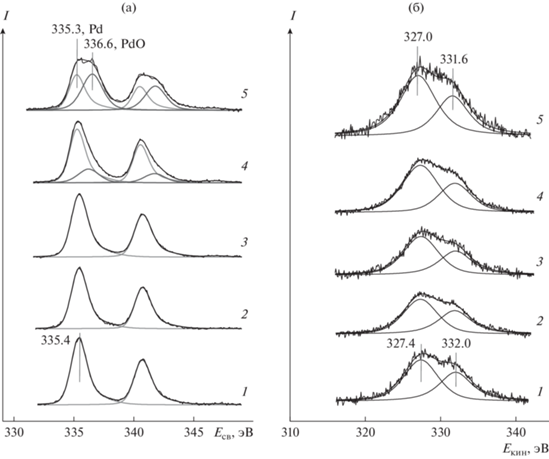
После взаимодействия образца с NO2 при комнатной температуре и при 150°С существенных изменений в спектрах Pd3d и Pd-M45VV не наблюдается, за исключением незначительного уменьшения интенсивности и уширения линий (рис. 4, спектры 2, 3). С повышением температуры до 200–300°С форма спектра Pd3d существенно изменяется в связи с появлением второй дублетной линии с энергией связи 336.6 эВ, которую следует отнести оксиду палладия PdO [55–64]. Из интенсивностей линий Pd3d, принадлежащих PdO и Pd0, был рассчитан вклад оксида в общее содержание палладия в образце; после обработки, проведенной при 300°С, он составил ∼50%.
Оже-спектр Pd-M45VV исходного образца Pd/C-HC представлен двумя линиями с кинетическими энергиями 327.4 и 332.0 эВ, соответствующими металлическому состоянию палладия [60]. Изменения, произошедшие в Оже-спектре после взаимодействия с NO2, не так заметны, как в спектре Pd3d. После обработки при 300°С наблюдается смещение обеих линий на 0.4 эВ в сторону меньших кинетических энергий (рис. 4б, спектр 5), т.е. в направлении, ожидаемом при переходе металлического палладия в окисленное состояние [59].
Перед напылением палладия на Сибунит последний отжигали в вакууме при 600°С в течение 30 мин. Спектр C1s, записанный для подготовленного таким образом углеродного материала, показан на рис. 2а (спектр 1). Напыление палладия не приводит к каким-либо видимым его изменениям. Серия спектров C1s, зарегистрированная в процессе взаимодействия образца Pd/C-EV с NO2, практически не отличается той, что была получена в аналогичных условиях для образца Pd/C-HC и показана выше на рис. 3. После обработки при комнатной температуре спектр претерпевает лишь несущественные изменения, которые сводятся к незначительному уменьшению (на ∼10%) интенсивности пика плазмона, а при 200°С он становится неотличимым от спектра, характеризующего состояние углерода в исходном образце Pd/C-EV.
Спектры образца Pd/C-EV в регионах Pd3d и Pd-M45VV, записанные до и после проведения взаимодействия с NO2, приведены на рис. 5. Из попарного сравнения спектров 1 и 2 на рис. 5а и 5б следует, что при комнатной температуре палладий остается в металлическом состоянии. С повышением температуры до 200°С палладий частично превращается в оксид PdO (3), о чем свидетельствует появление дублета с Eсв(Pd3d5/2) = = 336.7 эВ и смещение двух характерных линий Pd-M45VV в Оже-спектре в сторону меньших кинетических энергий на 0.5 и 1.2 эВ. Вклад оксидной формы в общем содержании палладия достигает при этом 57%. Обращает на себя внимание то, что склонность к окислению у частиц Pd в образце Pd/C-EV выше, чем в образце Pd/C-HC. Для сравнения, в последнем случае после проведения взаимодействия в аналогичных условиях вклад оксида палладия составлял только 21%. В спектре Pd3d на рис. 5а (спектр 3) обнаруживаются также пики, принадлежащие плазмонным потерям в металлическом палладии [56, 65], и сателлитам S1 и S2, характеризующим PdO [55, 58, 65].
Рис. 5.
Спектры Pd3d (а) и Pd-M45VV (б) образца Pd/C‑VE до (1) и после взаимодействия с NO2 при комнатной температуре (2) и 200°С (3).

Из-за наложения в спектре линии O1s на весьма интенсивную линию Pd3p3/2 исследование состояния кислорода в образцах Pd/C-HC и Pd/C-VE представляет собой непростую задачу. Только в случае образца Pd/C-VE нам удалось с удовлетворительным качеством разложить на компоненты спектры в регионе O1s и Pd3p3/2 (рис. 6). В спектре 1, записанном для исходного Сибунита, как и в спектрах O1s, приведенных на рис. 2б, также регистрируются две линии с энергиями связи 531.1 и 533.2 эВ. В дальнейшем при анализе данного региона эти две линии учитывались в виде компонентов разложения с фиксированными энергиями связи, шириной на половине высоты и отношением интенсивностей. После напыления палладия в спектре появляется принадлежащая металлическому Pd линия Pd3p3/2 с энергией связи 532.5 эВ [56, 65] и с пиком плазмонных потерь, который смещен по отношению к основной линии на ∼6.1 эВ в сторону бóльших энергий связи (спектр 2) [62, 65]. Полученное в настоящей работе значение энергии связи линии Pd3p3/2 на ∼0.3 эВ больше, чем у массивного металла, что, по-видимому, объясняется размерным эффектом. После взаимодействия с NO2 при комнатной температуре спектр в данном регионе практически не меняется (спектр 3). С повышением температуры до 200°С, когда по данным, полученным из других спектральных регионов палладия, происходит частичное окисление металла (рис. 5), интенсивность линии Pd3p3/2, отнесенной металлическому состоянию, падает, и параллельно появляются линии Pd3p3/2 и O1s с энергиями связи 533.7 и 530.6 эВ соответственно, которые принадлежат оксиду PdO (рис. 6, 4). Для массивного PdO приводятся значения Eсв(Pd3p3/2) = = 534.2 эВ [57, 59] и Eсв(O1s) = 530.5 эВ [59]. Пленка трехмерного оксида, образующаяся при окислении палладиевой фольги, характеризуется значениями энергии связи Eсв(Pd3p3/2) = 533.8 эВ [56, 65] и Eсв(O1s) ∼529.8–530.3 эВ [55, 56, 63–65].
Рис. 6.
Спектры Сибунита (1) и образца Pd/C‑VE (2‒4), записанные в регионе O1s + Pd3p3/2, до (2) и после взаимодействия с NO2 при комнатной температуре (3) и 200°С (4).

Таким образом, в отличие от палладия, напыленного на графит, в системе Pd/Сибунит независимо от способа нанесения палладия углеродный носитель при взаимодействии с NO2 не окисляется. При повышенных температурах (200–300°С) нанесенный металл частично превращается в оксид, причем для палладия, напыленного в вакууме, это происходит легче, чем для палладия в составе катализатора Pd/C-HC.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В литературе представлены многочисленные исследования по взаимодействию NO2 с углеродными материалами различной природы, нацеленные, главным образом, на создание систем для поглощения оксидов азота, а также сенсоров, чувствительных к ним. Для активированных углей, сажи и других материалов, обладающих низкой степенью графитизации, на начальном этапе адсорбция сопровождается восстановлением и диспропорционированием молекул NO2 с выделением в газовую фазу NO [66–70]. Параллельно образуются поверхностные комплексы состава C(NO2), C(O–NO2), C(O), C(O–NO), C(ONO3), C2(ONO2), последующая термическая диссоциация которых приводит к десорбции NO, NO2, CO, CO2 [66–70]. Напротив, на поверхности ВОПГ и углеродных нанотрубок, которые образованы плоско упакованными или свернутыми в цилиндр слоями графена, адсорбция NO2 и в равной степени окисление углерода при комнатной и более высоких температурах не наблюдаются [71, 72]. Как следует из спектров, представленных на рис. 2, Сибунит, благодаря высокой степени графитизации, слабо взаимодействует с NO2, что ставит его в один ряд с ВОПГ и нанотрубками.
Ранее нами было исследовано взаимодействие нанесенных на ВОПГ частиц палладия [28, 29] с NO2 при комнатной температуре и обнаружено интенсивное окисление углерода с сохранением у палладия металлического состояния. Вывод об окислении графита был сделан главным образом на основании сильных изменений, происходивших в спектре C1s, что продемонстрировано на рис. 7а. Наблюдалось исчезновение линии sp2-гибридного углерода при 284.4 эВ и появление дополнительных линий, характерных для sp3-углерода и поверхностных кислородсодержащих групп. Процесс сопровождался изменениями в спектре O1s [28, 29]. Предположительный механизм окисления графита включал в себя диссоциативную адсорбцию молекул NO2 на поверхности частиц палладия, внедрение атомов кислорода в приповерхностный слой частиц, диффузию растворенных атомов кислорода к границе раздела частиц с графитом и взаимодействие между атомами кислорода и углерода [73]. Можно было бы ожидать, что другие углеродные материалы будут столь же успешно окисляться диоксидом азота при комнатной температуре при участии нанесенного палладия, как это происходит в системе Pd/ВОПГ. Однако, как видно из рис. 7б, в указанных условиях Сибунит оказался более устойчивым, нежели графит. В спектре 2 на рис. 3а отмечается лишь небольшое уменьшение интенсивности пика плазмонных потерь в результате взаимодействия при комнатной температуре, но этот эффект исчезает с повышением температуры обработки образца (рис. 3а, спектры 3‑5).
Рис. 7.
Спектры C1s образцов Pd/ВОПГ (а) и Pd/C-HP (б) до (1) и после взаимодействия с NO2 при комнатной температуре (2). Спектры для Pd/ВОПГ взяты из работы [29].
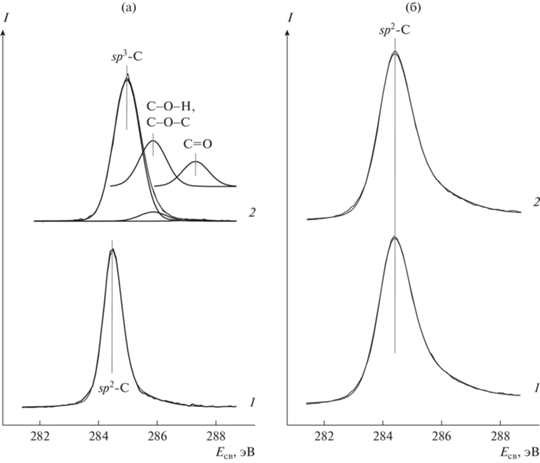
Какова же причина проявления Сибунитом в составе палладиевых (а, вероятно, и других металлических) катализаторов высокой устойчивости к окислению даже по сравнению с графитом, и какие факторы определяют различное поведение систем Pd/Сибунит и Pd/ВОПГ? Наблюдаемые явление нельзя объяснить состоянием углерода и палладия, поскольку, судя по спектрам C1s и Pd3d, в образцах Pd/Сибунит оно практически такое же, как в образцах Pd/ВОПГ. Причина может быть обусловлена наличием в системах Pd/Сибунит примесных элементов, входящих в состав исходного носителя или привносимых в процессе приготовления. Хорошо известно, что наличие на поверхности палладия примесей, в частности, атомов серы, может вызвать отравление катализатора [74–77]. Механизм отравления для реакций окисления обусловлен блокировкой поверхности атомами серы, препятствующими диссоциативной адсорбции молекул кислорода [78]. Применительно к нашему случаю адсорбированные на палладии атомы серы могли бы сделать невозможной одну из ключевых стадий процесса окисления углеродного носителя – диссоциацию молекул NO2. Однако тщательный анализ спектров РФЭС образца Pd/C-HC не обнаружил в его составе каких-либо примесных элементов за исключением небольших количеств натрия и азота с поверхностными концентрациями, соответствующими атомным отношениям [Na]/[C] ∼ 0.01–0.02 и [N]/[C] ∼ 0.002. Поскольку в исходном Сибуните натрий отсутствует, очевидно, что он появляется в процессе приготовления образца. Что касается азота, то его содержание в Сибуните без нанесенного палладия примерно такое же, как и в образце Pd/C-HC – как в исходном состоянии, так и после обработки в NO2. Следовательно, некоторое количество (причем очень незначительное) атомов азота входит в структуру использованного в работе Сибунита, и это количество, по-видимому, не может оказывать существенного влияния на изучаемые процессы. Здесь важно отметить, что в образце Pd/C-VE, приготовленном нанесением палладия методом вакуумного напыления, который исключает появление каких-либо посторонних элементов, на Сибунит, предварительно отожженный в вакууме при 600°С, азот и натрий вообще не регистрировались. Палладий в образце Pd/C-VE демонстрирует такую же низкую активность в окислении углеродного носителя, как и в катализаторе Pd/C-HC. Данный факт ставит под сомнение заметное влияние примесей на потерю палладием способности вести окисление углерода под действием NO2.
Для того чтобы понять причину различий в поведении образцов на основе Сибунита и ВОПГ, внимательно рассмотрим состояние поверхности этих углеродных материалов перед проведением обработки диоксидом азота. Единственным элементом, который помимо углерода присутствует в исследованных образцах в значимых количествах, является кислород, входящий в состав карбонильных, эфирных и фенольных групп (рис. 2б). Важно отметить, что в исследованных нами ранее образцах ВОПГ и модельных системах M/ВОПГ кислород не регистрировался [28, 32, 73]. Считается, что кислородсодержащие функциональные группы, в особенности это касается карбоксильных и фенольных групп, могут вступать в реакцию ионного обмена с металлокомплексными соединениями и таким образом являться центрами, на которых локализуется фрагмент молекулы-предшественника [27, 53, 79–83]. По мнению авторов указанных работ после восстановительной процедуры закрепление частиц металлического палладия происходит именно на таких центрах. Принимая во внимание факт возможной роли кислородсодержащих групп в процессе синтеза катализаторов, во многих работах в методику приготовления включают стадию окислительной модификации поверхности углеродного материала растворами сильных окислителей, например, HNO3, H2O2, KMnO4, с целью увеличения поверхностной концентрации этих групп [20, 23, 27, 51, 53]. Если частицы металла действительно связаны с поверхностью углеродного носителя через атомы кислорода, то в этом случае в системе Pd/Сибунит на границе раздела образуются кислородные мостики Pd‒O–C, которые могут служить барьером на пути атомов кислорода от частиц палладия к углероду. По этой причине окисление углерода становится затрудненным, вследствие чего в объеме частиц палладия накапливаются атомы кислорода в количестве, достаточном для превращения металла в оксид, что и наблюдается при повышении температуры взаимодействия образцов Pd/Сибунит с NO2 до 200–300°С (рис. 4–6).
В то же время в ряде работ полагается, что кислородсодержащие функциональные группы не могут играть существенной роли в закреплении частиц металлов на поверхности углеродного носителя ввиду их недостаточно высокой концентрации [25]. Считается, что частица палладия образует связи с ненасыщенными фрагментами >C=C<, локализованными по краям графеновых слоев. Результаты теоретических расчетов, выполненных в работе [84], свидетельствуют об устойчивости палладиевых частиц, связанных с углеродным носителем именно таким образом. Тем не менее, если даже поверхностный кислород не принимает участия в закреплении частиц палладия на поверхности Сибунита, нельзя полностью исключить его роль в стабилизации данного углеродного материала по отношению к окислительной среде. Возможно, что атомы кислорода, связанные с ненасыщенными фрагментами в структуре Сибунита, блокируют потенциальные места инициирования процесса окисления, открытые для атаки в случае использования в качестве носителя ВОПГ, не содержащего в своем составе кислорода. Таким образом, мы предполагаем, что причина низкой реакционной способности системы Pd/Сибунит в отношении окисления углерода диоксидом азота при комнатной температуре так или иначе обусловлена поверхностным кислородом, входящим в состав носителя.
ЗАКЛЮЧЕНИЕ
При исследовании взаимодействия NO2 с мезопористым углеродным материалом из семейства Сибунит, содержащим на своей поверхности наночастицы нанесенного палладия, при давлении 10–6 мбар и температурах от комнатной до 300°С установлено следующее:
1) Сибунит проявляет высокую устойчивость по отношению к NO2, и его состояние остается неизменным после проведения взаимодействия в указанных условиях;
2) при температурах ≤150°С частицы нанесенного палладия сохраняют металлическое состояние;
3) с повышением температуры до 200–300°С палладий частично переходит в состояние оксида PdO.
Высокая устойчивость носителя в составе катализаторов Pd/Сибунит по отношению к NO2 предположительно обусловлена атомами кислорода, связанными с его поверхностью и блокирующими места, на которых потенциально инициируется окисление углерода.
Список литературы
Yoon B., Wai C.M. // J. Am. Chem. Soc. 2005. V. 127. P. 17174.
Mori A., Miyakawa Y., Ohashi E., Haga T., Maegawa T., Sajiki H. // Org. Lett. 2006. V. 8. P. 3279.
Chen L., Yang K., Liu H., Wang X. // Carbon. 2008. V. 46. P. 2137.
Deliy I.V., Simakova I.L., Ravasio N., Psaro R. // Appl. Catal. A: Gen. 2009. V. 357. P. 170.
Yuan Z., Stephan R., Hanf M.C., Becht J.M., Le Drian C., Hugentobler M., Harbich W., Wetzel P. // Eur. Phys. J. D. 2011. V. 63. P. 401.
Martin-Martinez M., Rodriguez J.J., Baker R.T., Gymez-Sainero L.M. // Chem. Eng. J. 2020. V. 397. P. 125479.
Prasad K.V., Chaudhari R.V. // J. Cat. 1994. V. 145. P. 204.
Porsgaard S., Ono L.K., Zeuthen H., Knudsen J., Schnadt J., Merte L.R., Chevallier J., Helveg S., Salmeron M., Wendt S., Besenbacher F. // ChemPhysChem. 2013. V. 14. P. 1553.
Sawama Y., Asai S., Monguchi Y., Sajiki H. // Chem. Rec. 2016. V. 16. P. 261.
Matsumoto K., Yoshida M., Shindo M. // Angew. Chem. Int. Ed. 2016. V. 55. P. 5272.
Wilde C.A., Ryabenkova Y., Firth I.M., Pratt L., Railton J., Bravo-Sanchez M., Sano N., Cumpson P.J., Coates P.D., Liu X., Conte M. // Appl. Catal. A: Gen. 2019. V. 570. P. 271.
Matsumoto K., Kobayashi Y., Hirokane T., Yoshida M. // Chem. Pharm. Bull. 2020. V. 68. P. 167.
Yermakov Y.I., Surovikin V.F., Plaksin G.V., Semikolenov V.A., Likholobov V.A., Chuvilin A.V., Bogdanov S.V. // React. Kinet. Catal. Lett. 1987. V. 33. P. 435.
Likholobov V.A., Fenelonov V.B., Okkel L.G., Gonchrova O.V., Avdeeva L.B., Zaikovskii V.I., Kuvshinov G.G., Semikolenov V.A., Duplyakin V.K., Baklanova O.N., Plaksin G.V. // React. Kinet. Catal. Lett. 1995. V. 54. P. 381.
Стахеев А.Ю., Ткаченко О.П., Клементьев К.В., Grünert W., Брагина Г.О., Машковский И.С., Кустов Л.М. // Кинетика и катализ. 2005. Т. 46. С. 122. (Stakheev A.Yu., Tkachenko O.P., Klement’ev K.V., Grünert W., Bragina G.O., Mashkovskii I.S., Kustov L.M. // Kinet. Catal. 2008. V. 49. P. 748.)
Simakova O.A., Simonov P.A., Romanenko A.V., Simakova I.L. // React. Kinet. Catal. Lett. 2008. V. 95. P. 3.
Романенко А.В., Воропаев И.Н., Абдуллина Р.М., Чумаченко В.А. // Химия твердого топлива. 2014. № 6. С. 33. (Romanenko A.V., Voropaev I.N., Abdullina R.M., Chumachenko V.A. // Solid Fuel Chem. 2014. V. 48. P. 356.)
Симонов П.А., Романенко А.М., Лихолобов В.А. // Химия твердого топлива. 2014. № 6. С. 40. (Simonov P.A., Romanenko A.V., Likholobov V.A. // Solid Fuel Chem. 2014. V. 48. P. 364.)
Бельская О.Б., Мироненко Р.М., Гуляева Т.И., Тренихин М.В., Лихолобов В.А. // Изв. АН, сер. хим. 2018. № 1. С. 71. (Belskaya O.B., Mironenko R.M., Gulyaeva T.I., Trenikhin M.V., Likholobov V.A. // Russ. Chem. Bull., Int. Ed. 2018. V. 67. P. 71.)
Lokteva E.S., Golubina E.V. // Pure Appl. Chem. 2019. V. 91. P. 609.
Шляпин Д.А., Глыздова Д.В., Афонасенко Т.Н., Темерев В.Л., Цырульников П.Г. // Кинетика и катализ. 2019. Т. 60. С. 479. (Shlyapin D.A., Glyzdova D.V., Afonasenko T.N., Temerev V.L., Tsyrul’nikov P.G. // Kinet. Catal. 2019. V. 60. P. 446.)
Локтева Е.С., Ростовщикова Т.Н., Качевский С.А., Голубина Е.В., Смирнов В.В., Стахеев А.Ю., Телегина Н.С., Гуревич С.А., Кожевин В.М., Явсин Д.А. // Кинетика и катализ. 2008. Т. 49. С. 784. (Lokteva E.S., Rostovshchikova T.N., Kachevskii S.A., Golubina E.V., Smirnov V.V., Stakheev A.Yu., Telegina N.S. Gurevich S.A., Kozhevin V.M., Yavsin D.A. // Kinet. Catal. 2008. V. 49. P. 748.)
Gudarzi D., Simakova O.A., Hernández Carucci J.R., Biasi P.D., Eränen K., Kolehmainen E., Turunen I., Murzin D.Y., Salmi T. // Chem. Eng. Trans. 2010. V. 21. P. 925.
Golub F.S., Beloshapkin S., Gusel’nikov A.V., Bolotov V.A., Parmon V.N., Bulushev D.A. // Energies. 2019. V. 12. P. 3885. https://doi.org/10.3390/en12203885
Simonov P.A., Likholobov V.A. Physicochemical Aspects of Preparation of Carbon-Supported Noble Metal Catalysts. In: Catalysis and Electrocatalysis at Nanoparticle Surfaces. Eds. Wieckowski A., Savinova E.R., Vayenas C.G. CRC Press, 2003, Ch. 12. P. 409.
Охлопкова Л.Б., Кузнецова Н.И. // Кинетика и катализ. 2008. Т. 49. С. 38. (Okhlopkova L.B., Kuznetsova N.I. // Kinet. Catal. 2008. V. 49. P. 34.)
German D., Pakrieva E., Kolobova E., Carabineiro S.A.C., Stucchi M., Villa A., Prati L., Bogdanchikova N., Corberán V.C., Pestryakov A. // Catalysts. 2021. V. 11. P. 115.
Смирнов М.Ю., Калинкин А.В., Сорокин А.М., Бухтияров В.И. // Кинетика и катализ. 2020. Т. 61. С. 568. (Smirnov M.Yu., Kalinkin A.V., Sorokin A.M., Bukhtiyarov V.I. // Kinet. Catal. 2020. V. 61. P. 637.)
Смирнов М.Ю., Калинкин А.В., Сорокин А.М., Бухтияров В.И. // Кинетика и катализ. 2020. Т. 61. С. 893. (Smirnov M.Yu., Kalinkin A.V., Sorokin A.M., Bukhtiyarov V.I. // Kinet. Catal. 2020. V. 61. P. 907.)
Smirnov M.Yu., Kalinkin A.V., Vovk E.I., Simonov P.A., Gerasimov E.Yu., Sorokin A.M., Bukhtiyarov V.I. // Appl. Surf. Sci. 2018. V. 428. P. 972.
Pronkin S.N., Simonov P.A., Zaikovskii V.I., Savinova E.R. // J. Mol. Catal. A: Chem. 2007. V. 265. P. 141.
Калинкин А.В., Сорокин А.М., Смирнов М.Ю., Бухтияров В.И. // Кинетика и катализ. 2014. Т. 55. С. 371. (Kalinkin A.V., Sorokin A.M., Smirnov M.Yu., Bukhtiyarov V.I. // Kinet. Catal. 2014. V. 55. P. 354.)
http://xpspeak.software.informer.com/4.1/.
Ларичев Ю.В., Просвирин И.П., Шляпин Д.А., Шитова Н.Б., Цырульников П.Г., Бухтияров В.И. // Кинетика и катализ. 2005. Т. 46. С. 635. (Larichev Yu.V., Prosvirin I.P., Shlyapin D.A., Shitova N.B., Tsyrul’nikov P.G., Bukhtiyarov V.I. // Kinet. Catal. 2005. V. 46. P. 597.)
Ayusheev A.B., Taran O.P., Seryak I.A., Podyacheva O.Yu., Descorme C., Besson M., Kibis L.S., Boronin A.I., Romanenko A.I., Ismagilov Z.R., Parmon V. // Appl. Catal. B: Env. 2014. V. 146. P. 177.
Simakova I.L., Demidova Yu.S., Gläsel J., Murzina E.V., Schubert T., Prosvirin I.P., Etzold B.J.M., Murzin D.Yu. // Catal. Sci. Technol. 2016. V. 6. P. 8490.
Gromov N.V., Medvedeva T.B., Taran O.P., Bukhtiyarov A.V. Aymonier C.,· Prosvirin I.P., Parmon V.N. // Top. Catal. 2018. V. 61. P. 1912.
Glyzdova D.V., Afonasenko T.N., Khramov E.V., Leont’eva N.N., Prosvirin I.P., Bukhtiyarov A.V., Shlyapin D.A. // Appl. Catal. A: Gen. 2020. V. 600. P. 117627.
Ganguly A., Sharma S., Papakonstantinou P., Hamilton J. // J. Phys. Chem. C. 2011. V. 115. P. 17009.
Ansón-Casaosa A., Puértolas J.A., Pascual F.J., Hernández-Ferrera J., Castell P., Benito A.M., Maser W.K., Martínez M.T. // Appl. Surf. Sci. 2014. V. 301. P. 264.
Ghosh B., Sarma S., Pontsho M., Ray S.C. // Diamond Relat. Mater. 2018. V. 89. P. 35.
Yang D., Velamakanni A., Bozoklu G., Park S., Stoller M., Piner R.D., Stankovich S., Jung I., Field D.A., Ventrice C.A., Ruoff R.S. // Carbon. 2009. V. 47. P. 145.
Hou S., Su S., Kasner M.L., Shah P., Patel K., Madarang C.J. // Chem. Phys. Lett. 2010. V. 501. P. 68.
Figueiredo J.L., Pereira M.F.R. // Catal. Today. 2010. V. 150. P. 2.
Stobinski L., Lesiak B., Malolepszy A., Mazurkiewicz M., Mierzwa B., Zemek J., Jiricek P., Bieloshapka I. // J. Electron Spectrosc. Related Phenomena. 2014. V. 195. P. 145.
Jena G., Vanithakumari S.C., Thinaharan C., George R.P., Mudali U.K. // J. Bio. Tribo. Corrosion. 2018. V. 4. P. 20.
Kostecki R., Schnyder B., Alliata D., Song X., Kinoshita K., Kotz R. // Thin Solid Films. 2001. V. 396. P. 36.
Martınez M.T., Callejas M.A., Benito A.M., Cochet M., Seeger T., Anso’n A., Schreiber J., Gordon C., Marhic C., Chauvet O., Fierro J.L.G., Maser W.K. // Carbon. 2003. V. 41. P. 2247.
Simagina V.I., Netskina O.V., Tayban E.S., Komova O.V., Grayfer E.D., Ischenko A.V., Pazhetnov E.M. // Appl. Catal. A: Gen. 2010. V. 379. P. 87.
Kuznetsova L.I., Kuznetsova N.I., Koscheev S.V., Zaikovskii V.I., Lisitsyn A.S., Kaprielova K.M., Kirillova N.V., Twardowski Z. // Appl. Catal. A: Gen. 2012. V. 427–428. P. 8.
Iost K.N., Borisov V.A., Temerev V.L., Surovikin Y.V., Pavluchenko P.E., Trenikhin M.V., Arbuzov A.B., Shlyapin D.A., Tsyrulnikov P.G., Vedyagin A.A. // Int. J. Hydrogen Energy. 2018. V. 43. P. 17656.
Moulder J.F., Stickle W.F., Sobol P.E., Bomben K.D. Handbook of X-ray Photoelectron Spectroscopy. Eden Prairie: Perkin-Elmer Co., 1992.
Стахеев А.Ю., Ткаченко О.П., Капустин Г.И., Телегина Н.С., Баева Г.Н., Бруева Т.Р., Клементьев К.В., Грунерт В., Кустов Л.М. // Изв. Акад. Наук. Сер. хим. 2004. № 3. С. 502. (Stakheev A.Yu., Tkachenko O.P., Kapustin G.I., Telegina N.S., Baeva G.N., Brueva T.R., Klementiev K.V., Grunert W., Kustov L.M. // Russ. Chem. Bull. Int. Ed. 2004. V. 53. P. 528.)
Lokteva E.S., Peristyy A.A., Kavalerskaya N.E., Golubina E.V., Yashina L.V., Rostovshchikova T.N., Gurevich S.A., Kozhevin V.M., Yavsin D.A., Lunin V.V. // Pure Appl. Chem. 2012. V. 84. P. 495.
Kibis L.S., Titkov A.I., Stadnichenko A.I., Koscheev S.V., Boronin A.I. // Appl. Surf. Sci. 2009. V. 255. P. 9248.
Peuckert M. // J. Phys. Chem. 1985. V. 89. P. 2481.
Fleisch T.H., Mains G.J. // J. Phys. Chem. 1986. V. 90. P. 5317.
Pillo T., Zimmermann R., Steiner P., Hufner S. // J. Phys. Condens. Matter. 1997. V. 9. P. 3987.
Militello M.C., Simko S.J. // Surf. Sci. Spectra. 1997. V. 3. P. 395.
Brun M., Berthet A., Bertolini J.C. // J. Electron Spectrosc. Relat. Phenom. 1999. V. 104. P. 55.
Mirkelamoglu B., Karakas G. // Appl. Catal. A: Gen. 2006. V. 299. P. 84.
Zemlyanov D., Azalos-Kiss B., Kleimenov E., Teschner D., Zafeiratos S., Havecker M., Knop-Gericke A., Schlogl R., Gabasch H., Unterberger W., Hayek K., Klotzer B. // Surf. Sci. 2006. V. 600. P. 983.
Titkov A.I., Salanov A.N., Koscheev S.V., Boronin A.I. // Surf. Sci. 2006. V. 600. P. 4119.
Wang J., Yun Y., Altman E.I. // Surf. Sci. 2007. V. 601. P. 3497.
Смирнов М.Ю., Клембовский И.О., Калинкин А.В., Бухтияров В.И. // Кинетика и катализ. 2018. Т. 59. С. 750. (Smirnov M.Yu., Klembovskii I.O., Kalinkin A.V., Bukhtiyarov V.I. // Kinetics and Catalysis. 2018. V. 59. P. 786.)
Shirahama N., Moon S.H., Choi K.-H., Enjoji T., Kawano S., Korai Y., Tanoura M., Mochida I. // Carbon. 2002. V. 40. P. 2605.
Jeguirim M., Tschamber V., Brilhac J.F., Ehrburger P. // J. Anal. Appl. Pyrolysis. 2004. V. 72. P. 171.
Gao X., Liu S., Zhang Y., Luo Z., Ni M., Cen K. // Fuel Proc. Technol. 2011. V. 92. P. 139.
Ghouma I., Jeguirim M., Dorge S., Limousy L., Ghimbeu C.M., Ouederni A. // C. R. Chimie. 2015. V. 18. P. 63.
Fang M.-L., Chou M.-S., Chang C.-Y., Chang H.-Y., Chen C.-H., Lin S.-L., Hsieh Y.-K. // Aerosol Air Quality Res. 2019. V. 19. P. 2568.
Goldoni A., Petaccia L., Gregoratti L., Kaulich B., Barinov A., Lizzit S., Laurita A., Sangaletti L., Larciprete R. // Carbon. 2004. V. 42. P. 2099.
Larciprete R., Petaccia L., Lizzit S., Goldoni A. // J. Phys. Chem. C. 2007. V. 111. P. 12169.
Смирнов М.Ю., Калинкин А.В., Саланов А.Н., Сорокин А.М., Бухтияров В.И. // Кинетика и катализ. 2021. Т. 62. С. 619. (Smirnov M.Yu., Kalinkin A.V., Salanov A.N., Sorokin A.M., Bukhtiyarov V.I. // Kinet. Catal. 2021. V. 62. P. 664.)
L’Argentiere P.C., Figoli N.S. // Appl. Catal. 1990. V. 61. P. 275.
Lampert J.K., Kazi M.S., Farrauto R.J. // Appl. Catal. B: Env. 1997. V. 14. P. 211.
Yang Y., Wang G., Ge S., Yang H., Liu M., Liu M. // Int. J. Hydrogen Energy. 2021. V. 46. P. 6329.
Ren S., Liang W., Fang H., Zhu Y. // J. Env. Chem. Eng. 2021. V. 9. P. 106640.
Lahti M., Puisto A., Alatalo M., Rahman T.S. // Surf. Sci. 2008. V. 602. P. 3660.
Mager N., Meyer N., Leonard A.F., Job N., Devillers M., Hermans S. // Appl. Catal. B: Env. 2014. V. 148–149. P. 424.
Korovchenko P., Renken A., Kiwi-Minsker L. // Cat. Today. 2005. V. 102–103. P. 133.
Hermans S., Diverchy C., Demoulin O., Dubois V., Gaigneaux E.M., Devillers M. // J. Catal. 2006. V. 243. P 239.
Hermans S., Diverchy C., Dubois V., Devillers M. // Appl. Catal. A. 2014. V. 474. P. 263.
Jia N., Shi Y., Zhang S., Chen X., Chen P., An Z. // Int. J. Hydrogen Energy. 2017. V. 42. P. 8255.
Efremenko I., Sheintuch M. // J. Catal. 2003. V. 214. P. 53.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ



