Кинетика и катализ, 2022, T. 63, № 6, стр. 825-836
Возможности микропористых и иерархических цеолитов MFI в синтезе азотгетероциклических соединений
Н. Г. Григорьева a, b, *, О. С. Травкина a, b, С. В. Бубеннов a, Н. А. Филиппова a, А. С. Артемьева a, А. В. Байбуртли b, Р. З. Куватова a, Б. И. Кутепов a, b
a ФГБУН Институт нефтехимии и катализа УФИЦ РАН
450075 Уфа, просп. Октября, 141, Россия
b ФГБОУ ВО Уфимский государственный нефтяной технический университет
450062 Уфа, ул. Космонавтов, 1, Россия
* E-mail: ngg-ink@mail.ru
Поступила в редакцию 22.02.2022
После доработки 19.05.2022
Принята к публикации 30.06.2022
- EDN: CKCFGC
- DOI: 10.31857/S0453881122060053
Аннотация
Исследованы каталитические свойства микропористого цеолита H-ZSM-5 и гранулированного иерархического цеолита H-ZSM-5h в синтезе базовых пиридинов и хинолинов. Особенностью цеолита H-ZSM-5h является отсутствие в его гранулах связующего вещества, а пористая структура содержит микро-, мезо- и макропоры. В образце Н-ZSM-5h, кроме кристаллов исходного цеолита, наблюдаются кристаллы размером от 15 до 100 нм. Образец H-ZSM-5h во всех изученных реакциях показал более высокую активность, селективность и стабильность, чем микропористый цеолит H-ZSM-5.
ВВЕДЕНИЕ
Цеолиты – одна из наиболее важных групп гетерогенных катализаторов, которые в больших масштабах применяются в нефтеперерабатывающей, нефтехимической и химической промышленности [1, 2].
Традиционные цеолиты – это кристаллические материалы с упорядоченной микропористой структурой (диаметр пор менее 2 нм), хотя максимальный размер окон промышленных катализаторов составляет 0.74 нм (12-членное кольцо). Во многих случаях, в том числе в реакциях с малыми молекулами, размер которых меньше диаметра пор, микропоры обеспечивают высокую селективность процессов. В то же время именно микропоры создают проблемы для массопереноса молекул и увеличивают диффузионные затруднения, что в конечном итоге является причиной быстрого закоксовывания и дезактивации цеолитных катализаторов. Исследования показывают, что введение дополнительной мезопористости в кристаллическую структуру цеолитов позволяет добиться улучшения активности и селективности катализаторов, замедляет коксообразование и дезактивацию [3–7]. Цеолитные материалы, пористая структура которых имеет по крайней мере два уровня пористости – микро- и мезо/макропоры, называют иерархическими. Такие цеолиты зачастую превосходят свои микропористые аналоги, особенно в реакциях с участием объемных молекул или высокореакционноспособных соединений, являющихся причиной образования большого количества кокса.
Подобные процессы характерны для синтеза азотгетероциклических соединений – важного класса веществ с очень широким спектром использования: фармацевтика [8–13], сельское хозяйство [14], нефтехимическая и химическая промышленность [15–17], электроника [18, 19].
Многие известные синтетические способы получения пиридинов, хинолинов и других азотгетероциклов основаны на катализируемых кислотами или основаниями реакциях циклоконденсации аммиака/аминов с карбонильными соединениями [20]. Высокая реакционная способность последних, склонность к полимеризации, “жесткие” условия реакций, большое количество протекающих параллельно с циклоконденсацией побочных реакций – все это приводит к уменьшению селективности образования и выхода целевых соединений. Поэтому поиску новых, более эффективных гетерогенно-каталитических способов получения практически важных азотгетероциклических соединений постоянно уделяется большое внимание.
Ранее нами сообщалось о синтезе различных азотгетероциклических соединений в присутствии гранулированного цеолита Y высокой степени кристалличности с иерархической пористой структурой (микро-, мезо-, макропоры) [21–38].
В настоящее время по разработанной в лаборатории приготовления катализаторов ИНК УФИЦ РАН оригинальной методике получен гранулированный цеолит ZSM-5 высокой степени кристалличности с иерархической пористой структурой в Н-форме (далее H-ZSM-5h) [39–41].
В настоящей работе приведены результаты изучения его активности, селективности и стабильности в сравнении с микропористым цеолитом H-ZSM-5 (далее H-ZSM-5) в синтезе: а) пиридина и его алкилпроизводных взаимодействием этанола с формальдегидом и аммиаком; б) хинолинов и алкилхинолинов реакциями анилина с глицерином или альдегидами, а также реакцией 2-аминоацетофенона с 2,4-пентандионом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и реагенты
Для синтеза пиридинов использовали этанол (96%, “Acros”), водные растворы формальдегида (37%, “Acros”) и аммиака (28%, ч. д. а., “Сигма Тек”). Хинолин и алкилхинолины синтезировали из анилина (99.8%, “Acros”) и глицерина (99%, “Acros”)/альдегидов (пропаналя, 97%, бутаналя, 99%). 1-(2,4-Диметилхинолин-3-ил)этанон получали из 2-аминоацетофенона (≥98%, “Sigma-Aldrich”) и 2,4-пентандиона (99+%, “Acros”). В качестве растворителей применяли диэтиловый эфир, хлористый метилен, ацетонитрил, D-хлороформ, гексан, этилацетат, хлорбензол.
Реагенты перед опытами очищали по стандартным методикам [42].
Катализаторы
Цеолит Na-ZSM-5h синтезировали согласно методике, описанной в [40, 41]. Для приготовления использовали порошкообразный цеолит Na-ZSM-5 с мольным соотношением Si/Al = 15 производства ООО “ИСХЗК” и предварительно приготовленный аморфный алюмосиликат (Si/Al = 6). Указанные выше компоненты смешивали, увлажняли полученную смесь путем добавления воды, формовали гранулы диаметром 1.6 ± 0.1 мм и длиной (4–6) ± 0.2 мм, затем подвергали их термообработке при 550 ± 5°С в течение 4 ч и гидротермальной кристаллизации в растворе силиката натрия.
Цеолиты ZSM-5 и ZSM-5h в H-форме получали путем обмена катионов Na+ на ${\text{NH}}_{4}^{ + }$ с последующей термообработкой при 550 ± 5°С в течение 4–6 ч в атмосфере воздуха. Степень обмена катионов Na+ на Н+ в полученных образцах составила 0.96–0.98.
Непосредственно перед каталитическими испытаниями катализаторы подвергали высокотемпературной обработке в атмосфере осушенного воздуха при 540°С в течение 3–4 ч.
Физико-химические исследования катализаторов
Химический состав полученных цеолитов анализировали методом рентгенофлуоресцентной спектрометрии на приборе EDX-7000P (“Shimadzu”, Япония).
Фазовый состав и степень кристалличности образцов оценивали рентгенографическим методом (РФА). Перед анализом образцы подвергали термообработке при 600°С в течение 3 ч для удаления темплата. Запись дифрактограмм осуществляли на дифрактометре Ultima IV (“Rigaku”, Япония) в монохроматизированном CuKα-излучении в области углов от 3° до 50° по 2θ с шагом 0.5 град/мин и временем накопления в каждой точке 2 с. Степень кристалличности рассчитывали по отношению суммарной интегральной интенсивности от кристаллической фазы к сумме суммарных интегральных интенсивностей от кристаллической и аморфной фаз. Рентгенофазовый анализ проводили в программе PDXL сопоставлением полученных дифрактограмм с базой данных PDF2.
Пористую структуру анализировали с помощью низкотемпературной (77 К) адсобции–десорбции азота на сорбтометре ASAP-2020 (“Micromeritics”, США). Перед анализом образцы вакуумировали при 350°С в течение 6 ч. Удельную поверхность измеряли по методу БЭТ при относительном парциальном давлении Р/Р0 = 0.2. Распределение размера пор рассчитывали по десорбционной кривой методом Баррета–Джойнера–Халенды (BJH), общий объем пор определяли методом BJH при относительном парциальном давлении Р/Р0 = 0.95. Объем микропор в присутствии мезопор находили по t-методу де Бура и Липпенса [43].
Морфологию и размер кристаллов образцов исследовали методом сканирующей электронной микроскопии (СЭМ) на электронном микроскопе Regulus 8220 (“Hitachi”, Япония). Съемку изображений вели в режиме регистрации вторичных электронов при ускоряющем напряжении 2 кВ и рабочем расстоянии 8–10 мм.
Кислотные свойства цеолитов определяли методом термопрограммируемой десорбции аммиака (ТПД NH3) [44].
Синтез пиридинов и хинолинов
Синтез пиридинов осуществляли взаимодействием этанола с формальдегидом и аммиаком в проточном реакторе с неподвижным слоем катализатора (1 г, цеолит H-ZSM-5 в виде порошка, H-ZSM-5h измельчен до частиц размером 20–100 мкм) при 400°C, атмосферном давлении, объемной скорости подачи сырья (w) 7 ч–1, мольном соотношении C2H5OH : CH2O : NH3 = 1.0 : 0.8 : 1.5. После окончания реакции реактор продували азотом. Продукты реакции, собранные в охлаждаемый льдом приемник, экстрагировали диэтиловым эфиром и анализировали с помощью газожидкостной хроматографии (ГЖХ) на хроматографе (“Сarlo Erba”, Италия) с пламенно-ионизационным детектором (насадочная колонка 3 м, фаза 15% ПЭГ-6000 на Хроматоне, температура анализа 50–200°С с программированным нагревом со скоростью 8°С/мин).
Синтез хинолинов по Скраупу осуществляли реакцией анилина с 20%-ным водным раствором глицерина в проточном реакторе с неподвижным слоем катализатора (1 г) при 450°C, атмосферном давлении, w = 0.2 ч–1, мольном соотношении анилин : глицерин = 1 : 3. Анилин и водный раствор глицерина подавали в реактор в токе азота (10 мл/мин) двумя насосами. После окончания реакции реактор продували азотом в течение 0.5 ч. Продукты реакции, собранные в охлаждаемый льдом приемник, экстрагировали хлористым метиленом и анализировали с помощью ГЖХ на хроматографе GC-9A (“Shimadzu”, Япония) с пламенно-ионизационным детектором (стеклянная капиллярная колонка длиной 25 м, фаза SE-30, температура анализа 50–280°С с программированным нагревом со скоростью 8°С/мин). 3-Нитротуол добавляли как внутренний стандарт.
Диалкилхинолины синтезировали реакцией анилина с альдегидами С3–С4 в автоклаве при 160°С, мольном соотношении анилин : альдегид = = 1 : 2, 6 ч, в присутствии 20 мас. % катализатора. После окончания реакции автоклав охлаждали до комнатной температуры, продукты реакции экстрагировали дихлорметаном, после отгонки растворителя анализировали с помощью ГЖХ на хроматографе Кристаллюкс-4000М (ООО “НПФ “Мета-хром”, Россия) (детектор по теплопроводности, стеклянная капиллярная колонка фирмы “Agilent” с фазой DB-5 (50 м × 0.32 мм; толщина слоя – 0.52 мкм), программированный нагрев 100–250°С со скоростью 8°С/мин, газ-носитель – гелий). Индивидуальные соединения выделяли методом колоночной хроматографии (сорбент – SiO2, 35–70 нм, “Sigma-Aldrich”) с использованием градиентного элюирования. В качестве компонентов элюента применяли гексан (неполярный растворитель) и этилацетат (полярный растворитель) с соотношением (об. %) от 100 : 0 до 20 : 80.
Синтез хинолинов по Фридлендеру осуществляли взаимодействием 2-аминоацетофенона и 2,4-пентандиона в автоклаве при 150°C в присутствии 25 мас. % катализатора (в расчете на сумму реагентов), мольном соотношении кетоамин : дикетон = 1 : 1. Автоклав помещали в печь и нагревали при перемешивании в течение 5 ч. После окончания реакции автоклав охлаждали, продукты экстрагировали из реакционной массы ацетоном и анализировали с помощью ГЖХ на хроматографе Кристаллюкс- 4000М (детектор по теплопроводности, стеклянная капиллярная колонка фирмы “Agilent” с фазой DB-5 (50 м × 0.32 мм; толщина слоя 0.52 мкм), программированный нагрев 100–250°С со скоростью 8°С/мин, газ-носитель – гелий). Степень превращения исходного 2-аминоацетофенона определяли относительно внутреннего стандарта – толуола, в количестве 10% на исходный кетоамин. 1-(2,4-Диметилхинолин-3-ил)этанон выделяли при помощи колоночной хроматографии (SiO2, 100–200 мм). Использовали элюентную смесь гексан : этилацетат = 1 : 2.
Масс-спектры соединений получали на хромато-масс-спектрометре GCMS-QP2010Plus (“Shimadzu”, Япония) (фаза SPB-5, капиллярная колонка 30 м × 0.25 мм, газ-носитель – гелий, температура программирования 40–300°C, температура ионного источника – 200°C, энергия ионизации – 70 эВ).
Спектры ЯМР 1Н и 13С, гомо- и гетероядерные методики COSY, HSQC, HMBC регистрировали на приборе Avance III 500 HD Ascend (“Bruker”, Германия) (рабочая частота для 1Н – 500.17 МГц, для 13С – 125.78 МГц), растворитель – CDCl3.
Конверсию X (%) и селективность Si (%) рассчитывали по формулам:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Характеристики катализаторов
Отношение Si/Al, степень кристалличности и характеристики пористой структуры исследованных цеолитов H-ZSM-5 и H-ZSM-5h представлены в табл. 1.
Таблица 1.
Физико-химические характеристики катализаторов
| Катализатор | Si/Al | β, % | SБЭТ, м2/г |
Vмикро, см3/г |
Vмезо, см3/г |
Vмакро, см3/г |
Vобщ, см3/г |
|---|---|---|---|---|---|---|---|
| H-ZSM-5 | 15 | 100 | 285 | 0.12 | 0.01 | – | 0.13 |
| H-ZSM-5h | 12 | 95–97 | 319 | 0.12 | 0.19 | 0.31 | 0.62 |
В микропористом цеолите Н-ZSM-5 соотношение Si/Al составляет 15, а в гранулированном иерархическом H-ZSM-5h равно 12.
Согласно данным РФА, для образцов H-ZSM-5 и H-ZSM-5h характерна степень кристалличности близкая к 100%. У образца H-ZSM-5h она незначительно ниже и объясняется неполной кристаллизацией аморфной составляющей.
Традиционный цеолит H-ZSM-5 – это микропористый материал, на долю микропор в нем приходится 92% от общего объема пор (табл. 1). Суммарный объем пор образца H-ZSM-5h в 4.8 раз выше, чем образца H-ZSM-5. Цеолит H-ZSM-5h является микро-мезо-макропористым материалом, в котором объем мезо- и макропор преобладает над объемом микропор (микропоры – 19%, мезопоры – 31%, макропоры – 50%).
Методом сканирующей электронной микроскопии (СЭМ) изучены форма и размеры кристаллов образцов микропористого и гранулированного иерархического цеолитов H-ZSM-5 и H-ZSM-5h (рис. 1).
Для цеолита Н-ZSM-5 (рис. 1а) характерны кристаллы с различной морфологией. Наряду с кристаллами кубической формы присутствуют кристаллы стержневидной или вытянутой формы, размер их варьируется от 1 до 3 мкм. В образце Н-ZSM-5h (рис. 1б, 1в) кроме кристаллов исходного цеолита наблюдаются кристаллы с размером от 15 до 100 нм.
В спектрах ТПД NH3 всех изученных образцов присутствуют два пика, что означает наличие кислотных центров разной силы. Низкотемпературные пики с максимумом в области температур 270°С характеризуют слабые кислотные центры, а высокотемпературные пики в области температур 415°С – сильные. Суммарная концентрация слабых и сильных кислотных центров незначительно выше в цеолите H-ZSM-5h (728 мкмоль г–1) (табл. 2). При переходе к цеолиту H-ZSM-5 она закономерно снижается из-за уменьшения содержания атомов алюминия в кристаллической решетке цеолита.
Таблица 2.
Кислотные свойства цеолитов H-ZSM-5 и H-ZSM-5h, определенные методом ТПД NH3
| Образец | Температура десорбции, Tm, °C | Концентрация кислотных центров, ммоль/г* | |||
|---|---|---|---|---|---|
| T1 | T2 | слабыеa | сильныеb | ∑c | |
| H-ZSM-5h | 270 | 415 | 421 | 307 | 728 |
| H-ZSM-5 | 270 | 415 | 369 | 319 | 688 |
Более низкая концентрация сильных кислотных центров образца H-ZSM-5h по сравнению с образцом H-ZSM-5 объясняется тем, что в иерархическом материале кристаллы цеолита образуют сростки, поэтому часть кислотных центров недоступна для адсорбции молекул аммиака. Сила слабых и сильных кислотных центров в обоих образцах примерно одинакова.
Каталитические свойства пентасилов в синтезе N-гетероциклических соединений
Синтез пиридинов. Пиридины (пиридин, пиколины, лутидины) синтезировали реакцией этанола с формальдегидом и аммиаком (схема 1 ):
Схема 1 . Синтез пиридинов реакцией этанола с формальдегидом и аммиаком.
Как установлено, в составе пиколинов преобладает 3-метилпиридин, а в составе лутидинов основным соединением является 3,5-диметилпиридин. Конверсия этанола на цеолите H-ZSM-5h значительно выше (примерно в 2 раза), чем на микропористом цеолите H-ZSM-5 (табл. 3).
Таблица 3.
Реакция этанола с формальдегидом и аммиаком на цеолитах H-ZSM-5 и H-ZSM-5h*
| Катализатор | Конверсия этанола, % | Селективность, % | |||
|---|---|---|---|---|---|
| пиридин | пиколины | лутидины | “тяжелые” | ||
| H-ZSM-5h | 72 | 28 | 34 | 31 | 7 |
| H-ZSM-5 | 37 | 35 | 53 | 9 | 3 |
Полученные результаты обусловлены наличием наноразмерных кристаллов и развитой системы мезо- и макропор в цеолите H-ZSM-5h, которые обеспечивают исходным молекулам лучший доступ к активным центрам цеолита и более легкий транспорт образующихся пиридинов из пор катализатора.
Составы продуктов реакции на образцах H-ZSM-5 и H-ZSM-5h существенно отличаются: на микропористом катализаторе основные продукты – пиридин и пиколины (88%); на иерархическом 65% приходится на долю пиколинов и лутидинов. Образование значительного количества диметилпиридинов, безусловно, стало возможным только благодаря присутствию мезо- и макропор в пористой структуре цеолита H-ZSM-5h. Сравнение размера молекул пиридина, 3-пиколина и 3,5-лутидина (рис. 2) и 10-членных колец цеолита H-ZSM-5 (диаметр 0.51 × 0.55 нм и 0.53 × × 0.56 нм) показывает, что только диаметр молекулы пиридина меньше диаметра входных окон цеолита, а размеры молекул метилпиридинов – больше. Поэтому в каналах цеолита H-ZSM-5 может происходить только образование пиридина, а формирование более объемных пиколинов и лутидинов возможно в устьях пор или на внешней поверхности. Микропористая структура ограничивает как образование объемных молекул, так и их диффузию из пор катализатора в реакционный объем. Мезо- и макропоры не только делают активные центры цеолита H-ZSM-5h более доступными для реагирующих молекул, но и создают условия для появления более объемных молекул, например, диметилпиридинов.
Иерархическая пористая структура способствует повышению стабильности катализатора (рис. 3).
Рис. 3.
Влияние продолжительности синтеза на конверсию этанола в присутствии цеолитов H-ZSM-5 и H-ZSM-5h. Условия реакции: 300°С, 7 ч–1, мольное соотношение C2H5ОH : CH2О : NH3 = 1.0 : 0.8 : 1.5.

Установлено, что конверсия этанола через 8 ч на образце H-ZSM-5h снижается на 20%, в то время как цеолит H-ZSM-5 очень быстро дезактивируется продуктами коксообразования: уже через 3 ч конверсия спирта падает в два раза, а через 6 ч катализатор полностью неактивен.
Основными продуктами на цеолите H-ZSM-5 являются пиридин и 3-пиколин. В составе продуктов реакции за 5 ч происходят следующие изменения: уменьшается содержание пиридина и 3-пиколина, а содержание лутидинов возрастает в 2.3 раза (рис. 4а).
Рис. 4.
Влияние продолжительности синтеза на селективность образования пиридинов в присутствии H-ZSM-5 (а) и H-ZSM-5h (б). Условия реакции: 300°С, 7 ч–1, мольное соотношение C2H5ОH : CH2О : NH3 = 1.0 : 0.8 : 1.5.
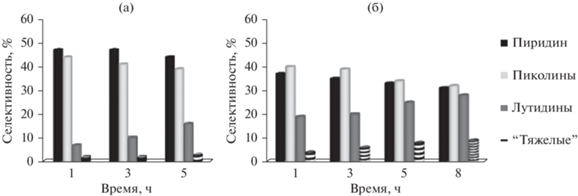
На иерархическом цеолите H-ZSM-5h, в отличие от микропористого образца H-ZSM-5, в составе продуктов реакции содержится большое количество лутидинов (19–28%). Состав продуктов во времени изменяется аналогично указанному для цеолита H-ZSM-5: селективность по пиридину и пиколинам уменьшается, а по лутидинам и “тяжелым” возрастает.
Для синтеза хинолинов использовали широко известные методы: Скраупа, Фридлендера и Дебнера–Миллера.
Синтез Скраупа осуществляли взаимодействием анилина с глицерином в присутствии цеолитов H-ZSM-5 и H-ZSM-5h. Основными продуктами реакции являются хинолин (1) и метилхинолины (2- и 4-изомеры) (2) (схема 2 ):
Схема 2 . Взаимодействие анилина с глицерином в присутствии цеолитных катализаторов.
Помимо указанных хинолинов, в реакционной массе присутствуют алкилхинолины (этилхинолин, диметилхинолин, метилэтилхинолин), алкиланилины (“другие”), продукты конденсации акролеина и ацетальдегида, образующихся из глицерина.
Установлено (табл. 4), что в изученных условиях реакция идет с высокой конверсией анилина на обоих катализаторах.
На цеолите H-ZSM-5h суммарный выход хинолинов достигает 72%, при этом доля хинолина в составе хинолиновой фракции составляет 96%. Селективность образования хинолинов на цеолите H-ZSM-5 значительно ниже. Суммарная селективность по хинолинам равна 67%, в составе хинолиновой фракции содержится 68% хинолина и 32% метилхинолинов. Для цеолита H-ZSM-5 характерно образование большого количества побочных продуктов (27%), среди которых преобладает продукт линейной конденсации анилина с альдегидами – N-метиланилин. Появление указанных соединений в микропорах цеолитов более предсказуемо, чем объемных молекул хинолинов, синтез которых происходит, по-видимому, в основном с участием поверхностных активных центров.
Количество кокса на катализаторе с микропористой структурой значительно (в 3 раза) выше, чем на образце H-ZSM-5h.
Очевидно, что по активности, селективности и выходу хинолинов иерархический цеолит эффективнее микропористого. Важным фактором для успешного осуществления реакции являются присутствие в иерархических цеолитах мезо- и макропор.
Одним из наиболее значимых недостатков цеолитных катализаторов, особенно в случае химических превращений объемных молекул, является быстрая дезактивация в результате образования кокса, которая значительно сокращает время работы катализатора.
На рис. 5 показано изменение конверсии анилина во времени на изученных образцах.
Рис. 5.
Влияние продолжительности синтеза на конверсию анилина на цеолитах H-ZSM-5 и H-ZSM-5h. Условия реакции: 450°С, 0.2 ч–1, мольное соотношение анилин : глицерин = 1 : 3.
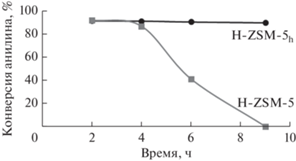
В первые часы работы (2 и 3 ч) оба катализатора (H-ZSM-5 и H-ZSM-5h) демонстрирую высокую активность: конверсия анилина составляет 91–92%. При дальнейшем увеличении времени работы (4 ч) на цеолите H-ZSM-5 начинается снижение конверсии, через 6 ч конверсия падает более чем в два раза, а через 9 ч катализатор полностью теряет активность.
Наиболее стабильно работает образец H-ZSM-5h, что обусловлено, по-видимому, отсутствием в нем диффузионных ограничений, являющихся причиной ускоренной дезактивации катализатора.
На рис. 6 показано изменение селективности образования хинолинов во времени в присутствии микропористого и иерархического цеолитов.
Рис. 6.
Влияние продолжительности синтеза на селективность образования продуктов в присутствии H-ZSM-5 (а) и H-ZSM-5h (б). Условия реакции: 450°С, 0.2 ч–1, мольное соотношение анилин : глицерин = 1 : 3.

На цеолите H-ZSM-5 суммарная селективность образования хинолинов (1) и (2) в первые 2 ч работы достигает 73%, при этом во фракции хинолинов преобладает хинолин 1. С увеличением времени работы селективность образования хинолина уменьшается, а селективность образования алкиланилинов, продуктов конденсации альдегидов (“другие”) возрастает.
На цеолите H-ZSM-5h высокая селективность по хинолину (до 76%) сохраняется без изменения в течение 6 ч, затем постепенно уменьшается до 66% (9 ч).
Изучено взаимодействие 2-аминоацетофенона с 2,4-пентандионом (реакция Фридлендера) в присутствии цеолитов Н-ZSM-5 и Н-ZSM-5h. Основным продуктом реакции является 1-(2,4-диметилхинолин-3-ил)этанон (3) (схема 3 ):
Схема 3 . Взаимодействие 2-аминоацетофенона с 2,4-пентандионом.
Установлено, что в отсутствие катализатора, а также на цеолите Na-ZSM-5h реакция не идет (табл. 5).
Таблица 5.
Взаимодействие 2-аминоацетофенона с 2,4-пентандионом в присутствии цеолитов ZSM-5*
| Катализатор | Конверсия 2-аминоацетофенона, % |
Селективность, % | |
|---|---|---|---|
| 3 | другие | ||
| Без катализатора | – | – | – |
| Na-ZSM-5h | – | – | – |
| H-ZSM-5h | 82 | 100 | – |
| H-ZSM-5 | 74 | 95 | 5 |
В присутствии цеолита H-ZSM-5h целевое соединение – (1-(2,4-диметилхинолин-3-ил)этанон – образуется со 100%-ной селективностью при конверсии 2-аминоацетофенона, достигающей 82%. На цеолите Н-ZSM-5 реакция идет с меньшей конверсией кетона и менее селективно.
Сравнение результатов, полученных при повторном использовании катализаторов в синтезе хинолина 3, свидетельствует о большей стабильности цеолита H-ZSM-5h. Он проявляет достаточно высокую активность в течение 5 циклов работы без регенерации катализатора, в то время как микропористый образец H-ZSM-5 практически теряет активность после 3-его цикла работы (рис. 7).
Рис. 7.
Конверсия аминоацетофенона на цеолитах H-ZSM-5 и H-ZSM-5h при их повторном использовании. Условия реакции автоклав, 150°С, 25 мас. % катализатора, соотношение аминоацетофенон : 2,4-пентандион = 1 : 1.

Селективность образования хинолина 3 на цеолите H-ZSM-5h незначительно уменьшается после 4-х циклов работы (рис. 8), на цеолите H-ZSM-5 наблюдается постепенное снижение селективности по целевому хинолину 3 после каждого цикла.
Рис. 8.
Селективность по продуктам реакции аминоацетофенона с 2,4-пентандионом на цеолитах H-ZSM-5 (а) и H-ZSM-5h (б) при повторном использовании катализаторов. Условия реакции: автоклав, 150°С, 25 мас. % катализатора, мольное соотношение аминоацетофенон : 2,4-пентандион = 1 : 1.

Синтез диалкилхинолинов осуществляли с помощью модифицированной реакции Дебнера–Миллера – взаимодействия анилина с альдегидами С3–С4. В присутствии цеолитов H-ZSM-5 и H-ZSM-5h реакция идет с образованием смеси продуктов, в которой преобладает 2-этил-3-метилхинолин 4a (в реакции с пропионовым альдегидом) или 2-пропил-3-этилхинолин 4b (в реакции с масляным альдегидом) (схема 4 ):
Схема 4 . Взаимодействие анилина с альдегидами.
Кроме диалкилхинолинов (4a, 4b), в реакционной массе присутствуют N-алкиланилины (5a, 5b), N-(2-алкил-2-алкен-1-илиден)анилины (енамины, 6a, 6b), а также “легкие” (продукты конденсации альдегидов, N,N-диалкиланилины) и “тяжелые” соединения с молекулярной массой выше 177 г/моль, в состав которых входят промежуточные соединения синтеза диалкилхинолинов, в том числе диалкил-N-фенил-1,2,3,4-тетрагидрохинолин-4-амины (тетрагидрохинолинамины 7a, 7b).
Установлено, что конверсия анилина в реакции более 90% на обоих катализаторах в реакции с пропаналем и практически полная в реакции с бутаналем (табл. 6).
Таблица 6.
Взаимодействие анилина с альдегидами С3–С4 в присутствии цеолитов Н-ZSM-5 и Н-ZSM-5h*
| Катализатор | Альдегид | Конверсия анилина, % |
Селективность, % | ||||
|---|---|---|---|---|---|---|---|
| 4а, 4b | 5а, 5b | 6а, 6b | “легкие” | “тяжелые” | |||
| H-ZSM-5h | Пропаналь | 92 | 47 | 18 | 8 | 23 | 4 |
| H-ZSM-5h | Бутаналь | 99 | 45 | 25 | 4 | 25 | 1 |
| H-ZSM-5 | Пропаналь | 91 | 39 | 11 | 11 | 19 | 20 |
| H-ZSM-5 | Бутаналь | 96 | 32 | 19 | 10 | 24 | 15 |
Реакция анилина с бутаналем в присутствии цеолита H-ZSM-5h идет с образованием целевого диалкилхинолина 4b и значительного количества алкиланилина 5b и “легких” соединений.
Сравнение селективности действия микропористого и иерархического катализаторов в реакции анилина с пропаналем показывает, что цеолит H-ZSM-5h обеспечивает более селективное получение диалкилхинолинов 4a, 4b. В продуктах, образующихся на цеолите H-ZSM-5, наблюдается большее количество “тяжелых” соединений 7а, 7b. Ранее [28], нами было показано, что указанные соединения формируются в заметных количествах именно на катализаторах с микропористой структурой. Появление объемных молекул 7а, 7b в каналах цеолита H-ZSM-5 невозможно, поэтому они образуются, по-видимому, на более слабых поверхностных активных центрах.
Иерархическая пористая структура способствует не только большей селективности в отношении диалкилхинолинов 4a, 4b, но и повышению стабильности работы катализатора. На рис. 9 и 10 показано, как изменяется конверсия анилина и селективность образования продуктов за 3 цикла повторной работы без регенерации образцов H-ZSM-5h и H-ZSM-5. Установлено, что через 3 цикла работы на цеолите H-ZSM-5h конверсия анилина снижается на 8%, а на H-ZSM-5 – на 16% (рис. 9).
Рис. 9.
Стабильность работы цеолитов H-ZSM-5h и H-ZSM-5 в реакции анилина с пропаналем. Условия реакции: 160°С, 6 ч, 20 мас. % катализатора, мольное соотношение анилин : пропаналь = 1 : 2, растворитель – хлорбензол.

Рис. 10.
Селективность образования продуктов реакции анилина с пропаналем на цеолитах H-ZSM-5 (а) и H-ZSM-5h (б). Условия реакции: 160°С, 6 ч, 20 мас. % катализатора, мольное соотношение анилин : пропаналь = 1 : 2, растворитель – хлорбензол.
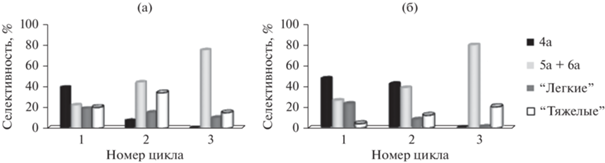
На образце H-ZSM-5h во 2-ом цикле происходит незначительное снижение селективности по 2-этил-3-метилхинолину, селективность по алкиланилинам остается на том же уровне (18%). Реакционная масса, полученная после 3-его цикла работы катализатора, не содержит хинолинов, в ней присутствует в основном енамин 6а.
На цеолите H-ZSM-5 уже во втором цикле хинолин практически не образуется, основной продукт реакции – енамин 6а. Синтез енаминов из анилина и альдегидов, как показано авторами [45], легко происходит в условиях термической реакции, поэтому очевидно, что микропористый образец полностью дезактивируется уже после 1-го цикла работы, в то время как активность и селективность иерархического цеолита практически не меняется в ходе двух циклов работы.
ЗАКЛЮЧЕНИЕ
В результате сравнения активности, селективности и стабильности цеолитов структурного типа MFI с различной текстурой – высокодисперсного микропористого H-ZSM-5 и гранулированного иерархического H-ZSM-5h – в синтезе практически значимых пиридинов и хинолинов установлена высокая эффективность цеолитного катализатора H-ZSM-5h во всех изученных реакциях, обусловленная присутствием в его пористой структуре мезо- и макропор, которые обеспечивают улучшенную диффузию реагентов к активным центрам внутри пор цеолитов и продуктов реакции из пор в реакционный объем, благоприятствуют образованию объемных молекул алкилпиридинов и хинолинов, позволяют создать в порах более высокую концентрацию реагирующих молекул, что приводит к увеличению актов химического взаимодействия, замедляют процессы коксообразования и дезактивации катализатора. Высокая активность цеолита H-ZSM-5h связана также с наличием кристаллов размером 15–100 нм, способствующих большей доступности активных участков внутри пор, а также снижению диффузионного пути реагента и молекул продукта.
Реакцией этанола с формальдегидом и аммиаком на цеолите H-ZSM-5h синтезированы пиридин, 3-пиколин, 3,5-лутидин с суммарной селективностью 93% при конверсии спирта 72%. Катализатор стабильно работает в течение 8 ч в отличие от микропористого цеолита H-ZSM-5, который становится неактивен через 6 ч.
Реакцией анилина с глицерином на цеолите H-ZSM-5h получены хинолин (76%) и метилхинолины (3%) при конверсии анилина более 91%. Катализатор не теряет активности и селективности в течение 9 ч, в то время как микропористый образец малоактивен после 4 ч работы,
Взаимодействие 2-аминоацетофенона с 2,4-пентандионом в присутствии цеолита Н-ZSM-5h обеспечивает получение 1-(2,4-диметилхинолин-3-ил)этанона со 100%-ной селективностью при конверсии кетона 82%. Показана возможность 5-кратного использования катализатора без регенерации.
При взаимодействии анилина с альдегидами С3–С4 на цеолите H-ZSM-5h образуются диалкилхинолины с выходами 43–45%. Катализатор может использоваться для синтеза алкилхинолинов повторно без регенерации.
Список литературы
Primo A., Garcia H. // Chem. Soc. Rev. 2014. V. 43. № 22. P. 7548.
Weckhuysen B.M., Yu J. // Chem. Soc. Rev. 2015. V. 44. P. 7022.
Yang Z. // 5th International Conference on Machinery, Materials and Computing Technology (ICMMCT 2017). Advances in Engineering. V. 126. P. 444.
Pan T., Wu Z., Yip A.C.K. // Catalysts. 2019. V. 9. P. 274.
Gao X.-H., Yan Zi-F., Peng P., Mintova S. // Natl Sci. Rev. 2020. V. 7. P. 1726.
Bai R., Song Y, Li Y., Yu J. // Trends in Chemistry. 2019. V. 1. № 6. P. 601.
Kerstens D., Smeyers B., Van Waeyenberg J., Zhang Q., Yu J., Sels B.F. // Adv. Mater. 2020. V. 32. № 44. [ID2004690].
Li J.J. Heterocyclic Chemistry in Drug Discovery. Hoboken: Wiley, 2013. 720 p.
Eicher T., Hauptmann S., Speicher A. The Chemistry of Heterocycles: Structure, Reactions, Synthesis, and Applications, 2nd Ed. John Wiley & Sons, 2003.
Taylor D., MacCoss M., Lawson A.D.G. // J. Med. Chem. 2014. 57. P. 5845.
Marella A., Tanwar O.P., Saha R., Rahmat Ali M., Srivastava S., Akhter M., Shaquiquzzaman M., Mumtaz Alam M. // Pharm. J. 2013. V. 21. № 1. P. 1.
Altaf A.A., Shahzad A., Gul Z., Rasool N., Badshah A., Lal B., Khan E. // J. Drug Des. & Med. Chem. 2015. V. 1. P. 1.
Chaubey A., Pandeya S.N. // Asian J. Pharm. Clin. Res. 2011. V. 4. P. 5.
Kandepi V.V.K.M., Narender N. // Catal. Sci. Technol. 2012. V. 2. P. 471.
Shimizu S., Watanabe N., Kataoka T., Shoji T., Abe N., Morishita S., Ichimura H. Ullmann’s Encyclopedia of Industrial Chemistry, V. 1. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2012.
Lavanya K., Saranya J., Chitra S. // Corrosion Rev. 2018. V. 36. № 4. P. 1.
Liu Y., Gao G., Liu L., Shi G. // J. Korean Chem. Soc. 2011. V. 55. P. 830.
Dos Santos G.C. // J. Fluoresc. 2017. V. 27. № 1. P. 271.
Zhang X., Kale D.M., Jenekhe S.A. // Macromolecules. 2002. V. 35. № 2. P. 382.
Krishna Mohan V.V., Narender N. // Catal. Sci. Technol. 2021. V. 2. P. 471.
Григорьева Н.Г., Филиппова Н.А., Хазипова А.Н., Травкина О.С., Кутепов Б.И. // Катализ в промышленности. 2015. Т. 15. № 4. С. 42. (Grigor’eva N.G., Filippova N.A., Khazipova A.N., Travkina O.S. & Kutepov B.I. // Catalysis in Industry. 2015. V. 7. P. 287.)
Travkina O.S., Agliullin M.R., Filippova N.A., Khazipova A.N., Danilova I.G., Grigor’eva N.G., Narender N., Pavlov M.L., Kutepov B.I. // RSC Adv. 2017. V. 7. P. 32 581.
Grigorieva N.G., Kostyleva S.A., Bubennov S.V., Bikbaeva V.R., Gataulin A.R., Filippova N.A., Khazipova A.N., Prosochkina T.R., Kutepov B.I., Narender N. // J. Saudi Chem. Soc. 2019. V. 23. P. 452.
Байбуртли А.В., Григорьева Н.Г., Раскильдина Г.З., Злотский С.С., Кутепов Б.И. // Докл. РАН. Химия, науки о материалах. 2020. Т. 490. № 1. С. 29. (Bayburtli A.V., Grigorieva N.G., Raskil’dina G.Z., Zlotsky S.S. & Kutepov B.I. // Doklady Chemistry. 2020. V. 490. P. 32.)
Григорьева Н.Г., Филиппова Н.А., Гатаулин А.Р, Бубеннов С.В., Аглиуллин М.Р, Кутепов Б.И., Нарендер Н. // Изв. АН, Сер. Хим. 2017. 11. С. 2115–2121. (Grigor’eva N.G., Filippova N.A., Gataulin A.R., Bubennov S.V., Agliullin M.R., Kutepov B.I., Narender N. // Russian Chemical Bulletin. 2017. V. 66. P. 2115–2121.)
Григорьева Н.Г., Филиппова Н.А., Бубеннов С.В., Хазипова А.Н., Кутепов Б.И., Дьяконов В.А. // Современные молекулярные сита. 2021. Т. 3. № 1. С. 119. (Grigor’eva N.G., Filippova N.A., Bubennov S.V., Khazipova A.N., Kutepov B.I., Dyakonov V.A. // Petroleum Chemistry. 2021. V. 61. P. 364.)
Григорьева Н.Г., Костылева С.А., Артемьева А.С., Бубеннов С.В., Кутепов Б.И. // Современные молекулярные сита. 2020. Т. 2. № 1. С. 134. (Gri-gor’eva N.G., Kostyleva S.A., Artem’eva A.S., Bubennov S.V., Kutepov B.I. // Petroleum Chemistry volume. 2020. 60. P. 525.)
Григорьева Н.Г., Костылева С.А., Гатаулин А.Р., Хазипова А.Н., Нарендер Н., Кутепов Б.И. // Нефтехимия. 2019. Т. 59. № 4. С. 437. (Grigor’eva N.G., Kostyleva S.A., Gataulin A.R., Khazipova A.N., Narender N. & Kutepov B.I. // Petroleum Chemistry. 2019. V. 59. P. 719.)
Пaтeнт PФ № 2759567, 2020.
Пaтeнт PФ № 2644164, 2016.
Пaтeнт PФ № 2555843, 2013.
Пaтeнт PФ № 2608734, 2014.
Пaтeнт PФ № 2609028, 2015.
Пaтeнт PФ № 2688228, 2018.
Пaтeнт PФ № 2690535, 2018.
Пaтeнт PФ № 2738603, 2019.
Пaтeнт PФ № 2697876, 2018.
Пaтeнт PФ № 2702358, 2019.
Пaтeнт PФ № 2740912, 2020.
Пaтeнт PФ 2713449, 2020.
Пaтeнт PФ 2739350, 2020.
Гордон А. Спутник химика. М.: Мир, 1976. 438 с.
Gregg S.J., Sing K.S. Adsorption, surface area, and porosity. Academic Press, 1995. 371 p.
Auroux A. Calorimetry and Thermal Methods in Catalysis. Springer, 2013. V. 154. 569 p.
Funabashi M., Iwakawa M., Yoshimura J. // Bull. Chem. Soc. Jpn. 1969. V. 42. № 10. P. 2885.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ