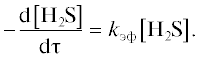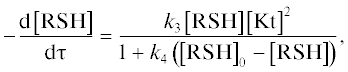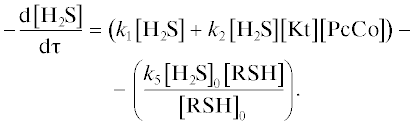Кинетика и катализ, 2022, T. 63, № 6, стр. 816-824
Исследование кинетики реакций окисления сероводорода и этилмеркаптана молекулярным кислородом в присутствии аммиачного раствора производных фталоцианина кобальта
О. М. Корнетова a, *, А. М. Мазгаров a, А. Ф. Вильданов a, Г. Б. Низамутдинова a
a АО Волжский научно-исследовательский институт углеводородного сырья
420061 Казань, ул. Н. Ершова, д. 35А, Республика Татарстан, Россия
* E-mail: olgakornetova@yandex.ru
Поступила в редакцию 16.02.2022
После доработки 18.05.2022
Принята к публикации 16.06.2022
- EDN: VKTAIW
- DOI: 10.31857/S0453881122060089
Аннотация
Исследованы основные кинетические закономерности индивидуального окисления сероводорода и совместного окисления сероводорода и этилмеркаптана молекулярным кислородом в присутствии аммиачного раствора замещенного производного фталоцианина кобальта. На основе экспериментальных данных получены кинетические уравнения реакций индивидуального окисления сероводорода и совместного окисления сероводорода и этилмеркаптана, а также рассчитаны константы скорости реакций.
ВВЕДЕНИЕ
Присутствие сероводорода и метил-, этилмеркаптанов в подготовленной нефти создает экологические и технологические проблемы при транспортировке, хранении и переработке нефти. Этим и обусловлена необходимость ее очистки от сероводорода и меркаптанов С1–С2 на стадии подготовки на промыслах до требований ГОСТ Р 51858-2002 и Технического регламента ЕАЭС 045/2017. Согласно указанным нормативным документам, в нефти, подлежащей транспортировке и хранению, содержание сероводорода не должно превышать 20 ppm, суммарное содержание метил- и этилмеркаптанов – не более 40 ppm.
Весьма перспективными являются окислительные методы промысловой очистки нефти от сероводорода и меркаптанов [1–5].
Для этого в АО “ВНИИУС” разработаны и внедрены в промышленность процессы серии ДМС (ДМС-1, ДМС-2 и ДМС-3 – для очистки легкой нефти, ДМС-1М – для очистки тяжелой нефти), которые основаны на реакциях (I)–(III) окисления содержащихся в нефти сероводорода и меркаптанов кислородом воздуха в присутствии катализаторного комплекса [6–8]:
(I)
$2{{{\text{H}}}_{{\text{2}}}}{\text{S}} + 2{{{\text{O}}}_{2}} + 2{\text{NaOH}}\xrightarrow{{{\text{Kt}}}}{\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(II)
${\text{RSH}} + {\text{NaOH}} \leftrightarrow {\text{RSNa}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(III)
$\begin{gathered} 2{\text{RSNa}} + 0.5{{{\text{O}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}\xrightarrow{{{\text{Kt}}}} \\ \to {\text{RSSR}} + 2{\text{NaOH}}. \\ \end{gathered} $Катализаторный комплекс (КТК) представляет собой водный раствор щелочного агента (едкий натр), в котором растворен катализатор – производные фталоцианина кобальта.
Более 10 установок для промысловой очистки нефти и газоконденсата от сероводорода и меркаптанов, построенные по технологиям ДМС, успешно эксплуатируются на месторождениях России, Казахстана и Ирана. Однако процессы ДМС с использованием щелочного раствора катализатора применяются преимущественно для очистки меркаптансодержащего углеводородного сырья (Тенгизская нефть, Карачаганакский и Астраханский конденсаты и др.), в которой концентрация сероводорода не превышает 30 ppm.
В случае нефти с высоким содержанием сероводорода окислительные технологии с использованием щелочных растворов производных фталоцианина кобальта имеют ряд серьезных недостатков:
– согласно (I) щелочь на реакцию с сероводородом расходуется безвозвратно, что приведет к большому расходу щелочного раствора катализатора, так как он уже не подлежит регенерации и повторному использованию;
– при очистке тяжелой нефти возникает проблема появления трудноразделяющихся эмульсий нефти со щелочными растворами, а образовавшиеся при окислении сульфида тиосульфат и сульфат остаются в товарной нефти и увеличивают содержание солей.
Многочисленные запросы нефтедобывающих предприятий выявили потребность в новой высокоэффективной и экономичной окислительной технологии для очистки нефти с высокой концентрацией либо сероводорода (например, нефти Татарстана), либо одновременно и сероводорода, и метил-, этилмеркаптанов (нефти Восточной Сибири, Западного Казахстана, газоконденсаты Ирана) в промысловых условиях.
Решение поставленной задачи оказалось возможным при использовании в качестве щелочного агента в составе КТК аммиака (слабое основание) вместо едкого натра (сильное основание), то есть катализаторным комплексом будет служить водный раствор аммиака с растворенным в нем фталоцианиновым катализатором. Замена едкого натра в составе катализаторного комплекса на аммиак приводит к изменению механизма реакции окисления сероводорода и образованию другого продукта – элементной серы.
Сероводород в присутствии аммиачного раствора производных фталоцианина кобальта окисляется с образованием элементной серы по реакции (IV):
(IV)
$2{{{\text{H}}}_{{\text{2}}}}{\text{S}} + 2{\text{N}}{{{\text{H}}}_{3}} + {{{\text{O}}}_{2}}\xrightarrow{{{\text{Kt}}}}2{{{\text{S}}}^{0}} + 2{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}}.$Скорость окисления сероводорода в аммиачном растворе в 2–3 раза выше, чем в растворе едкого натра.
Окисление меркаптанов кислородом в присутствии аммиачного раствора производных фталоцианина кобальта протекает с образованием дисульфидов:
(V)
$2{\text{RSH}} + 0.5{{{\text{O}}}_{2}}\xrightarrow{{{\text{Kt}},{\text{N}}{{{\text{H}}}_{4}}{\text{OH}}}}{\text{RSSR}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$В реакциях (IV), (V) аммиак не расходуется безвозвратно, и после окисления 1 моля сероводорода или 2 моль меркаптана высвобожденная молекула аммиака вновь участвует в реакциях (IV), (V) многократно до полного завершения процесса окисления.
При совместном окислении сероводорода и меркаптанов окислителем меркаптанов, кроме кислорода, будет выступать и элементная сера (реакция (VI)), которая образуется при окислении сероводорода по реакции (IV) и имеет высокую реакционную способность в момент образования:
В окислительной технологии с использованием аммиачного раствора производных фталоцианина кобальта расход кислорода на процесс очистки нефти от сероводорода и меркаптанов в два раза ниже. Это обусловлено следующими причинами:
– по стехиометрии на реакцию (IV) окисления сероводорода до элементной серы в присутствии аммиачного раствора требуется в два раза меньше кислорода, чем на реакцию (I) окисления ее до тиосульфата в присутствии щелочного раствора;
– на окисление меркаптанов кислорода нужно также примерно в два раза меньше, поскольку часть меркаптанов окисляется образующейся элементной серой.
Снижение расхода кислородсодержащего газа на процесс окисления уменьшает унос легких углеводородов нефти при сепарации отработанного воздуха, тем самым сокращая потери товарной нефти, и, кроме того, позволяет поддерживать более низкое давление в реакторе окисления.
Окислительно-каталитическая технология с использованием аммиачного раствора производных фталоцианина кобальта (процесс ДМС-1МА) предназначена для очистки тяжелой или легкой нефти с высокой концентрацией сероводорода и меркаптанов С1–С2 [9].
В настоящей работе представлены результаты изучения кинетических закономерностей индивидуального окисления сероводорода и совместного окисления сероводорода и этилмеркаптана в нефти молекулярным кислородом в присутствии аммиачного раствора производных фталоцианина кобальта. Целью исследований было установление оптимальных параметров технологического процесса ДМС-1МА (температура, концентрация катализаторного комплекса в реакционной массе, содержание фталоцианинового катализатора в КТК и т.д.).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для изучения реакции жидкофазного окисления сероводорода использовали карбоновую нефть УПВСН “Андреевка” и УПВСН “Кутема” ПАО “Татнефть”, а для исследований совместного окисления сероводорода и этилмеркаптана – сероводородсодержащую нефть Студенцовского месторождения ООО “ТНС-Развитие”, в которую добавляли реактив – этилмеркаптан (97%, “Sigma-Aldrich”).
В работе применяли химические реактивы марки “х. ч.” или “ч. д. а.”.
Для приготовления катализаторного комплекса использовали замещенный фталоцианин кобальта – дихлордисульфофталоцианин кобальта (ДХДСФК). Катализаторный комплекс – аммиачный раствор ДХДСФК получали растворением порошкообразной формы катализатора ДХДСФК в 25%-ном водном растворе аммиака. Готовый раствор катализаторного комплекса хранили в бутылке из темного стекла и применяли в течение не более 30 дней.
Эксперименты по окислению проводили при атмосферном давлении и температуре 40–60°C техническим кислородом ([O2] = 99.5 об. %). Лабораторная установка включала стеклянный цилиндрический реактор периодического действия, узел контроля и регулирования температуры в реакторе, узел подачи кислорода в реакционную массу, узел отбора пробы на анализ и устройство для перемешивания реакционной смеси со скоростью вращения N ≥ 3000 об. мин–1.
В реактор загружали нефть, содержащую окисляемые сернистые компоненты, расчетное количество катализаторного комплекса и включали обогрев. За начало реакции принимали момент достижения заданной температуры в реакторе. В это время включали перемешивание в реакторе и начинали подавать кислород в реакционную массу. Скорость подачи кислорода составляла 1.3–1.5 мл мин–1. Скорость реакций окисления находили по скорости расходования сернистых компонентов в реакционной массе. Анализ на содержание сероводорода и этилмеркаптана в реакционной смеси проводили через равные промежутки времени методом потенциометрического титрования раствором азотнокислого аммиаката серебра по ГОСТ 17323-71 (СТ СЭВ 756-77) “Топливо для двигателей. Метод определения меркаптановой и сероводородной серы потенциометрическим титрованием” на приборе pH-метр-иономер Эксперт-001 (“Эконикс-Эксперт”, Россия). С целью контроля достоверности получаемых экспериментальных данных периодически содержание сероводорода и этилмеркаптана в нефти до и после окисления находили методом газовой хроматографии на приборе “Кристаллюкс-4000М” (ООО “НПФ “Мета-Хром”, Россия) по ГОСТ 32918-2014 “Нефть. Метод определения сероводорода, метил- и этилмеркаптанов”.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследование реакций окисления сероводорода и этилмеркаптана кислородом, катализируемые аммиачным раствором ДХДСФК, проводили согласно следующему алгоритму.
1. На первом этапе в продолжение ранее опубликованной работы [10] были выполнены дополнительные эксперименты по изучению реакции индивидуального окисления сероводорода. Путем обработки экспериментальных данных было получено математическое описание кинетики реакции окисления сероводорода кислородом в присутствии аммиачного раствора ДХДСФК.
2. На втором этапе исследовали кинетические закономерности совместного окисления сероводорода и этилмеркаптана в нефти молекулярным кислородом в присутствии аммиачного раствора ДХДСФК.
В ходе работы были выполнены серии однофакторных экспериментов, когда в каждой серии изменяли лишь один из параметров процесса (температуру, концентрацию КТК в реакционной смеси, концентрацию ДХДСФК в КТК и начальную концентрацию сероводорода и этилмеркаптана), сохраняя остальные параметры неизменными.
Исследование реакции окисления сероводорода
При проведении предварительных опытов по окислению сероводорода было выполнено хромато-масс-спектрометрическое исследование на приборе GCMS 2010 Plus (“Shimadzu” Япония) модельной смеси сероводорода в бензоле до и после окисления кислородом в присутствии аммиака и дихлордисульфофталоцианина кобальта с целью подтверждения образования элементной серы по реакции (IV).
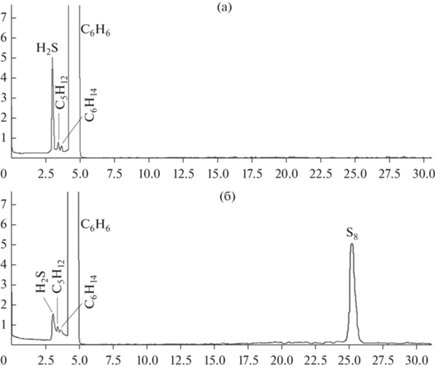
Были получены хроматограммы исходной модельной смеси сероводорода в бензоле (рис. 1а) и оксидата (рис. 1б).
На хроматограмме оксидата (рис. 1б) обнаружен пик, идентифицированный как элементная сера, что свидетельствует об образовании элементной серы при окислении сероводорода в аммиачном растворе фталоцианинового катализатора.
Лабораторные эксперименты по окислению сероводородсодержащей нефти с последующим определением количества тиосульфат- и сульфат-ионов в окисленной нефти позволили свести материальный баланс серосодержащих продуктов реакции окисления сероводорода кислородом в присутствии аммиачного раствора ДХДСФК, который представлен в табл. 1.
Таблица 1.
Материальный баланс серосодержащих продуктов реакции окисления сероводорода в нефти молекулярным кислородом в присутствии аммиачного раствора ДХДСФК*
| Время окисления, мин | Приход | Расход | ||||||
|---|---|---|---|---|---|---|---|---|
| содержание H2S (в расчете на серу) |
содержание (NH4)2S2O3 (в расчете на серу) |
содержание S0 (в расчете на серу) |
потери | |||||
| мг/г нефти | мас. % | мг/г нефти | мас. % | мг/г нефти | мас. % | мг/г нефти | мас. % | |
| 0 | 0.2850 | 100 | 0 | 0 | 0 | 0 | – | – |
| 20 | 0 | 0 | 0.0012 | 0.42 | 0.2831 | 99.33 | 0.0007 | 0.25 |
Результаты экспериментов показали, что при использовании аммиачного раствора ДХДСФК окисление сероводорода молекулярным кислородом в нефти протекает с образованием в качестве основного и практически единственного продукта элементной серы, что хорошо согласуется с теоретическими данными и ранее проведенными исследованиями. В реакционной смеси обнаружено малое количество тиосульфата аммония, сульфат аммония (NH4)2SO4 отсутствует.
В работах [7, 11–14] было установлено, что только фталоцианины кобальта проявляют высокую каталитическую активность в процессах окисления сероводорода и меркаптанов кислородом. При изучении реакции окисления сероводорода кислородом были проведены эксперименты с использованием 4-х образцов замещенных производных фталоцианина кобальта в составе катализаторного комплекса. Результаты исследования приведены в табл. 2.
Таблица 2.
Влияние различных заместителей в молекуле фталоцианина кобальта на кинетику окисления сероводорода в нефти
| № п/п |
Катализаторный комплекс | Концентрация КТК в реакционной смеси, моль/л | Температура, °С | Содержание ${{{\text{S}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}}}}$ в исходной нефти, ppm | Содержание ${{{\text{S}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}}}}$ в нефти после окисления, ppm | ||
|---|---|---|---|---|---|---|---|
| шифр фта-лоцианинового катализатора | концентрация фталоцианина в КТК, моль/л | 15 мин | 30 мин | ||||
| 1 | ТСФК | 0.0003 | 0.07 | 50 | 350 | 32 | 8 |
| 2 | СФК | 0.0003 | 0.07 | 50 | 350 | 65 | 23 |
| 3 | ДСФК | 0.0003 | 0.07 | 50 | 350 | 69 | 17 |
| 4 | ДХДСФК | 0.0003 | 0.07 | 50 | 350 | 46 | 0 |
Установлено, что в вышеуказанной реакции в присутствии аммиака наибольшую каталитическую активность проявляют тетрасульфофталоцианин кобальта и дихлордисульфофталоцианин кобальта, который известен под торговым названием “ИВКАЗ”. В настоящей работе представлены результаты экспериментального изучения реакций окисления сероводорода и этилмеркаптана с применением катализатора ДХДСФК.
Математическая обработка массива экспериментальных данных, полученных при исследовании реакции окисления сероводорода кислородом, позволила вывести кинетическое уравнение для расчета скорости реакции в присутствии аммиачного раствора катализатора ДХДСФК.
Порядок реакции по сероводороду определяли путем выбора координат спрямления кинетических кривых. Для этого использовали результаты серии экспериментов, выполненных при температуре 50°C, концентрации катализаторного комплекса в реакционной смеси 0.07 моль/л и концентрации ДХДСФК в КТК 0.0005 моль/л с изменением начальной концентрации сероводорода в интервале 0.01–0.02 моль/л. Анализ кинетических кривых расходования сероводорода показал, что скорость реакции линейно зависит от начальной концентрации сероводорода, что свидетельствует о концентрационном первом порядке реакции по H2S. В первом приближении уравнение для расчета скорости реакции окисления H2S имеет вид:
Проведенные исследования свидетельствуют, что скорость реакции окисления сероводорода существенно зависит от концентрации катализаторного комплекса в реакционной смеси (рис. 2) и концентрации ДХДСФК в растворе катализаторного комплекса (рис. 3).
Рис. 2.
Зависимость эффективной константы скорости реакции от концентрации КТК в реакционной смеси. Условия реакции: [H2S] = 0.02 моль/л, [PcCo] = = 0.0005 моль/л, T = 50°С.
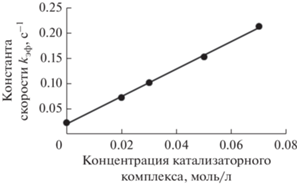
Рис. 3.
Зависимость эффективной константы скорости реакции от концентрации ДХДСФК в КТК. Условия реакции: [H2S] = 0.02 моль/л, [КТК] = = 0.07 моль/л, T = 50°С.

Полученные зависимости хорошо описываются прямой, что говорит о первом порядке реакции по концентрации катализаторного комплекса и по концентрации ДХДСФК в катализаторном комплексе. На рис. 2 отрезок, отсекаемый по оси ординат, соответствует константе скорости некаталитической реакции.
Уравнение для расчета скорости реакции окисления сероводорода молекулярным кислородом в присутствии аммиачного раствора ДХДСФК математически можно описать следующим выражением:
где k1 – константа скорости некаталитической реакции, с–1; k2 – константа скорости каталитической реакции, л2/(моль2 с); [H2S] – концентрация сероводорода, моль/л; [Kt] – концентрация КТК в реакционной смеси, моль/л; [PcCo] – концентрация ДХДСФК в КТК, моль/л.Отсюда эффективная константа скорости равна:
(3)
${{k}_{{{\text{эф}}}}} = {{k}_{1}} + {{k}_{2}}\left[ {{\text{Kt}}} \right]\left[ {{\text{PcCo}}} \right].$Рассчитанные согласно предложенной математической модели значения констант скорости некаталитической и каталитической реакций составляют k1 = 0.0331 с–1 и k2 = 4652 л2 моль–2 с–1 соответственно. При данных значениях констант скорости сравнение расчетных и экспериментальных данных по окислению сероводорода в нефти молекулярным кислородом в присутствии аммиачного раствора ДХДСФК показало удовлетворительную сходимость.
Исследование совместного окисления сероводорода и этилмеркаптана
При одновременном присутствии в нефти сероводорода и меркаптанов С1–С2 процессы их окисления протекают параллельно: сероводород при катализе аммиаком и производными фталоцианина кобальта окисляется по реакции (IV) до элементной серы; окисление меркаптанов идет согласно реакциям (V) и (VI) с образованием соответствующих дисульфидов.
Для исследования совместного окисления сероводорода и меркаптанов С1–С2 был выбран этилмеркаптан, поскольку выявлено, что с увеличением молекулярной массы реакционная способность меркаптанов снижается. Следовательно, этилмеркаптан является более трудноокисляемым компонентом, чем метилмеркаптан, и для его окисления требуются более жесткие условия, при которых скорость превращения метилмеркаптана будет выше.
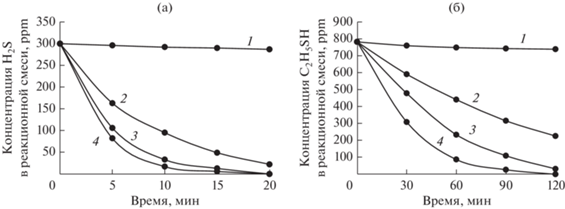
Скорость реакций при совместном окислении сероводорода и этилмеркаптана в нефти существенно зависит от концентрации катализаторного комплекса в реакционной смеси. Некаталитическое окисление сероводорода и этилмеркаптана протекает с незначительной скоростью (рис. 4а и 4б, кривые 1). Введение катализаторного комплекса значительно увеличивает скорости реакций и степени превращения (рис. 4а и 4б, кривые 2–4).
Рис. 4.
Зависимости концентрации сероводорода (а) и этилмеркаптана (б) от времени при различных концентрациях КТК: 1 – без КТК; 2 – 0.025 моль/л; 3 – 0.05 моль/л; 4 – 0.1 моль/л. Условия реакции: [PcCo] = 0.002 моль/л, T = 50°С.
На рис. 5 приведены кинетические кривые окисления сероводорода и этилмеркаптана при разных концентрациях ДХДСФК в катализаторном комплексе.
Рис. 5.
Зависимости концентрации сероводорода (а) и этилмеркаптана (б) от времени при различных концентрациях ДХДСФК в КТК: 1 – без ДХДСФК; 2 – 0.0005 моль/л; 3 – 0.001 моль/л; 4 – 0.002 моль/л. Условия реакции: [КТК] = = 0.05 моль/л, T = 50°С.

Кривые 1 на рис. 5а и 5б иллюстрируют, как изменяется содержание сероводорода и этилмеркаптана в реакционной смеси при окислении в присутствии 25%-ного водного раствора аммиака из расчета 0.05 моль/л без добавления катализатора ДХДСФК. В присутствии только аммиака эти реакции протекают с невысокой скоростью, поэтому необходимо добавить в водный аммиак катализатор – производные фталоцианина кобальта. Видно (рис. 5а и 5б, кривые 2–4), что чем больше концентрация ДХДСФК в катализаторном комплексе, тем выше скорость реакций окисления и конверсия сероводорода и этилмеркаптана.
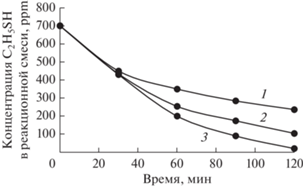
Рис. 6.
Зависимости концентрации этилмеркаптана от времени при разных начальных концентрациях H2S: 1 – 80 ppm; 2 – 170 ppm; 3 – 300 ppm. Условия реакции: [КТК] = 0.05 моль/л, [PcCo] = 0.002 моль/л, T = 50°С.
Нами было установлено, что лимитирующей реакцией при совместном окислении сероводорода и низкомолекулярных меркаптанов является окисление меркаптанов. В присутствии аммиачного раствора ДХДСФК сероводород окисляется в течение 15–30 мин даже при высоких начальных концентрациях 500–700 ppm, в то время как окисление этилмеркаптана продолжается до 60 мин при концентрациях 200–250 ppm, что, вероятнее всего, связано с более высокой энергией активации реакции окисления C2H5SH (Еа = = 40 195 Дж/моль). Энергия активации реакции окисления сероводорода, рассчитанная на основании результатов исследований зависимости скорости реакции от температуры, составляет Ea = 21 530 Дж/моль. Отсюда следует, что для упрощения расчет реактора совместного окисления H2S и C2H5SH можно выполнить, используя только кинетическое уравнение для скорости реакции окисления этилмеркаптана.
Поскольку при совместном окислении H2S и RSH меркаптаны окисляются еще и элементной серой, образующейся при окислении сероводорода, были проведены опыты по окислению модельной смеси этилмеркаптана элементной серой без доступа кислорода в атмосфере аргона в присутствии катализаторного комплекса и без него.
Результаты, представленные в табл. 3, свидетельствуют, что реакция (VI) окисления меркаптанов элементной серой не ускоряется при добавлении аммиачного раствора ДХДСФК.
Таблица 3.
Результаты окисления этилмеркаптана элементной серой в атмосфере аргона*
| Время, мин | Содержание этилмеркаптана в реакционной массе, ppm | |
|---|---|---|
| oкисление в присутствии КТК** | окисление без КТК | |
| 0 | 350 | 350 |
| 30 | 154 | 165 |
| 60 | 92 | 94 |
Варьирование начальной концентрации сероводорода в нефти при сохраняющемся постоянным значении концентрации этилмеркаптана (рис. 6) позволило выявить следующие закономерности: чем выше концентрация сероводорода в нефти, тем больше элементной серы образуется и тем выше скорость окисления и конверсия меркаптана, причем увеличение скорости окисления C2H5SH пропорционально отношению начальных концентраций сероводорода и этилмеркаптана.
Эксперименты показали, что при совместном окислении скорость расходования этилмеркаптана увеличивается, а сероводорода – несколько замедляется. Ускорение реакции окисления этилмеркаптана при совместном окислении с сероводородом по сравнению с индивидуальным окислением объясняется тем, что он расходуется и по реакции (V) с кислородом, и по реакции (VI) с элементной серой. По реакции (VI) этилмеркаптана с элементной серой происходит образование сероводорода, что приводит к замедлению его расходования. Этот факт учитывали при выводе кинетических уравнений для сероводорода и этилмеркаптана при их совместном окислении.
Обработку экспериментальных кривых проводили с использованием программы DosBox. При совместном окислении кинетическое уравнение для расчета скорости реакции окисления этилмеркаптана будет складываться из двух составляющих:
– уравнения для расчета скорости окисления C2H5SH кислородом в присутствии аммиачного раствора ДХДСФК, полученного нами ранее [15]:
где k3 и k4 – константы скорости; [RSH]0, [RSH] –концентрация меркаптана в реакционной смеси в начальный и текущий момент времени, моль/л; [Kt] – концентрация катализаторного комплекса в реакционной смеси, моль/л;– уравнения для расчета скорости окисления C2H5SH элементной серой по реакции (VI).
Для нахождения порядка реакции (VI) по меркаптану использовали данные серии опытов с изменяющейся начальной концентрацией этилмеркаптана в реакционной смеси при постоянном значении концентрации сероводорода. Кривые расходования C2H5SH линеаризуются в координатах реакции первого порядка, то есть реакция (VI) имеет первый порядок по меркаптану. Учитывая, что добавление катализаторного комплекса не оказывает влияния на скорость реакции окисления меркаптана элементной серой, кинетическое уравнение для расчета скорости реакции окисления этилмеркаптана при совместном окислении с сероводородом можно записать следующим образом:
где k5 – константа скорости реакции (VI) окисления меркаптана элементной серой, с–1.Первый член этого уравнения описывает индивидуальное окисление меркаптана и учитывает расходование меркаптана по реакции с кислородом, второй член – расходование меркаптана по реакции с серой, появляющейся при окислении H2S. Образование серы приняли пропорциональным отношению [H2S]0/[RSH]0.
По той же реакции (VI) происходит образование вторичного H2S со скоростью в два раза меньшей, чем расходование меркаптана. Окисление сероводорода в присутствии меркаптана протекает так же, как и индивидуальное, но с незначительным торможением за счет возникновения H2S по реакции (VI) при совместном окислении, поэтому в уравнение (2) скорости окисления сероводорода вводится второй член, учитывающий появление вторичного H2S.
Таким образом, кинетическое уравнение для скорости окисления сероводорода при совместном окислении с меркаптаном имеет следующий вид:
Константы k1 = 0.0331 с–1 и k2 = 4652 л2 моль–2 с–1 были определены при исследовании реакции индивидуального окисления сероводорода. Константы k3 = 3.89 л2 моль–2 с–1 и k4 = 0.72 л/моль являются константами уравнения индивидуального окисления этилмеркаптана. Расчетное значение константы скорости реакции окисления этилмеркаптана элементной серой равна k5 = 0.027 с–1. При указанных значениях констант скорости кинетические уравнения расчета скорости реакций для случая совместного окисления сероводорода и этилмеркаптана в нефти кислородом в присутствии аммиачного раствора ДХДСФК удовлетворительно описывают все полученные в ходе исследований экспериментальные данные.
ЗАКЛЮЧЕНИЕ
Исследованные кинетические закономерности реакций индивидуального окисления сероводорода и совместного окисления сероводорода и этилмеркаптана молекулярным кислородом в присутствии аммиачного раствора ДХДСФК использованы для установления оптимальных параметров окислительно-каталитической технологии (процесс ДМС-1МА) с целью эффективной очистки нефти от сероводорода и метил-, этилмеркаптанов до заданных остаточных концентраций.
В настоящее время процесс ДМС-1МА внедрен на двух объектах нефтедобычи. Промышленная установка для очистки тяжелой нефти от сероводорода мощностью 2 млн т/год эксплуатируется на УПВСН “Кутема” НГДУ “Нурлатнефть” ПАО “Татнефть”. Технология позволяет снизить содержание сероводорода в нефти с 400–500 ppm до значений менее 20 ppm.
Вторая установка по технологии окислительно-каталитической очистки мощностью 60 000 т/год эксплуатируется на ДНС-215 Студенцовского месторождения Самарской области для очистки нефти от сероводорода и меркаптанов С1–С2. Процесс ДМС-1МА обеспечивает снижение содержания в нефти сероводорода с 200–300 ppm до значений ниже 20 ppm и меркаптанов С1–С2 с 40–50 ppm до отсутствия при регламентном режиме работы.
Список литературы
Исмагилов Ф.Р., Богатырев Т.С., Курочкин А.В., Денильханов М.Н., Козлова И.И. // Технологии нефти и газа. 2013. № 6. С. 3.
Ишкаева Р.Р., Марушкин А.Б., Бачурин А.Н., Сухарев К.В. // Мир нефтепродуктов. 2017. № 3. С. 10.
Basu B., Satapathy S., Bhatnagar A.K. // Catal. Rev. Sci. Eng. 1993. V. 35. P. 571.
Вержичинская С.В., Мостовая У.Л., Тройников А.Д., Яровая О.В. // Успехи в химии и химической технологии. 2012. Т. XXVI. № 5. С. 53.
Тарханова И.Г., Вержичинская С.В., Буряк А.К., Зеликман В.М., Верная О.И., Сахабутдинов Р.З., Гарифуллин Р.М., Бухаркина Т.В., Тюрина Л.А. // Кинетика и катализ. 2017. Т. 58. № 4. С. 384.
Мазгаров А.М., Вильданов А.Ф. // Нефтехимия. 1999. Т. 39. № 5. С. 371.
Hoffmann M.R., Lim B.C. // Env. Sci. Technol. 1979. V. 13. № 11. P. 1406.
Ehsani M.R., Mirjani P., Safadoost A. // Int. J. Chem. React. Eng. 2013. V. 11. № 1. P. 431.
Пaтeнт PФ 2272065, 2006.
Корнетова О.М., Мазгаров А.М., Вильданов А.Ф., Хрущева И.К., Аюпова Н.Р., Аслямов И.Р. // Журн. прикладной химии. 2020. № 9. С. 1363.
Симонов А.Д., Кундо Н.Н., Мамаева Е.К., Акимова Л.А. // Журн. прикладной химии. 1977. Т. 50. № 2. С. 307.
Hoffman M.R., Hong A.P.K. // Sci. Total Env. 1987. V. 64. № 1. P. 99.
Chatti I., Ghorbel A., Grange P., Colin J.M. // Catal. Today. 2002. V. 75. № 1–4. P. 113.
Scott D.W., Myers D.L., Hill H., Omadoko O. // Fuel. 2019. V. 242. P. 573.
Корнетова О.М., Мазгаров А.М., Вильданов А.Ф., Хрущева И.К. // Нефтехимия. 2020. № 4. С. 483.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ