Кинетика и катализ, 2022, T. 63, № 6, стр. 743-748
Восстановительное аминирование карбонильных соединений на катализаторе Ni2P/SiO2 в проточном режиме
Я. Ван a, А. Л. Нуждин b, *, И. В. Шаманаев b, Г. А. Бухтиярова b
a ФБГОУ ВО Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
b ФБГУН ФИЦ Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: anuzhdin@catalysis.ru
Поступила в редакцию 24.05.2022
После доработки 29.06.2022
Принята к публикации 20.07.2022
- EDN: OUTDTM
- DOI: 10.31857/S0453881122060168
Аннотация
Изучены каталитические свойства нанесенного на силикагель никель-фосфидного катализатора в восстановительном аминировании карбонильных соединений в проточном реакторе с использованием молекулярного водорода в качестве восстановителя. Реакцию проводили в толуоле с небольшим избытком амина при общем давлении 10 бар и температуре 140–170°C. При применении первичных алифатических аминов катализатор 6.3% Ni2P/SiO2 обеспечивает образование вторичных аминов с выходом до 99%. Выход целевого продукта зависит от природы карбонильного соединения и уменьшается в следующем ряду: алифатические альдегиды > алифатические кетоны ~ ароматические альдегиды > ароматические кетоны, что объясняется снижением электрофильных свойств в данной последовательности. В то же время, в реакциях с участием ароматических аминов, которые являются более слабыми нуклеофилами, выход вторичных аминов оказался значительно ниже.
ВВЕДЕНИЕ
Важным классом органических веществ, широко применяемых в промышленном производстве медицинских препаратов, агрохимикатов и других продуктов тонкого органического синтеза, являются вторичные амины [1]. Существуют различные способы получения вторичных аминов, такие как N-алкилирование первичных аминов алкил галогенидами [2] и спиртами [2–4], реакция Бухвальда–Хартвига [5] и восстановительное аминирование карбонильных соединений [6–17].
Среди перечисленных реакций восстановительное аминирование в проточном режиме на гетерогенных металлических катализатора – один из наиболее привлекательных подходов, поскольку использует в качестве восстановителя дешевый и экологически безопасный молекулярный водород [7–17]. Кроме того, применение проточных систем в сравнении с автоклавными реакторами обеспечивает более точный контроль реакционных параметров, способствует повышению эффективности реакции благодаря значительному увеличению скорости тепло- и массопереноса, что положительно влияет на селективность образования или выход целевого продукта [18, 19]. На сегодняшний день большинство работ по восстановительному аминированию альдегидов и кетонов в проточном реакторе было реализовано с использованием катализаторов, содержащих благородные металлы, такие как Pd [10–13], Pt [10, 12, 13] и Au [14]. Однако значительным недостатком таких систем является высокая стоимость и низкая доступность драгоценных металлов, что стимулирует применение катализаторов на основе переходных элементов (Ni [15] и Cu [16, 17]).
В последние годы никель-фосфидные катализаторы привлекают большое внимание исследователей и активно изучаются в реакциях гидрооблагораживания (гидрообессеривание, гидродеазотирование и др.) и гидродеоксигенации компонентов биотоплива вследствие наличия в их составе как металлических, так и кислотных центров [20–22]. Поскольку восстановительное аминирование карбонильных соединений включает катализируемую кислотами стадию образования имина, фосфидные катализаторы представляют интерес для использования в этой реакции. В наших предыдущих исследованиях было показано, что нанесенные на силикагель фосфиды никеля являются эффективными катализаторами восстановительного аминирования этил левулината в N-алкил-5-метил-2-пирролидиноны в проточном реакторе, при этом наилучшие результаты получены на образце, приготовленном с применением фосфатного прекурсора и восстановленном при температуре 600°C [23, 24]. В настоящей работе изучена возможность использования данного подхода для синтеза вторичных аминов по реакции восстановительного аминирования различных альдегидов и кетонов первичными аминами на катализаторе Ni2P/SiO2 оптимального состава.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и материалы
В работе применяли фурфурол (99%), н-гептаналь (95%), 2-гептанон (98%), ацетофенон (98%), 3-фенилпропаналь (95%), п-метилбензальдегид (>99%), п-хлорбензальдегид (>98.5%), п-метоксибензальдегид (>99%), н-гексиламин (99%), н-бутиламин (>99%), анилин (99.8%), п-толуидин (99%) и н-декан (>99%), все “Acros Organics”, Бельгия. В качестве растворителя использовали толуол (“ос. ч.”, 99.5%, “ЗАО ЭКОС-1”) и изопропанол (“ос. ч.”, 99.8%, “АО Реахим”). Ni(CH3COO)2 · 4H2O (≥98%, “АО Реахим”), (NH4)2HPO4 (технический, “Alfa Aesar”), HNO3 (~70%, “АО Реахим”) и силикагель марки КСКГ (площадь удельной поверхности – 300 м2/г, объем пор – 0.80 см3/г, средний диаметр пор – 10.6 нм, “ООО Хроманалит”) применяли для приготовления катализатора.
Приготовление катализатора
Катализатор Ni2P/SiO2 получали пропиткой гранул SiO2 (фракция 0.25–0.50 мм) водным раствором, образующимся при растворении солей Ni(CH3COO)2 · 4H2O и (NH4)2HPO4 в разбавленном растворе азотной кислоты (исходное соотношение Ni : P = 1 : 2). Полученный прекурсор сушили при комнатной температуре в течение ночи при 110°C и затем прокаливали при 600°C в течение 3 ч [23–26].
Физико-химические свойства катализатора
Химический анализ на содержание Ni и P осуществляли методом оптической спектрометрии на индуктивно-связанной плазме на спектрометре Optima 4300 DV (“Perkin Elmer”, США). Рентгенофазовый анализ (РФА) проводили на дифрактометре Bruker D8 Advance (“Bruker”, Германия) с CuKα-излучением. Исследование катализатора методом просвечивающей электронной микроскопии высокого разрешения (ПЭМ ВР) было выполнено на электронном микроскопе JEM-2010 (“JEOL”, Япония) с разрешением по решетке 0.14 нм при ускоряющем напряжении 200 кВ.
Каталитические свойства
Каталитические свойства Ni2P/SiO2 были изучены в проточной установке, оборудованной реактором из нержавеющей стали (общая длина – 265 мм, внутренний диаметр – 9 мм). Предшественник катализатора (750 мг) разбавляли карбидом кремния (фракция 0.2–0.3 мм) в соотношении 1 : 3 и помещали в реактор между двумя слоями SiC. Непосредственно перед началом эксперимента образец восстанавливали in situ в потоке H2 (100 мл/мин) при температуре 600°C и атмосферном давлении в течение 1 ч [23, 24].
Далее реактор охлаждали до температуры реакции и с помощью ВЭЖХ насоса Gilson 305 (“Gilson”, США) подавали растворитель. После установления заданной температуры и давления в реакторе растворитель заменяли на реакционную смесь, содержащую карбонильное соединение (0.04 М) и первичный амин (0.041–0.048 М); данный момент времени считали отправной точкой эксперимента. Реакцию проводили при температуре 140–170°C, общем давлении 10 бар, скоростях подачи реакционной смеси и водорода 0.333 и 30 мл/мин соответственно. Пробы отбирали каждые 30 мин в интервале 2–4 ч от начала эксперимента и усредняли полученные результаты.
Продукты реакции анализировали методом ГХ, используя газовый хроматограф Agilent 6890N (“Agilent”, США), снабженный капиллярной колонкой HP 1-MS (длина колонки – 30 м, внутренний диаметр – 0.32 мм, толщина пленки – 1.00 мкм). Конверсии реагентов определяли по изменению площадей их пиков на хроматограмме в сравнении с исходной реакционной смесью, используя н-декан в качестве внутреннего стандарта. Селективности по продуктам и выход целевого вторичного амина рассчитывали по превращению карбонильного соединения. Идентификацию продуктов проводили методом газовой хроматографии–масс-спектрометрии (ГХ–МС) с помощью Agilent 7000B Triple Quad System (“Agilent”, США). Материальный баланс для изучаемых реакций, оцененный по ранее описанной методике [23], составлял не менее 95%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
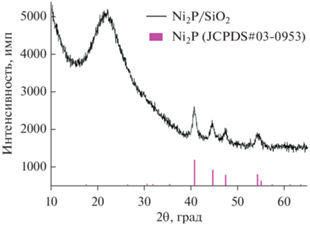
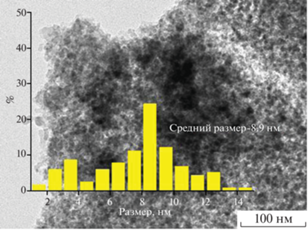
Согласно данным химического анализа, в состав приготовленного катализатора Ni2P/SiO2 входит 6.3 мас. % Ni и 3.8 мас. % P. Содержание фосфора в катализаторе оказалось заметно ниже расчетного значения (6.7 мас. %), что объясняется образованием летучих соединений PH3, P, P2 и др. в процессе восстановления [25, 26]. На дифрактограмме образца Ni2P/SiO2 (рис. 1) присутствуют сигналы при 2θ = 40.7°, 44.5°, 47.3°, 54.1° и 55.0°, характерные для фазы Ni2P (JCPDS #03-0953). Кроме того, на рентгенограмме имеется широкий пик при 2θ ~ 15°–30°, относящийся к аморфному SiO2. ПЭМ-снимки катализатора свидетельствуют о том, что образец содержит наночастицы размером от 1 до 15 нм со средним диаметром около 8.9 нм (рис. 2).
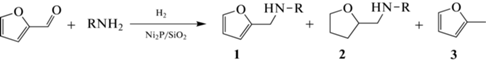
Прежде всего, каталитические свойства Ni2P/SiO2 были изучены в восстановительном аминировании фурфурола, который образуется из легкодоступной несъедобной лигноцеллюлозной биомассы и является исходным сырьем для синтеза N-замещенных фурфурил аминов – важного класса соединений, обладающих биологической активностью [7, 27, 28]. Непосредственно перед проведением эксперимента предшественник катализатора восстанавливали in situ [23, 24], при этом каждый раз использовали новую порцию образца. Было показано, что реакция фурфурола с небольшим избытком н-гексиламина (амин/фурфурол = 1.02) в толуоле при температуре 140°C и общем давлении 10 бар приводит к образованию гексилфурфуриламина (1а) с селективностью 87% при количественной конверсии фурфурола (табл. 1, строка 1). Помимо 1а в конечной реакционной смеси присутствуют вторичный амин (2a), появляющийся в результате восстановления фуранового кольца в целевом продукте, 2-метилфуран (3) – продукт гидродеоксигенации фурфурола, а также дигексиламин. При этом среди продуктов реакции не обнаружен фурфуриловый спирт и промежуточный имин. Повышение температуры реакции до 150°C заметно увеличивает скорость гидрирования фуранового кольца в 1a, что снижает селективность по целевому продукту (табл. 1, строка 2). Использование изопропанола в качестве растворителя также приводит к резкому снижению выхода гексилфурфуриламина (табл. 1, строка 3) вследствие образования большего количества 2a и частичного алкилирования н-гексиламина спиртом [23].
Таблица 1.
Восстановительное аминирование фурфурола на катализаторе Ni2P/SiO2 в проточном ректоре
 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|
| № | R | Амин/ фурфурол |
1 | Конверсия фурфурола, % | Конверсия амина, % | Селективность,% | Выход 1, % | ||
| 1 | 2 | 3 | |||||||
| 1 | н-C6H13 | 1.02 | 1a | 100 | 100 | 87 | 10 | 3 | 87 |
| 2* | н-C6H13 | 1.02 | 1a | 100 | 100 | 76 | 20 | 4 | 76 |
| 3** | н-C6H13 | 1.02 | 1a | 100 | 100 | 64 | 30 | 6 | 64 |
| 4 | н-C4H9 | 1.02 | 1b | 100 | 100 | 83 | 13 | 4 | 83 |
| 5 | н-C6H13 | 1.2 | 1a | 100 | 94 | 89 | 9 | 2 | 89 |
| 6 | н-C6H13 | 1.5 | 1a | 100 | 77 | 94 | 4 | 2 | 94 |
| 7 | н-C4H9 | 1.2 | 1b | 100 | 100 | 86 | 10 | 4 | 86 |
| 8 | Ph | 1.02 | 1c | 100 | 63 | 55 | 10 | 35 | 55 |
| 9 | п-CH3C6H4 | 1.02 | 1d | 100 | 69 | 68 | 6 | 26 | 68 |
Исследовано влияние структуры первичного амина и соотношения амин/фурфурол на протекание реакции. Во всех экспериментах наблюдается количественная конверсия фурфурола. Реакция с н-бутиламином протекает с несколько более низким выходом соответствующего вторичного амина 1b (табл. 1, строка 4), чем в случае н-гексиламина, что, вероятно, объясняется испарением низкокипящего н-бутиламина (температура кипения 78°C) из исходной реакционной смеси. В качестве побочных продуктов образуются амин 2b, 2-метилфуран и дибутиламин. Образование дигексиламина и дибутиламина в ходе реакции, по-видимому, связано с конденсацией молекул первичного алифатического амина на поверхности катализатора в присутствии водорода [24]. Данная побочная реакция приводит к недостатку амина в реакционной смеси при эквимолярном соотношении реагентов. Вследствие этого, повышение исходного отношения амин/фурфурол до 1.2–1.5 увеличивает выход вторичного амина (табл. 1, строки 1, 4–7). Однако при 50%-ном избытке первичного амина его остаточное содержание в конечной реакционной смеси довольно велико (табл. 1, строка 6). В отличие от алифатических аминов, использование анилина и п-толуидина в этой реакции приводит к значительно более низкому выходу целевых продуктов 1c и 1d (табл. 1, строки 8 и 9) из-за более слабых нуклеофильных свойств ароматических аминов.
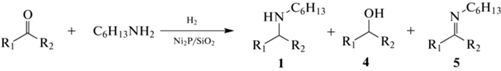
Изучено влияние природы карбонильного соединения на каталитические свойства Ni2P/SiO2 в реакции с 20%-ным избытком н-гексиламина. Практически во всех экспериментах наблюдается количественная (или почти количественная) конверсия альдегида или кетона (табл. 2). Обнаружено, что н-гептаналь и 3-фенилпропаналь обеспечивают более высокий выход вторичного амина в реакции с н-гексиламином, чем производные бензальдегида (табл. 2, строки 1–7), что объясняется более сильной электрофильной природой алифатических альдегидов. В случае п-метоксибензальдегида отмечается уменьшение выхода целевого продукта по сравнению с п-метилбензальдегидом (табл. 2, строки 3 и 4), что, вероятно, связано с более сильным электронодонорным эффектом от метоксигруппы, который способствует увеличению электронной плотности на атоме углерода карбонильной группы и, тем самым, снижает электрофильные свойства. Введение Cl-заместителя в пара-положение бензальдегида значительно замедляет скорость гидрирования промежуточного имина, в результате выход вторичного амина не превышал 61% (табл. 2, строка 5). Однако повышение температуры реакции до 170°C приводит к резкому падению селективности по имину и возрастанию выхода целевого продукта до 84% (табл. 2, строка 6). Использование 2-гептанона уменьшает выход вторичного амина по сравнению с н-гептаналем вследствие более слабых электрофильных свойств кетона (табл. 2, строки 1 и 7), при этом он оказывается таким же, как в случае с п-метилбензальдегидом. В реакции же с ацетофеноном, который обладает наиболее слабыми электрофильными свойствами среди всех исследованных карбонильных соединений, получен самый низкий выход целевого продукта из-за образования большого количества этилбензола в побочной реакции (табл. 2, строка 8).
Таблица 2.
Восстановительное аминирование карбонильных соединений н-гексиламином на катализаторе Ni2P/SiO2
 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|
| № | R1 | R2 | T, °C | Конверсия, % | Селективность, % | Выход 1, % | |||
| 1 | 4 | 5 | другие | ||||||
| 1 | н-C6H13 | H | 150 | 100 | 99 | 0 | 0 | 1* | 99 |
| 2 | PhCH2CH2 | H | 150 | 100 | 97 | 0 | 0 | 3* | 97 |
| 3 | п-CH3C6H4 | H | 150 | 100 | 96 | 4 | 0 | н/о | 96 |
| 4 | п-CH3OC6H4 | H | 150 | 100 | 92 | 0 | 2 | 6** | 92 |
| 5 | п-ClC6H4 | H | 150 | >99 | 61 | 11 | 28 | н/о | 61 |
| 6 | п-ClC6H4 | H | 170 | 100 | 84 | 11 | 5 | н/о | 84 |
| 7 | н-C5H11 | CH3 | 170 | >99 | 96 | 4 | 0 | 0 | 96 |
| 8 | Ph | CH3 | 170 | 92 | 59 | 0 | 0 | 41*** | 54 |
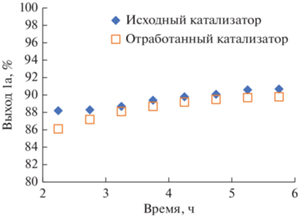
Кроме того, нами была исследована стабильность катализатора Ni2P/SiO2 в реакции фурфурола с н-гексиламином. При проведении реакции с 20%-ным избытком н-гексиламина при 140°C и общем давлении 10 бар в течение 6 ч выход 1a находится в пределах 88–91%, при этом наблюдается некоторое его увеличение со временем (рис. 3). После окончания эксперимента снижали температуру до 50°C при непрерывной подаче водорода, промывали отработанный катализатор в токе изопропилового спирта в течение часа (скорость потока 1 мл/мин) и далее хранили образец в атмосфере водорода. Для повторного использования замещали изопропанол на толуол и после установления заданной температуры и давления в реактор вводили реакционную смесь. В результате катализатор продемонстрировал выход целевого продукта, сопоставимый с исходным образцом, что указывает на высокую стабильность Ni2P/SiO2 в реакциях восстановительного аминирования.
ЗАКЛЮЧЕНИЕ
Установлено, что нанесенный на силикагель фосфид никеля является эффективным катализатором восстановительного аминирования альдегидов и кетонов первичными алифатическими аминами в проточном реакторе. Катализатор 6.3% Ni2P/SiO2 обеспечивает образование вторичных аминов с выходом до 99% при небольшом избытке амина и использовании толуола в качестве растворителя. Выход целевого продукта зависит от природы карбонильного соединения и уменьшается в следующем ряду: алифатические альдегиды > алифатические кетоны ~ ароматические альдегиды > ароматические кетоны, что объясняется снижением электрофильных свойств в данной последовательности. При взаимодействии фурфурола с н-гексиламином, взятом в 20%-ном избытке, синтезирован гексилфурфуриламин с выходом 89%, при этом катализатор показывает высокую стабильность и может использоваться повторно без заметного падения активности и селективности. В реакциях с участием ароматических аминов, которые обладают более слабыми нуклеофильными свойствами, выход соответствующих вторичных аминов оказался значительно ниже.
Список литературы
Salvatore R.N., Yoon C.H., Jung K.W. // Tetrahedron. 2001. V. 57. P. 7785.
Roundhill D.M. // Chem. Rev. 1992. V. 92. P. 1.
Climent M.J., Corma A., Iborra S. // Chem. Rev. 2011. V. 111. P. 1072.
Shimizu K. // Catal. Sci. Technol. 2015. V. 5. P. 1412.
Heravi M.M., Kheilkordi Z., Zadsirjan V., Heydari M., Malmir M. // J. Organomet. Chem. 2018. V. 861. P. 17.
Cukalovic A., Stevens C.V. // Green Chem. 2010. V. 12. P. 1201.
García-Ortiz A., Vidal J.D., Climent M.J., Concepción P., Corma A., Iborra S. // ACS Sustain. Chem. Eng. 2019. V. 7. P. 6243.
Santoro F., Psaro R., Ravasio N., Zaccheria F. // ChemCatChem. 2012. V. 4. P. 1249.
Domine M.E., Hernandez-Soto M.C., Perez Y. // Catal. Today. 2011. V. 159. P. 2.
Laroche B., Ishitani H., Kobayashi S. // Adv. Synth. Catal. 2018. V. 360. P. 4699.
Liu J., Fitzgerald A.E., Mani N.S. // Synthesis. 2012. V. 44. P. 2469.
Cooper C.G.F., Lee E.R., Silva R.A., Bourque A.J., Clark S., Katti S., Nivorozhkin V. // Org. Process. Res. Dev. 2012. V. 16. P. 1090.
Нуждин А.Л., Симонов П.А., Бухтияров В.И. // Кинетика и катализ. 2021. Т. 62. № 4. С. 459.
Carrillo A.I., Llanes P., Pericàs M.A. // React. Chem. Eng. 2018. V. 3. P. 714.
Chieffi G., Braun M., Esposito D. // ChemSusChem. 2015. V. 8. P. 3590.
Nuzhdin A.L., Bukhtiyarova M.V., Bukhtiyarova G.A. // J. Chem. Technol. Biotechnol. 2020. V. 95. P. 3292.
Артюха Е.А., Нуждин А.Л., Бухтиярова Г.А., Деревянникова Е.А., Герасимов Е.Ю., Гладкий А.Ю., Бухтияров В.И. // Кинетика и катализ. 2018. Т. 59. № 5. С. 583.
Gerardy R., Debecker D.P., Estager J., Luis P., Monbaliu J.-C.M. // Chem. Rev. 2020. V. 120. P. 7219.
Yu T., Jiao J., Song P., Nie W., Yi C., Zhang Q., Li P. // ChemSusChem. 2020. V. 13. P. 2876.
Prins R., Bussell M.E. // Catal. Lett. 2012. V. 142. P. 1413.
Oyama S.T., Gott T., Zhao H., Lee Y.-K. // Catal. Today. 2009. V. 143. P. 94.
Голубева М.А., Захарян Е.М., Максимов А.Л. // Наногетерогенный катализ. 2020. Т. 5. № 2. С. 89.
Wang Y., Nuzhdin A.L., Shamanaev I.V., Bukhtiyarova G.A. // Mol. Catal. 2021. V. 515. № 111884.
Wang Y., Nuzhdin A.L., Shamanaev I.V., Kodenev E.G., Gerasimov E.Yu., Bukhtiyarova M.V., Bukhtiyarova G.A. // Int. J. Mol. Sci. 2022. V.23. № 1106.
Shamanaev I.V., Deliy I.V., Aleksandrov P.V., Gerasimov E.Yu., Pakharukova V.P., Kodenev E.G., Ayupov A.B., Andreev A.S., Lapina O.B., Bukhtiyarova G.A. // RSC Adv. 2016. V. 6. P. 30372.
Deliy I.V., Shamanaev I.V., Aleksandrov P.V., Gerasimov E.Yu., Pakharukova V.P., Kodenev E.G., Yakovlev I.V., Lapina O.B., Bukhtiyarova G.A. // Catalysts. 2018. V. 8. № 515.
He J., Chen L., Liu S., Song K., Yang S., Riisager A. // Green Chem. 2020. V. 22. P. 6714.
Yang Z.-Y., Hao Y.-C., Hu S.-Q., Zong M.-H., Chen Q., Lia N. // Adv. Synth. Catal. 2021. V. 363. P. 1033.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ