Кинетика и катализ, 2023, T. 64, № 1, стр. 53-64
Превращения молекулярной каталитической системы Pd/(N-гетероциклический карбен) в реакции Мизороки–Хека
А. Ю. Костюкович a, Е. Д. Патиль a, Ю. В. Бурыкина a, В. П. Анаников a, *
a ФГБУН Институт органической химии им. Н.Д. Зелинского РАН
119991 Москва, Ленинский просп., 47, Россия
* E-mail: val@ioc.ac.ru
Поступила в редакцию 01.10.2022
После доработки 05.10.2022
Принята к публикации 06.10.2022
- EDN: KGSNIQ
- DOI: 10.31857/S0453881123010033
Аннотация
Изучен механизм формирования каталитических центров в практически важной реакции Мизороки–Хека, востребованной в современном тонком органическом синтезе. Обнаружено, что в условиях реакции Мизороки–Хека катализаторы на основе комплексов палладия с N-гетероциклическими карбеновыми лигандами трансформируются в “безлигандную” форму. Молекулярное моделирование, проведенное с использованием квантово-химических методов, показало, что данные процессы конкурируют с целевой реакцией на трех из шести стадий каталитического цикла. Наличие продуктов превращения катализатора в реакционной системе было подтверждено экспериментально методами ядерного магнитного резонанса и масс-спектрометрии. Получены важные механистические данные для рационального дизайна каталитических систем реакций кросс-сочетания.
ВВЕДЕНИЕ
Комплексы палладия с N-гетероциклическими карбеновыми лигандами (NHC) применяются в качестве каталитических систем во множестве синтетических превращений, включая реакции Мизороки–Хека, кросс-сочетания и присоединения по кратным связям [1, 2]. Основные преимущества данных соединений – большое структурное разнообразие и высокая прочность связи металл–лиганд [3, 4]. Вместе с тем в реакциях с использованием систем Pd/NHC нередко наблюдается агрегация металла, приводящая к формированию наночастиц и палладиевой черни [5]. Причиной этому являются побочные реакции сочетания NHC с другими лигандами металлического центра, протекающие в интермедиатах каталитических реакций [6]. Так, первая стадия реакций кросс-сочетания и Мизороки–Хека – окислительное присоединение – приводит к образованию интермедиатов (NHC)Pd(X)(R1)(Solv), где X – галоген, R – органический лиганд, а Solv – сольватный лиганд (рис. 1, стадия I). Следующая стадия – лигандный обмен X или Solv на молекулу исходного субстрата, однако возможен и побочный процесс – восстановительное элиминирование с образованием продукта R-NHC сочетания. В результате побочной реакции получается комплекс Pd0 со слабосвязанными лигандами, который служит источником атомарного палладия. Другая побочная реакция H-NHC сочетания может протекать в интермедиате (NHC)Pd(X)(H)(R1HC=CHR2), образующемся на стадии β-гидридного элиминирования (стадия IV). Процессы трансформации каталитических систем на основе палладия имеют принципиальное значение, поскольку они определяют устойчивость катализатора к агрегации и скорость высвобождения металла из молекулярных комплексов [7, 8]. Так как и каталитическая реакция, и агрегация каталитической системы представляют собой неравновесные процессы, механизм и скорость трансформации катализатора будут определяться соотношением энергий активации стадий каталитического цикла и побочных реакций.
Рис. 1.
Каталитическая реакция Мизороки–Хека и побочные процессы (выделены желтым цветом). Solv – сольватный лиганд, X – галоген, B – основание. I – стадия окислительного присоединения, II – лигандный обмен, III – внедрение алкена по связи Pd–Ph, IV – β-гидридное элиминирование, V – лигандный обмен, VI – восстановительное элиминирование.

В настоящей работе приводятся результаты исследования побочных процессов R-NHC и H-NHC сочетания реакции Мизороки–Хека теоретическими и физико-химическими методами. С помощью ЯМР и масс-спектрометрического анализа были обнаружены и количественно охарактеризованы продукты данных процессов. На основании квантово-химического моделирования установлен механизм R-NHC и H-NHC сочетания и проведено количественное сравнение их энергий активации с аналогичными параметрами целевой реакции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Cпектры ЯМР были зарегистрированы на спектрометре Fourier 300HD (“Bruker”, Германия) с рабочей частотой 300 МГц для 1Н и 75 МГц для 13С ядер.
Масс-спектры высокого разрешения записывали на тандемном квадрупольном/времяпролетном масс-спектрометре Bruker maXis Q-TOF (“Bruker Daltonik”, Германия) с источником ионизации электрораспылением. Прямой ввод анализируемого раствора осуществляли с помощью ВЭЖХ Agilent 1200 (“Agilent”, США). Анализ смеси проводили в режиме регистрации положительный ионов (+) (заземленная игла распыления, высоковольтный капилляр 4.5 кВ; разность потенциалов с защитным экраном спрея − 0.5 кВ) в диапазоне сканирования масс m/z 50–1500. Низкоконцентрированный калибровочный раствор Tuning mix (“Agilent Technologies”, США) использовали в качестве внешней калибровки прибора, ацетонитрил – в качестве подвижной фазы. В качестве газа-распылителя (1.0 бар) и газа-осушителя (200°С, 4.0 л/мин) применяли азот. Все спектры были зарегистрированы с частотой 1 Гц и обработаны с помощью Bruker Data Analysis 4.0.
Дейтерированные стандарты H-NHC-d6, Ph-NHC-d6 и NHC=O-d6 были синтезированы по ранее опубликованным методикам [9–11].
Реакция Мизороки–Хека. В стеклянную пробирку, снабженную магнитной мешалкой, помещали PhI (1.8 × 10−4 моль), бутилакрилат (1.8 × × 10−4 моль), K2CO3 (2 × 10−4 моль) и 1 мл N,N-диметилформамида (ДМФА). Палладиевый комплекс Pd/BIMe (5 мол. %) был добавлен последним. Реакционную смесь перемешивали в течение 24 ч при 120°С. По истечении указанного времени ее охлаждали до комнатной температуры и анализировали методами масс-спектрометрии с ионизацией электрораспылением (ИЭР-МС) и 1Н ЯМР.
Изучение реакционной смеси методом ИЭР-МС. В стеклянную виалу общим объемом 2 мл добавляли 1 мл CH3CN и 10 мкл реакционной смеси. Полученный раствор разбавляли в 100 раз (раствор V1). Во второй виале растворяли H-BIMe-d6 (2 мг) и Ph-BIMe-d6 (2 мг) в 1 мл CH3CN (раствор V2). В третьей виале смешивали 5 мг NHC=O-d6, 900 мкл CH3CN и 100 мкл ранее приготовленного раствора H-BIMe-d6 и Ph-BIMe-d6 (раствор V3). В разбавленный раствор реакционной массы (раствор V1) добавляли 10 мкл раствора стандартов (раствор V3). Выход продуктов считали по соотношению сигналов искомого продукта и соответствующего стандарта.
Квантово-химические расчеты. Расчеты были проведены в программном комплексе Gaussian 16 [12] в рамках теории функционала плотности с использованием гибридного функционала PBE1PBE [13] и трижды валентно расщепленного базисного набора Def2TZVP [14]. Для учета дисперсионных взаимодействий к энергии системы была добавлена эмпирическая поправка Гримме (Grimme) [15]. Влияние растворителя на протекание реакции учитывали в рамках модели поляризованного континуума (PCM) [16]. В качестве растворителя выбран ДМФА. Колебательные частоты были рассчитаны для всех структур. Основные состояния не имели мнимых колебательных частот, переходные состояния имели одну мнимую частоту.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Превращения каталитической системы Pd/NHC изучали в рамках модельной реакции Мизороки–Хека. Бутилакрилат реагировал с иодбензолом в N,N-диметилформамиде (ДМФА) в присутствии карбоната калия при 120°C в течение 24 ч (схема 1a ). В качестве катализатора был взят комплекс Pd/BIMe (схема 1 б). Выход бутилциннамата составил 99%. Анализ реакционной смеси проводили методами 1H ЯМР и ИЭР-МС. В масс-спектрах и спектрах 1Н ЯМР были обнаружены три продукта деградации комплекса Pd/BIMe: продукт H-BIMe сочетания, продукт Ph-BIMe сочетания и азолон BIMe=O (схема 1 б).
Схема 1 . Схема и условия реакции Мизороки–Хека (а) и превращения каталитической системы Pd/BIMe (б).
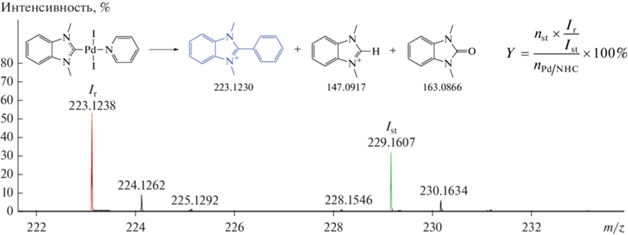
Выходы данных соединений определяли методом ИЭР-МС с применением внутренних стандартов – дейтерированных аналогов H-NHC-d6, Ph-NHC-d6 и NHC=O-d6 (см. экспериментальную часть). Массы исследуемых продуктов отличаются от своих дейтерированных стандартов на 6 Да, что позволяет избежать наложения изотопных распределений и использовать отношение интенсивностей сигналов в масс-спектре для расчета выходов (рис. 2). Основным продуктом деградации комплекса Pd/BIMe был Ph-BIMe (35%), соединения H-BIMe и BIMe=O образовывались в значительно меньших количествах – 4 и 5% соответственно.
Рис. 2.
Пример определения количества Ph-BIMe в реакционной смеси (Y): nst – количество вещества стандарта в исследуемом растворе, nPd/NHC – количество вещества исходного комплекса в исследуемом растворе, Ir – интенсивность первого сигнала изотопного распределения искомого вещества, Ist – интенсивность первого сигнала изотопного распределения стандарта.
Квантово-химические расчеты каталитического цикла Мизороки–Хека и процессов H-NHC и Ph-NHC сочетания были проведены в рамках теории функционала плотности (DFT) с использованием континуальной модели растворителя (PCM). В качестве субстратов выбраны метилакрилат и иодбензол, в качестве растворителя – ДМФА, основание – карбонат-дианион, катализатор – комплекс BIMe-Pd-ДМФА (1).
На первой стадии реакции Мизороки–Хека происходит окислительное присоединение иодбензола к палладиевому комплексу 1 с образованием четырехкоординационного комплекса палладия(II) 4 (схема 2 ). Данная стадия имеет низкий потенциальный барьер (ΔE‡(2 → TS-3) = 15.8 ккал/моль), а ее энергия ΔE(2 → 4) составляет −38.1 ккал/моль. Всего существует три изомера 4, различающихся расположением лигандов в координационной сфере палладия. В более стабильных изомерах 4a и 4b, близких по энергии, фенильный и диметилбензимидазольный лиганды находятся в цис-положении. В нестабильной структуре 4с, которая на 13.2 ккал/моль менее устойчива по сравнению с 4a, эти лиганды находятся в транс-положении.
Схема 2 . Стадия окислительного присоединения реакции Мизороки–Хека.
На следующей стадии протекает лигандный обмен, в результате которого метилакрилат связывается с палладиевым центром. Возможны два альтернативных пути реакции в зависимости от того, какой лиганд уходит из координационной сферы металла (схема 3 ). В случае катионного пути уходящей группой является иодид-анион, образуются катионные трехкоординационные комплексы 7. Энергия диссоциации для трех изомеров варьируется в пределах 18.6–33.1 ккал/моль. Легче всего диссоциация протекает в наиболее стабильном изомере 4a. Далее метилакрилат занимает вакантное координационное место с образованием катионных комплексов 8. Процессы лигандного обмена по катионному пути идут с повышением энергии системы: ΔE(4 → 8) составляет 0.9–4.2 ккал/моль. В случае нейтрального пути диссоциирует сольватный лиганд с образованием нейтральных трехкоординационных комплексов 5. Энергии диссоциации ДМФА ниже, чем аналогичные параметры диссоциации иодид-аниона, и лежат в пределах 13.3–17.4 ккал/моль. Наименьшую энергию имеет процесс диссоциации 4b → 5b. Координация метилакрилата с комплексами 5 приводит к образованию соединений 6. Реакция лигандного обмена 4a → 6a имеет положительное значение энергии (ΔE(4a → 6a) = = 0.6 ккал/моль). В целом нейтральный путь является немного более предпочтительным, но, поскольку энергетические параметры обоих механизмов близки, изменение растворителя или структуры вспомогательного лиганда могут переключить механизм реакции. Порядок стабильности изомеров продуктов лигандного обмена сохраняется: 6a (8a) > 6b (8b) > 6c (8c). Как и в случае комплексов 4, в наиболее стабильных структурах 6 и 8 фенильный и диметилбензимидазольный лиганды занимают цис-положение по отношению друг к другу. При моделировании следующих стадий рассматривался только нейтральный путь реакции.
В изомерах 4a и 4b возможен также процесс Ph-NHC сочетания (схема 4 ). Энергия активации данной реакции в комплексе 4a (ΔE‡(4a → TS-9a) = = 17.7 ккал/моль) всего на 0.8 ккал/моль выше, чем энергия диссоциации ДМФА. Таким образом, скорости обоих процессов сопоставимы, и на стадии лигандного обмена каталитического цикла образуются соединения 10, не имеющие связи Pd–NHC. Энергия активации Ph-NHC сочетания в изомерной структуре 4b (ΔE‡(4b → TS-9b) = = 20.1 ккал/моль) на 6.8 ккал/моль выше по сравнению с энергией диссоциации сольватного лиганда.
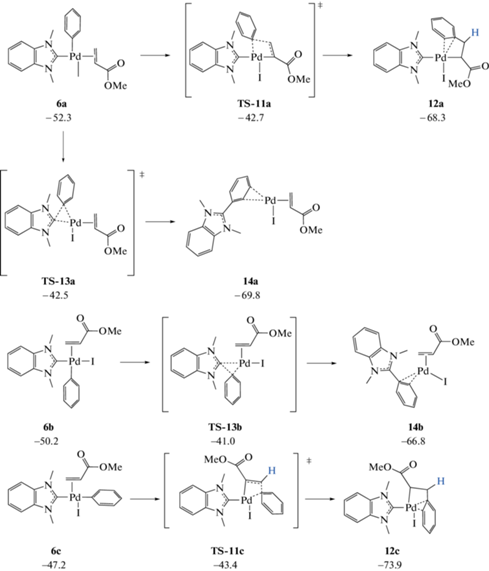
На следующей стадии реакции Мизороки–Хека – внедрения метилакрилата по связи Pd–Ph – также возможен процесс Ph-NHC сочетания (схема 5 ). В изомере 6а могут протекать как целевая, так и побочная реакции. В 6b идет только Ph-NHC сочетание, а в структуре 6c – только внедрение метилакрилата. При сравнении энергий переходных состояний четырех рассчитанных превращений получается следующий ряд стабильности (за ноль принята энергия наиболее стабильной структуры): TS-11c (0) > TS-11a (0.7) > TS-13a (0.9) > TS-13b (2.4 ккал/моль). Данный ряд совпадает с рядом термодинамической стабильности продуктов 12. Реакции 6 → 12 и 6 → 14 имеют отрицательные значения энергий от –26.7 до –16.0 ккал/моль, а энергии активаций варьируются в пределах 3.8–9.8 ккал/моль. У четырех переходных состояний близкие значения энергий, а, следовательно, все данные процессы возможны на третьей стадии реакции Мизороки–Хека. Неожиданно, что легче всего протекает внедрение метилакрилата в наименее стабильном изомере 4c. На втором месте также внедрение метилакрилата в структуре 4a. Немного более высокие барьеры имеют реакции Ph-NHC сочетания в изомерах 4a и 4b. Существует два изомера продукта внедрения метилакрилата 12. В более стабильной структуре 12с алкенильный и диметилбензимидазольный лиганды находятся в циc-положении. Алкенильный лиганд можно рассматривать как бидентантный, поскольку фенильная группа образует с паллдиевым центром дополнительную π-координацию.
При сравнении процессов R-NHC сочетания 4 → 10 (схема 4 ) и 6 → 12 (схема 5 ), обнаружилось, что энергетические параметры данных реакций сильно зависят от лигандного окружения атома палладия. Замена сольватного лиганда на метилакрилат приводит к существенному снижению потенциальных барьеров и энергий реакции. Например, потенциальный барьер и энергия активации процесса 4a → 10a, составляющие 17.7 и 5.8 ккал/моль соответственно, в реакции 6a → 12a снижаются до значений 9.6 и –16.0 ккал/моль.
Схема 3 . Стадия лигандного обмена реакции Мизороки–Хека. Катионный и нейтральный пути реакции.
Схема 4 . Реакции Ph-NHC сочетания в комплексе 4.
Схема 5 . Внедрение метилакрилата по связи Pd–Ph и альтернативный путь Ph-NHC сочетания.
β-Гидридное элиминирование – четвертая стадия каталитического цикла (схема 6 ). В результате данного процесса атом водорода мигрирует от алкенильного лиганда к металлическому центру с образованием связи Pd–H и целевого продукта (метилциннамата). Перед миграцией атома водорода происходит вращение вокруг С–С-связи алкенильного лиганда (12 → 12'), приводящее к разрыву π-координации фенильной группы с атомом палладия. Энергии вращения составляют 3.0 и 6.2 ккал/моль для структур 12c и 12a соответственно, что свидетельствует о том, что π-координация в данных соединениях является слабой. Согласно энергиям переходных состояний TS-15c и TS-15a β-гидридное элиминирование идет через менее стабильный изомер 12a по следующему пути: 12c → 12a → 12a' → TS-15a → 16a, преодолевая потенциальный барьер ΔE‡(12с → TS-15a) равный 15.2 ккал/моль.
Схема 6 . Стадия β-гидридного элиминирования.
В результате следующего лигандного обмена молекула основания ${\text{CO}}_{3}^{{2 - }}$ внедряется в координационную сферу металлического центра (схема 7 ). Карбонат-дианион замещает сразу два лиганда – метилциннамат и иодид-анион, образуется комплекс 22. Обмен происходит последовательно. Сначала диссоциирует только один лиганд. Существуют два альтернативных пути данного процесса: диссоциация иодид-аниона (16 → 19) и диссоциация метилциннамата (16 → 20). Согласно полученным данным, второй вариант более выгоден: комплексы 20 стабильнее структур 19 на 2.1–9.6 ккал/моль. Далее комплексы 20 координируются с карбонат-дианионом, который связывается с палладиевым атомом в монодентантном режиме (структуры 21). Затем иодид анион вытесняется из координационной сферы металла, и карбонат занимает два координационных места. Стадия лигандного обмена идет по следующему пути: 16a → 16b → 20b → 21b → 22, а скорость данного процесса определяется энергией диссоциации ΔE(16a → 20b) и составляет 16.3 ккал/моль. Реакция 16a → 22 идет самопроизвольно со значительным понижением энергии (ΔE(16a → 22) = –23.4 ккал/моль).
Схема 7 . Пятая стадия каталитического цикла Мизороки–Хека – лигандный обмен.
Энергия заключительной стадии восстановительного элиминирования составляет –0.7 ккал/моль, а ее потенциальный барьер равен 22.2 ккал/моль (схема 8 ). В результате реакции образуется комплекс палладия(0) 24. Процесс H-BIMe сочетания в комплексе 22 невыгоден, а точка минимума на поверхности потенциальной энергии, соответствующая продукту данного процесса – комплексу палладия с азолиевым катионом – не была найдена вследствие самопроизвольной атомной перегруппировки. На стадии восстановительного элиминирования H-BIMe сочетание не протекает.
Схема 8 . Шестая стадия каталитического цикла Мизороки–Хека – восстановительное элиминирование.
На рис. 3 приведен полный путь реакции Мизороки–Хека для наиболее стабильного изомера. Побочные процессы Ph-BIMe и H-BIMe сочетания могут протекать на трех из шести стадий реакции: внедрения фенильной группы по связи Pd–BIMe и на двух стадиях лигандного обмена. Потенциальные барьеры процессов Ph-BIMe сочетания, идущих на второй и третьей стадиях каталитического цикла, очень близки к аналогичным параметрам целевой реакции, следовательно на данных этапах каталитическая система активно превращается в комплексы, не содержащие BIMe лигандов. H-BIMe сочетание, конкурирующее со стадией лигандного обмена, идет намного быстрее целевой реакции. На данном этапе реакции Мизороки–Хека все палладиевые комплексы должны бы превратиться в “безлигандную” форму. Однако согласно экспериментальным данным продукта Ph-BIMe сочетания образовывалось почти в 9 раз больше, чем солей, содержащих катион H-BIMe. Данный факт вполне объясним обратимостью H-BIMe сочетания: соединения H-BIMe реагируют с основанием, образуя свободный карбен, способный легко присоединяться к металлическому центру. Аналогичный же путь для продуктов Ph-NHC невозможен, BIMe лиганд может вернуться в координационную сферу палладия только путем окислительного присоединения Ph-BIMe. Возможность окислительного присоединения определяется лигандным окружением атома палладия. Этот процес идет на второй стадии каталитического цикла, но невыгоден на третьей. Таким образом, соотношение продуктов деградации должно зависеть от времени реакции и меняться от преобладания в реакционной смеси соединения H-BIMe до преимущественного содержания Ph-BIMe.
ЗАКЛЮЧЕНИЕ
Исследование процессов трансформации каталитической системы Pd/NHC в условиях реакции Мизороки–Хека показало, что реакции Ph-NHC и H-NHC сочетания, протекают на трех из шести стадий каталитического цикла и приводят к образованию “безлигандных” соединений палладия. Процесс Ph-NHC конкурирует с целевым превращением на стадиях лигандного обмена и внедрения метилакрилата по связи Pd–Ph. Энергии активации и, соответственно, скорости целевой и побочной реакций имеют близкие значения. Реакция H-NHC сочетания конкурирует со стадией лигандного обмена замещенного олефина на молекулу основания, причем побочный процесс имеет значительно более низкий потенциальный барьер. На данной стадии реакции Мизороки–Хека каталитическая система полностью превращается в “безлигандную” форму. Наличие продуктов деградации комплексов Pd/NHC в реакционной системе было подтверждено методами ЯМР и ИЭР-МС.
Список литературы
Cazin C.S.J. N-Heterocyclic carbenes in transition metalcatalysis and organocatalysis. Springer Science & Business Media, 2010. 336 p. https://doi.org/10.1007/978-90-481-2866-2.
Темкин О.Н. “Золотой век” гомогенно-каталитической химии алкинов: димеризация и олигомеризация алкинов // Кинетика и катализ. 2019. Т. 60. № 6. С. 683. https://doi.org/10.1134/S0453881119060157
Díez-González S., Nolan S.P. Stereoelectronic parameters associated with N-heterocyclic carbene (NHC) ligands: a quest for understanding // Coord. Chem. Rev. 2007. V. 251. P. 874. https://doi.org/10.1016/j.ccr.2006.10.004
Jacobsen H., Correa A., Poater A., Costabile C., Cavallo L. Understanding the M-(NHC) (NHC = N-heterocyclic carbene) bond // Coord. Chem. Rev. 2009. V. 253. P. 687. https://doi.org/10.1016/j.ccr.2008.06.006
Van Leeuwen P.W. Decomposition pathways of homogeneous catalysts // Appl. Catal. A: Gen. 2001. V. 212. P. 61. https://doi.org/10.1016/S0926-860X(00)00844-9
Magill A.M., Yates B.F., Cavell K.J., Skelton B.W., White A.H. Synthesis of N-heterocyclic carbene palladium (II) bis-phosphine complexes and their decomposition in the presence of aryl halides // Dalton Trans. 2007. V. 31. P. 3398. https://doi.org/10.1039/B706053J
Курохтина А.А., Ларина Е.В., Лагода Н.А., Шмидт А.Ф. Роль процессов формирования–дезактивации катализатора и свидетельства нелинейного механизма в реакции Мицороки–Хека с арилхлоридами // Кинетика и катализ. 2022. Т. 63. № 5. С. 614–627. https://doi.org/10.31857/S0453881122050070
Ларина Е.В., Курохтина А.А., Лагода Н.А., Шмидт А.Ф. Влияние добавок солей и фосфинов на состав активных комплексов палладия в реакции Мицороки–Хека с ангидридами ароматических кислот // Кинетика и катализ. 2022. Т. 63. № 2. С. 234. https://doi.org/10.31857/S0453881122020058
Eremin D.B., Boiko D.A., Kostyukovich A.Yu., Burykina J.V., Denisova E.A., Anania M., Martens J., Berden G., Oomens J., Roithová J., Ananikov V.P. Mechanistic study of Pd/NHC-catalyzed sonogashira reaction: discovery of NHC-ethynyl coupling process // Chem. Eur. J. 2020. V. 26. P. 15672. https://doi.org/10.1002/chem.202003533
Denisova E.A., Eremin D.B., Gordeev E.G., Tsedilin A.M., Ananikov V.P. Addressing reversibility of R-NHC coupling on palladium: is nano-to-molecular transition possible for the Pd/NHC System? // Inorg. Chem. 2019. V. 58. P. 12218. https://doi.org/10.1021/acs.inorgchem.9b01630
Chernyshev V.M., Khazipov O.V., Shevchenko M.A., Chernenko A.Y., Astakhov A.V., Eremin D.B., Pasyukov D.V., Kashin A.S., Ananikov V.P. Revealing the unusual role of bases in activation/deactivation of catalytic systems: O-NHC coupling in M/NHC catalysis // Chem. Sci. 2018. V. 9. P. 5564. https://doi.org/10.1039/C8SC01353E
Gaussian 16, Revision C.01, Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Scalmani G., Barone V., Petersson G.A., Nakatsuji H., Li X., Caricato M., Marenich A.V., Bloino J., Janesko B.G., et al., Fox, D.J. Gaussian, Inc., Wallingford CT, 2016.
Adamo C., Barone V. Toward reliable density functional methods without adjustable parameters: The PBE0 model // J. Chem. Phys. 1999. V. 110. P. 6158. https://doi.org/10.1063/1.478522
Weigend F., Ahlrichs R. Balanced basis sets of split valence, triple zeta valence and quadruple zeta valence quality for H to Rn: Design and assessment of accuracy // Phys. Chem. Chem. Phys. 2005. V. 7. P. 3297. https://doi.org/10.1039/B508541A
Grimme S., Ehrlich S., Goerigk L. Effect of the damping function in dispersion corrected density functional theory // J. Comput. Chem. 2011. V. 32. P. 1456. https://doi.org/10.1002/jcc.21759
Scalmani G., Frisch M.J. Continuous surface charge polarizable continuum models of solvation. I. General formalism // J. Chem. Phys. 2010. V. 132. P. 114110. https://doi.org/10.1063/1.3359469
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ