Кинетика и катализ, 2023, T. 64, № 1, стр. 39-52
Особенности действия нанесенных палладиевых катализаторов в реакции Сузуки–Мияуры
А. Ф. Шмидт a, *, А. А. Курохтина a, Е. В. Ларина a, Н. А. Лагода a, Д. А. Явсин b, С. А. Гуревич b, В. М. Зеликман c, И. Н. Кротова c, Т. Н. Ростовщикова c, И. Г. Тарханова c
a ФГБОУ ВО Иркутский государственный университет, химический факультет
664033 Иркутск, ул. К. Маркса, 1, Россия
b Физико-технический институт им. А.Ф. Иоффе РАН
194021 Санкт-Петербург, Политехническая ул., 26, Россия
c Московский государственный университет им. М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1/3, Россия
* E-mail: aschmidt@chem.isu.ru
Поступила в редакцию 06.09.2022
После доработки 26.09.2022
Принята к публикации 27.09.2022
- EDN: KIVFHL
- DOI: 10.31857/S0453881123010082
Аннотация
Представлены результаты исследования реакции Сузуки–Мияуры с арилбромидами в присутствии ряда палладиевых предшественников катализатора разной природы (${\text{PdCl}}_{4}^{{2 - }}$ и Pd0), нанесенных химическим путем и лазерным электродиспергированием палладия на гетерогенные носители двух типов: модифицированный ионной жидкостью SiO2 и γ-Al2O3. Эксперименты проведены в так называемых “безлигандных” условиях, т.е. без использования добавок фосфиновых, аминовых, карбеновых или иных стабилизирующих палладий органических лигандов. Установлен значимый вклад гетерогенного механизма катализа в общую конверсию субстратов.
ВВЕДЕНИЕ
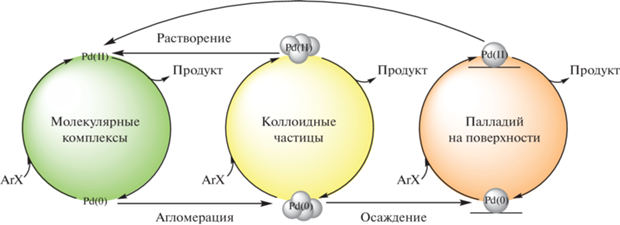
Получение замещенных биарилов путем перекрестного сочетания арилгалогенидов и арилборных производных, известное под названием реакции Сузуки–Мияуры [1, 2], представляет высокий интерес с точки зрения решения задач тонкого органического синтеза. На сегодняшний день эта реакция является (но не ограничивается) одной из обязательных стадий производства широкого спектра фармацевтических и биологически активных препаратов, жидких кристаллов, люминесцентных материалов [3–5], поскольку характеризуется не только возможностью использования широкого набора субстратов с различными функциональными группами в относительно мягких условиях, но также высокой селективностью по целевому продукту с одновременной толерантностью к примесям в исходных компонентах. Как и для любого каталитического процесса, необходимое условие развития его потенциала для практического применения – знание фундаментальных основ процессов, реализующихся в каталитической системе при протекании реакции. Только в таком случае появляется возможность рационального управления процессами с участием катализатора, в том числе лежащими за пределами основного каталитического цикла образования продукта, но при этом оказывающими ключевое влияние на эффективность катализа. Одним из центральных вопросов механизма любой каталитической реакции является надежное установление факта ее протекания с участием молекулярных соединений катализатора в растворе по механизму гомогенного катализа или на поверхности частиц гетерогенного катализатора, используемых в качестве предшественника или формирующихся в реакционной системе под действием веществ-участников реакции. Для реакции Сузуки–Мияуры вопрос различения гомогенного и гетерогенного механизмов катализа в течение двух десятилетий был одним из наиболее активно дискутируемых в литературе (см, например, обзорные работы [6–9]). Причиной прямо противоположных выводов о механизме катализа реакции истинно растворенными или, напротив, гетерогенными (включая наноразмерные) частицами палладия являлось многократно установленное одновременное сосуществование и взаимное динамическое превращение в ходе каталитического процесса этих форм катализатора вне зависимости от природы используемого предшественника (схема 1 ), приводящее к неоднозначности интерпретации экспериментальных результатов.
Схема 1 . Взаимные превращения различных форм палладия в каталитических системах реакции Сузуки–Мияуры.
В результате накопления и обобщения большого количества экспериментальных данных в этой области несколькими исследовательскими группами в последние годы наиболее популярной и широко принятой стала точка зрения о так называемом “коктейльном” типе катализа [10]. Суть этой концепции заключается в том, что в результате проведения реакции в тех или иных конкретных условиях каталитическую активность в превращении одних и тех же типов субстратов в реакции Сузуки–Мияуры способны проявлять различные типы палладиевых частиц – растворенные молекулярные комплексы, наноразмерные и более крупные агрегаты палладия. Таким образом, самой корректной является формулировка об относительном вкладе той или иной формы катализатора в конверсию субстрата в определенных условиях проведения процесса. Тем не менее, несмотря на, очевидно, невозможность сделать общий вывод о природе наиболее активных соединений в реакции Сузуки–Мияуры, установление частных закономерностей для конкретного типа каталитических и субстратных систем представляет собой актуальную научную задачу, поскольку знание этих закономерностей является необходимым для рационального поиска оптимальных условий в целях практического применения этих систем в получении синтетически важных продуктов. В настоящей работе изучен характер катализа реакции Сузуки–Мияуры с использованием пары арилбромидов в качестве конкурирующих субстратов и нанесенных гетерогенных палладиевых предшественников катализатора трех типов, отличающихся методом нанесения активного компонента, природой подложки, состоянием и способом закрепления палладия на носителе. Исследования проводили в так называемых “безлигандных” каталитических условиях, не предполагающих присутствия в реакционных системах добавок дорогостоящих, зачастую токсичных, а также чувствительных к влаге и кислороду воздуха [3, 8] сильных донорных органических лигандов (фосфинов, аминов, карбенов и т.д.). Отказ от их применения в пользу “безлигандного” варианта каталитического процесса предпочтителен с экономической и экологической позиций.
Катализаторы на силикагеле Pd/SiO2 синтезировали путем закрепления хлоридных анионных комплексов палладия, связанных с привитым к поверхности носителя имидазольным катионом. Такие композиции получили название SILC – supported ionic liquid catalyst [11]. Согласно литературным данным, этот метод иммобилизации активных центров с использованием ионных жидкостей дает возможность достигать высокой однородности каталитических центров, являющейся ключевым фактором высокой селективности молекулярных катализаторов [12].
Нанесение Pd на γ-Al2O3 осуществляли двумя способами: классическим методом пропитки с последующим восстановлением, а также с применением техники лазерного электродиспергирования (ЛЭД) [13]. Этот метод основан на плавлении металлической мишени под действием лазерного излучения и каскадном делении заряженных капель металла. Осаждение сформированных в плазме лазерного факела наночастиц металла на поверхность носителя позволяет формировать так называемые “корочковые” катализаторы. Данная техника обладает рядом преимуществ в сравнении с синтезом гетерогенных катализаторов с использованием стандартных химических методов, таких как пропитка, ионный обмен, осаждение из коллоидных дисперсий, поскольку дает возможность получать каталитические покрытия с высокой степенью заполнения поверхности отдельными частицами металлов строго фиксированного размера. Как показано на большом количестве примеров [13–15], такие катализаторы с низким содержанием (<10–2 мас. %) металлов по своей активности превосходят химически синтезированные аналоги со значительно бóльшим их содержанием. Катализаторы на основе наночастиц палладия на углеродном носителе Сибуните и оксиде алюминия обладали не только повышенной активностью, но и улучшенной стабильностью в реакциях с участием хлорбензола [16, 17].
Выбранные катализаторы являются представителями гетерогенных систем с разными типами закрепления и распределения активной фазы на поверхности носителя, что приводит к кардинальному различию электронного состояния палладия. Можно было ожидать, что в катализаторах Pd/SiO2 палладий стабилизируется в форме анионного комплекса ${\text{PdCl}}_{4}^{{2 - }}$, слабо взаимодействующего с носителем, в то время как в образцах Pd/Al2O3 присутствует в основном металлический палладий Pd0, распределенный в виде наночастиц по поверхности или в объеме носителя. Дисперсность частиц и степень металл-оксидного взаимодействия зависят от метода введения палладия. В связи с этим целью работы являлся анализ влияния этих факторов на поведение палладиевых катализаторов в реакции Сузуки–Мияуры, проводимой в “безлигандных” условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализаторов
Для всех синтезированных катализаторов цифра в обозначении образца соответствует содержанию палладия (мас. %).
Синтез катализаторов Pd/SiO2 на основе хлорида палладия. Модифицирование поверхности носителя Perlkat-97-0 SilicaGel осуществляли по методике, описанной в работах [18, 19]. Силикагель модифицировали 3-хлорпропилтриметоксисиланом, затем вводили в реакцию с N-этилимидазолом. Для этого смесь нагревали в запаянной ампуле при 180°C в течение 12 ч. Полученный образец отмывали от избытка имидазола и помещали в ацетонитрил (10 г на 50 мл). Хлорид палладия (0.5 г) растворяли в 100 мл ацетона (растворение проводили в течение 24 ч при небольшом нагревании) и смешивали с приготовленной ранее суспензией. Смесь упаривали при перемешивании при 45–50°С в течение нескольких часов, оставшийся раствор декантировали, а образовавшиеся гранулы светло-желтого цвета промывали ацетоном и сушили на воздухе. По данным атомно-абсорбционной спектроскопии (ААС) содержание Pd в образце (обозначен как 2.3Pd/SiO2) составило 2.3 мас. %, а N и Cl по данным элементного анализа – 4.1 и 3.3 мас. % соответственно.
Синтез катализаторов Pd/Al2O3 на основе наночастиц Pd. Метод ЛЭД. Образец 0.03Pd/Al2O3 готовили нанесением дозированного количества палладия на поверхность оксида алюминия методом ЛЭД под действием излучения импульсного YAG:Nd-лазера (длина волны – 1.06 мкм, длительность импульса – 30 нс, энергия в импульсе – 120 мДж). Метод подробно описан в работах [20, 21]. Использовали гранулы γ- Al2O3 (АОК-63-11, марка В) диаметром 0.4–1 мм. Нанесение проводили в ультразвуковой полиэтиленовой кювете при интенсивном перемешивании. Время нанесения (4 мин) выбирали на основании найденной ранее удельной скорости нанесения Pd – 3.9 мкг/см2 мин [21]. Были получены гранулы темно-серого цвета.
Химический синтез катализаторов Pd/Al2O3. Образцы 0.1Pd/Al2O3 и 0.05Pd/Al2O3 готовили пропиткой γ-Al2O3 рассчитанным количеством раствора Pd(NO3)2 по методике, подобной [22], прокаливали 3 ч при 300°С на воздухе и затем восстанавливали водородом 2 ч при 400°С. Были получены гранулы серого цвета.
Характеристики катализаторов
Количество металла в катализаторах контролировали методом ААС на спектрометре ThermoiCE 3000 (“Thermo Fisher Scientific Inc.”, США). Данные приведены в табл. 1.
Таблица 1.
Текстурные характеристики исходных и Pd-модифицированных носителей
| Образец | Метод синтеза | Удельная площадь поверхности, м2/г | Объем пор, см3/г | Размер пор, нм |
|---|---|---|---|---|
| SiO2 | – | 300 | 0.75 | 10 |
| 2.3Pd/SiO2 | Иммобилизация с использованием ИЖ | 224 | 0.49 | 9.4 |
| Al2O3 | – | 167 | 0.55 | 10.3 |
| 0.03Pd/Al2O3 | ЛЭД | 184 | 0.53 | 10.7 |
| 0.1Pd/Al2O3 | Пропитка | 158 | 0.52 | 10.7 |
| 0.05Pd/Al2O3 | Пропитка | Не определяли | – | – |
Микрофотографии просвечивающей электронной спектроскопии (ПЭМ) сделаны с применением прибора JEM2100F/UHR (“JEOL Ltd.”, Япония) с разрешением 0.2 нм при ускоряющем напряжении 200 кВ, размер пучка в сканирующем режиме – 1 нм. Идентификацию частиц проводили с помощью энергодисперсионного анализа (ЭДА) на приборе JED-2300, входящем в комплектацию микроскопа. Катализаторы на крупных гранулах SiO2 предварительно измельчали, гранулы Al2O3 использовали без предварительного измельчения. После обработки образца в этаноле в ультразвуковой ванне ВУ-09-“Я-ФП”-03 (Россия) каплю смеси помещали на медную сетку ПЭМ, покрытую углеродом, и сушили 1 ч на воздухе при комнатной температуре.
Текстурные характеристики исходных и Pd-модифицированных носителей определяли методом низкотемпературной адсорбции азота на анализаторе Autosorb-1 sorptionanalyzer (“Quantachrome”, США). Удельный объем находили при относительном давлении P/P0 = 0.995. Значения удельной площади поверхности, объема и размера пор рассчитывали с помощью встроенного программного обеспечения с использованием методов BET, V-t и BJH.
Анализ образцов методом рентгеновской фотоэлектронной спектроскопии (РФЭС) осуществляли на спектрометре AxisUltraDLD (“Kratos Analytical”, Великобритания) с энергией пропускания 160 и 40 эВ. Калибровку проводили по энергии связи С1s (284.8 эВ) спектров.
Температурно-программированное восстановление водородом (ТПВ-Н2) выполняли на анализаторе хемосорбции УСГА-101 (ООО “Унисит”, Россия), пропуская через кварцевый реактор, содержащий 50 мг невосстановленного предшественника катализатора, смесь 5% H2/Ar (30 мл/мин) при нагревании от 30 до 800°С со скоростью 10°С/мин. Изменение состава газовой смеси во время анализа фиксировали с помощью детектора по теплопроводности. С целью количественного анализа данных о поглощении/выделении водорода сигнал детектора предварительно калибровали в ходе ТПВ-Н2 стандартного образца NiO.
Каталитические эксперименты
В конкурентной реакции Сузуки–Мияуры с арилбромидами конкурирующие 4-бромацетофенон и бромбензол (по 5 ммоль каждого) и нафталин в качестве внутреннего стандарта для хроматографии (1 ммоль) растворяли при комнатной температуре в 5 мл ДМФА. Полученный раствор вводили в стеклянный реактор, снабженный резиновой мембраной и магнитным мешальником, содержащий фенилборную кислоту (5 ммоль), ацетат натрия в качестве основания (6.5 ммоль) и палладиевый предшественник катализатора (0.08–8 мкмоль палладия). Начинали реакцию, помещая реактор в предварительно нагретую до 140°С масляную баню при перемешивании (477.5 об/мин). Пробы реакционной смеси для хроматографического анализа периодически отбирали из реактора с помощью шприца с металлической иглой.
Продолжительность каталитических реакций составляла 6–8 ч. Суммарный выход продуктов конкурирующих реакций варьировался от 20 до 75% от теоретически возможного (суммарное число оборотов катализатора (моль продукта/моль палладия) было равно 440–4500 в зависимости от природы палладиевого предшественника катализатора и его загрузки).
Материальный баланс рассчитывали в каждой пробе реакционной смеси с учетом количества израсходовавшихся арилгалогенидов и образовавшихся в результате реакции биарилов. Отклонения от теоретического значения не превышали 5%. Расчет материального баланса позволял сделать однозначное заключение о том, что в реакции с применением незамещенного бромбензола и фенилборной кислоты дифенил образуется исключительно в результате их перекрестного сочетания (исключая образование дифенила в реакции окислительного гомосочетания фенилборной кислоты или восстановительного гомосочетания бромбензола). Все эксперименты проводили без использования инертной атмосферы. Пробы реакционной смеси анализировали на газожидкостном хроматографе Кристалл 5000 (“Хроматэк”, Россия, ДИП, колонка HP-5 15 м) и хромато-масс-спектрометре GCMS-QP2010 Ultra (“Shimadzu”, Япония) с ионизацией электронным ударом (энергия ионизации − 70 эВ, колонка GsBP-5MS размером 0.25 мкм × 0.25 мм × 30 м, газ-носитель − гелий) с программированным нагревом от 100 до 250°С. Полученные масс-спектры сравнивали с библиотечными (библиотеки сравнения Wiley, NIST, NIST05). Количественный состав проб вычисляли методом внутреннего стандарта (внутренний стандарт − нафталин) с применением калибровки по аутентичным образцам.
Математическую обработку кинетических данных, построение аппроксимирующих зависимостей (фазовых траекторий) и регрессионный анализ получаемых данных осуществляли с помощью средств программы “Microsoft Excel 2007” [23].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Структура катализаторов
Текстурные характеристики образцов приведены в табл. 1. Видно, что модифицирование силикагеля приводит к заметному уменьшению удельной площади поверхности, объема и диаметра пор. Величина изменения диаметра пор свидетельствует о формировании мономолекулярного слоя Pd-содержащей ионной жидкости (ИЖ) на поверхности носителя. Напротив, при нанесении палладия на оксид алюминия с использованием метода ЛЭД и химическим путем текстурные характеристики носителя меняются менее значительно. Это связано с высокой дисперсностью частиц палладия, как было показано ранее для модифицированных наночастицами Pd и Pt оксида алюминия и цеолита ZSM-5 [13, 14, 20].
Типичные микрофотографии ПЭМ 2.3Pd/SiO2 приведены на рис. 1 вместе со спектрами ЭДА выделенных областей. Видно, что палладий присутствует на всех выбранных фрагментах изображений. На рис. 1в фотография образца представлена вместе с картами распределения хлора и палладия, их соотношение приведено в табл. 2. Из полученных данных следует, что распределение палладия в катализаторе равномерно, однако выделить области преимущественного заполнения палладием, а также зафиксировать четкие изображения объектов, соответствующих металлическим частицам, не удается. Это может быть связано как с малым размером частиц палладия (<1 нм), так и с его стабилизацией в ионной форме.
Рис. 1.
Изображения ПЭМ образцов 2.3Pd/SiO2 (а), спектры ЭДА (б) и карты распределения элементов (в).
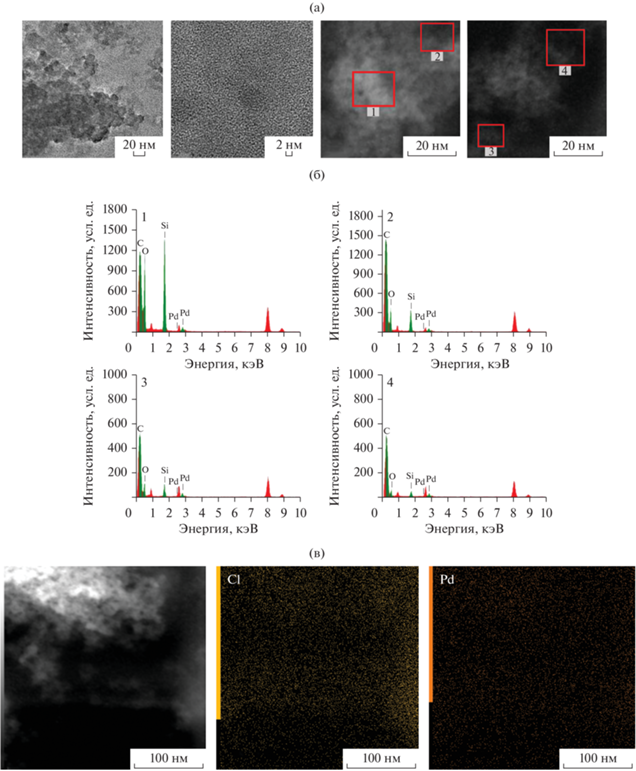
Таблица 2.
Доля основных элементов и атомов палладия в разных степенях окисления на поверхности образцов по данным РФЭС
| Образец | Доля основных элементов, ат. % | ν(Pd), % (Есв, эВ) | ||||
|---|---|---|---|---|---|---|
| Pd | Si | Al | Pd0 (335.5) | PdO (336.7) | Pd2+ (338.4) | |
| 2.3Pd/SiO2 | 0.4 | 28.2 | Отс. | 58 | 9 | 33 |
| 0.03Pd/Al2O3 | 19.7 | Отс. | 3.1 | 94 | – | 6 |
| 0.1Pd/Al2O3 | 0.1 | Отс. | 29.9 | 100 | – | – |
Иная картина наблюдается для образцов Pd/Al2O3 (рис. 2). По четко видным темным участкам на фоне игольчатой структуры оксида алюминия можно заключить, что в химически синтезированном образце 0.1Pd/Al2O3 (рис. 2а) палладий заполняет каналы практически по всему объему гранул носителя. Спектры ЭДА и фотографии ПЭМ высокого разрешения оказались неинформативны в виду низкого содержания Pd и его распределения в объеме Al2O3. На основании полученных снимков можно лишь оценить размер частиц палладия от 2 до 10 нм, что примерно сопоставимо с диаметром пор оксида алюминия. Это соответствует диапазону распределения частиц по размерам от 1 до 14 нм в сходных катализаторах Pd/Al2O3, синтезированных химическим путем в разных условиях [24, 25].
В образце 0.03Pd/Al2O3 (рис. 2б) характер распределения частиц другой. Высокодисперсные частицы палладия практически полностью заполняют внешнюю поверхность носителя, однако из-за сильного перекрывания изображений отдельных частиц строго определить их размер не удается. Наночастицы палладия, нанесенные методом ЛЭД на оксид алюминия и другие носители, многократно описаны в работах [13, 16, 17, 20, 21]. Во всех случаях независимо от степени заполнения поверхности и природы носителя формируются частицы палладия с узким распределением по размерам от 1.5 до 2.5 нм, средний размер частиц составляет 1.7 нм [20].
На поверхности образца 0.03Pd/Al2O3 атомное соотношение Pd : Al по данным ЭДА оказалось близко к 1. Столь высокое содержание палладия объясняется, прежде всего, использованием метода ЛЭД для его введения, а также с особенностями предподготовки образцов для регистрации ПЭМ-изображений. При их обработке ультразвуком в первую очередь отделяются “чешуйки” с внешней поверхности образцов, которые попадают преимущественно на сетки для регистрации ПЭМ-изображений. В образцах 2.3Pd/SiO2 соотношение Pd : Si на порядок ниже и составляет всего 0.11, поскольку в этом случае палладий равномерно заполняет весь объем образца, включая поровое пространство. А в химически синтезированном образце 0.1Pd/Al2O3 количество палладия, по данным ЭДА, ниже предела чувствительности метода и несоизмеримо с содержанием алюминия.
Разное содержание Pd на поверхности образцов подтверждают также данные РФЭС о составе поверхности, приведенные в табл. 2. Помимо указанных элементов в обзорных спектрах наблюдали линии кислорода, углерода, а также азота (3%) и хлора (2%) для образца 2.3Pd/SiO2. Соотношение Pd : Al, по результатам РФЭС, для катализатора 0.03Pd/Al2O3 оказалось значительно выше значения, полученного методом ЭДА ПЭМ, и составило 6.4. В то же время соотношение Pd : Si на поверхности 2.3Pd/SiO2, по данным РФЭС, значительно ниже. Это связано с особенностями распределения палладия на поверхности или в объеме носителей и разными областями анализа, доступными для этих методов.
На рис. 3 приведены Pd3d-спектры катализаторов. Для определения электронного состояния палладия спектры разложены на компоненты, при разложении учитывали компоненты с энергиями связи Pd3d5/2 равными 335.5 и 336.7 эВ, отвечающими металлическому палладию и оксиду палладия PdO [26]. Кроме этого, использовали дублет с энергией связи компоненты Pd3d5/2 около 338.4 эВ, который можно отнести к палладию в составе Pd(OH)2 или к катионам Pd2+, координированным с кислородом носителя. Результаты разложения спектров Pd3d представлены на рис. 3, а доли атомов Pd в различных состояниях указаны в табл. 2. Наблюдаемые энергии связи Pd3d5/2-компоненты металлического палладия (335.5 эВ) несколько больше, чем в объемном металлическом палладии (335.1 эВ). Это может быть обусловлено как размером частиц, так и их взаимодействием с адсорбированными молекулами и носителем. В образцах 2.3Pd/SiO2 и 0.03Pd/Al2O3 помимо металлического состояния присутствуют окисленные формы палладия, однако их содержание в образце ЛЭД очень незначительно. В спектре Pd3d5/2 образца 0.1Pd/Al2O3 обнаружен только малоинтенсивный сигнал с величиной Есв = 335.5 эВ, отнесенный к металлическому палладию. Как известно из литературных данных [24, 25], полное восстановление PdO в нанесенных катализаторах протекает при T < 400°С, что ниже температуры, использованной в работе.
Образец 2.3Pd/SiO2 отличается по данным РФЭС от катализаторов на оксиде алюминия присутствием в его составе значительной доли окисленного палладия и отсутствием четких изображений металлических наночастиц на изображениях ПЭМ, поэтому он был дополнительно исследован методом ТПВ-Н2. Из рис. 4 видно, что поглощение водорода, связанное с восстановлением палладия, наблюдается в узком и достаточно низкотемпературном интервале (<150°С). В нанесенных катализаторах Pd/Al2O3 восстановление частиц палладия протекает при более высокой температуре 180–320°С в зависимости от их размера и характера взаимодействия с носителем [22, 24, 25]. Следует отметить, что узкий температурный интервал свидетельствует об однородном составе активных центров – хлоридных комплексов, а низкое значение температуры восстановления говорит об их слабом взаимодействии с поверхностью носителя, поскольку связь осуществляется через алкилимидазольные линкеры [27].
Количественный анализ полученных данных показал, что поглощение водорода в области температур <150°C составило 205 мкмоль/г, что в точности совпадает с содержанием палладия в образце. Скорее всего, высокое содержание Pd0 на поверхности 2.3Pd/SiO2 по данным РФЭС обусловлено достаточно легким восстановлением Pd2+ с участием N-содержащих лигандов в условиях регистрации спектров.
Синтезированные и охарактеризованные гетерогенные предшественники катализатора использованы нами для различения гипотез о возможном характере катализа реакции Сузуки–Мияуры с арилбромидами – истинно гомогенном с участием молекулярных комплексов палладия, формирование которых в условиях реакции происходит в результате перехода палладия в жидкую фазу с поверхности таких предшественников [6–10], либо гетерогенном, включая катализ соединениями палладия, присутствующими непосредственно на поверхности предшественников или образующимися в результате растворения с последующей агломерацией с образованием наноразмерных и более крупных агрегатов палладия [6–10]. В качестве инструмента, позволяющего надежно различить случаи катализа в растворе или на поверхности металла, применяли метод сравнительного анализа закономерностей дифференциальной селективности (ДС) каталитической реакции, использующий так называемые фазовые траектории реакций [28]. Поскольку ДС, в отличие от каталитической активности, не зависит от количества активного катализатора, а определяется исключительно его природой, изменение величины ДС при варьировании условий проведения реакции является однозначным свидетельством изменения природы соединений-носителей каталитической активности. При этом оптимальным для оценки величины ДС является применение пары однотипных конкурирующих субстратов, отличающихся, например, природой удаленного от реакционного центра заместителя. Такой вариант оценки ДС делает гораздо более обоснованным постулат об одинаковых механизмах образования продуктов конкурентных реакций в сравнении с оценкой селективности по основным и побочным продуктам превращений одного и того же субстрата, механизмы которых могут иметь существенные различия вплоть до участия в этих превращениях разных соединений катализатора [28]. В случае конкурентной реакции с использованием пары конкурирующих субстратов фазовые траектории представляют собой зависимости выходов продуктов конкурирующих реакций друг от друга; тангенс угла наклона касательной к любой точке фазовой траектории равен отношению скоростей накопления этих продуктов, однозначно характеризующему величину ДС [28]. Следовательно, совпадение или, напротив, различие фазовых траекторий реакции при изменении условий ее проведения однозначно свидетельствует о, соответственно, сохранении или изменении величины ДС и, следовательно, природы каталитически активных соединений. Применение подхода, основанного на фазовых траекториях, требует лишь интегральных кинетических данных о значениях концентраций продуктов конкурирующих реакций в различные моменты времени, которые могут быть получены с помощью стандартного оснащения химической лаборатории без применения дорогостоящего специального оборудования, позволяющего находить дифференциальные кинетические зависимости [29].
Большой массив экспериментальных данных, накопленный за годы исследований реакций кросс-сочетания арилгалогенидов и, в частности, реакции Сузуки−Мияуры, позволяет уверенно утверждать, что в случае катализа на гетерогенных частицах палладия варьирование природы исходного палладиевого предшественника катализатора и его количества однозначно скажется на наблюдаемом значении ДС реакции. Поскольку одинаковые значения селективности при непосредственном участии в катализе отличающихся по форме, размеру и/или составу частиц металла крайне маловероятны, такое утверждение является справедливым в случае протекания реакции как непосредственно на частицах катализатора, присутствующих в применяемых предшественниках, так и на поверхности формирующихся in situ гетерогенных (включая наноразмерные) частицах катализатора (вследствие нелинейного характера их формирования [30, 31]). При этом в используемых нами “безлигандных” условиях при варьировании указанных факторов состав гомогенных молекулярных комплексов палладия в растворе, представляющих собой комплексы Pd0 и Pd+2, стабилизированные эндогенными галогенид-ионами, анионами основания и/или молекулами растворителя [8, 32], остается постоянным. Таким образом, при участии в катализе исключительно гомогенных форм палладия величина ДС не будет проявлять чувствительности к природе и количеству палладиевого предшественника катализатора.
Для решения задачи различения гомогенного и гетерогенного механизмов катализа реакции Сузуки–Мияуры нами была проведена серия экспериментов в условиях конкуренции пары арилбромидов (схема 2 ) с применением различных предшественников катализатора – растворимого в условиях реакции дихлорида палладия PdCl2, а также описанных выше нерастворимых гетерогенных 2.3Pd/SiO2, 0.03Pd/Al2O3, 0.05Pd/Al2O3 и 0.1Pd/Al2O3.
Схема 2 . Реакция Сузуки−Мияуры в условиях конкуренции пары арилбромидов.
Как следует из рис. 5, фазовые траектории в координатах концентраций образующихся из конкурирующих бромбензола и 4-бромацетофенона биарилов различались для разных типов предшественников катализатора. В условиях более высоких загрузок предшественников (рис. 5а) фазовые траектории для образцов Pd/Al2O3 были близки, в то время как для образцов 2.3Pd/SiO2 и PdCl2 они отличались как от траекторий, полученных в присутствии Pd/Al2O3, так и между собой. Принципиально 2.3Pd/SiO2 и PdCl2 отличаются от катализаторов на окиси алюминия высокой долей окисленного палладия в исходном предшественнике (в случае дихлорида палладия весь загружаемый в систему палладий является окисленным). Для гетерогенного 2.3Pd/SiO2 это должно приводить к относительно высокой концентрации окисленного палладия в растворе (как и в случае PdCl2) из-за более интенсивного его перехода с поверхности в раствор в сравнении с образцами, содержащими восстановленный палладий. В серии экспериментов с уменьшенными загрузками предшественников (рис. 5б) фазовые траектории реакций оказывались близкими, за исключением таковой для 0.05Pd/Al2O3, в котором, на основании данных [33], можно ожидать стабилизацию палладия в виде кластеров или ионов Pd2+, прочно связанных с носителем. В соответствии с приведенными выше рассуждениями, наблюдаемые закономерности изменения вида фазовой траектории и, соответственно, величины ДС указывают на протекание катализа реакции Сузуки−Мияуры с арилбромидами на поверхности гетерогенных форм палладия. В случае катализа на молекулярных комплексах палладия в растворе ни интенсивность растворения палладия с поверхности катализатора (поскольку ДС не зависит от количества активного катализатора), ни различный размер частиц палладия в составе прекурсора и характер их взаимодействия с поверхностью носителя не способны отразиться на составе молекулярных комплексов, лигандное окружение которых не меняется при использовании гетерогенных прекурсоров, отличающихся природой носителя. Обнаруженные закономерности согласуются с полученными ранее результатами, свидетельствующими об определяющем вкладе гетерогенного механизма катализа с применением нанесенных на различные углеродные носители наноразмерных частиц палладия [34]. Безусловно, наблюдаемая зависимость величины ДС от природы предшественника (рис. 5) не позволяет исключить гипотезу о частичном протекании реакции в растворе с участием формирующихся в условиях реакции растворенных форм металла. Однако можно однозначно утверждать, что вклад гетерогенного катализа в общую конверсию субстратов оказывается значимым и, как минимум, способным оказывать влияние на наблюдаемое значение величины ДС. Учитывая данные об отличающихся текстурных свойствах носителей в используемых гетерогенных предшественниках, в также о различной природе (в том числе размере) палладиевых частиц, находящихся в их составе (рис. 1 и 2, табл. 2), можно предположить, что различные значения ДС могут быть обусловлены протеканием катализа непосредственно на поверхности частиц, находящихся на носителе. Тем не менее, получаемые экспериментальные данные не позволяют различить случаи катализа на поверхности исходных предшественников от катализа на поверхности формирующихся в результате протекающих в реакционной системе процессов так называемых “растворенных” наночастиц (как минимум, такая ситуация реализуется при применении хлорида палладия в качестве прекурсора, когда какая-либо гетерогенная подложка в принципе отсутствует). В любом случае, вывод об участии одной или нескольких гетерогенных форм палладия в катализе реакции Сузуки−Мияуры на основании представленных на рис. 5 экспериментальных данных является однозначным, поскольку наблюдаемые закономерности не могут быть объяснены в приближении исключительно гомогенного механизма катализа на молекулярных комплексах палладия в растворе, природа которых остается неизменной при использовании отличающихся предшественников катализатора.
Рис. 5.
Фазовые траектории реакции Сузуки−Мияуры с фенилборной кислотой (схема 2 ), построенные в координатах концентраций биарилов, образующихся из конкурирующих 4-бромацетофенона и бромбензола, при варьировании природы палладиевого предшественника катализатора при загрузке палладия в системе 0.8 (а) и 0.4 мкмоль (б).

Как следует из рис. 5, в некоторых случаях, например, при применении Pd/Al2O3, полученных различными способами (ЛЭД и химический синтез) и содержащими разное количество палладия, фазовые траектории для различных предшественников оказывались близкими. В принципе, близкие (вплоть до совпадающих) фазовые траектории могут наблюдаться для катализаторов различной природы, что может объясняться невысокой чувствительностью ДС к природе катализатора в совокупности с недостаточной чувствительностью экспериментальных измерений концентраций образующихся в реакции продуктов, используемых для построения фазовых траекторий [28]. Для дополнительного подтверждения формулируемого вывода о различной ДС при варьировании природы палладиевого предшественника проведен линейный регрессионный анализ результатов измерений в приближении псевдопервого порядка реакции по конкурирующим арилбромидам [35]. В этом случае величина ДС, то есть отношение скоростей конкурирующих реакций (тангенс угла наклона касательных к фазовой траектории), будет описываться следующим отношением скоростей двух конкурирующих реакций:
(1)
$\frac{{{{r}_{{{\text{S2}}}}}}}{{{{r}_{{{\text{S1}}}}}}} = \frac{{{{{\text{d[S2]}}} \mathord{\left/ {\vphantom {{{\text{d[S2]}}} {{\text{d}}t}}} \right. \kern-0em} {{\text{d}}t}}}}{{{{{\text{d[S1]}}} \mathord{\left/ {\vphantom {{{\text{d[S1]}}} {{\text{d}}t}}} \right. \kern-0em} {{\text{d}}t}}}} = \frac{{{{k}_{2}}[{{{\text{X}}}_{{{\text{com}}}}}{\text{][S2}}]}}{{{{k}_{1}}[{{{\text{X}}}_{{{\text{com}}}}}{\text{][S}}1]}} = \frac{{{{k}_{2}}}}{{{{k}_{1}}}}\frac{{[{\text{S2}}]}}{{{\text{[S1]}}}},$Интегрирование дифференциального уравнения (1) приводит к уравнению (2):
(2)
$\ln \left( {\frac{{{\text{[S2]}}}}{{{{{{\text{[S2]}}}}_{{\text{0}}}}}}} \right) = \frac{{{{k}_{2}}}}{{{{k}_{1}}}}{\kern 1pt} \ln \left( {\frac{{{\text{[S1]}}}}{{{{{{\text{[S1]}}}}_{{\text{0}}}}}}} \right),$Соответственно, интегральная зависимость [S1] от [S2] будет выглядеть следующим образом:
(3)
$[{\text{S}}1] = \frac{{{{{{\text{[S1]}}}}_{{\text{0}}}}}}{{{{{({{{[{\text{S}}2]}}_{0}})}}^{{{{k}_{{{\text{rel}}}}}}}}}} \times {{[{\text{S}}2]}^{{{{k}_{{{\text{rel}}}}}}}},$В том случае, если арилбромиды S1 и S2 превращаются в продукты P1 и P2 соответственно (в нашем случае – биарилы, схема 2 ), то концентрации этих продуктов могут быть выражены следующим образом:
Тогда интегральная зависимость [P1] от [P2], т.е. фазовая траектория реакции, будет описываться уравнением следующего вида:
(4)
$[{\text{P}}1] = {{[{\text{S}}1]}_{0}} - \frac{{{{{[{\text{S1}}]}}_{0}}}}{{{{{({{{[{\text{S}}2]}}_{0}})}}^{{{{k}_{{{\text{rel}}}}}}}}}}{{\left( {{{{[{\text{S}}2]}}_{0}} - [{\text{P}}2]} \right)}^{{{{k}_{{{\text{rel}}}}}}}}.$Линеаризация уравнения (4) путем логарифмирования приводит к следующему выражению:
(5)
$\ln \left( {\frac{{({{{[{\text{S}}1]}}_{0}} - [{\text{P}}1])}}{{{{{[{\text{S}}1]}}_{0}}}}} \right) = {{k}_{{{\text{rel}}}}}{\kern 1pt} \ln \left( {\frac{{({{{[{\text{S}}2]}}_{0}} - [{\text{P}}2])}}{{{{{{\text{[S2]}}}}_{{\text{0}}}}}}} \right).$Уравнение (5) применяли для оценки значений относительных реакционных способностей конкурирующих арилбромидов (krel) с помощью стандартного регрессионного анализа с использованием 95% уровня надежности (программа Microsoft Excel 2007, Solver Add-in, инструмент “Анализ данных”).
Полученные в результате регрессионного анализа величины доверительных интервалов относительных реакционных способностей конкурирующих арилбромидов не совпадали в экспериментах с различными предшественниками катализатора (рис. 6). Кроме того, результаты дополнительных экспериментов с различными загрузками палладия в реакционную систему для растворимого PdCl2 и нанесенных гетерогенных 2.3Pd/SiO2, 0.03Pd/Al2O3, 0.1Pd/Al2O3 и 0.05Pd/Al2O3 однозначно указывали на зависимость величины ДС (несовпадение доверительных интервалов krel) и от количества используемого предшественника (рис. 6). Зависимость ДС от загрузки гетерогенного катализатора позволяет, как минимум, сделать вывод о существенном влиянии процессов перехода палладия в раствор на свойства формирующегося in situ активного гетерогенного катализатора. Сформировавшиеся после перехода палладия в раствор гетерогенные наноразмерные частицы могут оставаться в жидкой фазе или осаждаться на поверхность гетерогенных подложек (в случае их присутствия в системе). Именно нелинейный характер образования наночастиц палладия из истинно растворенных соединений обеспечивает зависимость их размера и/или формы от количества растворенного палладия, которое, несомненно, будет меняться при варьировании количества загружаемого предшественника катализатора [31]. В случае катализа на частицах палладия, находящихся на поверхности используемых предшественников и не подвергающихся растворению с повторным осаждением, ДС должна совпадать в экспериментах с различной загрузкой одного и того предшественника, поскольку, как уже упоминалось, ее величина не зависит от количества каталитически активной формы.
Рис. 6.
Относительные реакционные способности (krel, уравнение (5)) 4-бромацетофенона и бромбензола (S1 и S2 в уравнении (5) соответственно) в конкурентной реакции Сузуки−Мияуры с фенилборной кислотой (схема 2 ) при варьировании природы и загрузки предшественника катализатора: PdCl2 (1), 2.3Pd/SiO2 (2), 0.03Pd/Al2O3 (3), 0.1Pd/Al2O3 (4), 0.05Pd/Al2O3 (5).

ЗАКЛЮЧЕНИЕ
Приведенные в работе данные о различной величине ДС по конкурирующим арилбромидам в так называемых “безлигандных” условиях реакции Сузуки–Мияуры при использовании различных типов предшественников катализатора – растворимого и набора отличающихся по текстурным свойствам и природе находящихся на их поверхности частиц палладия нерастворимых гетерогенных – однозначно указывают на значимый вклад гетерогенного механизма катализа в общую конверсию субстратов. При этом катализ может осуществляться как на поверхности исходных гетерогенных предшественников, так и на формирующихся в результате растворения и последующей агломерации наноразмерных и более крупных частицах палладия, находящихся в растворе и/или на поверхности гетерогенного предшественника катализатора.
Список литературы
Suzuki A. // Angew. Chem. Int. Ed. 2011. V. 50. P. 6722.
Miyaura N. // J. Organomet. Chem. 2002. V. 653. P. 54.
Beletskaya I.P., Alonso F., Tyurin V. // Coord. Chem. Rev. V. 385. P. 137.
Pagett A.B., Lloyd-Jones G.C. // Org. React. 2019. V. 100. P. 547.
Taheri Kal Koshvandi A., Heravi M.M., Momeni T. // Appl. Organomet. Chem. 2018. V. 32. Article № e4210.
Phan N.T.S., van der Sluys M., Jones C.W. // Adv. Synth. Catal. V. 348. P. 609.
Шмидт А.Ф., Курохтина А.А. // Кинетика и катализ. 2012. Т. 53. № 6. С. 760.
Biffis A., Centomo P., del Zotto A., Zecca M. // Chem. Rev. 2018. V. 118. P. 2249.
Bourouina A., Meille V., de Bellefon C. // Catalysts. 2019. V. 9. P. 60.
Ananikov V.P., Beletskaya I.P. // Organometallics. 2012. V. 31. P. 1595.
Bartlewicz O., Dąbek I., Szymańska A., Maciejewski H. // Catalysts. 2020. V. 10. № 11. P. 1227.
Романовский Б.В., Тарханова И.Г. // Успехи химии. 2017. Т. 86. № 5. С. 444.
Ростовщикова Т.Н., Локтева Е.С., Шилина М.И., Голубина Е.В., Маслаков К.И., Кротова И.Н., Брыжин А.А., Тарханова И.Г., Удалова О.В., Кожевин В.М., Явсин Д.А., Гуревич С.А. // Жур. Физ. Хим. 2021. Т. 95. № 3. С. 348.
Golubina E.V., Rostovshchikova T.N., Lokteva E.S., Maslakov K.I., Nikolaev S.A., Shilina M.I., Gurevich S.A., Kozhevin V.M., Yavsin D.A., Slavinskay E.M. // Appl. Surf. Sci. 2021. V. 536. Article № 147656.
Golubina E.V., Rostovshchikova T.N., Lokteva E.S., Maslakov K.I., Nikolaev S.A., Egorova T.B., Gurevich S.A., Kozhevin V.M., Yavsin D.A., Yermakov A.Y. // Pure Appl. Chem. 2018. V. 90. № 11. P. 1685.
Lokteva E.S., Peristyy A.A., Kavalerskaya N.E., Golubina E.V., Yashina L.V., Rostovshchikova T.N., Gure-vich S.A., Kozhevin V.M., Yavsin D.A., Lunin V.V. // Pure Appl. Chem. 2012. V. 84. № 3. P. 495.
Локтева Е.С., Ростовщикова Т.Н., Качевский С.А., Голубина Е.В., Смирнов В.В., Стахеев А.Ю., Телегина Н.С., Гуревич С.А., Кожевин В.М., Явсин Д.А. // Кинетика и катализ. 2008. Т. 49. № 5. С. 784.
Ali-Zade A.G., Buryak A.K., Zelikman V.M., Oskolok K.V., Tarkhanova I.G. // New J. Chem. 2020. V. 44. № 16. P. 6402.
Ivanin I.A., Ali-Zade A.G., Golubeva E.N., Zubanova E.M., Zelikman V.M., Buryak A.K., Tarkhanova I.G. // Mol. Catal. 2020. V. 484. P. 110727.
Ростовщикова Т.Н., Николаев С.А., Кротова И.Н., Маслаков К.И., Удалова О.В., Гуревич С.А., Явсин Д.А., Шилина М.И. // Изв. АН Сер Хим. 2022. № 6. С. 1179.
Bryzhin A.A., Golubina E.V., Maslakov K.I., Lokteva E.S., Tarkhanova I.G., Gurevich S.A., Yavsin D.A., Rostovshchikova T.N. // ChemCatChem. 2020. V. 12. № 17. P. 4396.
Голубина Е.В., Локтева Е.С., Гурбанова У.Д., Харланов А.Н., Егорова Т.Б., Липатова И.А., Власкин М.С., Школьников Е.И. // Кинетика и катализ. 2019. Т. 60. № 3. С. 315.
Excel for Scientists and Engineers: Numerical Methods. E.J. Billo. John Wiley & Sons, 2007. 480 p.
Lokteva E.S., Shishova V.V., Tolkachev N.N., Maslakov K.I., Kamaev A.O., Maksimov S.V., Golubina E.V. // Mendeleev Commun. 2022. V. 32. № 2. P. 249.
Nikolaev S.A., Golubina E.V., Shilina M.I. // Appl. Catal. B: Env. 2017. V. 208. P. 116.
Pillo T., Zimmermann R., Steiner P., Hüfner S. // J. Phys. Condens. Matter. 1997. V. 9. P. 3987.
Бельская О.Б., Гуляева Т.И., Арбузов А.Б., Дуплякин В.К., Лихолобов В.А. // Кинетика и катализ. 2010. Т. 51. № 1. С. 114.
Шмидт А.Ф., Курохтина А.А., Ларина Е.В. // Кинетика и катализ. 2019. Т. 60. № 5. С. 555.
Blackmond D.G., Rosner T., Pfaltz A. // Org. Proc. Res. Dev. 1999. V. 3. P. 275.
Widegren J.A., Finke R.G. // J. Mol. Catal. A: Chem. 2003.V. 198. P. 317.
Finke R.G., Ozkar S. // J. Phys. Chem. C. 2019. V. 123. P. 54.
Köhler K., Kleist W., Pröckl S.S. // Inorg. Chem. V. 46. P. 1876.
Vedyagin A.A., Volodin A.M., Kenzhin R.M., Stoyanovskii V.O., Rogov V.A., Medvedev D.A., Mishakov I.V. // J. Therm. Anal. Calorim. 2017. V. 130. № 3. P. 1865.
Kurokhtina A.A., Larina E.V., Schmidt A.F., Malaika A., Krzyżyńska B., Rechnia P., Kozłowski M. // J. Mol. Catal. A: Chem. 2013. V. 379. P. 327.
Schmidt A.F., Kurokhtina A.A., Larina E.V. // Catal. Sci. Technol. 2014. V. 4. P. 3439.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ