Коллоидный журнал, 2019, T. 81, № 1, стр. 49-60
Разрушение оболочек полимерных и композитных микрокапсул под действием фокусированного ультразвука высокой интенсивности
О. А. Иноземцева 1, Д. В. Воронин 1, А. В. Петров 1, В. В. Петров 1, С. А. Лапин 1, А. А. Козлова 1, Д. Н. Браташов 1, А. М. Захаревич 1, Д. А. Горин 2, *
1 Саратовский национальный исследовательский государственный университет
им. Н.Г. Чернышевского
410012 Саратов, ул. Астраханская, 83, Россия
2 Сколковский институт науки и технологий
121205 Москва, ул. Нобеля, 3, Россия
* E-mail: d.gorin@skoltech.ru
Поступила в редакцию 11.08.2018
Аннотация
Описано получение полимерных (полиэлектролитных) и композитных микрокапсул состава полиэлектролит/магнетит, а также гибридных капсул на основе диоксида кремния в результате гидролиза силанового прекурсора, протекающего с образованием наночастиц диоксида кремния в структуре оболочки, содержащей различное число полимерных слоев. Полимерные и нанокомпозитные микрокапсулы были сформированы методом последовательной адсорбции противоположно заряженных полиэлектролитов и/или наночастиц, на поверхности микрочастиц ватерита, одной из полиморфных модификаций карбоната кальция. Полученные оболочки микрокапсул всех типов были исследованы методами атомно-силовой, конфокальной флуоресцентной и сканирующей электронной микроскопии до и после ультразвукового воздействия. Изучено влияние фокусированного ультразвука высокой интенсивности на полученные образцы микрокапсул, и установлены параметры ультразвукового воздействия, позволяющие эффективно разрушать их оболочки в водной среде. Установлено, что наиболее чувствительны к ультразвуковому воздействию композитные микрокапсулы, содержащие в оболочке наночастицы магнетита. Полученные композитные микрокапсулы имеют перспективу использования для разработки как новых систем доставки биологически активных веществ, так и мультифункциональных покрытий.
ВВЕДЕНИЕ
Разработка новых материалов с высокой чувствительностью к воздействиям физической природы является в настоящее время одним из наиболее важных направлений исследований как в современных технологиях адресной доставки биологически активных веществ [1], так и при создании мультифункциональных материалов различного назначения [2].
С практической точки зрения представляет интерес хорошо разработанный подход к получению таких систем адресной доставки, который основан на использовании последовательной адсорбции противоположно заряженных полиэлектролитов или наночастиц на поверхности частиц микронного размера с последующим растворением исходного “ядра” [3–6]. Этот подход позволяет включать различные структурообразующие и активные материалы в отдельную композитную капсулу или частицу типа ядро–оболочка [7]. Функциональность получаемых микрокапсул задается варьированием размера, состава и толщины оболочки [8–13].
Одним из новейших разработанных материалов для систем адресной доставки являются композитные полиэлектролитные структуры с оболочкой из диоксида кремния [1, 14–16]. Такие структуры потенциально привлекательны благодаря их химической инертности, биосовместимости, биоразлагаемости и возможности функционализации поверхности молекулами-векторами для обеспечения адресной доставки. Практический пример реализации подобных систем приведен в работах [17, 18], где сообщается о разработанных композитных микрокапсулах. Для формирования оболочек на основе диоксида кремния таких микрокапсул в качестве темплата были использованы пористые частицы карбоната кальция (ватерита), которые содержали флуоресцентно-меченый белок. Было продемонстрировано, что композитные капсулы на основе диоксида кремния имеют низкую проницаемость стенок, что позволяет иммобилизовывать низкомолекулярные гидрофильные вещества путем in situ формирования наночастиц диоксида кремния в оболочке капсулы в результате гидролиза силанового прекурсора, тетраэтилортосиликата (ТЭОС), с последующим “выращиванием” сплошного слоя SiO2 в полиэлектролитной оболочке. При этом авторы отмечают, что полученные микрокапсулы на основе диоксида кремния чувствительны к ультразвуковому воздействию [14].
Наряду с новыми материалами, находятся в разработке эффективные локальные и неинвазивные методы контролируемого высвобождения содержимого микрокапсул. Возможные подходы к решению данной проблемы основаны, например, на использовании оптического излучения [19–21], электромагнитного поля [22], ультразвука [22], химических веществ [23] и специфичных биохимических реакций [24]. Физические методы высвобождения требуют решения основной проблемы адресной доставки: амплитуда физических полей в области локализации микрокапсулы должна быть достаточно высокой, чтобы активировать механизм высвобождения. В то же время, это высокое значение амплитуды должно быть безопасным для окружающих тканей (например, вследствие локализации такого воздействия).
Представляется, что среди множества методов такого высвобождения наиболее перспективными являются методы, основанные на ультразвуковом воздействии [25]. В основе высвобождения капсулированных веществ при ультразвуковом воздействии на систему доставки лежит явление акустической кавитации – зарождение, рост и схлопывание кавитационных пузырьков в среде под действием ультразвуковой волны. Для ультразвуковых волн диапазона частот 20–40 кГц при значениях плотности мощности выше кавитационного порога (минимальной плотности мощности ультразвука, необходимой для возникновения кавитации) критический радиус кавитационного пузырька составляет несколько сотен микрометров [26]. При коллапсе (схлопывании) пузырька высвобождается значительная поверхностная энергия, которая достаточна для разрушения микрокапсул и выхода капсулированного вещества [27]. Известно, что размер кавитационных пузырьков и, как следствие, величина энергии, высвобождаемая при их схлопывании, определяются частотой ультразвуковой волны. Так, с увеличением частоты ультразвука, размер кавитационного пузырька уменьшается, а вместе с ним и поверхностная энергия, запасенная на границе фаз и высвобождаемая при его схлопывании [26]. Поэтому воздействие ультразвуком относительно низкой частоты (20–40 кГц) способно вызывать бóльшие механические повреждения по сравнению с ультразвуком более высоких частот (около 1 МГц) [28, 29]. Необходимо также отметить, что порог кавитации в той или иной среде увеличивается с ростом частоты ультразвука [26]. При этом было показано, что именно преодоление кавитационного порога является необходимым и обязательным условием эффективного воздействия ультразвука на системы адресной доставки и высвобождения капсулированных веществ, в том числе, in vivo [30]. Этими двумя фактами обуславливается выбор низкочастотного ультразвука для успешной реализации кавитационного режима в экспериментах по высвобождению капсулированных веществ in vitro и ex vivo. Установлено, что целостность и проницаемость оболочек полиэлектролитных микрокапсул зависят от длительности воздействия ультразвука, его мощности и частоты, а также от механических свойств оболочки, которые, в свою очередь, определяются ее толщиной и химическим составом [31–33]. Также показано влияние толщины оболочки и размера микрокапсул на время их разрушения при ультразвуковом воздействии [12]. Известно, что максимальное значение плотности мощности ультразвука в хирургии, стоматологии и других его медицинских приложениях может достигать нескольких Вт/см2. При этом используемые значения интенсивности ультразвука в публикациях разных авторов [31, 33, 34] существенно различаются и по-прежнему достаточно далеки от тех, которые используются в современной терапии.
В последнее время все большее распространение в медицине находит новый метод локального ультразвукового воздействия на глубоко расположенные ткани организма, получивший в англоязычной литературе сокращенное название HIFU (High Intensity Focused Ultrasound – фокусированный ультразвук высокой интенсивности) [35, 36]. Возможность эффективной фокусировки высокочастотного ультразвука внутри биоткани открывает широкие возможности для разработки и применения чувствительных к ультразвуку новых систем доставки биологически активных веществ [37–39]. Перспективы указанного подхода были продемонстрированы авторами [40] с использованием упорядоченных двумерных массивов полых микрорезервуаров, высвобождение капсулированных веществ из которых оказалось возможным с помощью HIFU. Подобные исследования не проводились на микроразмерных капсулах. Поэтому представляет значительный научный интерес изучение возможности применения фокусированного ультразвука высокой интенсивности для разрушения капсул или изменения проницаемости их оболочек в зависимости от типа капсул и состава оболочек.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Для получения микрокапсул и их экспериментального исследования использовали полистиролсульфонат натрия (ПCC, мол. масса M ≈ 70 000), полиаллиламина гидрохлорид (ПАА, мол. масса M ≈ 70 000), карбонат натрия, хлорид кальция, хлорид натрия, хлорид железа(II), хлорид железа(III), цитрат натрия, этилендиаминтетрауксусной кислоты динатриевая соль (ЭДТА), тетраэтоксиортосиликат (TЭOC), триметилродаминизотиоцианат (ТРИТЦ), бычий сывороточный альбумин, меченный триметилродаминизотиоцианатом (ТРИТЦ-БСА, M = 65 кДа), раствор аммиака, изопропиловый спирт, приобретенные у Sigma-Aldrich (Германия).
Вода, использованная во всех экспериментах, была подготовлена с помощью трехстадийной системы очистки Millipore Milli-Q 185 Plus и имела удельное сопротивление выше, чем 18.2 MОм см.
Получение наночастиц магнетита
Наночастицы магнетита (Fe3O4), стабилизированные лимонной кислотой, были получены по методике [41] химическим соосаждением из растворов солей двух- и трехвалентного железа в присутствии основания с использованием автоматического реактора. Отличительной особенностью такого реактора является пневматическая система управления, позволяющая добиться высокой чистоты во внутреннем объеме, что является важным условием получения монодисперсного коллоида магнетита с хорошей воспроизводимостью размера и состава наночастиц.
Получение темплатирующих частиц карбоната кальция
Синтез сферических частиц карбоната кальция (ватерита) был проведен путем их кристаллизации из раствора, полученного смешением равных объемов эквимолярных растворов CaCl2 и Na2CO3, в условиях непрерывного перемешивания.
Включение флуоресцентных красителей в исходные темплатные частицы ватерита
Для включения флуоресцентных красителей в состав исходных темплатных частиц был использован метод иммобилизации флуоресцентно-меченого белка (ТРИТЦ-БСА) в объеме пористой ватеритной матрицы. Он заключается во введении ТРИТЦ-БСА в смешанный раствор соответствующих солей (CaCl2 и Na2CO3), из которого кристаллизуются частицы ватерита [42].
Получение полиэлектролитных микрокапсул и композитных микрокапсул, содержащих в оболочке наночастицы магнетита
Полиэлектролитные и композитные оболочки были сформированы на поверхности полученных частиц карбоната кальция методом последовательной адсорбции полиэлектролитов и наночастиц [43, 44]. Для этого навеску частиц поочередно инкубировали (в течение 15 мин) в растворах противоположно заряженных полиэлектролитов – катионного (ПАА) и анионного (ПCC) с концентрацией 1 мг/мл в 0.2 М растворе хлорида натрия. Для придания большей чувствительности к ультразвуку в полученные полимерные оболочки вместо слоя ПCC был встроен один слой наночастиц магнетита. После проведения определенного числа циклов адсорбции темплатные частицы ватерита были растворены путем реакции с ЭДТА с образованием полых микрокапсул.
Получение композитных микрокапсул состава полиэлектролит/диоксид кремния
Для формирования покрытия на основе диоксида кремния 2 мл суспензии полиэлектролитных микрокапсул состава (ПАА/ПCC)n были разбавлены этанолом до 6 мл [14]. Емкость с суспензией капсул в этаноле была помещена на магнитную мешалку, после чего в нее был добавлен раствор аммиака (1 : 5 по объему), а затем раствор прекурсора (ТЭОС) в этаноле (1 : 2 по объему). Процессы нуклеации и роста наночастиц диоксида кремния проходили при температуре T = 50–60°C в течении 30 мин. Дальнейший рост покрытия из диоксида кремния проходил при комнатной температуре в течение 20 ч при непрерывном перемешивании. После этого полученная суспензия была подвергнута центрифугированию, осадок промыт этанолом, а затем деионизованной водой.
В данном исследовании были получены капсулы с различным числом бислоев полиэлектролитов состава (ПАА/ПСС)n в оболочке (n = 1, 2, 3), содержащие ТРИТЦ-БСА.
Методы исследования
Исследование свойств полученных микрокапсул проводилось с использование перечисленных ниже методов и оборудования.
Просвечивающая электронная микроскопия (ПЭМ). Исследование полученных структур методом ПЭМ было проведено с использованием микроскопа Libra-120 (Carl Zeiss, Jena, Германия).
Сканирующая электронная микроскопия (СЭМ). Исследование морфологии полученных структур методом СЭМ было проведено с помощью микроскопа MIRA II LMU (TESCAN, Чехия).
Атомно-силовая микроскопия (АСМ). АСМ-изображения высушенных микрокапсул были получены при комнатной температуре с помощью микроскопа NTEGRA Spectra (NT-MDT S.I., Россия) в полуконтактном режиме с использованием зондов NSG10 (NT-MDT S.I.).
Конфокальная лазерная сканирующая микроскопия. Оптическое исследование процесса иммобилизации флуоресцентных красителей и оценка механической целостности оболочек микрокапсул были проведены с использованием конфокального лазерного сканирующего микроскопа Leica TCS SP8 X (Leica Microsystems, Великобритания).
Описание экспериментальной установки HIFU
Для исследования влияния воздействия высокоинтенсивного фокусированного высокочастотного ультразвука на оболочки микрокапсул, была разработана лабораторная установка, схематичное изображение которой приведено на рис. 1.
Рис. 1.
Лабораторная установка для исследования влияния высокочастотного фокусированного ультразвука высокой интенсивности на оболочки микрокапсул: 1 – столик, 2 – резиновое кольцо, 3 – кварцевый стакан, 4 – стеклянная крышка, 5 – сферический пьезопреобразователь, 6 – коаксиальный кабель, 7 – суспензия капсул, 8 – генератор радиосигналов.
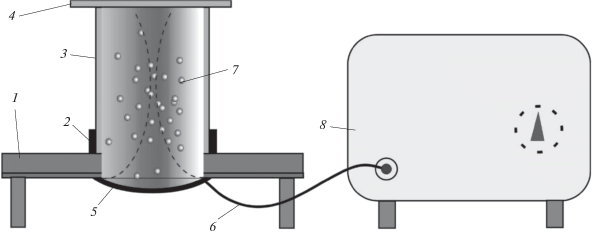
Установка представляет собой комплекс из ультразвукового и электронного модулей. Ультразвуковой модуль состоит из столика с ножками (1 на рис. 1), на который с помощью резинового кольца 2 установлен кварцевый цилиндр 3, выполняющий роль емкости для образцов, накрытый стеклянной крышкой 4. Фокусированный пучок ультразвука генерируется акустической сферической линзой 5, представляющей собой электроакустический преобразователь, выполненный из пьезокерамики ЦТС-19. На обеих поверхностях пьезослоя имеются серебряные электроды, к которым подсоединен коаксиальный кабель 6 для подведения высокочастотного электромагнитного излучения. Дека столика 1 изготовлена из металлизированного текстолита. В центре столика имеется отверстие, диаметр которого совпадает с диаметром пьезоизлучателя. Ободок серебряного электрода, нанесенного на внутреннюю поверхность сферического пьезослоя, припаян к нижней металлизированной поверхности деки столика. На верхнюю поверхность столика приклеено резиновое кольцо, внутренний диаметр которого равен диаметру пьезоизлучателя, и совпадает с внешним диаметром кварцевого цилиндра.
Во время проведения экспериментов кварцевый цилиндр был заполнен разбавленной водной суспензией микрокапсул 7, которая подвергалась воздействию ультразвукового излучения. Крышка 4 служит для предотвращения разбрызгивания суспензии в ходе ультразвукового воздействия.
Электронный модуль представляет собой специально разработанный непрерывно излучающий высокочастотный генератор радиосигналов, частота которых совпадает с резонансной частотой пьезоэлектрического преобразователя и составляет 2.65 МГц. Мощность ультразвукового излучения может быть изменена при помощи регулятора мощности.
В эксперименте мощность ультразвукового воздействия была определена калориметрическим методом [45] с помощью измерителя температуры ИТ-01 (ООО НТЦ “Магистр-С”, Россия) с использованием хромель-алюминиевой термопары. Максимальное значение плотности ультразвуковой мощности составило 1.1 Вт/см2.
Фокусное расстояние сферической акустической линзы в воде равно 15 мм. Диаметр излучающей области пьезопреобразователя также составляет 15 мм. Диаметр ультразвукового пучка в области каустики близок к 1 мм.
Эксперименты по воздействию фокусированного ультразвука на микрокапсулы
Было исследовано влияние фокусированного ультразвука с плотностью мощности 1.1 Вт/см2 на микрокапсулы с полиэлектролитными, нанокомпозитными и гибридными оболочками. Разбавленные водные суспензии микрокапсул подвергали непрерывному воздействию фокусированного ультразвука в течение 10 мин. Затем образцы капсул были сконцентрированы до исходного объема и повторно охарактеризованы с помощью сканирующей конфокальной флуоресцентной микроскопии.
Для получения оценочных данных о воздействии фокусированного ультразвука высокой интенсивности на механическую прочность оболочек микрокапсул была проведена серия экспериментов с различным временем ультразвукового воздействия на водную суспензию микрокапсул – от 1 до 5 мин с шагом в 1 мин. После этого степень разрушения образцов была качественно оценена путем их анализа в конфокальном лазерном сканирующем микроскопе.
Количественная оценка степени разрушения оболочек для каждой временно'й точки была проведена с помощью гемоцитометра. Для этого был произведен расчет доли микрокапсул, сохранивших целостность оболочек после ультразвукового воздействия, от их общего числа в исходной суспензии.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Наночастицы магнетита
Наночастицы магнетита были охарактеризованы методами ПЭМ и динамического рассеяния света. Анализ ПЭМ-изображения (рис. 2) показал, что частицы имеют форму, близкую к сферической, монодисперсны и не подвержены агрегации. Средний размер наночастиц магнетита, по результатам измерений динамического рассеяния света, составил 8 ± 3 нм. Былo также определенo значениe ζ-потенциала, которoе в среднем составилo –25 ± 3 мВ.
Полиэлектролитные и композитные микрокапсулы, содержащие наночастицы магнетита
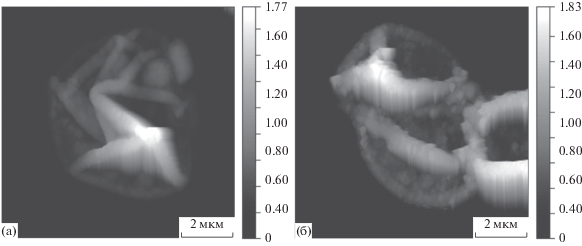
Для исследования свойств микрокапсул, содержащих наночастицы магнетита, были приготовлены полиэлектролитные и композитные микрокапсулы со структурой (ПАА/ПСС)5 и (ПАА/ПСС)2/(ПАА/Fe3O4)(ПАА/ПСС)2 соответственно, которые были охарактеризованы методами СЭМ, АСМ и конфокальной микроскопии. Для измерения средней толщины оболочки микрокапсул была использована АСМ. После проведения измерений полученные данные о рельефе поверхности микрокапсул были обработаны с помощью пакета свободного программного обеспечения Gwyddion [46], позволяющего удалить артефакты сканирования и выровнять базовую плоскость изображения. Оценка толщины оболочки была проведена путем измерения распределения высот плоских участков полиэлектролитного бислоя, нахождения максимума и вычета максимального значения пика на распределении высот, соответствующего подложке. Для каждого образца были проведены измерения 5 микрокапсул, после чего полученные результаты расчетов были усреднены. Таким образом, по результатам анализа АСМ-изображений (рис. 3) толщина бислоя полиэлектролитных микрокапсул (рис. 3а) составила 226 ± 5 нм, а композитных (рис. 3б) – 266 ± 7 нм. Кроме того, на приведенных АСМ-изображениях видно, что внедрение в оболочку микрокапсул наночастиц магнетита приводит к увеличению шероховатости поверхности оболочек (рис. 3а, 3б), что согласуется с ранее полученными результатами [47, 48].
Рис. 3.
АСМ-изображения поверхности капсул: (а) полиэлектролитные микрокапсулы (ПАА/ПСС)5, (б) нанокомпозитные микрокапсулы (ПАА/ПСС)2/(ПАА/Fe3O4)(ПАА/ПCC)2. Значения на шкале по оси z указаны в мкм.
Введение флуоресцентного (ТРИТЦ-меченого) модельного белка в состав микрокапсул позволяет оценить чувствительность их оболочек к фокусированному ультразвуку высокой интенсивности. Из анализа фотографий, сделанных в конфокальном микроскопе (рис. 4a, 4в), следует, что полученные полиэлектролитные и нанокомпозитные микрокапсулы, содержащие наночастицы магнетита, имели форму, близкую к сферической, и низкую степень агрегации, а их диаметр соответствовал диаметру исходных частиц-темплатов.
Рис. 4.
Изображения микрокапсул до (а, в) и после (б, г) 10 мин воздействия фокусированным ультразвуком, полученные методом конфокальной сканирующей микроскопии; (а, б) полиэлектролитные микрокапсулы состава (ПАА/ПCC)5, (в, г) нанокомпозитные микрокапсулы состава (ПАА/ПCC)2/(ПАА/Fe3O4)(ПАА/ПCC)2.
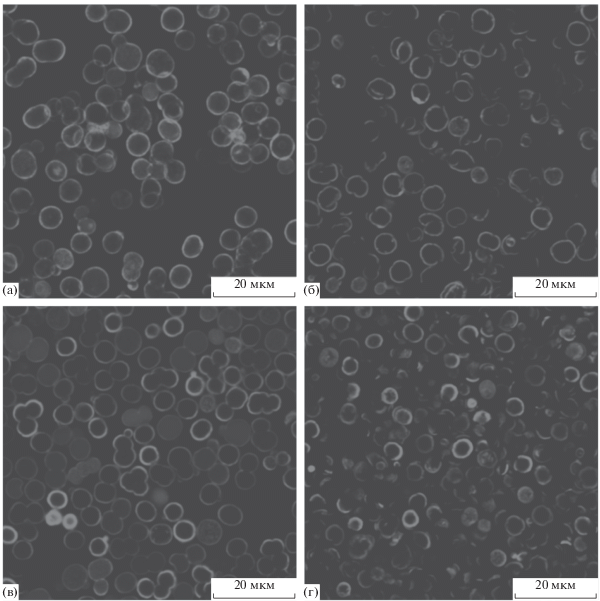
Представленные изображения свидетельствуют о том, что значительная часть оболочек микрокапсул оказывается поврежденной в результате ультразвукового воздействия.
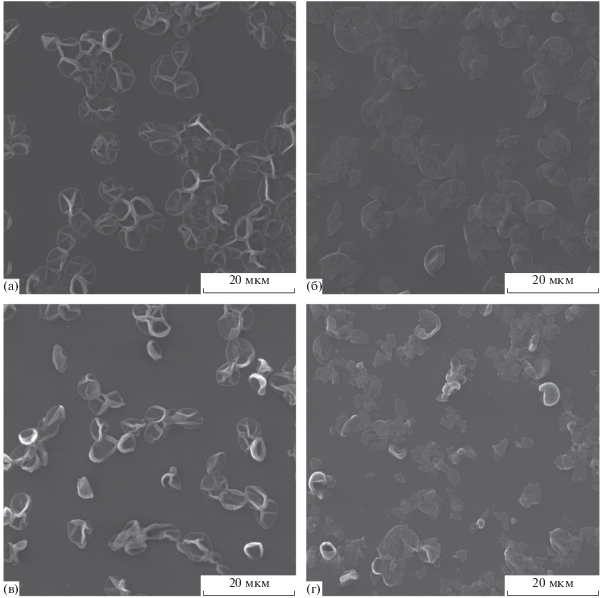
Сравнительный анализ образцов полиэлектролитных и композитных микрокапсул до (рис. 5а, 5в) и после ультразвукового воздействия (рис. 5б, 5г) методом СЭМ подтвердил вывод о полном разрушении оболочек микрокапсул под действием высокоинтенсивного фокусированного ультразвука.
Рис. 5.
СЭМ-изображения микрокапсул до (а, в) и после (б, г) 10 мин воздействия фокусированным ультразвуком; (а, б) полиэлектролитные микрокапсулы состава (ПАА/ПCC)5, (в, г) нанокомпозитные микрокапсулы состава (ПАА/ПCC)2/(ПАА/Fe3O4)(ПАА/ПCC)2.
Для получения оценочных данных о воздействии фокусированного ультразвука высокой интенсивности на механическую прочность оболочек полиэлектролитных и композитных микрокапсул была проведена серия экспериментов, в которых время ультразвукового воздействия на водную суспензию микрокапсул варьировалось от 1 до 5 мин. После этого степень разрушения микрокапсул была качественно оценена с помощью конфокальной лазерной сканирующей микроскопии (рис. 6, 7).
Рис. 6.
Изображения полимерных микрокапсул состава (ПАА/ПСС)5, полученные методом конфокальной сканирующей микроскопии до воздействия фокусированным ультразвуком (а) и через 1 (б), 2 (в), 3 (г), 4 (д) и 5 мин (е) после начала воздействия.

Рис. 7.
Изображения нанокомпозитных микрокапсул состава (ПАА/ПСС)2/(ПАА/Fe3O4)(ПАА/ПСС)2, полученные методом конфокальной сканирующей микроскопии до воздействия фокусированным ультразвуком (а) и через 1 (б), 2 (в), 3 (г), 4 (д) и 5 мин (е) после начала воздействия.

На представленных изображениях видно, что значительное количество полиэлектролитных капсул, попавших в поле зрения микроскопа, разрушается на второй минуте воздействия (рис. 6), в то время как на разрушение композитных микрокапсул требуется вдвое меньше времени (рис. 7).
Для количественной оценки степени разрушения оболочек для каждой временной точки с помощью гемоцитометра подсчитывали долю микрокапсул, сохранивших целостность оболочек после ультразвукового воздействия, (рис. 8).
Рис. 8.
Доля целых микрокапсул как функция времени воздействия фокусированным ультразвуком: 1 – полиэлектролитные микрокапсулы (ПАА/ПСС)5, 2 – композитные микрокапсулы с магнетитом состава (ПАА/ПСС)2/(ПАА/Fe3O4)/(ПАА/ПСС)2.
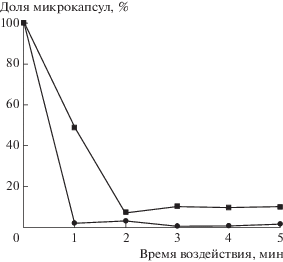
Оценка действия ультразвука подтвердила данные конфокальной микроскопии – композитные капсулы, содержащие в оболочке наночастицы Fe3O4, более чувствительны к ультразвуковому воздействию, что соответствует имеющимся литературным данным для микрокапсул, содержащих в оболочке неорганические наночастицы [12, 33]. При этом их полное разрушение происходит в течение первой минуты (рис. 8). Это обусловлено совокупностью, как минимум, двух факторов: снижением механической устойчивости оболочек к воздействию фокусированного ультразвука в результате взаимодействия наночастиц с полимерной матрицей и более неоднородной структурой нанокомпозитных оболочек по сравнению с полимерными, в результате чего нуклеационный порог для газовых нанопузырьков, играющих роль зародышей для кавитационных пузырей, будет существенно ниже. Таким образом, полученные результаты демонстрируют потенциал подобных систем в качестве систем адресной доставки лекарств, чувствительных к воздействию фокусированного ультразвука.
Полиэлектролитные микрокапсулы, покрытые оболочкой на основе диоксида кремния (гибридные микрокапсулы)
В данном исследовании были получены капсулы с различным числом бислоев полиэлектролитов состава (ПАА/ПСС)n, где n = 1, 2, 3, содержащие ТРИТЦ-БСА. Формирование стабильных оболочек с минимальным числом полиэлектролитных бислоев, по-видимому, обусловлено присутствием флоуресцентно-меченого белка в составе темплатных микрочастиц ватерита. Далее, согласно методике [45] на полиэлектролитных капсулах формировали слой аморфного диоксида кремния путем гидролиза ТЕОС в щелочной среде, при этом количество ТЭОС было постоянным независимо от числа слоев полиэлектролитов в оболочке капсул.
Для исследования структурных и поверхностных свойств полученных композитных материалов были использованы методы электронной и флуоресцентной сканирующей микроскопии. На фотографиях, сделанных в конфокальном флуоресцентном микроскопе (рис. 9), видно, что капсулы с увеличением числа слоев становятся менее проницаемыми и белок внутри них распределен более равномерно, по сравнению с более тонкими одно- и двухслойными образцами, где флуоресцентное вещество в основном сосредоточено на стенках капсул.
Рис. 9.
Изображения микрокапсул со структурой оболочки (ПАА/ПСС)n@SiO2, где (а, г) n = 1, (б, д) n = 2 и (в, е) n = 3, полученные методом конфокальной сканирующей микроскопии до (а–в) и после (г–е) 10 мин воздействия фокусированным ультразвуком.

Представленные изображения свидетельствуют о том, что значительная часть оболочек микрокапсул сохраняет целостность после 10 мин ультразвукового воздействия.
При анализе СЭМ-изображений образцов капсул до и после ультразвукового воздействия установлено, что исходные микрокапсулы имели форму, близкую к сферической, причем сохраняли ее в условиях получения изображений – после высушивания и нахождения в вакуумной среде (рис. 10а–10в). Важно отметить, что капсулы на основе диоксида кремния имеют совершенно иной характер разрушения ультразвуком по сравнению с более мягкими полиэлектролитными и магнетитсодержащими капсулами – их оболочка в основном сохраняет целостность, однако практически в каждой капсуле отмечаются своеобразные разломы, что возможно было установить только с помощью СЭМ (рис. 10г–10е). Толщина оболочек была измерена при помощи программного обеспечения сканирующего электронного микроскопа на изломах капсул – видно, что с ростом числа слоев полиэлектролитов толщина стенок микрокапсул также увеличивается (рис. 10ж–10и). Однако при этом обнаружено отсутствие выраженной зависимости степени разрушения оболочек (чувствительности к ультразвуковому воздействию) от числа бислоев полиэлектролитов.
Рис. 10.
Изображения микрокапсул со структурой оболочки (ПАА/ПCC)n@SiO2, где (а, г) n = 1, (б, д) n = 2 и (в, е) n = 3, полученные методом СЭМ до (а–в) и после (г–и) 10 мин воздействия фокусированным ультразвуком.

Провести сравнительный анализ степени разрушения образцов капсул с помощью подсчета гемоцитометром в данном случае не представляется возможным, так как при наблюдении в оптический микроскоп капсулы на основе диоксида кремния выглядят целостными оболочками.
ЗАКЛЮЧЕНИЕ
Исследовано влияние высокочастотного фокусированного ультразвука высокой интенсивности на микроразмерные капсулы с различным составом оболочки. Проведена оценка ультразвукового воздействия на капсулы с полиэлектролитной оболочкой, с композитной оболочкой, содержащей наночастицы магнетита, и на гибридные капсулы с оболочкой на основе диоксида кремния. Описаны оптимальные режимы воздействия и установлены пороговые значения мощности и времени облучения фокусированным ультразвуком в водной среде, позволяющие эффективно влиять на целостность оболочек капсул каждого типа. Методами конфокальной и сканирующей электронной микроскопии установлено, что, несмотря на то, что полиэлектролитные оболочки и оболочки на основе диоксида кремния имеют принципиально различный характер разрушения, после 10 мин воздействия фокусированным ультразвуком нарушается целостность оболочек большинства капсул любого типа. При этом наиболее подвержены разрушению композитные оболочки, содержащие наночастицы магнетита, – их основная часть разрушается уже после 1 мин ультразвукового воздействия.
Представлено описание разработанной установки, генерирующей фокусированный ультразвуковой пучок высокой интенсивности. Данная установка способна функционировать в различных операционных режимах с регулируемой мощностью и в перспективе позволит проводить эксперименты по управляемому высвобождению капсулированных веществ из различных систем адресной доставки как в водной среде, так и в ультразвуковых фантомах тканей и биологических тканях и средах.
Авторы выражают благодарность Центру коллективного пользования “Симбиоз” ИБФРМ РАН (Саратов) за проведение просвечивающей электронной микроскопии полученных структур.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 18-29-08046) и Министерства образования и науки Российской Федерации (проекты 11.8139.2017/П220 и 11.8289.2017/П220).
Список литературы
Timin A.S., Gao H., Voronin D.V., Gorin D.A., Sukhorukov G.B. // Adv. Mater. Interf. 2017. V. 4. P. 1600338.
Иноземцева О.А., Сальковский Ю.Е., Северюхина А.Н., Видяшева И.В.,Петрова Н.В., Метвалли Х.А., Стецюра И.Ю., Горин Д.А. // Успехи химии. 2015. Т. 84. С. 251.
Decher G. // Science. 1997. V. 277. P. 1232.
Decher G., Hong J.D. // Ber. Bunsenges. Phys. Chem. 1991. V. 95. P. 1430.
Tong W., Song X., Gao C. // Chem. Soc. Rev. 2012. V. 41. P. 6103.
Ariga K., Lvov Y.M., Kawakami K., Ji Q., Hill J.P. // Adv. Drug Deliv. Rev. 2011. V. 63. P. 762.
Wuytens P., Parakhonskiy B., Yashchenok A., Winterhalter M., Skirtach A. // Curr. Opin. Pharmacol. 2014. V. 18. P. 129.
Volodkin D.V., Schmidt S., Fernandes P., Larionova N.I., Sukhorukov G.B., Duschl C., Möhwald H., von Klitzing R. // Adv. Funct. Mater. 2012. V. 22. P. 1914.
Zhang F., Wu Q., Liu L.-J., Chen Z.-C., Lin X.-F. // Int. J. Pharm. 2008. V. 357. P. 22.
Gao C., Leporatti S., Moya S., Donath E., Möhwald H. // Chem. A Eur. J. 2003. V. 9. P. 915.
Antipov A.A., Sukhorukov G.B., Leporatti S., Radtchenko I.L., Donath E., Möhwald H. // Colloids Surf. A. 2002. V. 198–200. P. 535.
Колесникова Т.А., Хлебцов Б.Н., Щукин Д.Г., Горин Д.А. // Рос. нанотехнологии. 2008. Т. 3. № 9–10. С. 74.
Kolesnikova T.A., Skirtach A.G., Möhwald H. // Expert Opin. Drug Deliv. 2013. V. 10. P. 47.
Gao H., Wen D., Sukhorukov G.B. // J. Mater. Chem. B. 2015. V. 3. P. 1888.
Gao H., Goriacheva O.A., Tarakina N.V., Sukhorukov G.B. // ACS Appl. Mater. Interfaces. 2016. V. 8. P. 9651.
Ott A., Yu X., Hartmann R., Rejman J., Schütz A., Ochs M., Parak W.J., Carregal-Romero S. // Chem. Mater. 2015. V. 27. P. 1929.
Ochs M., Carregal-Romero S., Rejman J., Braeckmans K., De Smedt S.C., Parak W.J. // Angew. Chemie Int. Ed. 2013. V. 52. P. 695.
Caruso F. // Science. 1998. V. 282. P. 1111.
Wu Y., Frueh J., Si T., Möhwald H., He Q. // Phys. Chem. Chem. Phys. 2015. V. 17. P. 3281.
Yi Q., Sukhorukov G.B. // Adv. Colloid Interface Sci. 2014. V. 207. P. 280.
Gorin D.A., Portnov S.A., Inozemtseva O.A., Luklinska Z., Yashchenok A.M., Pavlov A.M., Skirtach A.G., Möhwald H., Sukhorukov G.B. // Phys. Chem. Chem. Phys. 2008. V. 10. P. 6899.
Klyachko N.L., Sokolsky-Papkov M., Pothayee N., Efremova M.V., Gulin D.A., Pothayee N., Kuznetsov A.A., Majouga A.G., Riffle J.S., Golovin Y.I., Kabanov A.V. // Angew. Chem. Int. Ed. 2012. V. 51. P. 12016.
Ma Y., Dong W.-F., Hempenius M.A., Möhwald H., Vancso G.J. // Nat. Mater. 2006. V. 5. P. 724.
Lomova M.V., Brichkina A.I., Kiryukhin M.V., Vasina E.N., Pavlov A.M., Gorin D.A., Sukhorukov G.B., Antipina M.N. // ACS Appl. Mater. Interfaces. 2015. V. 7. P. 11732.
Pitt W.G., Husseini G.A., Staples B.J. // Expert Opin. Drug Deliv. 2004. V. 1. P. 37.
Sponer J. // Czech. J. Phys. 1990. V. 40. P. 1123.
De Geest B.G., De Koker S., Sukhorukov G.B., Kreft O., Parak W.J., Skirtach A.G., Demeester J., De Smedt S.C., Hennink W.E. // Soft Matter. 2009. V. 5. P. 282.
Barnett S.B., Ter Haar G.R., Ziskin M.C., Rott H.-D., Duck F.A., Maeda K. // Ultrasound Med. Biol. 2000. V. 26. P. 355.
Mason T.J., Cobley A.J., Graves J.E., Morgan D. // Ultrason. Sonochem. 2011. V. 18. P. 226.
Graham S.M., Carlisle R., Choi J.J., Stevenson M., Shah A.R., Myers R.S., Fisher K., Peregrino M.-B., Seymour L., Coussios C.C. // J. Control. Release. 2014. V. 178. P. 101.
De Geest B.G., Skirtach A.G., Mamedov A.A., Antipov A.A., Kotov N.A., De Smedt S.C., Sukhorukov G.B. // Small. 2007. V. 3. P. 804.
Pavlov A.M., Saez V., Cobley A., Graves J., Sukhorukov G.B., Mason T.J. // Soft Matter. 2011. V. 7. P. 4341.
Kolesnikova T.A., Gorin D.A., Fernandes P., Kessel S., Khomutov G.B., Fery A., Shchukin D.G., Möhwald H. // Adv. Funct. Mater. 2010. V. 20. P. 1189.
Shchukin D.G., Gorin D.A., Möhwald H. // Langmuir. 2006. V. 22. P. 7400.
Росницкий П.Б., Гаврилов Л.Р., Юлдашев П.В., Сапожников О.А. Хохлова В.А. // Акустич. журн. 2017. Т. 5. С. 489.
Буравков С.В., Пономарчук Е.М., Хохлова Т.Д., Ванг Я.Н., Хохлова В.А. // Клин. эксп. морфология. 2017. Т. 3. С. 38.
Hijnen N., Langereis S., Grüll H. // Adv. Drug Deliv. Rev. 2014. V. 72. P. 65.
Lovegrove C. // Nat. Clin. Pract. Oncol. 2006. V. 3. P. 8.
Ma M., Xu H., Chen H., Jia X., Zhang K., Wang Q., Zheng S., Wu R., Yao M., Cai X., Li F., Shi J. // Adv. Mater. 2014. V. 26. P. 7378.
Gai M., Frueh J., Tao T., Petrov A.V., Petrov V.V., Shesterikov E.V., Tverdokhlebov S.I., Sukhorukov G.B. // Nanoscale. 2017. V. 9. P. 7063.
Герман С.В., Иноземцева О.А., Маркин А.В., Метвалли Х., Хомутов Г.Б., Горин Д.А.// Коллоид. журн. 2013. Т. 75. С. 534.
Svenskaya Y.I., Pavlov A.M., Gorin D.A., Gould D.J., Parakhonskiy B.V., Sukhorukov G.B. // Colloids Surf. B. 2016. V. 146. P. 171.
Donath E., Sukhorukov G.B., Caruso F., Davis S.A., Möhwald H. // Angew. Chem. Int. Ed. 1998. V. 37. P. 2201.
Sukhorukov G.B., Donath E., Davis S., Lichtenfeld H., Caruso F., Popov V.I., Möhwald H. // Polym. Adv. Technol. 1998. V. 767. P. 759.
Mazda F.F. Electronic Instruments and Measurement Techniques. Cambridge: Cambridge Univ. Press, 1987.
Nečas D., Klapetek P. // Open Phys. 2012. V. 10. P. 181.
Ященок А.М., Иноземцева О.А., Горин Д.А. // Рос. нанотехнологии. 2009. Т. 4. № 5–6. С. 85.
Andreeva D.V., Gorin D.A., Shchukin D.G., Sukhorukov G.B. // Macromol. Rapid Commun. 2006. V. 27. P. 931.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал



