Коллоидный журнал, 2019, T. 81, № 1, стр. 78-85
Регулирование заряда и гидродинамического диаметра наночастиц диоксида кремния в микроэмульсиях АОТ
Н. О. Шапаренко 1, Д. И. Бекетова 1, М. Г. Демидова 1, А. И. Булавченко 1, *
1 Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, проспект Академика Лаврентьева, 3, Россия
* E-mail: bulavch@niic.nsc.ru
Поступила в редакцию 24.04.2018
Аннотация
Гидролизом тетраэтилортосиликата в обратных микроэмульсиях бис-(2-этилгексил)сульфосукцината натрия (Аэрозоль ОТ, АОТ) в н-декане получены стабильные органозоли SiO2. Методами фазового анализа рассеянного света и фотон-корреляционной спектроскопии исследованы зависимости электрофоретической подвижности и гидродинамического диаметра наночастиц диоксида кремния от содержания воды (0–10 об. %), хлороформа в смеси н-декан–хлороформ (0–40 об. %), а также оксиэтилированного ПАВ Tergitol NP-4 (0–0.125 М) и температуры (0–60°C). Электрофоретическая подвижность наночастиц увеличивалась в 3–4 раза при добавлении воды и хлороформа. Наночастицы с гидродинамическим диаметром 20 нм в отсутствие воды заряжены отрицательно; перезарядка их поверхности происходит при содержании воды и хлороформа более 0.1 и 17 об. % соответственно.
ВВЕДЕНИЕ
Стабильные органозоли наночастиц оксидов являются перспективными системами нанохимии и нанотехнологий [1]. Органозоли SiO2 представляют большой интерес в связи с их потенциальным применением в формировании новых наноматериалов для катализа, биосенсорики, доставки лекарств [2–4]. Кроме того, из-за развитой поверхности и возможности ее модификации, наночастицы SiO2 могут выступать в качестве переносчиков наночастиц металлов, полупроводников, диэлектриков и биологически активных молекул, что существенно расширяет область их применения [5, 6].
В золях наночастицы “свободны”; т.е. не образуют коагуляционных или кристаллизационных контактов. Поэтому при их использовании для создания наноматериалов обеспечивается более равномерное распределение наночастиц в объемной или поверхностной фазе композита. Отметим, что только в этом случае в полной мере проявляется основное “полезное” свойство наносостояния вещества – размерный эффект [7].
Одним из самых распространенных и перспективных методов получения наночастиц SiO2 с размерами в диапазоне 10–100 нм является мицеллярный (микроэмульсионный) синтез. В качестве мицеллообразующего поверхностно-активного вещества (ПАВ) и стабилизатора микроэмульсии чаще всего применяется анионное ПАВ, бис(2-этилгексил)сульфосукцинат натрия (Аэрозоль ОТ, АОТ). Помимо того, что АОТ обладает прекрасными мицеллообразующими свойствами и высокой солюбилизирующей способностью, это ПАВ способно создавать значительный заряд на различных поверхностях в средах с низкой диэлектрической проницаемостью [8, 9]. Преимуществом мицеллярного синтеза является возможность получения стабильных органозолей с узкой функцией распределения наночастиц по размерам. Ранее нами [10] была разработана методика синтеза наночастиц SiO2 с гидродинамическим диаметром 10–50 нм в микроэмульсии АОТ в н-декане, но полученные частицы проявляли низкую электрофоретическую подвижность.
В данной работе исследуется влияние состава микроэмульсий и температуры на гидродинамический диаметр и электрофоретическую подвижность наночастиц SiO2 в микроэмульсии АОТ в н-декане с целью получения наночастиц c высокой электрофоретической подвижностью для увеличения эффективности и скорости их концентрирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
В работе использовали н-декан (99.9%), хлороформ (х. ч.), бис(2-этилгексил)сульфосукцинат натрия (Sigma-Aldrich, содержание основного вещества не менее 96%), тетраэтилортосиликат (ТЭОС) (98%, Acros Seal), аммиак (ос. ч. 23-5), деионизованную воду, полиоксиэтилированный нонилфенол со степенью оксиэтилирования, равной четырем, – Tergitol NP-4 (Dow Chemical Co.).
Методика синтеза органозолей SiO2
В пробирку помещали 10 мл 0.25 М раствора АОТ в н-декане, добавляли 40 мкл ТЭОС и перемешивали в течение 3 мин (концентрация ТЭОС в растворе составляла 0.018 М). Затем приливали 200 или 300 мкл 9 М раствора NH3 порциями по 100 мкл, каждый раз перемешивая раствор в течение 1 мин. Конечное содержание водной псевдофазы (Vs/Vo) составляло 2.0–3.0 об. %, что с учетом содержания аммиака соответствовало концентрации воды 0.8–1.3 М. Далее раствор перемешивали на механической мешалке в течение 2 ч со скоростью 60 об./мин, после чего реакционную смесь оставляли на сутки. Затем из микроэмульсии испаряли воду перемешиванием на магнитной мешалке в стакане с площадью поверхности испарения 10 см2 в течение 2–3 ч при комнатной температуре.
Остаточное содержание воды в органозоле по данным фотон-корреляционной спектроскопии (ФКС) и ИК-фурье-спектроскопии составляло 0.2 об. %. Увеличение времени перемешивания и повышение температуры не приводило к его изменению. Данное содержание воды было принято за условный ноль и в общей солюбилизационной емкости не учитывалось.
В полученные органозоли вводили исследуемые добавки и проводили соответствующие измерения.
Определение характеристик органозолей
Эффективный гидродинамический диаметр частиц определяли методом динамического рассеяния света на спектрометре NanoBrook Omni (Brookhaven Instruments Corp., США). Автокорреляционная функция обрабатывалась с использованием полимодального анализа при помощи алгоритма NNLS (Non-Negatively Constrained Least Squares). Перед измерением органозоли очищали от пыли пятикратным циклическим фильтрованием через мембранный фильтр из политетрафторэтилена с диаметром пор 0.2 мкм (Sartorius, Германия) непосредственно в измерительную 1-см стеклянную ячейку (Brookhaven, США). Мощность твердотельного лазера с длиной волны 640 нм составляла 35 мВт, рассеянные частицами фотоны детектировались под углом 90° к источнику излучения. Время накопления фотонов для одного измерения составляло 10–30 с, гидродинамический диаметр определялся как среднее из 20–30 измерений. Z-усредненный гидродинамический диаметр рассчитывался для сферических частиц с использованием формулы Стокса–Эйнштейна
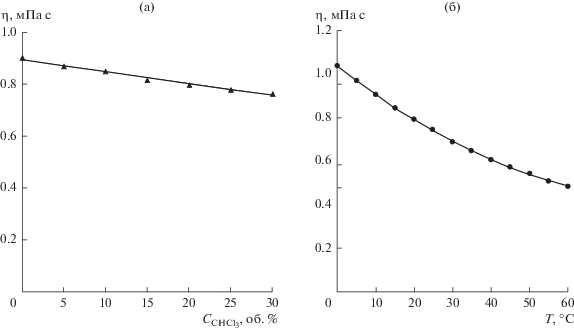
Динамическую вязкость индивидуальных растворителей и их смесей определяли с помощью вискозиметра MicroVISC (ReoSense Inc., США). В вискозиметре используется микрофлюидная технология датчиков VROS, измеряющих вязкость по падению давления исследуемой жидкой системы по мере ее протекания через прямоугольную щель. Конструкция позволяет исследовать образцы минимального объема (начиная с 10 мкл) при различной температуре. Измерения проводили в воздушном температурном контроллере MicroVISC TC при 20°C; точность поддержания температуры составляла ±0.02°C. Температурная зависимость динамической вязкости смеси декан–хлороформ (4 : 1 по объему) и зависимость вязкости от содержания хлороформа в смеси декан–хлороформ представлены на рис. 1.
Рис. 1.
Зависимость динамической вязкости смеси н-декан–хлороформ от содержания хлороформа (а) и смеси н-декан–хлороформ (объемное соотношение 4 : 1) от температуры (б).
Электрокинетический потенциал (ζ-потенциал) наночастиц измеряли методом лазерного электрофореза с использованием опции фазового анализа рассеянного света (phase analysis light scattering, PALS) на том же спектрометре, что и гидродинамический диаметр частиц. Рассеянные частицами фотоны детектировались под углом 15°. Измерения проводили в специальной ячейке SRR2, устойчивой к действию органических растворителей, с плоскопараллельными палладиевыми электродами площадью примерно 45 мм2 при межэлектродном зазоре 3.45 мм. Электроды также обеспыливали непрерывным пропусканием через них растворителя в течение 20 мин с помощью специализированной фильтрующей системы BI-SFS (Brookhaven Instruments Corp., США). Скорость потока составляла 7.8 мл/мин. Измерения скорости движения наночастиц проводили в ручном режиме, варьируя напряжение в диапазоне от 80 до 200 В. Для каждого значения напряжения средняя скорость определялась из 10–20 измерений. Для всех систем зависимости скорости от напряженности поля были линейными, что свидетельствует о выполнимости критериев “истинного” (линейного) электрофореза [11]. Электрофоретическую подвижность (μe) определяли из тангенса угла наклона, а расчет ζ-потенциала производился по формуле Хюккеля
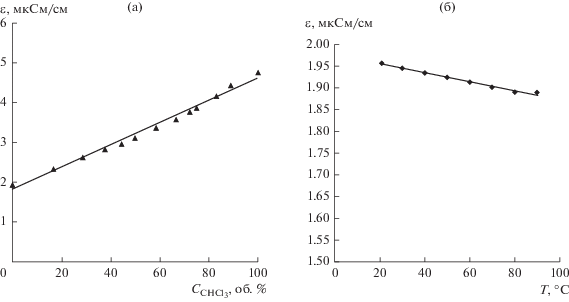
Диэлектрическую проницаемость растворителей и их смесей определяли на анализаторе диэлектрической постоянной BI-870 (Brookhaven, США). Измерение происходит путем погружения зонда, состоящего из двух стальных цилиндров, непосредственно в растворитель. Диэлектрическая постоянная жидкого образца определяется путем измерения тока между внешним и внутренним цилиндрами зонда. Зависимости диэлектрической проницаемости н-декана от температуры и диэлектрической проницаемости смеси декан–хлороформ от содержания хлороформа представлены на рис. 2.
Рис. 2.
Зависимости диэлектрической проницаемости смеси н-декан–хлороформ от содержания хлороформа (а) и н‑декана от температуры (б).
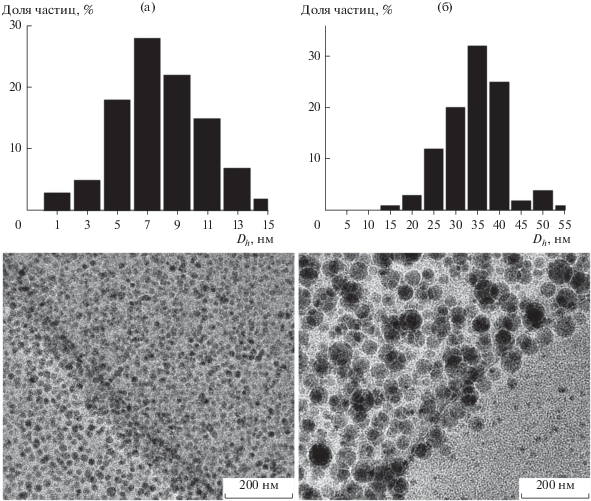
Изображения наночастиц получены с помощью просвечивающего электронного микроскопа (ПЭМ) JEM-2010 (JEOL, Япония); функции распределения строились из измерений размеров 100–500 наночастиц при разных увеличениях.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние температуры
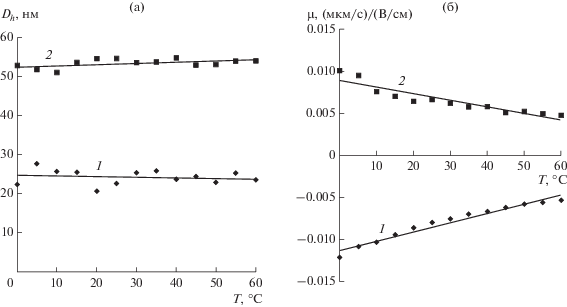
Все исследования были проведены для двух дегидратированных золей (в качестве исходных систем) на основе АОТ в декане, содержащих синтезированные наночастицы SiO2 с гидродинамическим диаметром 20 и 52 нм. По данным ПЭМ (рис. 3) диаметр наночастиц для этих исходных систем составил 7 и 35 нм соответственно. Разница в размерах, определенных методами ПЭМ и ФКС, обусловлена наличием на наночастицах развитых адсорбционных слоев, состоящих из мицелл АОТ [10]. Повышение температуры от 0 до 60°C не влияет заметным образом на эффективный гидродинамический диаметр наночастиц (рис. 4а). 20-нм частицы, синтезированные в присутствии 2 об. % 9 М раствора NH3, имеют отрицательный заряд; заряд 52-нм частиц дегидратированного золя – положительный (рис. 4б). Ранее факт перезарядки частиц SiO2 установлен при изучении влияния концентрации АОТ в растворах декана в отсутствие воды [12, 13]. Таким образом, благодаря ионной природе АОТ является для оксидов заряжающим агентом дуального действия [14]: варьируя условия синтеза можно получать положительно и отрицательно заряженные наночастицы SiO2. Абсолютная величина электрофоретической подвижности уменьшается с ростом температуры в указанном диапазоне приблизительно в два раза как для первой, так и для второй систем, вероятно, из-за частичного разрушения адсорбционных слоев (рис. 4б).
Влияние Tergitol NP-4
Смешанные микроэмульсии АОТ–Tergitol NP-4 в декане формировали добавлением к органозолям наночастиц SiO2 в растворе АОТ 0.25 М раствора Tergitol NP-4 в н-декане. В итоге суммарная концентрация ПАВ была постоянной и составляла 0.25 М.
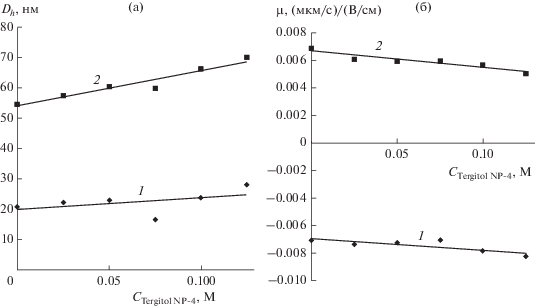
Гидродинамический диаметр наночастиц незначительно увеличивался с ростом содержания Tergitol NP-4 до 0.125 М: для частиц с исходным размером 20 нм – до 28 нм, для больших частиц (52 нм) – до 70 нм. Отметим, что для обеих зависимостей имелся минимум на кривой при содержании Tergitol NP-4, равном 0.075 М. Увеличение размеров наночастиц обусловлено, по-видимому, ростом толщины поверхностного слоя за счет дополнительной адсорбции молекул Tergitol NP-4. Электрофоретическая подвижность частиц также изменилась незначительно при увеличении содержания Tergitol NP-4 до 0.125 М (рис. 5), что вполне логично, так как слой анионного АОТ на их поверхности частично достраивается молекулами неионогенного Tergitol NP-4.
Влияние воды
По данным ФКС для каждой исходной микроэмульсии имеет место бимодальное распределение присутствующих в ней частиц по размерам с первой модой, соответствующей 2.5 нм, а второй – 20 или 52 нм. Первая мода относится к “пустым” мицеллам AOT. При добавлении 2–10 об. % воды к исходным микроэмульсиям в обоих случаях гидродинамический диаметр “пустых” мицелл АОТ возрастает с 2.5 до 9 нм (рис. 6a). Для частиц SiO2 с исходным диаметром 20 нм наблюдается незначительное уменьшение гидродинамического диаметра, а для больших частиц диаметром 52 нм – увеличение гидродинамического диаметра с выходом на плато.
Рис. 6.
Зависимости эффективного гидродинамического диаметра (а) и электрофоретической подвижности (б) наночастиц SiO2 размером 20 (1) и 52 нм (2) в микроэмульсиях 0.25 М АОТ в н-декане от содержания воды; зависимость (3) на графике (а) относится к моде “пустых” мицелл АОТ. На врезке графика (б) показана электрофоретическая подвижность частиц при низком содержании воды (0–1.2 об. %).
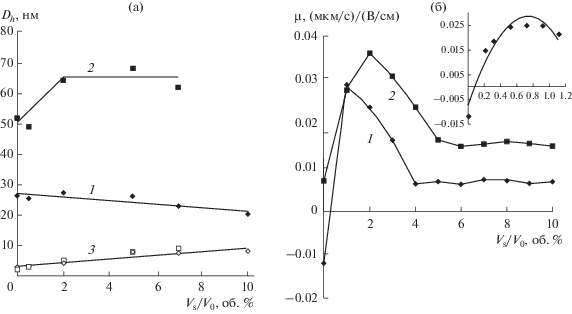
Электрофоретическая подвижность частиц SiO2 начинает изменяться уже при добавлении 0.1 об. % воды (врезка на рис. 6б). В случае малых частиц происходит перезарядка их поверхности. Заряд наночастиц в присутствии АОТ обусловлен предпочтительной адсорбцией ионов Na+ на оксиде, проявляющем гидрофильные свойства, или ионов АОТ– на оксиде с гидрофобными свойствами [15]. Очевидно, что добавление в мицеллярный раствор воды, либо содержащих ее реагентов, способствует, с одной стороны, гидратации частиц, а с другой стороны, – диссоциации молекул АОТ в обратных мицеллах. Это может приводить к росту электрофоретической подвижности частиц SiO2 и даже к их перезарядке. Общий вид зависимостей на рис. 6б для частиц разного размера совпадает. Начальные значения электрофоретической подвижности (без добавления воды) различаются из-за разного содержания водной фазы, введенной в систему в ходе синтеза, и, вероятно, разной степени ее последующей отгонки. Для золей с 20-нм наночастицами отмечен максимум μe при введении 1 об. % воды, для 52-нм наночастиц – 2 об. %. При дальнейшем добавлении воды вплоть до 4–5 об. % электрофоретическая подвижность уменьшалась и затем выходила на постоянное значение (рис. 6б). Уменьшение электрофоретической подвижности с увеличением содержания воды объясняется, по нашему мнению, электростатическим экранированием частиц заряженными мицеллами, образующимися при их столкновении по механизму диспропорционирования при концентрации ПАВ более 0.3 мас. % [16]. Более 10 об. % воды ввести в микроэмульсии не удается, так как это ведет к нестабильности золя и коагуляции наночастиц SiO2.
Влияние хлороформа
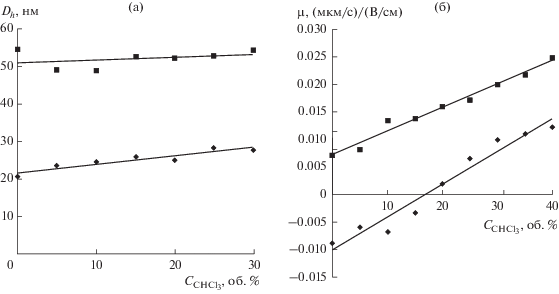
При добавлении к органозолям хлороформа гидродинамический диаметр наночастиц SiO2 практически не изменяется (рис. 7а). Электрофоретическая подвижность значительно возрастает как для наночастиц размером 20 нм, так и для 52-нм наночастиц при увеличении содержания хлороформа до 40 об. % (рис. 7б). Стоит отметить, что у 20-нм наночастиц происходит перезарядка поверхности при содержании хлороформа, равном 17 об. %. Можно предположить, что характер изменения электрофоретической подвижности объясняется как ростом полярности среды, так и введением в мицеллярные растворы воды, присутствующей в качестве примеси в хлороформе. Поэтому перезарядка частиц SiO2 происходит при содержании хлороформа на два порядка большем по сравнению с водой. Дальнейшее добавление хлороформа (до 40 об. %) приводит к бóльшим величинам электрофоретической подвижности – 0.012 (мкм/с)/(В/см) для 20-нм частиц и 0.025 (мкм/с)/(В/см) для 52-нм частиц. Однако наибольшие значения ζ-потенциала и μe наночастиц SiO2 достигаются при добавлении небольшого количества воды: для 20-нм частиц добавление 1 об. % приводит к значению μe = = 0.029 (мкм/с)/(В/см) (ζ-потенциал – 20.1 мВ), для 52-нм частиц добавление 2 об. % приводит к значению μe = 0.036 (мкм/с)/(В/см) (ζ-потенциал – 25.1 мВ).
Рис. 7.
Зависимости эффективного гидродинамического диаметра (а) и электрофоретической подвижности (б) наночастиц SiO2 размером 20 (1) и 52 нм (2) в микроэмульсиях 0.25 М АОТ в н-декане от содержания хлороформа.
Таким образом, исследована возможность регулирования гидродинамического диаметра наночастиц SiO2, а также их электрофоретической подвижности путем изменения температуры и состава микроэмульсии. Практически все зависимости гидродинамического диаметра и электрофоретической подвижности от температуры и состава микроэмульсии идентичны для частиц с гидродинамическим диаметром 20 и 52 нм. Значительный рост электрофоретической подвижности обнаружен при добавлении к микроэмульсии на основе АОТ и н-декана хлороформа и воды. Полученные данные позволят нам в дальнейшем провести электрофоретическое концентрирование наночастиц SiO2 (положительно и отрицательно заряженных) и значительно сократить время этого процесса.
Список литературы
Grayfer E.D., Kozlova M.N., Fedorov V.E. // Adv. Colloid Interface Sci. 2017. V. 245. P. 40.
Шабанова Н.А., Саркисов П.Д. Золь-гель технологии. Нанодисперсный кремнезем. М.: Бином. Лаборатория знаний, 2012.
Jankiewicz B.J., Jamiola D., Choma J., Jaroniec M. // Adv. Colloid Interface Sci. 2012. V. 170. P. 28.
West J.L., Halas N.J. // Annu. Rev. Biomed. Eng. 2003. V. 5. P. 85.
Tang F., Li L., Chen D. // Adv. Mater. 2012. V. 24. P. 1504.
Tang H., Xiang D., Wang F., Mao J., Tan X., Wang Y. // Mol. Med. Rep. 2017. V. 15. P. 1117.
Бричкин С.Б., Разумов В.Ф. // Успехи химии. 2016. Т. 85. С. 1297.
Beunis F., Strubbe F., Neyts K., Verschueren A.R.M. // Appl. Phys. Lett. 2007. V. 90. P. 182103.
Barz D.P.J., Vogel M.J., Steen P.H. // Langmuir. 2010. V. 26. P. 5.
Демидова М.Г., Шапаренко Н.О., Подлипская Т.Ю., Булавченко А.И. // Журн. неорг. химии. 2017. Т. 62. С. 729.
Kuo S., Osterle F. // J. Colloid Interface Sci. 1967. V. 25. P. 421.
Keir R.I., Suparno, Thomas J.C. // Langmuir. 2002. V. 18. P. 1463.
Булавченко А.И., Сапьяник А.А., Демидова М.Г., Рахманова М.И., Поповецкий П.С. // Журн. физ. химии. 2015. Т. 89. С. 812.
Gacek M., Brooks G., Berg J.C. // Langmuir. 2012. V. 28. P. 3032.
Poovarodom S., Poovarodom S., Berg J.C. // J. Colloid Interface. Sci. 2010. V. 351. P. 415.
Gacek M., Bergsman D., Michor E., Berg J.C. // Langmuir. 2012. V. 28. P. 11 633.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал