Коллоидный журнал, 2019, T. 81, № 1, стр. 16-23
Адсорбционные комплексы пуриновых нуклеотидов на поверхности диоксида титана
Н. Н. Власова 1, *, О. В. Маркитан 1
1 Институт химии поверхности им. А.А. Чуйко Национальной академии наук Украины
03164 Киев, ул. генерала Наумова, 17,
Украина
* E-mail: natalie.vlasova@gmail.com
Поступила в редакцию 07.08.2018
Аннотация
Показано, что при адсорбции пуриновых нуклеотидов из водных растворов на поверхности нанокристаллического диоксида титана образуются внешнесферные электростатические комплексы. Рассчитаны константы устойчивости адсорбционных комплексов, в которых анионные формы нуклеотидов связаны с протонированными группами диоксида титана.
ВВЕДЕНИЕ
Наноразмерные материалы находят все большее применение в различных отраслях техники, науки и медицины [1–3]. Благодаря набору уникальных свойств [4] наноразмерный диоксид титана широко используется в биомедицине [5], что делает особенно необходимым понимание природы взаимодействий его поверхностных групп с биообъектами [6–8]. Такие контакты сложны, поскольку они включают в себя образование множества различных по природе связей с участием многочисленных группировок биомолекул и функциональных групп поверхности твердого тела. Исследования взаимодействий поверхности наноразмерных оксидов с мономерными биомолекулами – нуклеотидами, аминокислотами, моносахаридами, из которых образуются соответствующие биополимеры, могут служить основой установления механизма на молекулярном уровне.
Целью настоящего исследования было получение количественных характеристик адсорбции нуклеотидов пуринового ряда и определение механизма их взаимодействия с поверхностью диоксида титана.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали нанокристаллический порошок диоксида титана (Aldrich) с удельной поверхностью 62 ± 5 м2/г (Nova 1200, Quantachrome), который по данным рентгенофазового анализа представляет собой анатаз с размером частиц 30 нм, что соответствует величине, заявленной производителем (<25 нм).
Пуриновые нуклеотиды в виде натриевых солей – аденозин-5'-монофосфат (АМФ, “ч.”, Reanal), гуанозин-5'-монофосфат (ГМФ, “ч.”, Reanal) и инозин-5'-монофосфат (ИМФ, “ч. д. а.”, Sigma) и хлорид натрия (“ч. д. а.”, Merck) были использованы без дополнительной очистки.
Для установления необходимых значений pH растворов и суспензий применяли стандарт-титры HCl и NaOH (Titrisol, Merck, Германия). Все растворы и суспензии были приготовлены на бидистиллированной воде.
Адсорбцию пуриновых нуклеотидов изучали при температуре 20 ± 2°C по методике, подробно описанной в [9].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействие пуриновых нуклеотидов и функциональных групп диоксида титана было интерпретировано как образование адсорбционных комплексов. В состав таких комплексов могут входить протонированные в различной степени нуклеотиды и гидроксильные группы сорбента.
Нуклеотиды являются мономерными единицами нуклеиновых кислот, состоящими из гетероциклического основания, в котором атом водорода при одном из атомов азота замещен фосфорилированным углеводным остатком. Кроме обычных пуриновых оснований – аденина и гуанина в составе нуклеиновых кислот встречается “минорное” основание гипоксантин, нуклеозид которого называется инозин, а соответствующий нуклеотид – инозинмонофосфат.
Формулы исследованных пуриновых мононуклеотидов и константы их ионизации, рассчитанные для разных значений ионной силы, представлены в табл. 1.
Таблица 1.
Константы ионизации пуриновых мононуклеотидов
| Нуклеотид | Константы ионизации | |
|---|---|---|
| lg Ka1 (–NH+) | lg Ka2 (–OP(=O)(OH)O–) | |
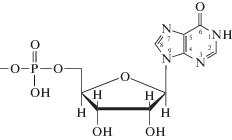 |
–6.19 0.1 M [9] | |
| –6.47 0.01 M | ||
| –6.59 0.001 M | ||
| Инозин-5'-монофосфат, HL– | ||
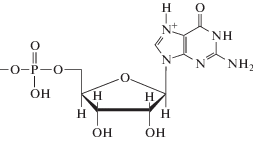 |
–N7H+ | |
| –2.32 0.1 M [9] | –6.20 0.1 M [9] | |
| –2.48 0.01 M | –6.48 0.01 M | |
| –2.54 0.001 M | –6.66 0.001 M | |
| Гуанозин-5'-монофосфат, H2L± | ||
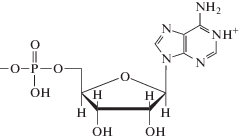 |
–N1H+ | |
| –3.80 0.1 M [9] | –6.18 0.1 M [9] | |
| –3.96 0.01 M | –6.46 0.01 M | |
| –4.01 0.001 M | –6.58 0.001 M | |
| Аденозин-5'-монофосфат, H2L± | ||
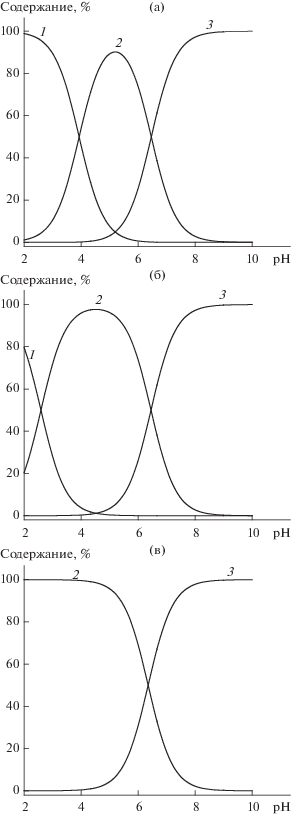
Атомы азота пуринового кольца изученных нуклеотидов существенно различаются по оснóвности. Отщепление протона от группы N1–Н+ аденозин-5'-монофосфата происходит при pH ~ 4; депротонирование группы N7–Н+ гуанозин-5'-монофосфата наблюдается при pH > 2.3; атом азота N7 инозин-5'-монофосфата протонирован только в очень кислых растворах. К этим кислотно-основным равновесиям добавляются общие для всех мононуклеотидов реакции ионизации фосфатных групп. В табл. 1 приведены константы ионизации вторичной фосфатной группы, поскольку отщепление протона от первичной группы происходит в кислой области (рН < 2). На рис. 1 представлены диаграммы распределения различных форм изученных пуриновых нуклеотидов в зависимости от pH.
Рис. 1.
Диаграммы распределения частиц АМФ (а), ГМФ (б) и ИМФ (в) в растворе в зависимости от pH: цвиттер-ион H2L± (1), моноанион HL– (2) и дианион L2– (3).
Для того чтобы выбрать возможные реакции комплексообразования необходимо учесть состояние функциональных групп поверхности оксида и формы, в виде которых адсорбирующиеся вещества присутствуют в растворе в зависимости от pH.
Для интерпретации экспериментальных данных о зависимости адсорбции пуриновых нуклеотидов от pH и ионной силы были использованы основная модель комплексообразования на поверхности Штерна [11] и программа GRFIT [12]. В соответствии с положениями этой модели на поверхности оксида присутствуют нейтральные (≡TiOH), протонированные ($ \equiv {\kern 1pt} {\text{TiOH}}_{2}^{ + }$) и ионизированные (≡TiO–) группы, которые частично связаны с ионами фонового электролита, образуя внешнесферные комплексы – ионные пары (≡Ti${\text{OH}}_{2}^{ + }$Cl– и ≡TiO–Na+). В кислой среде гидроксильные группы в основном протонированы, при pH выше точки нулевого заряда (6.5) преобладают ионизированные группы [13]. Поверхность подразделяется на 2 плоскости, одна из которых обозначается символом 0, в ней непосредственно происходит адсорбция потенциалопределяющих ионов и сильно сорбирующихся веществ. Во второй плоскости, обозначенной символом 1, располагаются противоионы фонового электролита и слабо сорбирующиеся вещества. Частицы, расположенные в этих плоскостях, определяют величину и знак заряда поверхности.
При моделировании кислотно-основных свойств и адсорбционных кривых по программе GRFIT составляется матрица компонентов, взаимодействие которых приводит к образованию всех частиц в системе. К материальным компонентам относятся гидроксильные группы диоксида титана, ионы фонового электролита, адсорбат и протоны. Кроме того, матрица компонентов дополняется электрическими составляющими ехр0 и ехр1, которые соответствуют величинам зарядов частиц в плоскостях 0 и 1. Матрица частиц для системы диоксид титана–нуклеотид–хлорид натрия приведена в табл. 2. В матрице представлены реакции протонирования и ионизации функциональных групп поверхности, их взаимодействия с ионами Na+ и Cl–, а также реакции ионизации нуклеотидов. Концентрация OH–-групп задается через ионное произведение воды при данной ионной силе. Константы равновесия реакций образования комплексов на поверхности, отмеченные звездочкой, подбираются при обработке экспериментальных данных с помощью программы. В качестве исходного компонента нуклеотида может быть выбрана любая его форма, присутствующая в растворе. В табл. 2 первые 9 частиц одинаковы для всех исходных компонентов – цвиттер-иона, моно- и дианионов. Частицы нуклеотидов 10−12, которые находятся в равновесии в водном растворе, и образующиеся на поверхности (13, 14), различаются стехиометрией по протонам и величинами констант равновесия соответствующих реакций.
Таблица 2.
Матрица частиц, образующихся в системе TiO2–АМФ–NaCl (0.01 М)
| Частица | Компоненты | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| TiOH | exp0 | exp1 | Na+ | Cl– | H2L± | H+ | lg K | ||
| 1 | TiOH | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 2 | ${\text{TiOH}}_{2}^{ + }$ | 1 | 1 | 0 | 0 | 0 | 0 | 1 | 5.2 |
| 3 | TiO– | 1 | –1 | 0 | 0 | 0 | 0 | –1 | –7.8 |
| 4 | ${\text{TiOH}}_{2}^{ + }$Cl– | 1 | 1 | –1 | 0 | 1 | 0 | 1 | 6.2 |
| 5 | TiO–Na+ | 1 | –1 | 1 | 1 | 0 | 0 | –1 | –6.8 |
| 6 | Na+ | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| 7 | Cl– | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| 8 | H+ | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| 9 | OH– | 0 | 0 | 0 | 0 | 0 | 0 | –1 | –13.92 |
| Исходный компонент – цвиттер-ион H2L± | |||||||||
| 10 | H2L± | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| 11 | HL– | 0 | 0 | 0 | 0 | 0 | 1 | –1 | –3.95 |
| 12 | L2– | 0 | 0 | 0 | 0 | 0 | 1 | –2 | –10.42 |
| 13 | ${\text{TiOH}}_{2}^{ + }$HL– | 1 | 1 | –1 | 0 | 0 | 1 | 0 | |
| 14 | ${\text{TiOH}}_{2}^{ + }$L2– | 1 | 1 | –2 | 0 | 0 | 1 | –1 | |
| Исходный компонент – анион HL– | |||||||||
| TiOH | exp0 | exp1 | Na+ | Cl– | HL– | H+ | lg K | ||
| 10 | HL– | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| 11 | H2L± | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 3.95 |
| 12 | L2– | 0 | 0 | 0 | 0 | 0 | 1 | –1 | –6.47 |
| 13 | ${\text{TiOH}}_{2}^{ + }$HL– | 1 | 1 | –1 | 0 | 0 | 1 | 1 | |
| 14 | ${\text{TiOH}}_{2}^{ + }$L2– | 1 | 1 | –2 | 0 | 0 | 1 | 0 | |
| Исходный компонент – дианион L2– | |||||||||
| TiOH | exp0 | exp1 | Na+ | Cl– | L2– | H+ | lg K | ||
| 10 | L2– | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| 11 | HL– | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 6.47 |
| 12 | H2L± | 0 | 0 | 0 | 0 | 0 | 1 | 2 | 10.42 |
| 13 | ${\text{TiOH}}_{2}^{ + }$HL– | 1 | 1 | –1 | 0 | 0 | 1 | 2 | |
| 14 | ${\text{TiOH}}_{2}^{ + }$L2– | 1 | 1 | –2 | 0 | 0 | 1 | 1 | |
Реакции комплексообразования на поверхности и соответствующие им константы равновесия реакций могут быть записаны различным образом в зависимости от выбора исходной частицы.
Исходный компонент цвиттер-ион H2L±:
(1)
$\begin{gathered} \quad \equiv {\kern 1pt} {\text{TiOH}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{ \pm }}{\text{ }} \leftrightarrows \,\, \equiv {\kern 1pt} {\text{TiOH}}_{2}^{ + }{\text{H}}{{{\text{L}}}^{ - }}, \\ K_{{{\text{1S}}}}^{{{{{\text{H}}}_{{\text{2}}}}{\text{L}}}} = \frac{{{\text{[TiOH}}_{{\text{2}}}^{ + }{\text{H}}{{{\text{L}}}^{ - }}{\text{]}}}}{{{\text{[TiOH][}}{{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{ \pm }}{\text{]}}}}\exp {{(F({{\Psi }_{0}} - {{\Psi }_{1}})} \mathord{\left/ {\vphantom {{(F({{\Psi }_{0}} - {{\Psi }_{1}})} {RT)}}} \right. \kern-0em} {RT)}}, \\ \end{gathered} $(2)
$\begin{gathered} \equiv {\kern 1pt} {\text{TiOH}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{ \pm }} \leftrightarrows \,\, \equiv {\kern 1pt} {\text{TiOH}}_{2}^{ + }{{{\text{L}}}^{{2 - }}} + {{{\text{H}}}^{ + }}, \\ K_{{{\text{2S}}}}^{{{{{\text{H}}}_{{\text{2}}}}{\text{L}}}} = \frac{{{\text{[TiOH}}_{{\text{2}}}^{ + }{{{\text{L}}}^{{{\text{2}} - }}}{\text{][}}{{{\text{H}}}^{ + }}{\text{]}}}}{{{\text{[TiOH][}}{{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{ \pm }}{\text{]}}}}\exp (F({{{{\Psi }_{0}} - 2{{\Psi }_{1}})} \mathord{\left/ {\vphantom {{{{\Psi }_{0}} - 2{{\Psi }_{1}})} {RT}}} \right. \kern-0em} {RT}}). \\ \end{gathered} $Исходный компонент моноанион HL–:
(3)
$\begin{gathered} \equiv {\kern 1pt} {\text{TiOH}} + {{{\text{H}}}^{ + }} + {\text{H}}{{{\text{L}}}^{--}} \leftrightarrows \,\, \equiv {\kern 1pt} {\text{TiOH}}_{2}^{ + }{\text{H}}{{{\text{L}}}^{ - }}, \\ K_{{{\text{1S}}}}^{{{\text{HL}}}} = \frac{{{\text{[TiOH}}_{{\text{2}}}^{ + }{\text{H}}{{{\text{L}}}^{ - }}{\text{]}}}}{{{\text{[TiOH][}}{{{\text{H}}}^{ + }}{\text{][H}}{{{\text{L}}}^{ - }}{\text{]}}}}\exp (F{{({{\Psi }_{0}} - {{\Psi }_{1}})} \mathord{\left/ {\vphantom {{({{\Psi }_{0}} - {{\Psi }_{1}})} {RT)}}} \right. \kern-0em} {RT)}}, \\ \end{gathered} $(4)
$\begin{gathered} \equiv {\kern 1pt} {\text{TiOH}} + {\text{H}}{{{\text{L}}}^{--}} \leftrightarrows \,\, \equiv {\kern 1pt} {\text{TiOH}}_{2}^{ + }{{{\text{L}}}^{{2 - }}}, \\ K_{{{\text{2S}}}}^{{{\text{HL}}}} = \frac{{{\text{[TiOH}}_{{\text{2}}}^{ + }{{{\text{L}}}^{{{\text{2}} - }}}{\text{]}}}}{{{\text{[TiOH][H}}{{{\text{L}}}^{ - }}{\text{]}}}}\exp (F{{({{\Psi }_{0}} - 2{{\Psi }_{1}})} \mathord{\left/ {\vphantom {{({{\Psi }_{0}} - 2{{\Psi }_{1}})} {RT)}}} \right. \kern-0em} {RT)}}. \\ \end{gathered} $Исходный компонент дианион L2–:
(5)
$\begin{gathered} \equiv {\kern 1pt} {\text{TiOH}} + {\text{2}}{{{\text{H}}}^{ + }} + {{{\text{L}}}^{{{\text{2}}--}}} \leftrightarrows \,\, \equiv {\kern 1pt} {\text{TiOH}}_{2}^{ + }{\text{H}}{{{\text{L}}}^{ - }}, \\ K_{{{\text{1S}}}}^{{\text{L}}} = \frac{{{\text{[TiOH}}_{{\text{2}}}^{ + }{\text{H}}{{{\text{L}}}^{ - }}{\text{]}}}}{{{\text{[TiOH][}}{{{\text{H}}}^{ + }}{{{\text{]}}}^{{\text{2}}}}{\text{[}}{{{\text{L}}}^{{{\text{2}} - }}}{\text{]}}}}\exp {{(F({{\Psi }_{0}} - {{\Psi }_{1}})} \mathord{\left/ {\vphantom {{(F({{\Psi }_{0}} - {{\Psi }_{1}})} {RT)}}} \right. \kern-0em} {RT)}}, \\ \end{gathered} $(6)
$\begin{gathered} \equiv {\kern 1pt} {\text{TiOH}} + \quad{\text{ }}{{{\text{H}}}^{ + }} + {{{\text{L}}}^{{{\text{2}}--}}} \leftrightarrows \,\, \equiv {\kern 1pt} {\text{TiOH}}_{2}^{ + }{{{\text{L}}}^{{2 - }}}, \\ K_{{{\text{2S}}}}^{{\text{L}}} = \frac{{[{\text{TiOH}}_{{\text{2}}}^{ + }{{{\text{L}}}^{{{\text{2}} - }}}]}}{{[{\text{TiOH][}}{{{\text{H}}}^{ + }}{\text{][}}{{{\text{L}}}^{{{\text{2}} - }}}]}}\exp (F{{({{\Psi }_{0}} - 2{{\Psi }_{1}})} \mathord{\left/ {\vphantom {{({{\Psi }_{0}} - 2{{\Psi }_{1}})} {RT}}} \right. \kern-0em} {RT}}). \\ \end{gathered} $В уравнениях констант равновесия коэффициенты при значениях потенциалов (${{\Psi }_{0}}$ и ${{\Psi }_{1}}$) соответствуют величинам зарядов в плоскостях 0 и 1. Заряд протонированной группы $ \equiv {\kern 1pt} {\text{TiOH}}_{2}^{ + }$ в плоскости 0 равен +1, а заряд в плоскости 1 определяется зарядом частицы нуклеотида, которая образует адсорбционный комплекс: –1 или –2.
Так, образование комплекса с однозарядным анионом ≡Ti${\text{OH}}_{2}^{ + }$HL– по уравнению (1) не сопровождается выделением или поглощением протона, по уравнению (3) один протон присоединяется к гидроксильной группе TiO2. Образование этого же комплекса по уравнению (5) требует присоединения 2 протонов, один из которых необходим для протонирования TiOH-группы, а другой – для образования однозарядного аниона из двухзарядного. Аналогичные рассуждения можно привести для образования комплекса с двухзарядным анионом.
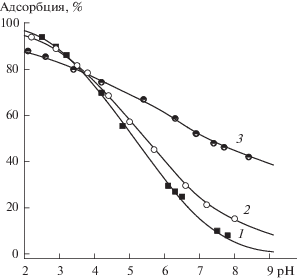
На рис. 2 приведены кривые зависимости адсорбции пуриновых нуклеотидов из водных растворов на поверхности TiO2 от pH. Адсорбционные кривые исследованных пуриновых нуклеотидов различаются только в кислой области, выше pH 5 они практически совпадают. Это, по-видимому, связано с разной оснóвностью атомов азота пуринового кольца и зарядом исходной частицы. Так, для ИМФ исходная частица – моноанион, для АМФ и ГМФ – цвиттер-ионные формы, различающиеся величинами констант депротонирования азотистых оснований. Наличие максимумов на адсорбционных кривых АМФ и ГМФ свидетельствует о том, что частицы с положительным зарядом на атоме азота пуринового кольца не адсорбируются на поверхности диоксида титана. Рост адсорбции наблюдается после значения pH, примерно соответствующего константе депротонирования. Уменьшение адсорбции всех нуклеотидов при pH > 6–7 можно объяснить отталкиванием одноименно заряженных анионов и ионизированных поверхностных групп. Вероятно, анионные формы нуклеотидов взаимодействуют с протонированными гидроксильными группами диоксида титана. При этом образуются внешнесферные комплексы, компоненты которых связаны электростатическими связями. Подтверждением этому может служить зависимость адсорбции ИМФ от ионной силы раствора (рис. 3). В кислой области проявляется конкуренция фосфат-анионов с анионами фонового электролита: чем больше концентрация последнего, тем меньше адсорбция фосфатных анионов. При увеличении pH адсорбция из растворов с высокой ионной силой становится больше по сравнению с адсорбцией из менее концентрированных растворов. По-видимому, это является следствием повышения концентрации протонированных групп с увеличением ионной силы раствора.
Рис. 2.
Адсорбция ИМФ (1), ГМФ (2) и АМФ (3) на поверхности диоксида титана в зависимости от pH; CПМФ = = 0.1 ммоль/л, ${{C}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}}$ = 1 г/л, 0.01 М NaCl.
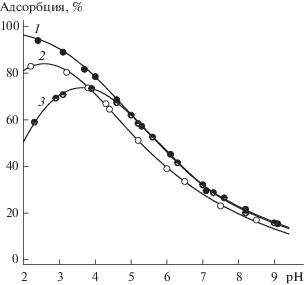
Рис. 3.
Адсорбция ИМФ на поверхности диоксида титана в зависимости от pH при разной ионной силе раствора: 0.001 (1), 0.01 (2) и 0.1 М NaCl (3); CИМФ = 0.1 ммоль/л, ${{C}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}}$ = 1 г/л.
Константы равновесия всех реакций комплексообразования были определены по программе GRFIT, при работе которой эти величины подбираются таким образом, чтобы разница между экспериментальными и рассчитанными значениями была минимальной. В табл. 3 приведены константы равновесия реакций образования комплексов АМФ по всем шести уравнениям реакций. Оказалось, что все эти константы могут быть пересчитаны в константы устойчивости комплексов с учетом констант равновесия реакций протонирования ТiОН-групп диоксида титана и реакций ионизации/протонирования нуклеотида:
Таблица 3.
Константы равновесия реакций (lg KnS), рассчитанные для различных исходных компонентов (АМР), и константы устойчивости комплексов на поверхности (lg KSC)
| Комплекс AMP на поверхности |
Исходный компонент | |||||
|---|---|---|---|---|---|---|
| H2L± | HL– | L2– | ||||
| lg KnS | lg KSC | lg KnS | lg KSC | lg KnS | lg KSC | |
| ${\text{TiOH}}_{2}^{ + }$HL– (n = 1) | 6.67 | 5.43 | 10.60 | 5.40 | 17.13 | 5.47 |
| ${\text{TiOH}}_{2}^{ + }$L2– (n = 2) | 1.37 | 6.59 | 5.36 | 6.62 | 11.78 | 6.58 |
Константы устойчивости одного и того же комплекса, как и ожидалось, оказались одинаковыми: для однозарядного аниона АМФ ${\text{lg}}K_{{{\text{SC}}}}^{{{\text{HL}}}}$ = = 5.43 ± 0.04, для двухзарядного аниона ${\text{lg}}K_{{{\text{SC}}}}^{{\text{L}}}$ = = 6.60 ± 0.02, – поскольку они определяют прочность связывания между одними и теми же частицами.
Выбранные реакции комплексообразования и рассчитанные для них константы равновесия позволяют воспроизвести адсорбционные кривые всех исследованных нуклеотидов (табл. 4). Константы устойчивости комплексов одного и того же типа для разных нуклеотидов примерно одинаковы: ${\text{lg}}K_{{{\text{SC}}}}^{{{\text{HL}}}}$ комплексов с однозарядным анионом изменяется от 5.11 до 5.40, ${\text{lg}}K_{{{\text{SC}}}}^{{\text{L}}}$ комплексов с двухзарядным анионом − от 6.18 до 6.60. Комплексы с двухзарядным анионом более устойчивы, чем комплексы с однозарядным анионом. Такая же закономерность наблюдается и для комплексных соединений неорганического фосфата с ионами некоторых переходных металлов: константы устойчивости комплексов ионов меди Cu(H2PO4)+ и Cu(HPO4) различаются на 2 порядка [14], а для ионов Fe(III) даже больше [15]. Влияние пуриновых оснований на устойчивость комплексов на поверхности невелико, что, по-видимому, связано с участием в адсорбционных взаимодействиях одинаковых для всех нуклеотидов фосфат-анионов. Сходство адсорбционных кривых пуриновых нуклеотидов и неорганического фосфата [9] служит подтверждением этого предположения.
Таблица 4.
Константы равновесия реакций комплексообразования и константы устойчивости комплексов ИМФ и ГМФ
| Ионная сила (NaCl, M) |
ИМФ | ГМФ | ||||||
|---|---|---|---|---|---|---|---|---|
| ${\text{TiOH}}_{2}^{ + }$HL– | ${\text{TiOH}}_{2}^{ + }$L2– | ${\text{TiOH}}_{2}^{ + }$HL– | ${\text{TiOH}}_{2}^{ + }$L2– | |||||
| lg K1S | lg KSC | lg K2S | lg KSC | lg K1S | lg KSC | lg K1S | lg KSC | |
| 0.1 | 10.38 | 5.18 | 5.20 | 6.19 | ||||
| 0.01 | 10.37 | 5.17 | 4.91 | 6.18 | 7.84 | 5.11 | 2.71 | 6.46 |
| 0.001 | 10.35 | 5.15 | 4.81 | 6.20 | ||||
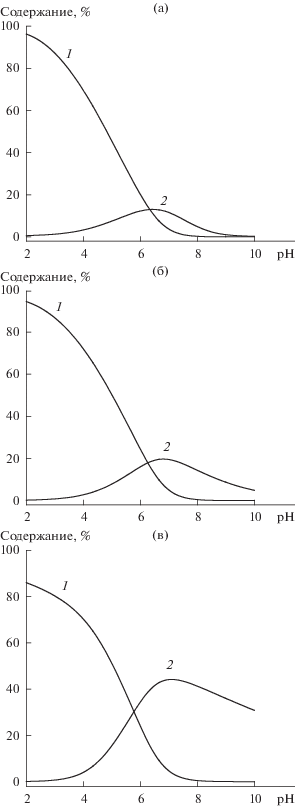
На основании рассчитанных констант равновесия реакций были построены диаграммы распределения адсорбционных комплексов нуклеотидов на поверхности диоксида титана в зависимости от pH. На рис. 4 в качестве примера приведены диаграммы распределения комплексов ИМФ, образующихся на поверхности TiO2 при адсорбции из растворов с различной концентрацией фонового электролита. Следует отметить, что кривые, отражающие содержание различных комплексов, пересекаются при pH > 6. Эта величина соответствует константе ионизации однозарядного аниона, т.е. ионизация адсорбированного однозарядного аниона на поверхности происходит примерно при тех же значениях рН, что и в растворе.
Рис. 4.
Диаграммы распределения адсорбционных комплексов ИМФ $ \equiv {\kern 1pt} {\text{TiOH}}_{2}^{ + }$HL– (1) и $ \equiv {\kern 1pt} {\text{TiOH}}_{2}^{ + }$L2– (2) на поверхности диоксида титана в зависимости от pH при разной ионной силе раствора: 0.001 (а), 0.01 (б) и 0.1 М NaCl (в).
Таким образом, установлено, что пуриновые нуклеотиды адсорбируются из водных растворов на поверхности диоксида титана с образованием устойчивых комплексов одно- и двухзарядных анионов. Можно предположить, что и нуклеиновые кислоты, в составе которых активные группы оснований заняты в образовании водородных связей, а фосфатные группы свободны, взаимодействуют с поверхностью диоксида титана с формированием подобных комплексов.
Список литературы
Moyano D.F., Rotello V.M. // Langmuir. 2011. V. 27. P. 10 376.
Lee J., Mahendra S., Alvarez P.J.J. // ACS Nano. 2010. V. 4. P. 3580.
Moghimi S.M., Hunter A.C., Murray J.C. // FASEB J. 2005. V. 19. P. 311.
Fishre J., Egerton T.A. Titanium Compounds. In: Inorganic Kirk-Othmer Encyclopedia of Chemical Technology. New York: Wiley-Interscience, 2001.
Ai J., Biazar E., Jafarpour M. et al. // Int. J. Nanomed. 2011. V. 6. P. 1117.
Stark W.J. // Angew. Chem. Int. Ed. 2011. V. 50. P. 1242.
Shemetov A.A., Nabiev I., Sukhanova A. // ACS Nano. 2012. V. 6. P. 5668.
Gagner J.E., Shrivastava S., Qian X. et al. // J. Phys. Chem. Lett. 2012. V. 3. P. 3149.
Власова Н.Н., Маркитан О.В. // Коллоид. журн. 2018. Т. 80. С. 379.
Smith R.M., Martell A.E., Chen Y. // Pure Appl. Chem. 1991. V. 63. P. 1015.
Westall J.C., Hohl H. // Adv. Colloid Interface Sci. 1980. V. 12. P. 265.
Ludwig Chr. GRFIT, a Program for Solving Speciation Problems, Evaluation of Equilibrium Constants, Concentrations, and Other Physical Parameters. Internal Report of University of Bern, 1992.
Власова Н.Н., Маркитан О.В., Головкова Л.П. // Коллоид. журн. 2015. Т. 77. С. 441.
Childs C.W. // Inorg. Chem. 1970. V. 9. P. 2465.
Galal-Gorchev H., Stumm W. // J. Inorg. Nucl. Chem. 1963. V. 25. P. 567.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


