Коллоидный журнал, 2019, T. 81, № 6, стр. 788-794
Взаимодействие тиосемикарбазидов с цианопропилсиликагелем
А. В. Ульянов 1, К. Е. Полунин 1, И. А. Полунина 1, А. К. Буряк 1, *
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, Россия
* E-mail: akburyak@mail.ru
Поступила в редакцию 17.04.2019
После доработки 21.04.2019
Принята к публикации 24.04.2019
Аннотация
Исследовано взаимодействие этил-, аллил- и фенилдиметилтиосемикарбазида с силикагелем с привитыми цианопропильными группами в водных и органических растворах в условиях жидкостной хроматографии с нормальными и обращенными фазами. Изучено влияние состава подвижной фазы и температуры на процессы разделения реакционных смесей тиосемикарбазидов и изотиоцианатов на колонке Zorbax-CN. Обнаружено, что последовательность выделения этил-, аллил- и фенилдиметилтиосемикарбазида одинакова при использовании их водных и органических растворов. Проведено сопоставление селективности силикагелей с привитыми цианопропильными и октадецильными группами. Определены термодинамические параметры адсорбции тиосемикарбазидов на химически модифицированных силикагелях.
ВВЕДЕНИЕ
Интерес к тиосемикарбазидам и соединениям, полученным на их основе, обусловлен наличием в их ряду значительного количества биологически и физиологически активных соединений [1]. Тиосемикарбазиды проявляют антибактериальную, противоопухолевую, противовоспалительную, фунгицидную, инсектицидную и гербицидную активность, могут выступать в качестве регуляторов роста растений [1–3]. Это – полифункциональные соединения с несколькими активными реакционными центрами (атомы азота и серы, а также их комбинации). Свойства динуклеофилов, характерные для тиосемикарбазидов, позволяют широко использовать их в синтезе биологически активных триазолов, пиразолов, оксазолов, тиадиазинов, триазинов и других азотсодержащих гетероциклов [1]. Кроме того, тиосемикарбазиды способны образовывать комплексы с катионами металлов и широко применяются для обнаружения Pt, Cd, Ni и Hg [4]. В [5, 6] тиосемикарбазиды было предложено использовать в качестве дериватов алкилгидразинов при проведении хроматографического анализа несимметричного диметилгидразина в объектах окружающей среды и исследовано их взаимодействие с гидрофобными сорбентами (полидиметилсилоксаном и пористым графитированным углеродом) в условиях газовой и жидкостной хроматографии.
Цианопропилсиликагель, или силикагель с привитыми цианопропильными группами (SiO2-RCN), относится к сорбентам средней полярности, хотя RCN-группа имеет довольно значительный дипольный момент (4.0 Д) [7]. Однако, как отмечается в [8, 9], полярность сорбентов не вполне коррелирует с полярностью привитых органических соединений из-за взаимного влияния привитых групп и их взаимодействия с поверхностью сорбента и растворителем. Цианопропилсиликагель гидролитически устойчив при pH 1–8, в отличие от силикагеля, и поэтому с успехом может использоваться для анализа полярных соединений в системах с водными и органическими растворителями методами высокоэффективной жидкостной хроматографии с нормальными и обращенными фазами (НФ ВЭЖХ и ОФ ВЭЖХ), а также методом гидрофильной хроматографии [8–12]. Привитый слой цианопропильных радикалов имеет структуру “щетки”, т.е. радикалы ориентированы перпендикулярно поверхности, в отличие от слоя октадецильных радикалов, в котором они расположены относительно поверхности силикагеля хаотично (неупорядоченно). Кроме того, RCN-группы могут взаимодействовать с остаточными OH-группами модифицированного силикагеля, образуя арочные структуры [8]. Наличие диполя в виде CN-группы облегчает ионные и координационные взаимодействия с поляризуемыми соединениями. Как установлено в [8], селективность удерживания бензола и гексана на SiO2-RCN практически одинакова, т.е. вклад специфических взаимодействий цианофазы с бензолом незначителен. Цианопропилсиликагель способен к образованию слабых водородных связей в качестве их акцептора, но на его поверхности почти не образуется слоя воды в режиме гидрофильной хроматографии [11].
По данным [9–12] сорбционные свойства SiO2-RCN в НФ ВЭЖХ напоминают свойства полярного силикагеля. Оба сорбента используются для разделения аминов, карбоновых кислот, спиртов, альдегидов, кетонов, пестицидов и лекарственных препаратов в органических средах. Однако присутствие CN-группы иногда изменяет селективность сорбента [10]. Вклады некоторых функциональных групп в удерживание на SiO2-RCN примерно в 5 раз меньше соответствующих вкладов в удерживание на силикагеле [8]. Поэтому применение неподвижных цианофаз наиболее выгодно, когда требуется с помощью одной хроматограммы зарегистрировать ряд соединений, сильно различающихся по полярности.
В режиме ОФ ВЭЖХ цианопропилсиликагель широко используется для разделения основных, кислых и нейтральных соединений в водно-органических средах. Помимо неспецифических гидрофобных взаимодействий сорбент способен к взаимодействиям с полярными группами молекул сорбатов и растворителей. В результате селективность систем на основе SiO2-RCN будет отличаться от селективности традиционных систем, например, на основе октадецилсиликагеля (SiO2-C18). Замена октадецилсиликагеля на цианопропилсиликагель в режиме ОФ ВЭЖХ может служить средством изменения селективности разделения смеси анализируемых соединений, так же как изменение полярности растворителя при переходе от НФ к ОФ ВЭЖХ [8]. Влияние температуры на удерживание соединений на SiO2-RCN изучено мало, но имеются сведения, что фактор удерживания должен уменьшаться с ростом температуры [8].
Цель работы – исследование взаимодействия тиосемикарбазидов с цианопропилсиликагелем в водных и органических средах методами НФ и ОФ ВЭЖХ, а также изучение возможности применения SiO2-RCN для разделения смесей тиосемикарбазидов и их отделения от изотиоцианатов, используемых в качестве реагентов при синтезе тиосемикарбазидов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве сорбента использовали силикагель с привитыми цианопропильными группами, упакованный в колонку Zorbax-CN (DuPont Instruments, США) размером 4.6 × 150 мм. Удельная поверхность сорбента по БЭТ – 180 м2/г, размер зерна – 5 мкм, диаметр пор – 70 Å, содержание углерода в модифицирующем слое равно 7%. Для сравнения использовали силикагель с привитыми октадецильными группами, упакованный в колонку Zorbax-С18 (Zorbax Eclipse XDB C18, Agilent Technologies, США) размером 4.6 × 150 мм. Удельная поверхность сорбента по БЭТ – 180 м2/г, размер зерна – 5 мкм, диаметр пор – 80 Å, содержание углерода в модифицирующем слое – 20%.
Хроматографический анализ проводили на жидкостном хроматографе Agilent 1200 Series с диодно-матричным УФ-детектором Agilent G1315B и программным обеспечением ChemStation А.10.02 (Agilent Technologies, США). Хроматографические разделения проводили в изократическом режиме при скорости элюента 0.5 мл/мин и объеме вводимой пробы 20 мкл. В зависимости от режима хроматографирования в качестве элюентов использовали смесь н-гексана с пропанолом-2 или воду с добавкой метанола. Также использовались модификаторы – тетрагидрофуран, дихлорэтан, диэтиламин. Все растворители от Sigma-Aldrich (США) имели квалификацию HPLC. Идентификацию соединений проводили по их поглощению в области 240 нм [6].
4-Этил-1,1-диметилтиосемикарбазид (I), 4-аллил-1,1-диметилтиосемикарбазид (II) и 4-фенил-1,1-диметилтиосемикарбазид (III) были получены в результате взаимодействия 1,1-диметилгидразина с этил-, аллил- и фенилизотиоцианатом (RNCS, где R – Et, All и Ph соответственно) при комнатной температуре [5, 6].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 приведены данные о влиянии состава подвижной фазы на хроматографическое поведение 4-аллил-1,1-диметилтиосемикарбазида II в системе Zorbax-CN/н-гексан с добавками различных органических модификаторов (дихлорметана, тетрагидрофурана, пропанола-2 и диэтиламина).
Рис. 1.
Влияние состава подвижной фазы на время удерживания 4-аллил-1,1-диметилтиосемикарбазида на колонке Zorbax-CN: 1 – дихлорметан/н-гексан (30/70 по объему), 2 – тетрагидрофуран/н-гексан (30/70), 3 – пропанол-2/н-гексан (30/70), 4 – пропанол-2/н-гексан, модифицированный 0.15% диэтиламина (30/70).
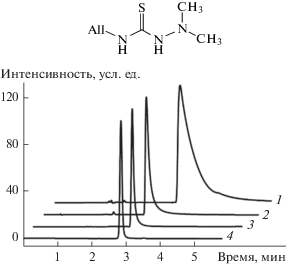
При проведении хроматографического эксперимента в режиме НФ ВЭЖХ обнаружено, что задний фронт хроматографического пика тиосемикарбазида II довольно сильно размыт (рис. 1), что приводит к снижению разрешающей способности колонки Zorbax-CN. В условиях равновесной хроматографии асимметричная форма пика свидетельствует об отклонении изотермы адсорбции от линейности [12]. Пик с острым передним фронтом и растянутым задним фронтом соответствует выпуклой изотерме адсорбции тиосемикарбазида, т.е. характеризует достаточно сильное взаимодействие вещества с цианопропилсиликагелем. Для ослабления взаимодействия тиосемикарбазида с сорбентом в состав н-гексана вводили органические модификаторы. Варьируя состав растворителя, можно в широких пределах изменять сорбционные характеристики и селективность разделения анализируемых соединений. В ряду н-гексан → дихлорметан → тетрагидрофуран → пропанол-2 увеличивается значение сольватохромного параметра основности растворителей β (по Камлеру и Тафту [7]) в последовательности 0 → 0.10 → 0.55 → 0.95. Данные модификаторы, особенно пропанол-2, способны конкурировать с тиосемикарбазидом за место на поверхности неподвижной фазы SiO2-RCN, содержащей остаточные силанольные группы, а также взаимодействовать с тиосемикарбазидом, что изменяет существующие в системе равновесия. Как видно на рис. 1, в результате использования модификаторов хроматографический пик II становится более симметричным. Аналогичным образом состав подвижной фазы влияет на форму хроматографических пиков тиосемикарбазидов I и III.
Наилучшие результаты и наименьшее время удерживания соединений I–III достигаются при использовании смеси пропанола-2 с н-гексаном, дополнительно модифицированным 0.15% диэтиламина, который снижает влияние остаточных кислых силанольных групп на поверхности SiO2-RCN на сорбцию тиосемикарбазидов. Данный элюент в дальнейшем был использован при разделении реакционных смесей тиосемикарбазидов с изотиоцианатами, избыток которых используется при синтезе тиосемикарбазидов.
На рис. 2 приведены результаты хроматографического разделения на колонке Zorbax-CN реакционных смесей тиосемикарбазидов I–III с соответствующими изотиоцианатами. Поскольку изотиоцианаты являются более полярными соединениями, чем тиосемикарбазиды, то они дольше удерживаются на поверхности SiO2-RCN. При этом значительному размыванию подвергаются передние фронты их хроматографических пиков. Такой форме пиков соответствует вогнутая изотерма равновесной адсорбции изотиоцианатов на цианопропилсиликагеле из данного растворителя вследствие их конкурентного взаимодействия с полярными компонентами подвижной фазы и между собой [12]. Особенно сильная асимметрия пика наблюдается для фенил- и аллилизотиоцианата (рис. 2, кривые 3 и 2). Эти соединения дольше удерживаются на поверхности сорбента, чем этилизотиоцианат.
Рис. 2.
Хроматограммы разделения смесей тиосемикарбазидов (время удерживания tR = 2.2–3.1 мин) с изотиоцианатами (tR = 3.5–5.5 мин) в системе Zorbax-CN/смесь (30/70 по объему) пропанола-2 с н-гексаном, модифицированным 0.15% диэтиламина: 1 – смесь I и EtNCS, 2 – смесь II и AllNCS, 3 – смесь III и PhNCS.

Время удерживания тиосемикарбазидов также увеличивается с ростом углеводородного радикала в последовательности I–II–III. По данным [8–10], определяющий вклад в удерживание анализируемых соединений на колонке Zorbax-CN вносит специфическое взаимодействие их молекул с группами CN-группами привитого слоя. Исследуемые производные тиосемикарбазидов (как и производные изотиоцианатов) имеют одинаковый набор функциональных групп, поэтому наблюдаемые различия в их удерживании на поверхности цианофазы обусловлены полярностью, электронной плотностью и геометрическими характеристиками углеводородного радикала. Аллильный и фенильный заместители влияют на распределение электронной плотности в молекуле в гораздо большей степени, чем этильный заместитель. Положительный мезомерный эффект аллильного и фенильного радикалов усиливает разделение зарядов в молекулах анализируемых веществ и поляризуемость этих соединений. Индукционный эффект этильного радикала значительно слабее. Кроме того, как обнаружено в [6], соединение III взаимодействует со спиртами слабее двух других.
Как видно на рис. 2, в данных условиях хроматографического разделения на колонке Zorbax-CN пики тиосемикарбазидов “замаскированы”, а пик III едва детектируем на хроматограмме. Это затрудняет разделение тиосемикарбазидов и изотиоцианатов в реакционных смесях с низким содержанием целевых продуктов и избытком реагентов.
Малополярный цианопропилсиликагель можно рассматривать и в качестве обратной фазы, т.е. использовать в ОФ ВЭЖХ с полярными элюентами. Эффективность разделения смеси будет зависеть от способности разделяемых соединений взаимодействовать с подвижной и неподвижной фазами при движении по колонке. Удерживание в ОФ ВЭЖХ определяется преимущественно неспецифическим взаимодействием вещество–адсорбент и специфическим взаимодействием вещество–элюент.
На рис. 3а приведена экспериментальная хроматограмма, полученная при разделении смеси тиосемикарбазидов на колонке Zorbax-CN в водном растворе метанола. Для сравнения показана аналогичная хроматограмма, зарегистрированная при использовании колонки Zorbax-C18 с силикагелем с привитыми октадецильными радикалами (рис. 3б). Видно, что порядок выхода хроматографических пиков тиосемикарбазидов I–III одинаков на обоих химически модифицированных силикагелях: первым выходит соединение I, а последним – соединение III. В той же последовательности увеличивается фактор липофильности тиосемикарбазидов lg P [13] (1.11 → 1.30 → 2.35), который является наиболее распространенной характеристикой способности вещества к переходу из неполярной фазы в полярную. Для соединений I и II значения lg P довольно близки, что затрудняет их разделение, но они значительно отличаются от значения lg P, рассчитанного для тиосемикарбазида III, основной вклад в которое вносит бензольное кольцо. Таким образом, чем больше неполярная углеводородная часть тиосемикарбазида и его поляризуемость, тем сильнее он удерживается на цианопропилсиликагеле. Аналогичный результат был получен ранее при разделении смеси тиосемикарбазидов на колонке Hypercarb [6].
Рис. 3.
Хроматограммы разделения смеси тиосемикарбазидов I (1), II (2) и III (3) на колонках Zorbax-CN (а) и Zorbax-C18 (б) из раствора метанол/вода (50/50 по объему).

Силы взаимодействия молекул сорбата и сорбента определяют селективность сорбента. Для характеристики селективности сорбентов использовали величину фактора разделения α [12]. Экспериментально определенные факторы разделения тиосемикарбазидов на колонках Zorbax-СN и Zorbax-C18 составляют α = 1.3 и 1.5 соответственно. Поскольку α > 1, то удовлетворительное разделение смеси тиосемикарбазидов возможно на обоих сорбентах, но разница в значениях факторов липофильности I и II невелика (1.11 и 1.30), что с большой долей вероятности должно привести к перекрыванию соответствующих пиков. Как уже отмечалось, привитый слой цианопропильных радикалов имеет структуру “щетки”, поэтому плоская форма молекулы II не оказывает такого большого влияния на сорбцию, как в случае углеродного сорбента Hypercarb.
Повысить селективность разделения I и II можно, изменяя полярность элюента. Для характеристики удерживания исследованных соединений использовали величину фактора удерживания k. На рис. 4 приведены зависимости обратного фактора удерживания 1/k тиосемикарбазидов I–III от объемной доли φ метанола в воде. Наблюдается ослабление удерживания тиосемикарбазидов на цианопропилсиликагеле с увеличением содержания метанола, т.е. с увеличением полярности подвижной фазы. Нелинейный характер зависимости 1/k = f(φ) подтверждает сильное межмолекулярное взаимодействие соединений I и II с метанолом. Тиосемикарбазид III с метанолом взаимодействует слабее двух других, и состав элюента влияет на его удерживание значительно слабее. Аналогичным образом состав растворителя влияет на удерживание тиосемикарбазидов на Zorbax-C18.
Рис. 4.
Зависимости обратного фактора удерживания 1/k тиосемикарбазидов I (1), II (2) и III (3) на колонке Zorbax-CN от объемной доли φ метанола в воде.
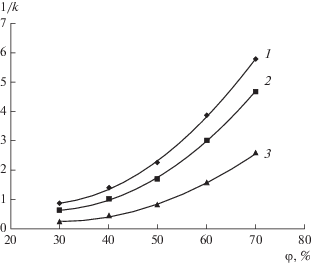
Уравнения зависимости 1/k = f(φ) для удерживания соединений I–III на колонке Zorbax-CN выглядят следующим образом (r 2 – коэффициент детерминации):
Данные уравнения позволяют предсказать хроматографическое поведение тиосемикарбазидов при использовании колонки Zorbax-CN и элюентов с различным содержанием метанола в воде.
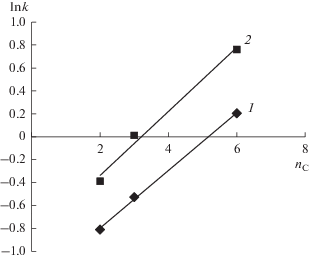
Как видно на рис. 5, наблюдается линейное изменение фактора удерживания тиосемикарбазидов на колонке Zorbax-CN при увеличении числа атомов углерода nC в их углеводородном радикале. Полученная зависимость может быть описана уравнением ln k = 0.2513nC – 1.2986 (r 2 = = 0.9999). Аналогичная зависимость удерживания тиосемикарбазидов на Zorbax-C18 идет несколько выше (кривая 2): ln k = 0.2788nC – 0.8939 (r 2 = 0.9884).
Рис. 5.
Зависимость логарифма фактора удерживания k на сорбентах Zorbax-CN (1) и Zorbax-C18 (2) от числа атомов углерода nC в углеводородном радикале тиосемикарбазидов I–III.
Исследование влияния температуры на хроматографическую систему позволяет определять термодинамические характеристики процесса сорбции. На рис. 6 приведены экспериментально полученные температурные зависимости значений фактора удерживания тиосемикарбазидов I–III на Zorbax-CN. Для всех соединений в достаточно широком диапазоне температуры, T = 298–318 К, эти зависимости линейны (коэффициент детерминации r 2 = 0.9974–0.9993). При увеличении температуры удерживание тиосемикарбазидов закономерно снижается, но изменение селективности процесса разделения не наблюдается. Ввиду значительных различий в значениях ln k смесь соединений I–III может быть эффективно разделена во всем исследованном диапазоне температуры.
Рис. 6.
Экспериментальные зависимости значений фактора удерживания lnk тиосемикарбазидов I (1), II (2) и III (3) на колонке Zorbax-CN от температуры.

Из экспериментально полученных зависимостей ln k = f(1/T) в соответствии с уравнением ln k = –ΔH°/RT + ΔS°/R + ln φ были определены значения энтальпии, энтропийной константы и температурного коэффициента сорбции тиосемикарбазидов I–III на силикагелях с привитыми группами CN и С18 (табл. 1). Приведенный в таблице температурный коэффициент сорбции V = = [(k1 – k2) – 1]/(T2 – T1) позволяет определить изменение фактора удерживания вещества при изменении температуры на 1 К. Эта информация может быть полезна для повышения эффективности разделения тиосемикарбазидов, т.к. повышение рабочей температуры колонок – удобный способ уменьшения вязкости подвижной фазы и снижения давления в колонке.
Таблица 1.
Значения энтальпии, энтропийной константы и температурного коэффициента сорбции тиосемикарбазидов I–III на колонках Zorbax-CN и Zorbax-C18
| Колонка | Вещество | –ΔH°, кДж/моль | –ΔS°/R + + ln φ* | V × 103, К–1 |
|---|---|---|---|---|
| Zorbax-CN | I | 7.4 | 3.8 | 10 |
| II | 8.6 | 4.0 | 12 | |
| III | 11.6 | 4.6 | 18 | |
| Zorbax-C18 | I | 4.2 | 2.0 | 6 |
| II | 5.3 | 2.1 | 7 | |
| III | 8.8 | 2.5 | 12 |
Как следует из данных табл. 1, увеличение температуры на 1 К влечет за собой изменение удерживания тиосемикарбазидов на колонке Zorbax-CN на 1–1.8%, а на колонке Zorbax-C18 на 0.6–1.2%, т.е. воспроизводимость времен удерживания соединений I–III на колонке Zorbax-CN немного хуже. Чтобы добиться долговременной воспроизводимости величин удерживания на колонке Zorbax-CN желательно ее термостатирование.
Значения термодинамических характеристик адсорбции соединений I–III на Zorbax-CN выше, чем на Zorbax-C18, т.е. взаимодействие тиосемикарбазидов с цианопропилсиликагелем сильнее, чем с октадецилсиликагелем. Это связано с реализацией сложного механизма удерживания соединений на SiO2-RCN, зависящего как от специфических, так и от гидрофобных взаимодействий сорбат–сорбент.
Проведенные исследования взаимодействия различных тиосемикарбазидов с цианопропилсиликагелем позволили подобрать оптимальные условия хроматографического разделения этих соединений и их смесей с изотиоцианатами, используемыми в качестве реагентов при синтезе тиосемикарбазидов. Обнаружена интересная особенность цианопропилсиликагеля – его селективность в отношении разделения смеси этил-, аллил- и фенилтиосемикарбазида мало изменяется при переходе от неполярного элюента к полярному, т.е. порядок выхода тиосемикарбазидов при разделении их смесей на колонке Zorbax-CN в режимах НФ и ОФ ВЭЖХ преимущественно определяется природой привитой цианофазы.
ВЫВОДЫ
Исследовано взаимодействие этил-, аллил- и фенилтиосемикарбазида с силикагелем с привитыми цианопропильными группами в условиях жидкостной хроматографии с нормальными и обращенными фазами. Селективность разделения смеси этил-, аллил- и фенилтиосемикарбазида на колонке с SiO2-RCN слабо зависит от полярности элюента, а порядок выхода тиосемикарбазидов при разделении их смесей в режимах НФ и ОФ ВЭЖХ определяется в основном природой привитого слоя цианопропильных радикалов.
Удерживание соединений на колонке Zorbax-CN из водных и органических растворов увеличивается в последовательности 4-этил-1,1-диметилтиосемикарбазид → 4-аллил-1,1-диметилтиосемикарбазид → 4-фенил-1,1-диметилтиосемикарбазид. Изучено влияние состава подвижной фазы и температуры на процесс разделения смесей тиосемикарбазидов. Сопоставлена селективность силикагелей с привитыми цианопропильными и октадецильными группами. Показано, что последовательность выделения тиосемикарбазидов из смесей одинакова на колонках Zorbax-CN и Zorbax-C18. Определены термодинамические параметры сорбции тиосемикарбазидов на химически модифицированных силикагелях.
Проведенные исследования позволили оптимизировать хроматографическое разделение смесей различных тиосемикарбазидов, а также подобрать условия разделения их реакционных смесей с изотиоцианатами, используемыми в качестве реагентов для синтеза тиосемикарбазидов.
Список литературы
Газиева Г.А., Кравченко А.Н. // Успехи химии. 2012. Т. 81. С. 494.
Крутов И.А., Гаврилова Е.Л., Бурангулова Р.Н., Корнилов С.С., Валиева А.А., Самигуллина А.И., Губайдуллин А.Т., Синяшин О.Г., Семина И.И., Никитин Д.О., Плотникова А.В. // Журн. общей химии. 2017. Т. 87. С. 1977.
Huang H., Chen Q., Ku X., Meng L., Lin L., Wang X., Zhu C., Wang Y., Chen Z., Li M., Jiang H., Chen K., Ding J., Liu H. // J. Med. Chem. 2010. V. 53. P. 3048.
Costa R.F.F., Rebolledo A.P., Matencio T., Calado H.D.R., Ardisson J.D., Cortés M.E., Rodrigues B.L., Beraldo H. // J. Coord. Chem. 2005. V. 58. P. 1307.
Парамонов С.А., Ульянов А.В., Буряк А.К. // Изв. АН. Серия хим. 2010. Т. 59. С. 517.
Полунин К.Е., Матюшин Д.Д., Ульянов А.В., Полунина И.А., Буряк А.К. // Коллоид. журн. 2019. Т. 81. (в печати).
Райхардт К. Растворители и эффекты среды в органической химии. М.: Мир, 1991.
Модифицированные кремнеземы в сорбции, катализе и хроматографии / Под ред. Лисичкина Г.В. М.: Химия, 1986.
Химия привитых поверхностных соединений / Под ред. Лисичкина Г.В. М.: Физматлит, 2003.
Weiser E.L., Salotto A.W., Flach S.M., Snyder L.R. // J. Chromatogr. A. 1984. V. 303. P. 1.
Gama M.R., da Costa Silva R.G., Collins C.H., Bottoli C.B.G. // Trends Anal. Chem. 2012. V. 37. P. 48.
Шатц В.Д., Сахартова О.В. Высокоэффективная жидкостная хроматография. Рига: Зинатне, 1988.
Cheng T., Zhao Y., Li X., Lin F., Xu Y., Zhang X., Li Y., Wang R., Lai L. // J. Chem. Inf. Model. 2007. V. 47. P. 2140.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


