Коллоидный журнал, 2019, T. 81, № 6, стр. 750-758
Дезагрегация тетра(4-карбоксифенокси)фталоцианината цинка в водных растворах бромидов додецил-, тетрадецил- и гексадецилтриметиламмония в интервале pН 6–9
Т. Г. Мовчан 1, *, А. Ю. Чернядьев 1, Е. В. Плотникова 1, А. Ю. Цивадзе 1, В. Е. Баулин 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспeкт, 31, Россия
* E-mail: movchan_tamara@mail.ru
Поступила в редакцию 07.05.2019
После доработки 17.05.2019
Принята к публикации 21.05.2019
Аннотация
Методами электронной спектроскопии поглощения и люминесцентной спектроскопии проанализированы процессы агрегации тетра(4-карбоксифенокси)фталоцианината цинка, ZnPc(COOH)4, в органических растворителях и в воде при различных значениях pH. Установлено, что в водных системах при pH 6–9 ZnPc(COOH)4 существует в агрегированном состоянии, а в диметилформамиде и диметилсульфоксиде образует молекулярные растворы. За счет применения катионных ПАВ (бромидов додецил-, тетрадецил- и гексадецилтриметиламмония) достигнут эффект распада агрегатов ZnPc(COOH)4 в водных растворах при pH ≥ 6 на отдельные молекулы. Это открывает возможность применения ZnPc(COOH)4 в качестве препарата для фотодинамической терапии в физиологических растворах, поскольку каждая его молекула может участвовать в процессе генерации синглетного молекулярного кислорода.
ВВЕДЕНИЕ
Фотодинамическая терапия (ФДТ) злокачественных опухолей, как известно, является одним из методов химиотерапии онкологических заболеваний. ФДТ включает в себя применение фотосенсибилизатора (ФС), способного селективно накапливаться в тканях опухолей, и электромагнитного излучения в красной или ближней ИК-области (630–850 нм, “фототерапевтическое окно”) для генерации синглетного молекулярного кислорода, эффективно разрушающего клетки опухоли [1–4]. ФС первого поколения (Фотофрин, Фотосан, Фотогем) имеют ряд недостатков. В частности, они существуют в растворе в виде смеси индивидуальных молекул и их агрегатов, что снижает эффективность генерации синглетного кислорода по сравнению с молекулярным раствором. Кроме того, максимум их поглощения лежит вблизи 630 нм, что недостаточно для поражения глубоко расположенных опухолей из-за поглощения меланином кожи, и они обладают высокой фототоксичностью для кожных покровов [1, 2].
Проблема существования фталоцианинатов металлов в агрегированном состоянии в водных растворах [1–10] и ограничение диапазона возбуждающего света “фототерапевтическим окном” для генерации синглетного кислорода обусловливают поиск новых ФС на основе фталоцианинов, содержащих различные функциональные группы на периферии молекулы, а также гибридных ФС на основе наночастиц, к поверхности которых “пришиты” молекулы фталоцианинов [11].
К настоящему времени известно довольно много сульфо- и карбоксизамещенных фталоцианинатов, которые представляют интерес для ФДТ в силу их высокой растворимости в воде. Однако согласно данным спектральных методов (электронной спектроскопии поглощения (ЭСП), люминесцентной спектроскопии, ЯМР) сульфо- и карбоксизамещенные фталоцианины в водном растворе существуют преимущественно в виде агрегатов за счет π–π-стекинга, водородных связей между карбоксильными группами соседних молекул или образования карбоксильными группами сетки водородных связей с участием молекул воды [1–9].
Ранее были предприняты попытки решить проблему агрегации карбоксизамещенных фталоцианинатов в воде путем наращивания числа периферийных карбоксильных групп (рис. 1) [1, 9]. Предполагалось, что в щелочной среде анионы фталоцианинов будут отталкиваться друг от друга благодаря их высокому отрицательному заряду. Однако эффект дезагрегации был достигнут при наличии не 4 или 8 (рис. 1, соединения а, б, в), а только 16 карбоксильных групп при фталоцианиновом цикле (рис. 1, соединение г). Более того, даже создание вокруг фталоцианинового цикла дендримерных ветвей, несущих карбоксильные группы (рис. 1, соединение д), позволило преодолеть процессы агрегации только при достаточно большом объеме таких дендримерных фрагментов, стерически препятствующем π−π-стекингу [3].
Для решения проблемы агрегации молекул фталоцианинов в водных растворах также может быть применен метод их солюбилизации в мицеллах ПАВ. Известно, что этот метод хорошо работает в случае сульфозамещенных [6–8], а также для краун-замещенных фталоцианинов [6, 10, 12].
В данной работе мы попытались применить классические и коммерчески доступные катионные ПАВ для солюбилизации тетра(4-карбоксифенокси)фталоцианината цинка – соединения, которое обладает высоким квантовым выходом генерации синглетного кислорода, однако существует в водных растворах преимущественно в виде агрегатов, препятствующих, как уже отмечено выше, эффективной генерации синглетного молекулярного кислорода [1–4, 13].
Цель данной работы – исследование влияния бромидов додецил-, тетрадецил- и гексадецилтриметиламмония на процессы дезагрегации тетра(4-карбоксифенокси)фталоцианината цинка(II) в водных растворах при изменении pH в интервале 6–9, поскольку известно, что межклеточная жидкость опухолей может быть как слабощелочной, так и слабокислой [14] в зависимости от химической природы продуктов жизнедеятельности, выделяемых клетками опухоли.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Тетра(4-карбоксифенокси) фталоцианинат цинка ZnPc(COOH)4 (рис. 1а) синтезирован согласно разработанной ранее методике [13]. Бромиды додецил- (С12ТАБ), тетрадецил- (С14ТАБ) и гексадецилтриметиламмония (С16ТАБ) производства Acros Organics с содержанием основного вещества 99.8% дополнительной очистке не подвергали. Значения ККМ С12ТАБ, С14ТАБ и С16ТАБ в водных растворах, определенные методом кондуктометрии, соответственно равны 0.015, 0.0038 и 0.001 М [15]. Концентрацию СnТАБ варьировали от 5 × 10–4 до 2 × 10–2 М в условиях изменения pH среды от 6 до 9.
Для приготовления буферных растворов с pH 6.86 и 9.18 использовали стандарт-титры на основе смеси солей КН2РО4 и Na2НРО4 и Na2B4O7 · 10Н2О соответственно. Растворы с промежуточными значениями pH получали, используя свежеприготовленные водные растворы NaOH и соляной кислоты.
Все измерения проводили при комнатной температуре.
Насыщенные растворы ZnPc(COOH)4 с pH 6–9, содержащие ПАВ, выдерживали в плотно закрытых сосудах в темноте в течение 2–7 сут, периодически регистрируя их ЭСП. По значениям оптической плотности A в максимуме Q-полосы поглощения с учетом коэффициента экстинкции (измеренного в растворах ДМСО) оценивали предельное содержание фталоцианина в мицеллярных растворах ПАВ.
Значения pH среды определяли на приборе Seven Multi (Mettler Toledo), используя комбинированный электрод InLab Expert Pro pH. Калибровку электрода осуществляли по стандартным буферным растворам в диапазоне pH 2–9.18.
Электронные спектры поглощения ZnPc(COOH)4 регистрировали с помощью однолучевого сканирующего спектрофотометра UNICO UV-2800 по методике, изложенной в [16]. Исследуемые растворы помещали в кварцевые кюветы с длиной светового пути (l) 0.1 или 1 см в зависимости от концентрации фталоцианина в растворе.
Спектры флуоресценции измеряли на спектрофлуориметре Fluorolog 3 (Horiba Jobin Yvon S.A.S.) в прозрачной по четырем граням кварцевой кювете (1 см × 1 см) при длине волны возбуждения 288, 358 и 605 нм. Ширина щели канала возбуждения составляла 4 или 5 нм. Для регистрации спектров с низкой интенсивностью флуоресценции (ZnPc(COOH)4 в системах без ПАВ) щель увеличивали до 7–11 нм. На рисунках показаны исправленные с учетом спектральной чувствительности ФЭУ (истинные) спектры флуоресценции.
Квантовый выход флуоресценции в диапазоне 625–800 нм определяли абсолютным методом с использованием интегрирующей сферы Quanta-φ при возбуждении образца светом с длиной волны 612 нм. Образец не подвергали дегазации или продувки инертными газами. Оптическая плотность в максимуме наиболее интенсивной полосы поглощения исследуемого раствора (Q-полоса ZnPc(COOH)4) была меньшей 0.05 для устранения эффекта самопоглощения. Значение квантового выхода вычисляли с помощью программы FluoroEssenceTM.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
1. Процессы растворения и агрегации ZnPc(COOH)4 в диметилсульфоксиде, диметилформамиде и воде при изменении pH
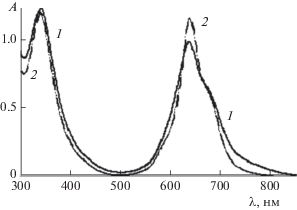
Фталоцианинат цинка ZnPc(COOH)4 растворяется в полярных органических растворителях, таких как ДМСО и ДМФА. По данным ЭСП, а также люминесцентной спектроскопии растворение ZnPc(COOH)4 в этих средах происходит с образованием истинных растворов, что, по-видимому, связано с тем, что молекулы растворителя играют роль экстра-лигандов, препятствующих формированию кофациальных агрегатов фталоцианината цинка. В ЭСП ZnPc(COOH)4 в ДМСО и ДМФА (рис. 2) отсутствуют характерные полосы поглощения агрегатов в области полосы Сорэ и в области Q-полос [1] и присутствуют полосы поглощения неагрегированных молекул ZnPc(COOH)4.
Рис. 2.
Спектры поглощения ZnPc(COOH)4 (1, 2) и его люминесценции при длине возбуждения λв = 605 нм (3, 4) в ДМФА (1, 3) и ДМСО (2, 4).
Интенсивная флуоресценция растворов ZnPc(COOH)4 в ДМСО и ДМФА (вставка на рис. 2) также указывает на присутствие в растворе неагрегированных молекул фталоцианината цинка, поскольку его агрегаты не флуоресцируют [17]. Близкий к зеркальной симметрии характер спектров флуоресценции по отношению к ЭСП [18] в области Q-полос (рис. 3) также свидетельствует об отсутствии агрегатов фталоцианина в его растворах в ДМСО и ДМФА. Нестрогое соответствие правилу зеркальной симметрии может объясняться регистрацией спектров поглощения и флуоресценции при разной ширине щелей (1 нм – для ЭСП, 4 нм – для спектров флуоресценции).
Рис. 3.
Спектры поглощения ZnPc(COOH)4 (1, 2) и его люминесценции при λв = 605 нм (3, 4) в ДМФА (1, 3) и ДМСО (2, 4) в шкале волновых чисел.

В диапазоне изученных концентраций ZnPc(COOH)4, cф = (0.1–2.2) × 10–5 М, зависимость A = f(cф) в случае ДМСО (в максимуме Q‑полосы при 678 нм) отвечает уравнению Бугера–Ламберта–Бера с коэффициентом ε = 7.2 × 104 М–1 см–1, близким к значению, приводимому в [19].
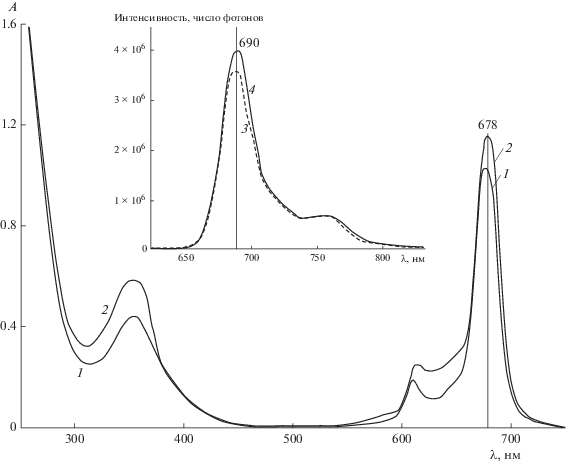
В кислой водной среде (pH 6 и 6.5) ZnPc(COOH)4 практически не растворяется. При pH 6.86 после выдерживания в течение 7 сут были зарегистрировали малоинтенсивные полосы поглощения агрегатов фталоцианината цинка (рис. 4). Наличие (судя по ЭСП, в небольшом количестве) неагрегированных молекул ZnPc(COOH)4 в растворе с pH 6.86 подтверждается данными спектрофлуориметрии – для раствора регистрируется спектр флуоресценции (вставка на рис. 4).
В кислой среде формирование агрегатов, вероятно, реализуется не только за счет π–π-стэкинга ароматических систем электронов фталоцианина, но и за счет образования водородных связей между карбоксильными группами соседних молекул ZnPc(COOH)4 [20]. По-видимому, и в твердом состоянии молекулы ZnPc(COOH)4 связаны друг с другом множественными водородными связями, что может объяснять медленное растворение данного соединения в кислом водном растворе [20].
В щелочной среде (pH 7.5–9.18) растворение ZnPc(COOH)4 заметно ускоряется, о чем свидетельствует наблюдаемое окрашивание водного раствора в зелено-изумрудный цвет уже в первые минуты его контакта с твердым фталоцианинатом цинка. Процесс растворения ускоряется благодаря реакции нейтрализации тетракарбоновой кислоты ZnPc(COOH)4) с образованием карбоксилата щелочного металла ZnPc(COO–)4${\text{M}}_{{\text{4}}}^{ + }$ (рис. 5).
Однако ЭСП (рис. 6) и спектры флуоресценции (рис. 7) растворов с pH 7.5 и 9.18 (с регистрацией спектров флуоресценции при ширине щелей каналов возбуждения и эмиссии, равной 11 и 7 нм, и соответственно, вследствие малой интенсивности флуоресценции) свидетельствуют о преимущественном содержании агрегатов фталоцианината цинка. Спектры флуоресценции неагрегированных молекул при pH 9.18 обнаруживают красное смещение по сравнению со спектрами при pH 7.5 (рис. 7). Такое смещение может быть обусловлено как увеличением ионной силы раствора, что наблюдалось и для тетрасульфозамещенных порфиринов [21], так и возрастанием вероятности координации гидроксил-иона катионом цинка соли ZnPc(COO–)4${\text{M}}_{{\text{4}}}^{ + }$ при увеличении pH раствора [22].
2. Процессы растворения ZnPc(COOH)4 в присутствии ПАВ при изменении pH
В мицеллярных растворах СnТАБ в слабокислой среде (при pH 6.0–6.86) увеличивается доля неагрегированных молекул ZnPc(COOH)4 по сравнению с растворами без ПАВ. Об этом можно судить по ЭСП (рис. 8), в которых, как и в случае органических растворителей (рис. 2), присутствуют полосы поглощения мономерного фталоцианина. При низких концентрациях С14ТАБ и pH 6 рост оптической плотности в максимуме Q-полосы мономера происходит очень медленно и слабо. Так, для насыщенного раствора ZnPc(COOH)4 при концентрации С14ТАБ c = 0.004 М изменения A перестают наблюдаться только спустя 7 сут. По оценке cф = A/lε содержание мономера (cфм) в нем при A = 0.2, l = 1 см и ε = 7.2 × 104 М–1 см–1 составляет 5.6 × 10–6 М, что не превышает 7% от исходного значения cф = 8 × 10–5 М. Заметный рост оптической плотности для насыщенного раствора ZnPc(COOH)4 c pH 6 наблюдается при концентрации С14ТАБ c ≥ 0.008 М (≅2 ККМ).
Рис. 8.
ЭСП ZnPc(COOH)4 в его насыщенных растворах при pH 6 (1), 6.5 (2), 6.86 (3) в присутствии 0.01 М С14ТАБ (l = 0.1 см). На вставке – зависимости относительной оптической плотности при λmах = 682 нм от содержания С14ТАБ в растворах с pH 6.0 (4), 6.5 (5), 6.86 (6), 7.5 (7) и 9.18 (8).
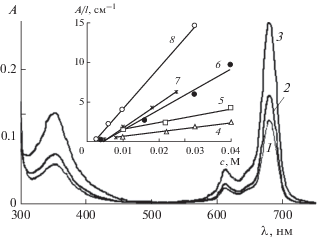
При увеличения pH процесс дезагрегации ZnPc(COOH)4 в присутствии ПАВ ускоряется и концентрация неагрегированных (мономерных) молекул (cфм) возрастает. В качестве примера на рис. 8 приведены ЭСП фталоцианина в 0.01 М растворах С14ТАБ при pH 6–6.86, иллюстрирующие увеличение оптической плотности и пропорциональное ей число неагрегированных молекул ZnPc(COOH)4с ростом pH. Расчет показывает примерно 140-кратное увеличение cфм в насыщенном растворе ZnPc(COOH)4 при pH 6.86 в присутствии 0.01 М С14ТАБ по сравнению со значением cфм в буферном растворе без ПАВ (2.6 × 10–7 М).
На вставке рис. 8 показаны экспериментальные данные, характеризующие изменение относительной оптической плотности A/l насыщенных растворов ZnPc(COOH)4 в максимуме поглощения при pH 6–9.18 и концентрации С14ТАБ в диапазоне 1–10 ККМ. Аппроксимация экспериментальных данных дает линейную зависимость A/l от c ПАВ как следствие взаимодействия между ZnPc(COOH)4 и мицеллами. Увеличение угла наклона этой зависимости с повышением pH в диапазоне 6–9.18 демонстрирует тенденцию роста солюбилизационной емкости S мицелл С14ТАБ по отношению к ZnPc(COOH)4, поскольку величина S пропорциональна тангенсу угла наклона b зависимости A/l от c [23]: S = b/ε.
Оценка содержания мономера фталоцианина в растворе С14ТАБ при с = 0.04 М и pH 6 приводит к величине сфм = 3.3 × 10–5 М, а при с = 0.03 М и pH 6.86 – к сфм = 8 × 10–5 М, что составляет ≈40 и 100% соответственно от исходного значения сф.
На рис. 9 приведены спектры поглощения (кривая 1) и флуоресценции (кривая 2) полностью растворенного (в 0.03 М С14ТАБ) ZnPc(COOН)4 при pH 6.86. Наличие интенсивной полосы флуоресценции наряду с интенсивными полосами поглощения с максимумами при 690 и 680 нм, соответственно, указывает на присутствие преимущественно неагрегированных молекул ZnPc(COOН)4 в этой системе, поскольку его агрегаты, как известно [17], не излучают.
Рис. 9.
Спектры поглощения (1) и люминесценции (2) ZnPc(COOH)4 в 0.03 М растворе С14ТАБ с pH 6.86 при сф = 2 × 10–6 М. λв = 605 нм, l = 1 см.

В отличие от слабокислой среды в щелочной, при pH 7.5 и 9.18, на ЭСП ZnPc(COOH)4 присутствуют полосы поглощения неагрегированных молекул уже в домицеллярных (с ≈ 0.5 ККМ) растворах СnТАБ, однако их интенсивность слабее, чем в мицеллярных системах (рис. 10, 11). При переходе от растворов без ПАВ (спектр 1 на рис. 10, 11) к растворам с ПАВ (спектры 2, 3 на рис. 10, 11) в ЭСП наблюдается ряд изменений. Во-первых, имеет место “красное” смещение (≈10 нм) полосы Сорэ, а во-вторых, вместо широкой Q-полосы с λmах = 644 нм, отражающей преимущественное содержание агрегатов, появляется узкая Q-полоса с λmах = 681 нм.
Рис. 10.
Спектры поглощения водных растворов Z-nPc(COOH)4 при сф = 8.2 × 10–6 М и pH 7.5 без ПАВ (1) и в присутствии С12ТАБ (2) и С14ТАБ (3) в концентрации ≅0.5 ККМ. На вставке – зависимости оптической плотности от содержания СnТАБ. l = 1 см. Пояснения в тексте.
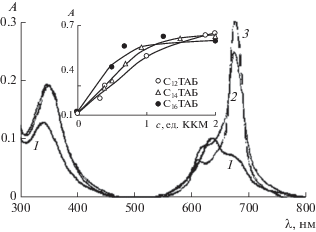
Рис. 11.
Спектры поглощения водных растворов Zn-Pc(COOH)4 при сф = 8.2 × 10–6 М и pH 9.18 без ПАВ (1) и в присутствии С12ТАБ (2) и С14ТАБ (3) в концентрации ≅0.5 ККМ; на вставке – зависимости оптической плотности от содержания С12ТАБ и С14ТАБ. l = 1 см. Пояснения в тексте.

С увеличением концентрации ПАВ до ККМ оптическая плотность A в максимуме Q-полосы ZnPc(COOH)4 резко возрастает, а при c ≥ ККМ замедляется (вставка на рис. 10 и 11), если не изменяется концентрация фталоцианина cф. Такое изменение оптической плотности обусловлено увеличением доли неагрегированных молекул (или ионов) препарата в системе вплоть до полной дезагрегации за счет роста концентрации мицелл, обеспечивающих их солюбилизацию. Близкое соответствие спектров поглощения 1–3 и флуоресценции 1'–3' ZnPc(COOH)4 в растворах СnТАБ (с = 2.5 ККМ) при pH 9.18, построенных в шкале волновых чисел (рис. 12), позволяет сделать вывод о практически полном высвобождении молекул фталоцианината цинка из агрегатов.
Рис. 12.
Спектры поглощения (1–3) и флуоресценции при λв = 605 нм (1'–3') ZnPc(COOH)4 при cф = 8.2 × × 10–6 М и pH 9.18 в растворах С12ТАБ (1, 1'), С14ТАБ (2, 2') и С16ТАБ (3, 3') с концентрацией 2.5 ККМ.

Усиление влияния pH на солюбилизацию ZnPc(COOH)4 в присутствии ПАВ обусловлено ростом степени разрушения водородных связей между карбоксильными группами соседних молекул фталоцианина и диссоциацией карбоксильных групп (при pH > 7). При увеличении pH выше 7 в воде реализуется процесс взаимодействия молекул фталоцианина в кислой форме в составе его кристаллов с гидрокcид-ионами из раствора с переходом образовавшихся анионов ZnPc(COO–)4 в раствор. Электростатически взаимодействуя с положительно заряженными поверхностно-активными катионами СnТА+ в предмицеллярных растворах, анионы ZnPc(COO–)4 формируют ассоциаты, а взаимодействуя с положительно заряженными мицеллами СnТАБ они полностью или частичного внедряются в их гидрофобные ядра, тем самым повышая долю неагрегированного ZnPc(COOН)4 в системе.
Наблюдаемое влияние длины алкильной цепи СnТАБ на растворимость ZnPc(COOН)4 при pH 7.5 и 9.18 – слабое (рис. 10–12), при этом в домицеллярной и мицеллярной областях концентрации ПАВ (рис. 10, 11) оно неоднозначно. В случае С16ТАБ (с большей длиной алкильной цепи) процесс растворения начинается при меньшей концентрации ПАВ (из-за меньшего значения ККМ) и более эффективен при увеличении его содержания в домицеллярной области, чем в случае С12ТАБ. Для мицеллярных растворов имеет место обратная тенденция.
Усиление дезагрегации ZnPc(COOH)4 при уменьшении длины алкильной цепи ПАВ, по-видимому, обусловлено, как и в случае тетрасульфоната фталоцианината цинка при pH 7.4 [7], увеличением глубины проникновения красителя внутрь мицелл вследствие меньшей их компактности, что приводит к снижению полярности микроокружения молекул ZnPc(COOН)4.
Следует отметить, что применение С14ТАБ для солюбилизации карбоксизамещенного ZnPc оказывается более эффективным, чем неионного Cremophor EL [9, 24]: дезагрегация фталоцианина в случае С14ТАБ имеет место при меньшем числе карбоксигрупп в молекуле ZnPc (4 вместо 8 в [9]) и не только при pH 7.5, но и в слабокислых (pH 6–6.86) растворах. К тому же для этого требуется меньшее содержание ПАВ в растворе (4% Cremophor EL и меньше 1% С14ТАБ).
Для дезагрегированной системы (0.03 М С14ТАБ, сф = 2 × 10–6 М, pH 6.86) нами была проведена оценка квантового выхода флуоресценции молекул ZnPc(COOH)4 в мицеллах абсолютным методом. Измеренное значение квантового выхода составило 33.4% и оказалось значительно выше измеренного относительным методом в работе [9] для окта-карбоксифталоцианината цинка (18–20% при варьировании степени ионизации карбоксильных групп (соединение б на рис. 1)). Более высокий квантовый выход флуоресценции ZnPc(COOН)4 может объясняться электронодонорным влиянием “эфирных” атомов кислорода на сопряженную ароматическую систему фталоцианинового кольца, поскольку для циклических тетрапирролов известно, что электронодонорные заместители при ароматическом кольце увеличивают квантовый выход флуоресценции, а электроноакцепторные – напротив, уменьшают вероятность излучательных переходов флуоресценции [25]. Сопряженная система электронов фталоцианинового кольца окта-карбоксифталоцианината цинка подвержена сильному электроноакцепторному влиянию восьми карбоксильных групп, связанных непосредственно с его атомами углерода, чем и может объясняться низкий квантовый выход флуоресценции по сравнению c ZnPc(COOH)4.
На основании полученных результатов можно сделать вывод, что катионные ПАВ ряда бромидов алкилтриметиламмония позволяют достичь эффекта полного распада агрегатов ZnPc(COOH)4 на отдельные молекулы в водных растворах с pH ≥ 6.86 и преимущественного – при pH 6 и 6.5. Это открывает возможность применения ZnPc(COOH)4 в мицеллярных растворах катионных ПАВ в ФДТ, поскольку именно индивидуальные молекулы фталоцианинатов цинка способны эффективно генерировать синглетный молекулярный кислород, убивающий клетки опухоли [1, 3, 8, 9]. Для более быстрого растворения фталоцианината цинка ZnPc(COOH)4 при pH 6 и 6.5 кроме традиционных методов (перемешивание и повышение температуры) можно использовать предварительное растворение его кислотной формы для получения натриевой (ZnPc(COONa)4) или калиевой (ZnPc(COOK)4) соли.
Список литературы
Zhou L., Chen E., Jin W., Wang Y., Zhou J., Wei S. // Dalton Trans. 2016. V. 45. P. 15170.
Кудинова Н.В., Березов Т.Т. // Биомедицинская химия. 2009. Т. 55. С. 558.
Li X.-y., He X., Ng A.C.H., Wu C., Ng D.K.P. // Macromolecules. 2000. V. 33. P. 2119.
Ogunsipe A., Chen J.-Y., Nyokong T. // J. Chem. 2004. V. 28. P. 822.
Цивадзе А.Ю. // Успехи химии. 2004. Т. 73. С. 6.
Гольдшлегер Н.Ф., Баулин В.Е., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2014. Т. 50. С. 117.
Jadhao M., Mukherjee S., Joshi R., Kumar H., Ghosh S.K. // RSC Adv. 2016. V. 6. P. 77161.
Howe L., Zhang J. Z. // Photochem. Photobiol. 1998. V. 67. P. 90.
Калия О.Л., Кузнецова Н.А., Булгаков Р.А, Соловьева Л.И., Шевченко Е.Н., Сливка Л.К., Лукьянец Е.А. // Макрогетероциклы. 2016. Т. 9. С. 186.
Мовчан Т.Г., Аверин А.А., Баулин Д.В., Плотникова Е.В., Баулин В.Е., Цивадзе А.Ю. // Коллоид. журн. 2018. Т. 80. С. 528.
Xia L., Kong X., Liu X., Tu L., Zhang Y., Chang Y., Liu K., Shen D., Zhao H., Zhang H. // Biomaterials. 2014. V. 35. P. 4146.
Мовчан Т.Г., Чернядьев А.Ю., Аверин А.А., Плотникова Е.В., Баулин В.Е., Цивадзе А.Ю. // Коллоид. журн. 2018. Т. 80. С. 694.
Nazeeruddin MD.K., Humphry-Baker R., Grätzel M., Wöhrle D., Schnurpfeil G., Schneider G., Hirth A., Trombach N. // J. Porphyr. Phthalocyanines. 1999. V. 3. P. 230.
Раевский П.М. // Рос. хим. журн. 2002. Т. 46. С. 90.
Мовчан Т.Г., Русанов А.И., Плотникова Е.В. // Коллоид. журн. 2016. Т. 78. С. 750.
Мовчан Т.Г., Плотникова Е.В., Усьяров О.Г. // Коллоид. журн. 2013. Т. 75. С. 351.
Лебедева Н.Ш., Юрина Е.С., Губарев А.Ю., Майзлиш В.Е. // Биоорг. химия. 2016. Т. 42. С. 36.
Лакович Дж. Основы флуоресцентной спектроскопии. М.: Мир, 1986.
Лебедева Н.Ш., Попова Т.Е., Малькова Е.А., Губарев Е.А. // Журн. физ. химии. 2013. Т. 17. С. 2070.
Березин Б.Д., Березин Д.Б. Курс современной органической химии. М.: Высшая школа, 1999.
Блинова И.А., Васильев В.В., Шагисултанова Г.А. // Журн. физ. химии. 1994. Т. 68. С. 841.
Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. Часть 3. М.: Мир, 1969.
Демьянцева Е.Ю., Копнина Р.А. Солюбилизация в растворах поверхностно-активных веществ: учебно-методическое пособие. СПб.: СПбГТУРП, 2015.
Priev A., Zalipsky S., Cohen R., Barenholz Y. // Langmuir. 2002. V. 18. P. 612.
Harriman A. // J. Chem. Soc., Faraday Trans. 2. 1981. V. 77. P. 1695.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал