Коллоидный журнал, 2020, T. 82, № 1, стр. 82-88
Влияние водно-этанольных растворов хлорида натрия на селективность и электроповерхностные свойства ацетилцеллюлозной мембраны
К. Г. Саббатовский 1, *, И. П. Сергеева 1, В. Д. Соболев 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119097 Москва, Ленинский проспект, 31, Россия
* E-mail: sabbat07@mail.ru
Поступила в редакцию 26.06.2019
После доработки 05.07.2019
Принята к публикации 08.07.2019
Аннотация
Исследованы электрокинетические и селективные свойства ацетилцеллюлозной мембраны по отношению к 0.0001 моль/л раствору хлорида натрия в водно-этанольных растворах. Проведены измерения электропроводности, потенциала течения, фильтрационных и селективных характеристик мембраны. Получено, что для раствора с содержанием спирта 4% селективность мембраны по хлориду натрия повышается, а для 12%-го раствора спирта, наоборот, понижается по сравнению с водным раствором. Корреляции между селективностью мембраны и ее поверхностным зарядом не наблюдается. Обнаружена небольшая селективность мембраны по этанолу (20–26%). Высказано предположение о различном изменении энтальпии сольватации ионов электролита в свободном растворе и в порах мембраны при разном содержании этанола в смеси, что приводит к изменению ее селективности.
ВВЕДЕНИЕ
Исследование механизма селективности обратноосмотических мембран (ООМ) представляет собой большой научный интерес, так как понимание причин, влияющих на задержку ионов мембраной, позволит прогнозировать результаты, а также более целенаправленно и избирательно подходить к синтезу самих мембран и подбору реагентов.
Современные теории механизмов задержки ионов ООМ, как правило, используют концепции “нерастворяющего объема”, связанного со снижением сольватирующей способности воды вследствие ее пониженной диэлектрической проницаемости (ДП) в порах селективного слоя мембраны (изменение борновской энергии ионов) и “диэлектрического исключения ионов”, обусловленного низкой ДП матрицы мембраны. Это приводит к повышению свободной энергии и стандартного химического потенциала (СХП) ионов при их транспорте из объемного раствора в мембрану и, как следствие, к снижению их концентрации в порах мембраны [1–4]. Ряд авторов также обращал внимание на возможность изменения транспортных характеристик ионов вследствие фрикционного взаимодействия с полимерной матрицей мембраны [5–7]. В целом, перенос ионов через мембрану в неравновесных условиях обратного осмоса осуществляется за счет диффузии, конвекции растворителя и электромиграции. Снижение как концентрации, так и подвижности ионов при их транспорте через мембрану приводит к уменьшению плотности их потока и способствует задержке ионов.
Ионная селективность нанофильтрационных мембран (НФМ) в основном интерпретируется в рамках зарядового механизма задержки ионов [8–10] (доннановское исключение коионов из порового пространства) и пониженной ДП воды в порах селективного слоя, а также низкой ДП матрицы мембраны [3, 4] (диэлектрическое исключение). В качестве критериев, определяющих доннановское исключение, фигурируют плотность поверхностного заряда, концентрация электролита и размер пор. В последнее время применительно к НФМ и ООМ получили широкое распространение комбинированная модель и различные ее варианты, учитывающие одновременно зарядовый механизм, эффект снижения концентрации ионов в порах вследствие пониженной ДП воды и стерический фактор [11–17].
Первая попытка модельного расчета термодинамических параметров ионной сольватации была предпринята Борном [18], предложившим для свободной энергии сольватации ΔGs уравнение
(1)
$\Delta {{G}_{{\text{s}}}} = \frac{{N{{z}^{2}}{{e}^{2}}}}{{2{{r}_{{\text{i}}}}}}\left( {1 - \frac{1}{E}} \right),$Однако было обнаружено значительное расхождение значений ΔGs, полученных экспериментально и рассчитанных по уравнению (1). Указанное несоответствие разные авторы пытались решить введением в (1) ряда дополнительных членов. Наиболее удачной в этом отношении попыткой считается модель Стокса [19]. Автор ввел эффективную диэлектрическую проницаемость, толщину слоя воды, взаимодействующего с ионом, и радиус иона, равный радиусу инертного газа. Полученные в рамках этой модели результаты в пределах ±13% согласуются с экспериментальными. В работе [20], построенной на принципах нелокальной электростатики, авторы ввели характерный радиус корреляции флуктуаций ориентационной поляризации, имеющий разные значения в свободном растворе и в тонких порах ООМ. Ими приводится формула для расчета изменения борновской энергии переноса иона из свободного раствора в объем поры. Однако такой электростатический подход к процессу сольватации имеет два основных недостатка: он не учитывает ковалентность ион-дипольного взаимодействия и энергию диполь-дипольных взаимодействий.
Одновременно с эволюцией уравнения Борна развивался другой подход, в котором авторы отказались от борновской модели “сфера в континууме”. Основой для этой концепции послужили идеи, содержащиеся в классическом труде Бернала и Фаулера [21]. Сущность их модели состоит в учете строения молекул воды по соседству с ионом. Крестовым [22] был усовершенствован этот метод с привлечением полуэмпирических выражений для интегралов межмолекулярных взаимодействий:
1) собственной энергии сольватного комплекса в жидкости,
2) энергии, которую молекулы сольватного комплекса имели в чистой жидкости,
3) энергии взаимодействия молекул сольватного комплекса с окружающими их молекулами,
4) энтальпии поляризации вне первой сольватной оболочки, оцениваемой по уравнению Борна–Бьеррума (ΔUпол).
Результаты расчетов показывают определяющий вклад энергии образования сольватного комплекса в ΔH сольватации щелочных ионов. Однако с увеличением радиуса иона ΔUпол увеличивается.
Если рассматривать энергию сольватного комплекса в жидкости, то существуют два подхода к анализу природы связи в сольватах: электростатический и донорно-акцепторный, но ни тот, ни другой, по данным масс-спектроскопии, не в состоянии отдельно описать в полной мере взаимодействие катионов с молекулами гидроксилсодержащих соединений. Вероятно, необходимо учитывать как классические, так и квантовые эффекты. Их вклад меняется с изменением радиуса, заряда и электронной конфигурации иона. Не обсуждая вопрос о структуре сольватного комплекса в свободном растворе и в поре мембраны, можно сказать, что энергия образования сольватного комплекса в свободном растворе и в поре мембраны будет различна.
Упрочнение водородных связей в порах мембраны под действием поверхностных сил приводит к тому, что энергия, затрачиваемая на переориентацию диполей, входящих в непосредственное окружение иона, будет выше, чем в объеме, так как поляризация упруго-связанных полярных молекул am зависит не только от величины электрического момента каждой молекулы µ0, но и от энергии межмолекулярных связей U0 [23]:
Два взаимно противоположных положения оси диполя соответствуют двум минимумам его потенциальной энергии. Для того чтобы перевести диполь из первого положения во второе (поворот на 180°), необходимо затратить некоторую работу отрыва диполя от других диполей. Величина этой работы определяется потенциальным барьером, разделяющим эти два положения.
Указанный вклад должен возрастать с увеличением способности ионов (Li+ Mg2+, F–) формировать собственные гидратные комплексы, не нарушая структуры воды. Если рассматривать другие составляющие энергии сольватации, то для гипотетической жидкости, обладающей свойствами растворителя в порах мембраны, их вклады будет отличаться от таковых в свободном растворе. В квазимолекулярных моделях энергия взаимодействия частиц сольватного комплекса играет главную роль. В электростатических расчетах фактически вычисляется энергия частиц в вакууме, а затем предполагается, что энергия образования изолированного сольвата совпадает с энергией взаимодействия частиц в растворе. Данный подход переносится и на случай расчета изменения собственной энергии иона при его переносе из свободного раствора в пору мембраны. Действительно, неэмпирические расчеты гидратов ионов показывают [24], что заполнение второго и последующих слоев практически не влияет на расстояние иона до молекул гидратного слоя, но энергия их образования будет различной, что естественно для ассоциированных жидкостей. Вследствие этого более корректной оценкой, характеризующей селективные свойства ООМ, будет энтальпия переноса иона из свободного раствора в пору мембраны. Нельзя также игнорировать изменение энтропийной составляющей. Расчет энергии по Борну (довольно грубо) отражает фактически поляризационную составляющую энтальпии переноса иона из свободного раствора в пору мембраны. Принимая во внимание реальные размеры пор (1–2 нм) обратноосмотических мембран и учитывая, что для многих ионов формирование гидратного комплекса не ограничивается 1-ой и даже 2-ой сферой, становится очевидным, что в процессе изменения энтальпии гидратации ионов при их переносе из свободного раствора в пору мембраны важную роль будет играть потенциальная энергия ион-молекулярных и межмолекулярных взаимодействий.
В работах [25, 26] обнаружено, что энергия переноса ионов кобальтоцена и кобальтоциния в апротонных растворителях с различной ДП хорошо описывается формулой Борна. Эти эксперименты явились хорошей моделью для проверки формулы Борна. Молекулы растворителя не связаны друг с другом, следовательно, межмолекулярные взаимодействия отсутствуют. Ионы кобальтоцена и кобальтоциния представляют собой металлоорганические соединения, в которых ион кобальта окружен двумя циклопентадиениловыми кольцами, надежно защищающими его от непосредственного контакта с ионами растворителя. В этом случае среду вокруг иона можно рассматривать как континуальную, и ион будет обладать лишь поляризующим действием на молекулы растворителя, т.е. полностью соблюдается принцип электростатического подхода Борна “шар в континууме”. В этих же работах авторы обнаружили отклонение экспериментальных данных от рассчитанных по формуле Борна при расчете энергии переноса ионов в водно-спиртовых смесях. Это связывается с неучетом специфических взаимодействий. Кроме того, здесь нельзя игнорировать влияние сольвофобных эффектов.
Используя данные ЯМР, авторы [27] вычислили стандартную энергию Гиббса переноса Li+ из POCl3 в SOCl2. Обнаружена линейная корреляция между СХП иона и донорным числом растворителя. В данном случае механизм сольватации оксигалогенидами аналогичен таковому в диполярных апротонных растворителях. В работе [28] получена корреляция энтальпии переноса ионов с кислотно-основными свойствами бинарных растворов, что согласуется с донорно-акцепторным механизмом взаимодействия ион–растворитель. Это указывает на важную роль потенциала ион-дипольного взаимодействия в изменении СХП иона. Из изложенного выше становится очевидным, что применение формулы Борна для интерпретации механизма селективности ООМ имеет существенные ограничения, накладываемые следующими факторами:
1) изменением молекулярного поля жидкости в поре мембраны относительно свободного раствора,
2) спецификой ион-дипольных взаимодействий, связанных с перераспределением электронной плотности,
3) различиями в энергии образования гидратного комплекса в свободном растворе и в поре мембраны,
4) анизотропией молекулярного поля жидкости в поре мембраны под действием поверхностных сил,
5) принятием “жесткого” сольватного комплекса без учета его молекулярно-кинетических изменений [29].
Расчетами методом молекулярной динамики авторы [30] получили, что в порах полиамидных ООМ ионы Na+ и Cl– частично дегидратированы, а количество водородных связей между молекулами воды снижено.
В работе [31] авторы, используя экспериментальные значения плотности связанной воды в тонкопористых стеклах (меньшие по сравнению с объемным примерно на 3%), повышенные значения теплоемкости (25%) и вязкости, попытались создать статистическую термодинамическую модель воды в тонких порах. Модель коррелировала с некоторыми термодинамическими и динамическими свойствами воды в тонких порах. Согласно этой модели, оказалось, что связанная вода в тонких порах подобна воде в переохлажденном состоянии или находящейся под отрицательным давлением. Иными словами, водородные связи упрочнены вблизи твердой поверхности.
В случае ацетилцеллюлозных мембран (АЦМ), являющихся умеренно гидрофильными, взаимодействие молекул воды с матрицей полимера, как это следует из исследования состояния воды в АЦМ при малом влагосодержании методами ИК-спектроскопии и спектроскопии комбинационного рассеяния, намного слабее взаимодействия между собой [32]. В работе [33] обнаружено, что в АЦМ существует вода, не замерзающая при –40°C. Авторы оценили кластерное число воды (1.8–2.4) и сделали вывод о низкой степени ассоциации, тогда как в объемном растворе кластерное число воды, как правило, близко 6 [34]. На основании адсорбционных измерений сделан вывод о более слабом взаимодействии вода–мембрана, чем молекул воды между собой.
Авторы [35], используя метод метастабильного парожидкостного равновесия для исследования предела устойчивости жидкой воды в зависимости от температуры в диапазоне от 15 до 0°C в случае нанопористой кремниевой мембраны с размером пор 3–8 нм, также получили, что состояние воды в порах мембраны аналогично ее состоянию под высоким отрицательным давлением (до –30 МПа).
Молекулы этанола, будучи дифильными, проявляют свойства неионогенного ПАВ и адсорбируются на кислотных гидрофильных центрах кислородным атомом гидроксильной группы [36]. Добавки спирта в водные растворы электролитов способны значительно влиять на сольватацию ионов. Уже при невысокой мольной доле этанола (0.05) отмечено повышение энергии сольватации ионов [37–39], которое связывают с “сольвофобным эффектом” [40]. Молекулы спирта встраиваются между молекулами воды, способствуя усилению водородных связей между ними, и, как следствие, повышается энергия сольватации ионов.
При высоких концентрациях этанола в воде, отрицательный потенциал поверхности кварца снижается и становится затем даже положительным в случае очень высоких концентраций спирта [41]. Аналогичные результаты были получены и для полированной поверхности кремния, при этом авторы отмечают, что небольшие концентрации этанола в воде очень слабо влияют на поверхностные свойства [42]. Для полиамидных НФМ марок ОПМН (Владипор, Россия) и NF200 (Filmtec) также было обнаружено снижение отрицательного потенциала поверхности, вплоть до ее перезарядки [43] при очень высоких концентрациях этанола в водно-спиртовых растворах электролита. Авторы [44] связывают этот эффект с повышением энергии сольватации катионов солей в водно-спиртовых растворах. С повышением содержания спирта этот эффект усиливается и потенциал адсорбции катиона на поверхности повышается, что приводит к положительным значениям потенциала поверхности при очень высоком содержании этанола в водно-спиртовой смеси (более 80%).
Исследования влияния этанола на селективность мембран по отношению к растворам электролита представляют большой интерес, так как помимо того, что добавки этанола изменяют (понижают) ДП водных растворов, они также изменяют их физико-химические свойства: полярность, кислотно-основные и донорно-акцепторные свойства и способность к ассоциации.
МАТЕРИАЛЫ И МЕТОДЫ
В экспериментах использовали водные и водно-спиртовые растворы NaCl с концентрацией этанола 4 и 12 мас. %, что соответствует значениям его мольной доли, равным 0.016 и 0.051. Концентрация NaCl во всех случаях составляла 10–4 моль/л. Водный раствор NaCl 10–4 моль/л служил в качестве раствора сравнения.
Концентрацию ионов Na+ в фильтратах водных и водно-спиртовых растворов измеряли с помощью Na+-иономера OP-263 (Radelkis, Венгрия). Содержание этанола в фильтрате определяли хроматографическим методом, при помощи газового хроматографа GC 8700 (Perkin Elmer, США).
В экспериментах использовали ацетилцеллюлозную мембрану МГА-80 (НПО “Владипор”), натрий хлористый марки “х. ч.” и спирт этиловый – ректификат. Растворы готовили на тридистиллированной воде с электропроводностью 1.2 × 10–6 Ом–1 см–1 и pH 6.3. Измерения проводили при температуре 20°С.
На лабораторной установке динамического типа [45], позволяющей проводить измерения потенциала течения, электрического сопротивления и проницаемости мембраны непосредственно в ходе разделения, была исследована селективность мембраны по хлориду натрия. Разделение проводили при перепаде давления ΔP на мембране до 3 МПа.
Заряд мембраны σ рассчитывали на основе подхода, развитого Шмидом и Шварцем [9],
(3)
$\sigma = {{\Delta Er} \mathord{\left/ {\vphantom {{\Delta Er} {2\Delta PR{{K}_{{\text{f}}}}}}} \right. \kern-0em} {2\Delta PR{{K}_{{\text{f}}}}}},$где ΔE – потенциал течения, R – электрическое сопротивление делящего слоя мембраны, Kf – коэффициент фильтрации мембраны, r – средний радиус пор делящего слоя мембраны. Для расчетов значений R и r использовалась ранее разработанная методика [46]. Средний радиус пор делящего слоя мембраны, рассчитанный по дистиллированной воде, равен 1.4 нм.
Используя данные о коэффициенте фильтрации Kf и вязкости водно-спиртовых смесей η с учетом селективности мембраны по спирту, можно проследить за изменением радиуса пор мембраны при протекании через нее водно-спиртовых растворов NaCl при помощи уравнения Пуазейля
(4)
${{K}_{{\text{f}}}} = {{\pi {{r}^{4}}N} \mathord{\left/ {\vphantom {{\pi {{r}^{4}}N} {8\eta h}}} \right. \kern-0em} {8\eta h}},$Если принять, что во всех опытах значения N и h оставались неизменными, то тогда относительное изменение радиуса пор находится из соотношения
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 приведены зависимости селективности φ мембраны по ионам Na+ от перепада давления (рис. 1а) и скорости течения раствора (рис. 1б). Видно, что для кривых 2, соответствующих содержанию этанола 4%, максимальные значения коэффициента селективности в области плато равны примерно 0.85. Эти значения превосходят соответствующие значения φ для 10–4 М водного раствора NaCl, достигающие 0.79 (кривые 1). При увеличении доли этанола до 12% коэффициент задержки ионов Na+ уменьшается и составляет в области плато 0.60 (кривые 3).
Рис. 1.
Зависимости селективности φ мембраны МГА-80 по катионам Na+ от перепада давления ΔP (а) и скорости течения раствора V (б) при разном содержании этанола в водно-спиртовой смеси: 1 – 10–4 моль/л водный раствор NaCl, 2 – раствор с содержанием спирта 4%, 3 – раствор с содержанием спирта 12%.
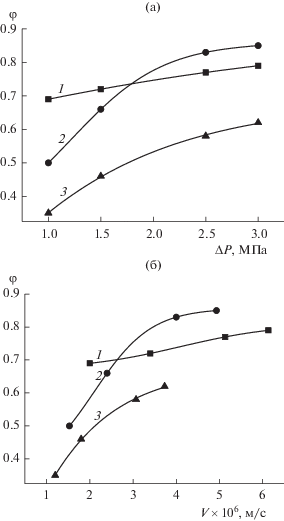
Так как вязкость растворов изменялась от опыта к опыту, более корректными и информативными в нашем случае должны быть зависимости селективности мембраны от скорости течения растворов.
На рис. 2 изображены кривые зависимости селективности мембраны по этанолу от приложенного давления (рис. 2а) и скорости течения растворов (рис. 2б). Характер кривых при этом несколько изменяется. Видно, что мембрана имеет небольшие значения селективности по этанолу – 0.26 и 0.20 в области плато – для растворов с концентрацией спирта 4 и 12% соответственно.
Рис. 2.
Зависимости селективности φ мембраны МГА-80 по этанолу от перепада давления ΔP (а) и скорости течения раствора V (б) при содержании спирта в 10–4 моль/л водном растворе NaCl, равном 4 (1) и 12% (2).
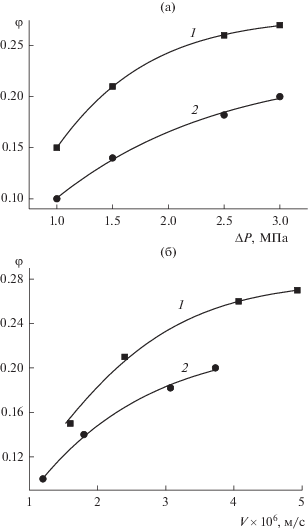
Следует отметить резкое снижение скорости течения при использовании водно-этанольного раствора NaCl с содержанием спирта 4% по сравнению с водным раствором соли. Эффект снижения был обратим для обоих водно-спиртовых растворов, что подтверждается воспроизводимым неизменным значением коэффициента фильтрации дистиллированной воды после каждого проведенного опыта. Так как селективность мембраны по спирту для 4%-го раствора этанола составила 0.26, а для 12%-го раствора – 0.20, то в порах мембраны концентрация этанола была снижена до 3% в первом случае и до 9.6% во втором. Поэтому в расчетах использовали значения вязкости, соответствующие концентрации этанола в фильтрате, полагая, что его концентрация в поровом растворе равна таковой в фильтрате. Для 4%-го и 12%-го растворов спирта эти значения составили 1.16 и 1.5 мПа с соответственно. Вязкость 10–4 М водного раствора NaCl принимали равной 1 мПа с.
Расчеты показали, что при использовании приведенных выше значений вязкости водно-спиртовых смесей и при переходе от водного к водно-спиртовому 10–4 М раствору NaCl с содержанием спирта 4% расчетный радиус пор мембраны оказывается меньше на 4%. Это происходит, вероятно, вследствие адсорбции молекул спирта на поверхности пор мембраны и повышения вязкости граничных (адсорбированных) слоев спирта [47].
Авторы [41] отмечали, что в водно-этанольных смесях молекулы спирта вытесняют молекулы воды с твердой поверхности в объем раствора. В результате средняя эффективная вязкость раствора может оказаться несколько выше значений, используемых нами.
Сравнительный анализ на основе уравнения (5) показал, что в случае фильтрации смеси 10–4 М водно-спиртового раствора NaCl с содержанием этанола 12% радиус пор мембраны не изменяется по сравнению с водно-спиртовым раствором NaCl, содержащим 4% спирта. Однако, как свидетельствуют кривые 3 на рис. 1а и 1б, при разделении раствора с содержанием спирта 12% происходит заметное снижение селективности мембраны по ионам натрия.
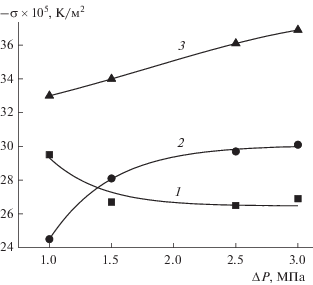
Зависимости поверхностного заряда мембраны от перепада давления при течении водного и водно-спиртовых растворов хлорида натрия через мембрану, рассчитанные по уравнению (3), изображены на рис. 3. Как следует из их анализа, нет корреляции между селективностью мембраны и ее поверхностным зарядом. Так, в растворе с содержанием этанола 12% мембрана приобретает более высокий заряд, чем в 4%-ном растворе спирта и в водном растворе, однако ее селективность по ионам натрия минимальна во всех 3-х случаях. Следует признать, что мембрану МГА-80 нельзя отнести к мембранам нанофильтрационного типа, для которых зависимости селективности от заряда поверхности мембраны и знака заряда ионов электролита и их концентрации имеют более ярко выраженный характер.
ЗАКЛЮЧЕНИЕ
Полученные результаты показывают, что даже очень малые добавки этанола (0.016 и 0.051 мольной доли) в 10–4 моль/л водный раствор NaCl оказывают противоположное влияние на селективность ацетилцеллюлозной мембраны по ионам натрия. По нашему мнению, это обусловлено различиями в изменении энтальпии сольватации иона при его транспорте из объемного раствора в пору мембраны. При мольной доле этанола 0.016 это изменение оказывается много большим, чем при его мольной доле, равной 0.051. Не обнаружено корреляции между значениями селективности мембраны по ионам натрия и величиной поверхностного заряда мембраны для водно-спиртовых смесей.
Список литературы
Мартынов Г.А., Старов В.М., Чураев Н.В. // Колло-ид. журн. 1980. Т. 42. С. 489.
Derjaguin B.V., Churaev N.D., Martynov G.A. // J. Colloid. Interface. Sci. 1980. V. 75. P. 419.
Чураев Н.В., Дерягин Б.В. // Журн. ВХО им. Д.И. Мен-делеева. 1987. Т. 32. С. 614.
Yaroshchuk A.E. // Adv. Colloid Interface. Sci. 2000. V. 85. P. 193.
Spiegler K.S. // Trans. Faraday Soc. 1958. V. 54. P. 1408.
Desalination by reverse osmosis. / Ed. by Merten U. Cambridge: MIT Press, 1966.
Manning G.S. // J. Phys. Chem. 1972. V. 76. P. 393.
Donnan F.G. // J. Membr. Sci. 1995. V. 100. P. 45.
Schmid G., Schwars H. // Z. Elektrochem. 1952. V. 52. P. 35.
Hoffer E., Kedem O. // J. Phys. Chem. 1972. V. 76. P. 3638.
Bowen W.R., Mukhtar H. // J. Membr. Sci. 1996. V. 112. P. 263.
Bowen W.R., Welfoot J.S. // Chem. Eng. Sci. 2002. V. 57. P. 1121.
Vezzani D., Bandini S. // Desalination. 2002. V. 149. P. 477.
Bandini S., Vezzani D. // Chem. Eng. Sci. 2003. V. 58. P. 3303.
Bandini S. // J. Membr. Sci. 2005. V. 264. P. 75.
Bruni L., Bandini S. // J. Membr. Sci. 2008. V. 308. P. 136.
Szymczyk A., Fievet P. // J. Membr. Sci. 2005. V. 252. P. 77.
Born M. // Z. Phys. 1920. V. 1. P. 45.
Stokes R.H. // J. Am. Chem. Soc. 1964. V. 64. P. 979.
Корнышев А.А., Цицуашвили Г.И., Ярощук А.Э. // Электрохимия. 1989. Т. 25. С. 1037.
Bernal J.D., Fowler R.H. // J. Chem. Phys. 1933. V. 1. P. 515.
Крестов Г.А. Ионная сольватация. М.: Наука, 1987.
Сканави Г.И. Физика диэлектриков. М.: Гос. изд-во технико-теоретической литературы, 1949.
Ontaki H., Yamaguchi T., Maeda M. // Bull. Chem. Soc. Jap. 1976. V. 49. P. 701.
Кришталик Л.И., Алпатова Н.М., Овсянникова Е.В. // Электрохимия. 1990. Т. 26. С. 429.
Кришталик Л.И., Алпатова Н.М., Овсянникова Е.В. // Электрохимия. 1990. Т. 26. С. 436.
Мишустин А.И., Мозалевская В.А., Пономарев В.П. // Журнал физ. химии. 1989. Т. 63. С. 1345.
Манин Н.Г., Королев В.П. // Журн. физ. химии. 2002. Т. 76. С. 246.
Самойлов О.Я. Структура водных растворов электролитов и гидратация ионов. М.: Изд. АН СССР, 1957.
Ding M., Szymczyk A., Ghouf A. // Desalination. 2015. V. 368. P. 76.
Etzler F.M. // J. Colloid Interface Sci. 1983. V. 92. P. 43.
Овчинников А.Л., Тимашев С.Ф., Белый Ф.Л. Кинетика диффузионно-контролируемых процессов. М.: Химия, 1986.
Атаманенко И.Д., Брык Ю.И. // Коллоид. журн. 1991. Т. 53. С. 336.
Sun Q., Zheng H.-F. // Chinese Phys. Lett. 2006. V. 23. P. 3022.
Chen I.T., Sessoms D.A., Sherman Z., Choi E., Vincent O., Stroock A.D. // J. Phys. Chem. B. 2016. V. 120. P. 5209.
Иванова Н.И., Вакар Н.Т., Перцов Н.В. // Коллоид. журн. 1987. Т. 49. С. 1348.
Чанкина Т.И., Парфенюк В.И. // Журн. физ. химии. 2011. Т. 85. С. 1419.
Чанкина Т.И., Парфенюк В.И. // Электрохимия. 2008. Т. 44. С. 1251.
Парфенюк В.И. // Журн. физ. химии. 2005. Т. 79. С. 1037.
Кесслер Ю.М., Зайцев А.Л. Сольвофобные эффекты. Теория, эксперимент, практика. Л.: Химия, 1989.
Жуков А.Н., Федорова И.Л. // Коллоид. журн. 2004. Т. 66. С. 333.
Kosmulski M., Matijevic E. // Langmuir. 1992. V. 8. P. 1060.
Pihlajamaki A., Laakso T., Manttari M. // Procedia Eng. 2012. V. 44. P. 1502.
Жуков А.Н., Федорова И.Л. // Коллоид. журн. 1990. Т. 52. С. 781.
Саббатовский К.Г., Соболев В.Д., Чураев Н.В. // Коллоид. журн. 1991. Т. 53. С. 74.
Саббатовский К.Г., Соболев В.Д., Чураев Н.В. // Коллоид. журн. 1991. Т. 53. С. 403.
Родионова И.А., Школьников Е.И., Волков В.В.// Коллоид. журн. 2005. Т. 67. С. 518.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал