Коллоидный журнал, 2020, T. 82, № 1, стр. 96-100
Водород в наночастицах палладия: усиление каталитической активности в реакции восстановления гексацианоферрат(III)-ионов в водном растворе
Р. Д. Соловов 1, *, А. Ю. Перевозникова 1, Б. Г. Ершов 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
117342 Москва, ул. Обручева, 40, Россия
* E-mail: roman_solovov@mail.ru
Поступила в редакцию 05.06.2019
После доработки 10.06.2019
Принята к публикации 17.06.2019
Аннотация
Изучена каталитическая активность гидрозоля палладия в реакции восстановления гексацианоферрат(III)-ионов водородом. Установлено, что скорость реакции возрастает при увеличении степени насыщения наночастиц палладия водородом. Получено уравнение, описывающее зависимость константы скорости реакции от времени предварительного насыщения гидрозоля водородом. Наблюдаемый эффект, по-видимому, вызван разрядом–ионизацией растворенного в наночастице водорода и увеличением в ней электронной плотности, что приводит к усилению ее каталитических свойств.
ВВЕДЕНИЕ
Палладий является одним из наиболее эффективных металлов в катализе [1, 2], исследование материалов на его основе является чрезвычайно важным и актуальным. В настоящее время каталитическая активность этого металла в наноразмерном состоянии является предметом пристального внимания. Коллоиднaя форма и увеличение поверхности оказывают существенное влияние на скорость каталитических реакций, в частности, реакций гидрирования [3, 4], окисления [5, 6], образования углерод-углеродной связи [7, 8], электрохимических реакций в топливных элементах [9]. Также склонность палладия адсорбировать водород привела к использованию его наночастиц (НЧ) для хранения водорода [10, 11].
Большое внимание уделялось изучению состояния водорода в металлическом палладии и изменению его физических характеристик [12]. Однако практически отсутствуют работы по изучению влияния молекулярного водорода на физико-химические и каталитические свойства палладия в наноразмерном состоянии. Развитая поверхность должна способствовать усилению каталитической активности. Поэтому исследование механизма и основных закономерностей протекания каталитических реакций с участием НЧ палладия и водорода является принципиально важной и интересной задачей.
Цель данной работы заключалась в изучении процесса насыщения НЧ палладия водородом и установлении влияния данного процесса на каталитическую активность палладия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение НЧ палладия
Наночастицы палладия были синтезированы воздействием импульсного УФ-света на водные растворы [Pd(NH3)4]Cl2 по ранее описанной методике [13]. В качестве стабилизатора образующихся НЧ Pd использовался полиакрилат натрия. Полученный гидрозоль Pd характеризуется мономодальным узким распределением НЧ по размерам; их средний размер равен 2.5 ± 0.3 нм. Дзета-потенциал НЧ гидрозоля был достаточно большим по абсолютной величине (–61.3 мВ), что указывает на его высокую агрегативную устойчивость.
Гидрирование наночастиц Pd
Гидрирование НЧ палладия проводили следующим образом. Гидрозоль Pd помещали в специальную ячейку, снабженную кварцевой кюветой с длиной светового пути 1 см. Конструкция ячейки позволяла провести ее деаэрирование и изолировать ее внутренний объем от окружающей среды. Затем в нее вводился водород, и после насыщения гидрозоля Pd его перемешивали при небольшом избыточном давлении в течение требуемого времени. При необходимости удаления растворенного водорода ячейку с гидрозолем Pd повторно вакуумировали.
Небольшое изменение значения дзета-потенциала относительно начальной его величины (до гидрирования ζ = –(55.0 ± 7.0) мВ, после гидрирования ζ = –(47.3 ± 9.0) мВ) указывает на процессы, протекающие на поверхности НЧ металла. Однако сохранившаяся его относительно большая абсолютная величина (более 40 мВ) подразумевает, что данные процессы не повлияли на высокую агрегативную (и седиментационную) устойчивость гидрозоля. Размер и степень полидисперсности НЧ палладия после гидрирования, согласно данным просвечивающей электронной микроскопии, остается прежним. Метод динамического рассеяния света также подтверждает это. Таким образом, гидрирование золя палладия в водном растворе не сопровождается какими-либо заметными изменениями размеров коллоидных частиц металла и/или их агрегированием.
Реакция восстановления гексацианоферрат(III)-ионов водородом
В качестве модельной реакции окислительно-восстановительного катализа использовалось восстановление гексацианоферрата(III)-ионов водородом. Катализ проводился следующим образом. Аликвоту гидрозоля смешивали с водным раствором, содержащим гексацианоферрат(III) калия. Полученный раствор перемешивали на магнитной мешалке, деаэрировали и насыщали водородом.
Методы исследования
Оптические спектры измеряли с помощью спектрофотометра Cary 100 Scan с термостатируемым отсеком для ячейки; длина оптического пути l = 1 см. Все спектры регистрировали при 20.0°С.
Гидродинамический размер и дзета-потенциал образовавшихся коллоидных частиц определяли методом динамического рассеяния света на приборе Delsa Nano C (Beckman Coulter, Inc.), используя лазер с длиной волны излучения λ = 658 нм и пакет программного обеспечения Delsa Nano.
Размеры и форму НЧ анализировали в просвечивающем электронном микроскопе (ПЭМ) JEM-2100 (JEOL). Для этого каплю коллоидного раствора наносили на покрытую формваром и углеродом медную сеточку (300 меш) и затем избыток раствора удаляли фильтровальной бумагой.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ранее было установлено [14], что НЧ палладия катализируют восстановление гексацианоферрат(III)-ионов водородом в водном растворе. Каталитическое действие палладия в реакциях с участием водорода, как ранее уже отмечалось в наших работах [13–16], объясняется растворением молекулярного водорода в металле и протеканием диссоциативной адсорбции H2 на его поверхности. При “стекании” электронов водорода “в металл” значительно облегчается процесс восстановления, заключающийся в переносе электрона от НЧ к гексацианоферрат(III)-ионам.
Было установлено [14], что при насыщении гидрозоля Pd водородом его оптические свойства существенно изменяются. Полоса поглощения НЧ Pd с максимумом при 215–220 нм трансформируется в новую более широкую полосу с максимумом при 265 нм. Такое изменение оптических свойств НЧ Pd обратимо. При откачке водорода и выдерживании гидрозоля под вакуумом наблюдается постепенное медленное восстановление исходной полосы поглощения НЧ палладия.
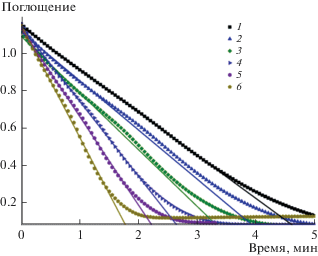
Следует отметить, что процесс удаления водорода из НЧ в растворе протекает за времена значительно бóльшие, нежели процесс их насыщения. Кинетические характеристики “прямого” процесса гидрирования НЧ Pd исследовать достаточно сложно, поэтому для оценки его скорости был использован метод относительных констант скоростей. Метод заключался в измерении наблюдаемой константы скорости реакции восстановления гексацианоферрат(III)-ионов водородом в присутствии НЧ Pd, насыщенных H2 в течение разного времени при интенсивном перемешивании (рис. 1).
Рис. 1.
Кинетические кривые восстановления гексацианоферрат(III)-ионов водородом в гидрозоле палладия при разном времени предварительного насыщения его водородом: 1 – 0, 2 – 60, 3 – 180, 4 – 420, 5 – 720, 6 – 2400 с. $\left[ {{\text{Fe}}({\text{CN}})_{{\text{6}}}^{{{\text{3}}--}}} \right]$ = 1.00 мМ, $\left[ {{\text{Pd}}_{{{\text{coll}}}}^{0}} \right]$ = = 0.020 мМ, [H2] = 0.80 мМ (p(H2) = 1.025 атм).
Процесс насыщения водородом частицы палладия и последующую реакцию разряда водорода на ней можно представить следующим образом:
Сам процесс переноса электронов к гексацианоферрат(III)-ионам является быстрым. Исходя из экспериментально установленных зависимостей, можно утверждать, что лимитирующей стадией является диссоциативная адсорбция H2 на поверхности НЧ. Тогда наблюдаемая константа реакции восстановления гексацианоферрат(III)-ионов прямо пропорциональна степени заполнения поверхности НЧ атомами водорода θH (степени протекания диссоциативной адсорбции) с некоторым коэффициентом пропорциональности α. Степень заполнения, в свою очередь, может быть выражена на основе феноменологического рассмотрения равновесия адсорбции–десорбции следующим образом:
Концентрация адсорбированного водорода на поверхности НЧ [H2 ad] пропорциональна времени насыщения гидрозоля водородом (τsat). Тогда уравнение для наблюдаемой константы скорости реакции kobs и степени протекания диссоциативной адсорбции θH можно преобразовать к виду
Для линеаризации данного уравнения и расчета постоянных величин α и Kβ необходимо представить его в следующем виде:
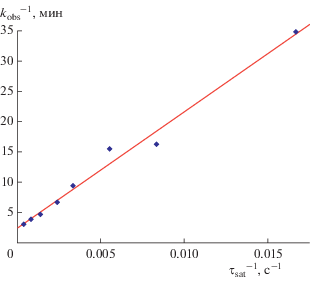
Уравнение (1) хорошо описывает экспериментальные данные. На рис. 2 приведена зависимость константы скорости восстановления гексацианоферрат(III)-ионов водородом в гидрозоле Pd от времени предварительного насыщения его водородом в спрямляющих координатах. Следует отметить, что уравнение (1) выведено в предположении о мономолекулярной ленгмюровской адсорбции. В действительности же, в данном случае процесс адсорбции осложняется ее полимолекулярным характером, неравноценностью центров адсорбции (НЧ имеет анизотропную поверхность), а также диффузией водорода с поверхности внутрь НЧ Pd.
Рис. 2.
Линейная анаморфоза зависимости константы скорости восстановления гексацианоферрат(III)-ионов водородом в гидрозоле Pd от времени предварительного насыщения его водородом. $\left[ {{\text{Fe}}({\text{CN}})_{{\text{6}}}^{{{\text{3}}--}}} \right]$ = = 1.00 мМ, $\left[ {{\text{Pd}}_{{{\text{coll}}}}^{0}} \right]$ = 0.020 мМ, [H2] = 0.80 мМ (p(H2) = 1.025 атм).
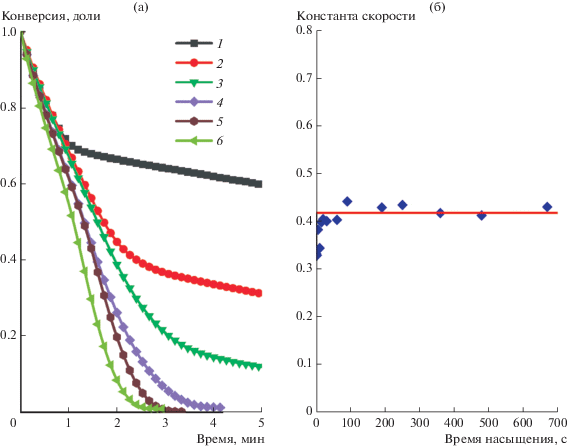
Для подтверждения того, что влияние на каталитические свойства НЧ Pd оказывает именно водород, растворенный в металле, было исследовано влияние времени насыщения водородом раствора, содержащего гексацианоферрат(III)-ионы, но свободного от катализатора, на скорость процесса восстановления. Такой режим эксперимента исключает влияние времени предварительного насыщения НЧ Pd водородом, а лишь показывает влияние концентрации H2, присутствующего в растворе, на кинетику процесса. При этом сам процесс восстановления протекал в присутствии “гидрированных” НЧ Pd. Видно (рис. 3), что примерно за 15 с насыщения раствора водородом накапливается достаточное его количество для восстановления всех гексацианоферрат(III)-ионов. Более того, кинетические параметры самого процесса, то есть константа скорости и порядок реакции по водороду, никак не изменяются при всех значениях τsat. При τsat менее 15 с на кинетических кривых наблюдается излом и переход в линейный режим, соответствующий псевдонулевому порядку реакции. То есть количество H2 в растворе оказывается недостаточным для восстановления всех гексацианоферрат(III)-ионов, и после его полного расходования процесс лимитируется растворением H2 в реакционной системе (рис. 3а, линейные участки кинетических кривых при τsat = 0, 2, 5 и 10 с).
Рис. 3.
(а) Кинетические кривые восстановления гексацианоферрат(III)-ионов водородом в присутствии гидрозоля Pd при разном времени насыщения раствора гексацианоферрата(III) калия водородом: 1 – 0, 2 – 2, 3 – 10, 4 – 15, 5 – 60, 6 – 670 с. (б) Константа скорости этого процесса в зависимости от времени насыщения раствора. $\left[ {{\text{Fe}}({\text{CN}})_{{\text{6}}}^{{{\text{3}}--}}} \right]$ = = 1.00 мМ, $\left[ {{\text{Pd}}_{{{\text{coll}}}}^{0}} \right]$ = 0.020 мМ, [H2] = 0.80 мМ (p(H2) = 1.025 атм).
Как отмечалось ранее [14], водород, растворенный в металле, изменяет его каталитические и оптические характеристики. Поэтому наблюдаемый эффект усиления каталитических свойств НЧ Pd мы связываем с разрядом–ионизацией растворенного в металле водорода и возникновением избытка электронной плотности в НЧ. Это вызывает трансформацию катализирующих НЧ Pd в новое состояние – “гидрированное”. Избыточная плотность электронов в металле приводит к усилению каталитических свойств. Все это указывает на принципиальное различие гидрозоля Pd и “гидрированного” гидрозоля Pd. Кроме того, такой результат хорошо согласуется с принятым предположением о лимитировании всего процесса скоростью диссоциативной адсорбции H2 на поверхности НЧ палладия.
Список литературы
Astruc D. // Inorg. Chem. 2007. V. 46. P. 1884.
Bell A.T. // Science. 2003. V. 299. P. 1688.
Semagina N., Renken A., Kiwi-Minsker L. // J. Phys. Chem. C. 2007. V. 111. P. 13933.
Wilson O.M., Knecht M.R., Garcia-Martinez J.C., Crooks R.M. // J. Am. Chem. Soc. 2006. V. 128. P. 4510.
Dimitratos N., Porta F., Prati L. // Appl. Catal. A. 2005. V. 291. P. 210.
Hou Z., Theyssen N., Brinkmann A., Leitner W. // Angew. Chem. Int. Ed. 2005. V. 44. P. 1346.
Beller M., Fischer H., Kuhlein K., Reisinger C.-P., Herrmann W.A. // J. Organomet. Chem. 1996. V. 520. P. 257.
Narayanan R., El-Sayed M.A. // J. Catal. 2005. V. 234. P. 348.
Cheong S., Watt J.D., Tilley R.D. // Nanoscale. 2010. V. 2. P. 2045.
Horinouchi S., Yamanoi Y., Yonezawa T., Mouri T., Nishihara H. // Langmuir. 2006. V. 22. P. 1880.
Yamauchi M., Ikeda R., Kitagawa H., Takata M. // J. Phys. Chem. C. 2008. V. 112. P. 3294.
Brodowsky H. // Ber. Bunsenges. Phys. Chem. 1972. V. 78. P. 740.
Ершов Б.Г., Соловов Р.Д., Абхалимов Е.В. // Коллои-д. журн. 2014. Т. 76. С. 601.
Ershov B.G., Solovov R.D. // Catal. Commun. 2018. V. 103. P. 34.
Соловов Р.Д., Ершов Б.Г. // Коллоид. журн. 2014. Т. 76. С. 645.
Соловов Р.Д., Абхалимов Е.В., Ершов Б.Г. // Коллоид. журн. 2016. Т. 78. С. 629.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


