Коллоидный журнал, 2020, T. 82, № 2, стр. 223-230
Молекулярно-динамическое моделирование устойчивости сферических нанокластеров гидратов метана и углекислого газа
А. А. Сизова 1, *, В. В. Сизов 1, Е. Н. Бродская 1
1 Санкт-Петербургский государственный университет
198504 Санкт-Петербург,
Университетский просп., 26, Россия
* E-mail: shapovalovaaa@mail.ru
Поступила в редакцию 07.10.2019
После доработки 14.10.2019
Принята к публикации 17.10.2019
Аннотация
Методом молекулярной динамики в изохорных и изобарных условиях исследована устойчивость сферических нанокластеров гидратов метана и углекислого газа в окружении переохлажденной воды. Процесс плавления системы рассматривался в температурном интервале от 180 до 280 K при давлении 1, 50 и 100 атм (для изобарных условий). Показано, что кластеры гидрата CO2 плавятся при более низких температурах, чем кластеры гидрата CH4. Разница в температурах плавления гидратов составляет около 40 K, что объясняется большей растворимостью углекислого газа в воде. Рассчитанные значения коэффициентов диффузии воды и газов свидетельствуют о разных механизмах плавления двух гидратов. Устойчивость гидратов в изохорных условиях оказывается ниже, чем в изобарных. При этом изменение давления при моделировании в изобарных условиях, а также степень заполнения гидрата углекислого газа не сказываются на положении области плавления гидратных нанокластеров.
ВВЕДЕНИЕ
Газовые гидраты представляют собой нестехиометрические соединения, состоящие из кристаллического водного каркаса, образованного за счет водородных связей, структура которого стабилизируется газовыми молекулами. Газ располагается в полостях – многогранниках, в узлах которых находятся молекулы H2O. Строение и количество полостей, входящих в состав гидрата, определяют тип его структуры. Так, элементарная ячейка гидрата структуры sI состоит из двух додекаэдрических (512) полостей, обозначаемых как “малые”, и из шести “больших” тетрадекаэдрических полостей (512 62).
Среди всех газовых гидратов наиболее широко изученными являются, пожалуй, гидраты метана ввиду своей распространенности в природе и потенциальной возможности их использования в качестве источника углеводородного сырья. Одним из подходов, предложенных для добычи метана из залежей гидратов, является его замещение молекулами CO2, что позволяет одновременно решать проблему захоронения избытков техногенного углекислого газа [1]. Такой подход возможен, поскольку, как показано экспериментально, гидрат CO2 более устойчив, чем гидрат CH4 в условиях, при которых происходит замещение. При этом разность температур для фиксированного давления составляет около 5 градусов, а разность равновесных давлений около 20 атм при данной температуре [2]. Однако непосредственная замена в диффузионном режиме метана углекислым газом в гидрате неосуществима из-за исключительно низких значений коэффициентов диффузии газов. Кроме того, процесс замены газа осложняется так называемым явлением самоконсервации гидратов, когда кристаллическая фаза попадает в метастабильное состояние выше равновесной температуры плавления при атмосферном давлении. Поэтому рассматривают двухступенчатую процедуру замены газов с диссоциацией гидрата метана на воду и газовую фазу и последующим гидратообразованием с участием углекислого газа. Тем не менее, экспериментально полученные данные о такого рода процессах часто оказываются неопределенными и труднообъяснимыми [3]. По этой причине важную роль в изучении каждого из фазовых превращений газовых гидратов, в первую очередь, метана и углекислого газа, играют методы молекулярного моделирования [4]. Большое внимание уделяется выбору силовых полей для адекватного представления свойств гидратов. Так, в зависимости от используемой модели воды обнаруживается существенный разброс в значениях параметров фазовых переходов в газогидратных системах [5–7]. В большинстве работ по диссоциации гидрата моделируются образцы объемных гидратов или гидратов с плоскими границами, т.е. предполагается, что система имеет макроскопические размеры (см., например, [8–11]). Однако и в лабораторном эксперименте, и в природных условиях гидраты часто представлены в виде поликристаллических систем, содержащих частицы разного размера, включая и наноразмерные. В последнем случае размер частицы должен значительно влиять на фазовое состояние гидрата.
Моделированию поведения наноразмерных гидратов посвящено ограниченное количество работ [12–16]. В работах [14–16] было подробно изучено явление самоконсервации на примере плавления сферических наночастиц гидратов. Температуру фазового перехода для двух систем: изолированного кластера газового гидрата, окруженного тонкой ледяной оболочкой, и объемной системы лед–гидрат метана изучали в [14]. Было показано, что тонкая оболочка льда в случае наночастицы не может обеспечить необходимый рост давления в гидрате и потому ее устойчивость ниже, чем в случае объемной системы, в которой образуются конгломераты из покрытых льдом кристаллов гидрата. В [15] методом молекулярной динамики моделировали нанокластеры гидратов метана и криптона и определяли их температуры плавления, основываясь на калорических кривых, критерии Линдемана и температурной зависимости коэффициентов диффузии компонентов систем. Было показано, что нанокластеры гидратов радиусом примерно 1.5 нм оказываются более устойчивыми, чем аналогичный нанокластер льда: температура плавления выше примерно на 25 K для гидрата метана и на 15 K для гидрата криптона. В свою очередь, температура плавления ледяного нанокластера, находящегося в переохлажденной воде, оказалась практически равной температуре плавления объемного льда. Анализ изменения механического состояния (локального тензора давления) нанокластеров гидратов метана и криптона, проведенный в работе [16], показал, что при низком внешнем давлении главным условием повышенной устойчивости является наличие непроницаемой для газа водной оболочки. Кроме того, сплошная ледяная оболочка способствует возникновению в гидрате повышенного давления, стабилизирующего его фазовое состояние.
Моделированию наногидратов других газов, в частности CO2, уделялось значительно меньше внимания.
Целью данной работы является сравнение устойчивости нанокластеров гидратов CO2 и CH4 по результатам молекулярно-динамических расчетов. Для этого было проведено моделирование плавления сферических частиц двух гидратов в окружении переохлажденной воды в широком температурном интервале. Температура плавления определялась по верхней границе интервала заметного изменения структурных, транспортных и энергетических характеристик системы при нагревании.
МЕТОДИКА МОДЕЛИРОВАНИЯ
Системы, рассмотренные в настоящей работе, включали в себя наноразмерный кластер газового гидрата, помещенный в переохлажденную жидкую воду. Нанокластеры гидратов метана и углекислого газа были подготовлены вырезанием сферической частицы диаметром 32 Å из объемных гидратов структуры sI (рис. 1). В таком образце находились 99 молекул газа и 588 молекул воды при условии полного заполнения. В случае гидрата CO2 также было изучено плавление частично заполненного гидратного нанокластера. Молекулы углекислого газа занимали либо 85 случайно выбранных полостей, либо только большие полости, малые оставались свободны. Сферические кластеры гидратов помещались в кубическую ячейку, заполненную переохлажденной водой. Молекулярно-динамическое моделирование проводилось на основе программного пакета GROMACS 2016.4 [17, 18] в изохорных (NVT-ансамбль) и изобарных (NpT-ансамбль) условиях, что позволило сравнить устойчивость нанокластеров при закреплении различных макроскопических параметров и выявить влияние давления на протекание процесса плавления.
Рис. 1.
Мгновенные конфигурации нанокластеров гидратов метана (слева) и углекислого газа (справа) до плавления (180 K).

Плавление изучалось путем последовательного повышения температуры в системе от 180 K, когда кластер заведомо устойчив, до температуры, при которой кластер полностью разрушается (в данной работе – 280 K) с интервалом в 10 K. Задавались три значения давления: 1, 50 и 100 атм. Для поддержания постоянных температуры и давления использовались термостат и баростат Берендсена с временем релаксации 1 пс. При моделировании в NpT-ансамбле определялась средняя плотность окружающей воды, которая зависела от заданных давления и температуры. Плотность переохлажденной воды при моделировании в изотермо-изохорных условиях при всех значениях температуры была постоянной и принималась равной плотности воды в гидрате. Продолжительность расчетов составила от 100 до 250 нс с шагом интегрирования 1 фс. Расчет характеристик системы проводился по равновесному участку траектории длиной не менее 30 нс (в зависимости от размера флуктуаций). Достижение устойчивого равновесия было подтверждено отсутствием дрейфа среднего значения потенциальной энергии системы.
Межмолекулярные взаимодействия в системе описывались суммой потенциалов Леннард-Джонса и Кулона с радиусом обрезания 15 Å. Учет электростатического дальнодействия производился методом “частица–сетка” Эвальда (PME). Для метана и углекислого газа использовались модели OPLS-UA [19] и TraPPE [20] соответственно. Для воды была выбрана модель TIP4P/ice [21], которая отличается от использованной нами ранее [15] модели SPC/E более высокой температурой плавления, близкой к экспериментальному значению. Перекрестные взаимодействия определялись по правилу Лоренца–Бертло, за исключением параметра ε для взаимодействия углерода углекислого газа с кислородом воды. В работе [5] было показано, что для корректного воспроизведения свойств объемных гидратов необходимо увеличить его значение в 1.08 раза.
Для определения устойчивости нанокластеров гидратов метана и углекислого газа были получены температурные зависимости таких характеристик как радиальные функции распределения, коэффициенты диффузии и энергия межмолекулярного взаимодействия газов. С учетом выбранного интервала между соседними температурными значениями погрешность определения точки плавления составляет около 5 градусов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно, что плавление малых частиц в отличие от объемных фаз представляет собой непрерывный процесс, занимающий некоторый температурный интервал, характеризующийся заметными изменениями всех свойств системы. Верхнюю границу этого интервала можно выбирать в качестве характерного значения температуры плавления. В рассматриваемых системах для определения точки плавления гидратных нанокластеров при разных значениях температуры были рассчитаны радиальные функции распределения (РФР), коэффициенты диффузии газов и потенциальная энергия взаимодействия между компонентами системы.
Радиальные функции распределения
Одним из признаков разрушения структуры гидрата метана при повышении температуры являются изменения РФР, полученных в результате молекулярно-динамического моделирования. На рис. 2а показаны парные функции распределения метан–метан, рассчитанные в NVT-ансамбле. При температуре 200 K видны высокие четко разделенные пики, что свидетельствует о наличии упорядоченной структуры метана, расположенного в полостях гидрата. Расстояние между ближайшими соседними молекулами метана составляет около 6.5 Å, количество таких соседей равно 9.4. Аналогичные структурные характеристики были получены и при значениях температуры 180, 210, 220 и 230 K. При 240 K интенсивность максимумов снижается, пики сглаживаются. Из рис. 2 следует, что окончательное разрушение структуры гидрата происходит при переходе от 250 к 260 K. При этом количество ближайших соседей в системе уменьшается до 5.2 при 250 K и достигает близкого к нулю значения (0.2) при 260 K.
Рис. 2.
Радиальные функции распределения (а) метан–метан (C–C) и (б) метан–вода (C–O) в изохорных условиях при разной температуре: 1 – 200, 2 – 250, 3 – 260 K.
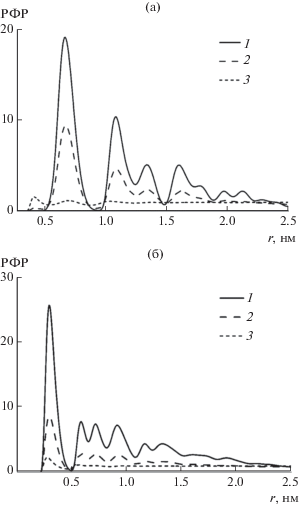
Согласно радиальным функциям распределения C–O (метан–вода) (рис. 2б) полное разрушение кристаллической структуры также происходит при температуре 260 K. Однако стоит отметить, что снижение интенсивности максимумов начинается при более низкой температуре (230 K). Это свидетельствует о том, что плавление гидрата начинается с разрушения водного каркаса, что способствует последующему выходу газа из полостей. Количество молекул воды в первой координационной сфере метана, рассчитанное по функции распределения C–O, составило 18 до плавления и около 2 после него. Таким образом, согласно структурным данным, в изохорных условиях полное плавление гидрата метана происходит при 260 K.
РФР, полученные в изотермо-изобарных условиях качественно не отличаются от представленных выше, однако в данном случае полное разрушение кристаллической структуры происходит при повышении температуры от 260 до 270 K при всех трех значениях давления (1, 50, 100 атм). Количество ближайших соседей, определенное по РФР C–C и C–O в NpT-ансамбле, с высокой точностью совпадает с полученным в изохорных условиях (разница не превышает 5%). Следовательно, при фиксированном давлении плавление гидрата метана происходит при температуре 270 K, что на 10 K выше, чем значение, полученное для изохорных условий.
Аналогичным образом были определены температуры начала плавления и полного разрушения нанокластера гидрата углекислого газа. В изохорных условиях пики на РФР молекул газа (C–C) начинают размываться уже при 200 K, а полное разрушение структуры наблюдается при 220 K. При моделировании гидрата углекислого газа в изобарных условиях кристаллическая структура на функции распределения C–C перестает наблюдаться при температуре 230 K вне зависимости от давления (рис. 3а). Как и в случае гидрата метана, количество ближайших соседних газовых молекул равно 9 до плавления и близко к нулю после плавления (0.3 при 230 K).
Рис. 3.
Радиальные функции распределения (а) СO2–CO2 (C–C) и (б) СO2–H2O (C–O) в изобарных условиях при разной температуре: 1 – 210, 2 – 220, 3 – 230 K.
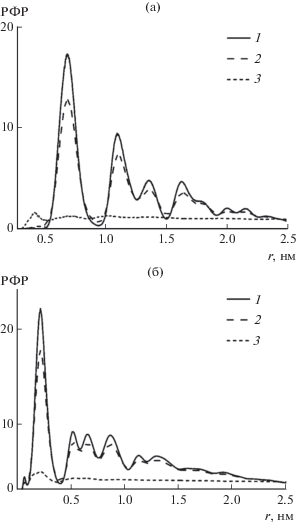
На РФР газ–вода (C–O) (рис. 3б), в отличие от гидрата метана, структурный переход при плавлении наблюдается в том же температурном интервале, что и на РФР C–C, то есть структуры воды и углекислого газа разрушаются одновременно. Число ближайших к CO2 молекул воды изменяется так же, как и в гидрате метана (17 до плавления и 2 после).
Как видно на рис. 3, плавление гидрата CO2 происходит более резко, чем гидрата CH4. Этот факт подтверждается тем, что количество ближайших соседей при температурах, предшествующих плавлению, в случае углекислого газа оказывается выше: при 230 K – 8 молекул газа и 15 воды, тогда как для метана при 260 K – 5 и 7 молекул соответственно.
Для кластеров обоих газов температура плавления в условиях постоянства давления оказывается выше, чем при постоянном объеме, то есть нанокластеры гидратов метана и углекислого газа оказываются более устойчивыми в изобарных условиях. Согласно полученным структурным данным, разница в температурах плавления обоих гидратов, рассчитанных в NVT- и NpT-ансамблях, составляет 10 K. Однако к величине давления в рассмотренном интервале (1–100 атм) температура плавления оказывается нечувствительна. Следует заметить, что более низкая температура плавления кластера углекислого газа по сравнению с кластером метана противоречит экспериментальным данным о более устойчивом состоянии объемных гидратов углекислого газа.
Коэффициенты самодиффузии
Наряду со структурой, величинами, чувствительными к фазовому состоянию, являются транспортные характеристики, в данной работе представленные коэффициентами диффузии. Коэффициенты самодиффузии (D) молекул газов и воды были рассчитаны с использованием соотношения Эйнштейна для временнóй зависимости среднеквадратичных смещений молекул.
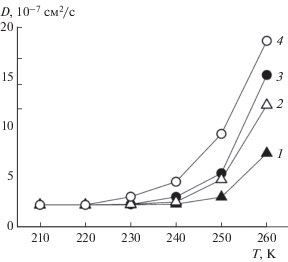
На рис. 4 приведена температурная зависимость коэффициентов диффузии метана и воды, входящих в состав гидрата, для разных условий – постоянства давления или объема. При температуре 180–220 K коэффициенты диффузии молекул имеют близкие к нулю значения, т.е. структура гидрата сохраняется. С дальнейшим повышением температуры начинается постепенный рост коэффициентов диффузии, который свидетельствует о появлении “подвижных” молекул, перешедших из гидрата в окружающую среду, т.е. о начале разрушения кристаллической структуры. Для обоих веществ постоянство давления соответствует более низким значениям коэффициентов диффузии. При этом значения коэффициента диффузии воды начинают расти при более низкой температуре и оказываются выше, чем коэффициенты диффузии метана. Так, в изохорных условиях видимое увеличение коэффициента диффузии H2O происходит уже при 230–240 K, а для метана только при температуре 250 K (рис. 4, кривые 2, 4). При моделировании системы при постоянном давлении 50 атм подвижность молекул начинает увеличиваться при более высоких температурах: 240–250 K для воды и 260 K для метана (рис. 4, кривые 1 и 3). Судя по полученным результатам, можно предположить, что плавление гидрата метана начинается при 250 K в изохорных условиях и при 260 K в изобарных.
Рис. 4.
Температурные зависимости коэффициентов самодиффузии D: 1 – метан, изобара (50 атм), 2 – метан, изохора, 3 – вода, изобара (50 атм), 4 – вода, изохора.
Коэффициенты диффузии углекислого газа при различной температуре приведены на рис. 5. Увеличение подвижности молекул газа происходит при температуре 220 и 230 K при постоянном объеме и давлении соответственно (рис. 5, кривые 1 и 3). Для гидрата углекислого газа при постоянном давлении были проведены дополнительные расчеты плавления структуры с неполным заполнением, когда только 86% полостей в гидрате были первоначально заняты газом (рис. 5, кривая 2). Видно, что до температуры 230 K подвижность молекул углекислого газа в гидрате не зависит от степени заполнения полостей, но при 240 K коэффициент диффузии газа в частично заполненном гидрате становится заметно выше, чем в случае полного заполнения. Вероятно, температура 240 K соответствует уже жидкому раствору углекислого газа, и его концентрация в случае изначально частичного заполнения гидрата будет меньше, чем для первоначально полностью заполненного гидрата. Понижение концентрации газа может объяснить повышение его коэффициента диффузии. Однако заметное изменение коэффициента диффузии при повышении температуры для обоих вариантов распределения молекул по полостям (случайное или заполнены только большие полости) происходит в одном и том же температурном интервале. Таким образом, видно, что плавление частично и полностью заполненных гидратов начинается при одной и той же температуре, примерно при 230 K (рис. 5, кривые 2 и 3).
Рис. 5.
Температурные зависимости коэффициентов самодиффузии D углекислого газа (1–3) и воды (4): 1 – полное заполнение, изохора, 2 – неполное заполнение (большие полости), изобара (100 атм), 3 – полное заполнение, изобара (100 атм), 4 – полное заполнение, изобара (100 атм).
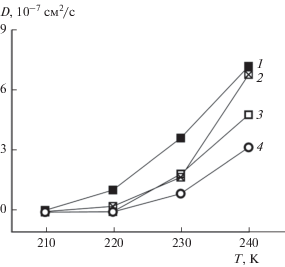
Поведение коэффициента диффузии воды в данной системе отличается от того, что получено для гидрата метана: его значения ниже, чем для углекислого газа, и рост начинается при более высокой температуре (240 K). Можно сделать вывод, что плавление гидрата углекислого газа, в отличие от гидрата метана, начинается с выхода из структуры молекул газа с последующим разрушением водного каркаса. Это свидетельствует об отличном от гидрата метана механизме разрушения гидрата углекислого газа.
Следует отметить, что во всех системах коэффициенты диффузии газов и воды, полученные при разных значениях давления, совпадают в пределах погрешности во всем рассмотренном температурном интервале.
Энергетические характеристики
Изменение энергетических характеристик в ходе плавления проиллюстрировано с помощью температурной зависимости потенциальной энергии взаимодействия между молекулами газов (E) как для постоянного давления, так и для постоянного объема (рис. 6).
Рис. 6.
Потенциальная энергия взаимодействия E молекул газа. Изобарные условия (50 атм): 1 – CH4–CH4, 2 – CO2–CO2; изохорные условия: 3 – CH4–CH4, 4 – CO2–CO2.
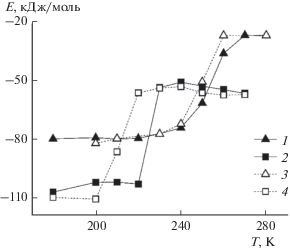
Следует отметить, что эта характеристика отличается от традиционно используемой калорической кривой. Это связано с тем, что наноразмерный образец гидрата представляет собой малую часть рассматриваемой системы и изменения его энергии слабо отражаются на поведении энергии всей системы.
Более сильные взаимодействия наблюдаются между молекулами углекислого газа, преимущественно за счет наличия электростатического вклада. При плавлении взаимодействия между молекулами ослабевают, потенциальная энергия растет. До и после области плавления на зависимостях E(T) наблюдаются плато, соответствующие энергиям взаимодействия между молекулами газа в гидрате и водном растворе. При плавлении гидрата метана (кривые 1, 3 на рис. 6) можно видеть, что резкое возрастание потенциальной энергии при постоянном объеме или давлении имеет место при одной и той же температуре (250 K). Однако выход на плато (окончание плавления) происходит в условиях заданного объема при более низкой температуре (260 K): на 10 K ниже, чем при постоянном давлении (270 K).
Изменение внешних условий оказывает заметное влияние только на энергию гидрата углекислого газа (рис. 6, кривые 2 и 4). Температурный интервал на зависимости энергии от температуры, соответствующий плавлению, оказывается существенно уже, чем для метана, что отмечалось выше при анализе РФР. В изохорных условиях гидрат углекислого газа (кривая 4 на рис. 6) начинает плавиться при 210 K, а выход потенциальной энергии взаимодействия CO2–CO2 на плато наблюдается при температуре 220 K. В NPT-ансамбле (кривая 3 на рис. 6) не наблюдается переходной температурной области, когда гидрат уже начал разрушаться, но еще не разложился окончательно, т.е. гидрат CO2 плавится полностью при температуре 230 K.
Обсуждение результатов
Сравнивая данные для трех рассмотренных характеристик – радиальных функции распределения, коэффициентов диффузии, энергии межмолекулярного взаимодействия – можно сказать, что температурный интервал плавления для нанокластера гидрата метана соответствует 250–270 K, а для нанокластера гидрата углекислого газа – 220–230 K. Как и следовало ожидать, для кластера гидрата метана полученные значения меньше, чем для объемного гидрата [22], но существенно выше, чем для аналогичного кластера, исследованного в [15] с использованием другой модели воды (SPC/E), характеризующейся более низким значением температуры плавления.
Однако полученные значения температуры плавления для гидрата углекислого газа заметно ниже не только полученных в литературе при моделировании фазовой диаграммы объемного гидрата в рамках той же молекулярной модели [22], но и ниже соответствующих значений для наногидрата метана. Вероятно, последнее можно объяснить большей растворимостью углекислого газа из нанокластера гидрата за счет большей доли поверхности в сравнении с плоской поверхностью объемного гидрата, что приводит к меньшей устойчивости в сравнении с наногидратом метана.
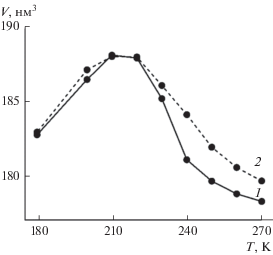
При сравнении данных для изохорных и изобарных условий вторые следует рассматривать как лучше соответствующие реальным экспериментам и природным условиям. Закрепление объема системы означает пренебрежение ее тепловым расширением при нагревании и изменением плотности при плавлении. В изобарных условиях можно определить, как изменяется объем в процессе нагревания. На рис. 7 приведены две изобары для температурной зависимости объема системы, содержащей наногидрат углекислого газа. Увеличение температуры приводит к расширению системы, и объем достигает максимального значения при температурах 210–220 K, после чего резко уменьшается. Следует отметить, что после плавления объем системы оказывается меньше, чем исходный. Снижение объема является следствием того, что плотность переохлажденной воды выше, чем плотность гидрата. Но, поскольку кластер гидрата занимает лишь небольшой объем системы, эффект снижения общего объема оказывается меньше, чем разница в плотностях двух фаз. Видно, что объем системы до плавления фактически не зависит от давления. Давление оказывает влияние на объем системы после разрушения структуры гидрата. Так, при 100 атм объем оказывается меньше, чем при 1 атм, примерно на 0.8%, что по порядку величины сопоставимо с разницей в плотности воды при соответствующих давлениях (около 0.5%).
ВЫВОДЫ
Методами компьютерного моделирования определены температурные области плавления сферических нанокластеров гидратов углекислого газа и метана. Показано, что кластер гидрата CO2 плавится при температуре 220 K в изохорных условиях и 230 K в изобарных условиях. Сферическая наночастица гидрата метана полностью разрушается при значениях температуры 260 K (NVT-ансамбль) и 270 K (NpT-ансамбль). Таким образом, разница в температурах плавления гидратов составляет около 40 K.
Полученное противоречие с данными для объемных гидратов, вероятно, обусловлено увеличением растворимости CO2 с поверхности наногидрата по сравнению с объемным образцом. Это предположение подтверждается поведением коэффициентов диффузии газа и воды в данной системе. Полученные результаты, в первую очередь, разница соотношений коэффициентов диффузии воды и газов при плавлении двух гидратов, свидетельствует о различных молекулярных механизмах их разрушения при нагревании.
Практически не обнаружена зависимость области плавления нанокластеров гидратов от давления в интервале от 1 до 100 атм.
Температура плавления наногидрата углекислого газа оказалась нечувствительной к снижению степени заполнения полостей до 86%.
Список литературы
Boswell R., Schoderbek D., Collett T.S., Ohtsuki S., White M., Anderson B.J. // Energ. Fuel. 2017. V. 31. P. 140.
Uddin M., Coombe D. // J. Phys. Chem. 2014. V. 118. P. 1921.
Striolo A. // Mol. Phys. 2019. https://doi.org/10.1080/00268976.2019.1646436
English N.J., MacElroy J.M.D. // Chem. Eng. Sci. 2015. V. 121. P. 133.
Costandy J., Michalis V.K., Tsimpanogiannis I.N., Stubos A.K., Economou I.G. // J. Chem. Phys. 2015. V. 143. 094506.
Smirnov G.S., Stegailov V.V. // J. Chem. Phys. 2012. V. 136. 044523.
Miguez J.M., Conde M.M., Torre J.-P., Blas F.J., Pineiro M.M., Vega C. // J. Chem. Phys. 2015. V. 142. 124 505.
Liu Y., Zhao J., Xu J. // Comput. Theor. Chem. 2012. V. 991. P. 165.
Uddin M., Coombe D. // J. Phys. Chem. C. 2014. V. 118. P. 1971.
Bagherzadeh S.A., Alavi S., Ripmeester J., Englezos P. // J. Chem. Phys. 2015. V. 142. 214701.
Sarupria S., Debenedetti P.G. // J. Phys. Chem. A. 2011. V. 115. P. 6102.
Baez L.A., Clancy P. // Ann. N. Y. Acad. Sci. 1994. V. 715. P. 177.
English N.J., Johnson J.K., Taylor C.E. // J. Chem. Phys. 2005. V. 123. 244 503.
Субботин О.С., Белослудов В.Р., Бродская Е.Н., Пиотровская Е.М., Сизов В.В. // Журн. физ. химии. 2008. Т. 82. С. 1472.
Бродская Е.Н., Сизов В.В. // Коллоид. журн. 2009. Т. 71. С. 585.
Бродская Е.Н., Сизов В.В. // Коллоид. журн. 2013. Т. 75. С. 408.
Abraham M.J., Murtola T., Schulz R., Pall S., Smith J.C., Hess B., Lindahl E. // SoftwareX. 2015. V. 1. P. 19.
Van der Spoel D., Lindahl E., Hess B., Groenhof G., Mark A.E., Berendsen H.J.C. // J. Comput. Chem. 2008. V. 26. P.1701.
Jorgensen W. L., Madura J. D., Swenson C.J. // J. Am. Chem. Soc. 1984. V. 106. P. 6638.
Potoff J.J., Siepmann J.I. // AIChE J. 2001. V. 47. P. 1676.
Abascal J.L.F., Sanz E., García Fernández R., Vega C. // J. Chem. Phys. 2005. V. 122. 234511.
Waage M.H., Vlugt T.J.H., Kjelstrup S. // J. Phys. Chem. B. 2017. V. 121. P. 7336.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал