Коллоидный журнал, 2020, T. 82, № 5, стр. 585-593
Динамические поверхностные свойства растворов комплексов бычьего сывороточного альбумина и наночастиц кремнезема
О. Ю. Миляева *
Санкт-Петербургский государственный университет, кафедра коллоидной химии
198504 Санкт-Петербург, Университетский просп., 26, Россия
* E-mail: o.milyaeva@spbu.ru
Поступила в редакцию 24.04.2020
После доработки 05.05.2020
Принята к публикации 08.05.2020
Аннотация
Поверхностные свойства водных дисперсий комплексов бычьего сывороточного альбумина и наночастиц кремнезема были исследованы с применением комплекса методов, чувствительных к изменению структуры и состава поверхностного слоя. Несмотря на то, что компоненты одноименно заряжены, их взаимодействие приводит к изменению поверхностных свойств дисперсий: скорость изменения динамической поверхностной упругости и динамического поверхностного натяжения падает вследствие высокого электростатического барьера адсорбции. Добавление электролита позволяет уменьшить электростатический барьер. В этом случае адсорбция комплексов приводит к росту динамической поверхностной упругости от значений, характерных для растворов чистого бычьего сывороточного альбумина (~80 мН/м), вплоть до 170 мН/м, что соответствует образованию макроскопически однородной адсорбционной пленки комплексов наночастиц и белка.
ВВЕДЕНИЕ
Твердые наночастицы благодаря своему малому размеру могут принимать участие в клеточных процессах и проникать в недоступные для частиц большего размера области организма, например в мозг [1–3]. Когда наночастица попадает внутрь организма, она сразу же покрывается оболочной из белков и других биомолекул [3–6]. В частности, устойчивую оболочку на поверхности частицы образуют бычий сывороточный альбумин (БСА) и фибриноген [7–10]. При образовании оболочки (короны) на поверхности частицы третичная и вторичная структуры белка могут изменяться, что в дальнейшем влияет на взаимодействие комплекса белок/наночастица с клеткой [11–13]. Исследование адсорбции таких комплексов на межфазной границе жидкость–газ позволяет получить информацию о конформации белка в комплексе [14].
В данной работе методы динамической поверхностной реологии, а также эллипсометрия и динамическое рассеяние света были применены для исследования адсорбции комплексов БСА и наночастиц кремнезема. Отметим, что образование таких комплексов в объеме водной фазы исследовалось многими авторами [15–17]. Адсорбция БСА и частиц кремнезема на границе жидкость–газ по отдельности также многократно исследовалась [18–20].
Гидрофильные наночастицы кремнезема не обладают поверхностной активностью. Если их поверхность модифицирована, например, в результате взаимодействия с поверхностно-активными веществами, то динамическая поверхностная упругость водных дисперсий таких комплексов может достигать высоких значений (~150 мН/м) [20].
Глобула БСА имеет сердцевидную форму с размерами главных осей 1.7 нм × 4.2 нм и при нейтральном pH заряжена отрицательно [21]. Когда БСА адсорбируется на границе жидкость–газ, он образует плотный монослой с поверхностной упругостью около 80 мН/м [22, 23]. Кинетические зависимости динамической поверхностной упругости и поверхностного давления оказываются монотонными, что свидетельствует о сохранении глобулярной структуры белка в поверхностном слое. Адсорбция белка на поверхности твердой наночастицы может приводить к структурным изменениям, в частности к изменению соотношения α-спиралей и β-листов [7, 15]. Такие изменения при образовании короны БСА во многом зависят от свойств наночастицы, прежде всего, от ее заряда и размера. Так, например, при адсорбции на отрицательно заряженных полистирольных частицах третичная и вторичная структуры БСА практически не изменяются, в то же время адсорбция на положительно заряженных полистирольных наночастицах приводит к частичной денатурации белка [24]. Также увеличение диаметра частиц кремнезема может приводить к заметным изменениям конформации БСА в короне [25].
Методы дилатационной поверхностной реологии характеризуются высокой чувствительностью к изменениям конформации макромолекул в поверхностном слое [26, 27]. В данной работе они используются для оценки состояния БСА в комплексе с наночастицами кремнезема на границе фаз водный раствор–воздух, а также для установления механизма формирования адсорбционной пленки комплексов на этой границе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Динамическая поверхностная упругость измерялась методами осциллирующего кольца [28] и осциллирующей капли [29]. Оба метода основаны на регистрации отклика поверхностного натяжения на слабое механическое растяжение–сжатие поверхности. В первом случае оно достигалось за счет осцилляций стеклянного кольца вдоль его оси, перпендикулярной поверхности исследуемой жидкости. Кольцо было частично погружено в жидкость. Внутренняя поверхность кольца была отшлифована для улучшения смачивания. Движение кольца вдоль его оси приводило к периодическим изменениям площади поверхности в результате изменения формы мениска у внутренней поверхности кольца. Амплитуда и частота осцилляций площади поверхности составляли 7% и 0.1 Гц соответственно. Возникающие в результате движения кольца осцилляции поверхностного натяжения измерялись методом пластинки Вильгельми.
Для измерений методом осциллирующей капли использовался прибор PAT1 (Sinterface Technologies, Германия). Висящая капля была сформирована на конце капилляра с помощью автоматической системы дозирования, позволявшей изменять объем капли по заранее заданному закону. Капилляр был помещен внутрь стеклянной ячейки, на дне которой находилась вода для уменьшения испарения капли. При измерениях использовались гармонические колебания площади поверхности с амплитудой 10% и частотой 0.1 Гц. Соответствующие колебания поверхностного натяжения определялись из колебаний формы капли.
В случае малой амплитуды колебаний комплексная динамическая дилатационная поверхностная упругость E определяется соотношением
(1)
$E{\text{(}}\omega {\text{)}} = {{E}_{{{\text{re}}}}}{\text{ + }}i{{E}_{{{\text{im}}}}} = \frac{{\delta \gamma }}{{\delta \ln A}},$В общем случае E зависит не только от амплитуд колебаний поверхностного натяжения и площади поверхности, но и от фазового сдвига между этими двумя величинами, т.е. оказывается комплексной величиной. Для исследуемых в данной работе систем мнимая часть динамической поверхностной упругости была меньше действительной части. Поэтому в дальнейшем будут представлены результаты только для модуля динамической поверхностной упругости.
Эллипсометрические измерения проводились с помощью нуль-эллипсометра Multiskop (Optrel GBR, Германия) с длиной волны 632.8 нм при постоянном значении угла падения 49°, близком к углу Брюстера. Разность между эллипсометрическими углами для исследуемого раствора и чистой воды Δsurf пропорциональна величине адсорбции для двухкомпонентного раствора [30].
Размеры и ζ-потенциал комплексов белок–наночастица в водных растворах измерялись с помощью динамического рассеяния света (ДРС) на приборе Zetasizer ZS Nano (Malvern Instruments, Великобритания) при угле рассеяния 173°.
Морфология адсорбционных пленок комплексов белок–наночастица определялась с помощью атомно-силового микроскопа (NT-MDT, Россия). Для этого адсорбционные пленки переносили на поверхность слюды методом Ленгмюра–Шеффера. После переноса пленку высушивали в эксикаторе при комнатной температуре в течение двух дней. Все измерения проводились в полуконтактном режиме.
Водные дисперсии наночастиц кремнезема готовились разбавлением коммерческого реактива LUDOX (Sigma-Aldrich, Германия) с содержанием частиц 30 мас. %. Применение метода ДРС показало, что наночастицы LUDOX можно рассматривать как монодисперсные (индекс полидисперсности около 0.134) со средним радиусом около 20 нм.
БСА (Sigma-Aldrich, Германия) с молекулярной массой 66700 использовался без дополнительной очистки. Изоэлектрическая точка БСА примерно соответствует pH 5, т.е. при нейтральном pH белок заряжен отрицательно. Растворы белка готовились разбавлением исходного раствора с концентрацией C = 0.5 г/л, который хранился при температуре ниже 10°C не более пяти дней.
Дисперсии комплексов белок–наночастица получали путем смешения равных объемов раствора белка заданной концентрации и разбавленной дисперсии наночастиц. Чтобы избежать возможной агрегации, дисперсию наночастиц до смешения их с белком обрабатывали в ультразвуковой ванне в течение 15 мин. Раствор БСА добавляли по каплям к исходной дисперсии наночастиц кремнезема при постоянном перемешивании. Все исследуемые дисперсии содержали 0.2 мас. % наночастиц.
Измерения проводились при двух различных значениях ионной силы растворов (I = 0.02 и 0.1). Ионную силу раствора варьировали за счет добавления NaCl (Реахим, Москва), предварительно прокаленного при температуре 800°C в муфельной печи с целью удаления органических примесей. pH всех растворов был равен 7 и поддерживался постоянным с помощью буферной смеси Na2HPO4 и NaH2PO4 (Sigma-Aldrich, Германия).
При приготовлении растворов использовалась трижды перегнанная вода. Две последние перегонки осуществлялись на установке, целиком сделанной из стекла. Поверхностное натяжение буферного раствора без белка составляло 72.8 мН/м.
Все измерения проводились при температуре 20 ± 1°C.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При pH 7 макромолекулы БСА и наночастицы кремнезема заряжены одноименно. Поэтому можно ожидать сильного отталкивания между этими компонентами. Однако образование комплексов оказывается возможным благодаря тому, что на поверхности глобулы БСА имеются отдельные положительно заряженные участки [31]. Повышение ионной силы приводит к экранированию электростатического отталкивания и способствует образованию комплекса.
Применение ДРС к дисперсиям комплексов наночастица–БСА показало, что в области концентраций БСА 5 × 10–8–1 × 10–6 М агрегацией в растворе можно пренебречь: размер и заряд комплекса почти не изменяются и близки к соответствующим значениям для наночастиц кремнезема в отсутствие белка (рис. 1). ζ-Потенциал и радиус наночастиц кремнезема при pH 7 и I = 0.02 составляли –22.5 мВ и 23.4 нм. Увеличение концентрации БСА приводит к уменьшению ζ-потенциала. Все изменения размера частиц лежат в пределах погрешности вплоть до концентрации БСА 5 × 10–6 М, когда начинает наблюдаться агрегация в объеме раствора. Таким образом, можно предположить, что при исследованных концентрациях белка в растворе образуется комплекс, состоящий из одной наночастицы и нескольких молекул БСА. Поскольку компоненты комплекса заряжены одноименно, его абсолютный заряд растет при увеличении концентрации белка, препятствуя агрегации.
Рис. 1.
Зависимости ξ-потенциала (1, 2) и диаметра (3, 4) комплексов БСА и наночастиц SiO2 от концентрации белка. Сплошные символы соответствуют ионной силе 0.02, открытые символы – ионной силе 0.1.
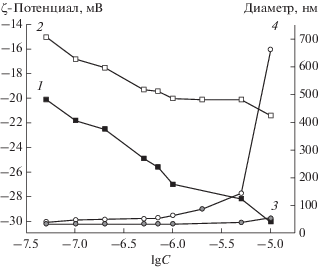
Если концентрация NaCl достигает 0.1 М, то размер частиц заметно растет. При увеличении концентрации БСА с 1 × 10–6 до 5 × 10–6 М диаметр частиц возрастает примерно в три раза, свидетельствуя о начале агрегации. При концентрации белка выше 2 × 10–6 М дисперсия теряет седиментационную устойчивость из-за резкого увеличения размера агрегатов. В случае, когда концентрация БСА равна 1 × 10–5 М, седиментация заканчивается в течение нескольких часов.
Образование комплексов БСА с наночастицами кремнезема приводит к изменению поверхностных свойств. Результаты измерения динамической поверхностной упругости и динамического поверхностного натяжения растворов комплексов БСА и наночастиц кремнезема методами осциллирующей капли и осциллирующего кольца представлены на рис. 2 и 3.
Рис. 2.
Кинетические зависимости динамической поверхностной упругости растворов БСА концентрацией 5 × 10–7 М (1, 5) и комплексов БСА и наночастиц SiO2 (2–4, 6–8), полученные методами осциллирующей капли (1–4) и осциллирующего кольца (5–8). Концентрация белка: 5 × 10–8 (2, 6), 5 × 10–7 (3, 7), 5 × 10–6 М (4, 8).
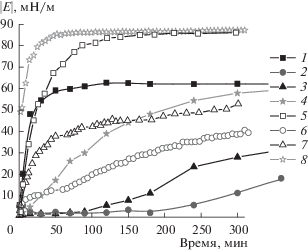
Рис. 3.
Кинетические зависимости динамического поверхностного натяжения растворов БСА концентрацией 5 × 10–7 М (1, 5) и комплексов БСА и наночастиц SiO2 (2–4, 6–8), полученные методами осциллирующей капли (1–4) и осциллирующего кольца (5–8). Концентрация белка: 5 × 10–8 (2, 6), 5 × 10–7 (3, 7), 5 × 10–6 М (4, 8).
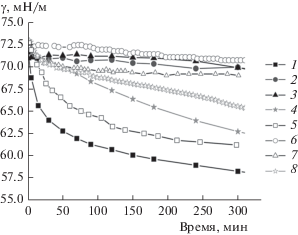
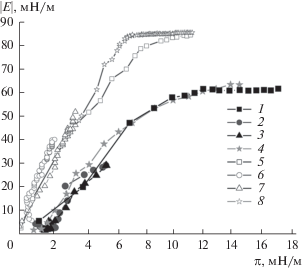
Скорость изменения динамических поверхностных свойств дисперсий уменьшается уже при малых концентрациях белка (~5 × 10–8 М). В случае относительно высокой концентрации белка (5 × 10–6 М) динамическая поверхностная упругость достигает значений, близких к 60 мН/м, при использовании метода осциллирующей капли и 85 мН/м – метода осциллирующего кольца. Такие значения характерны для растворов самого белка. Скорость изменения поверхностного натяжения дисперсии при концентрации 5 × 10–8 М также сильно уменьшилась по сравнению со скоростью для раствора БСА, но при концентрации 5 × 10–6 М приблизилась к скорости для раствора чистого белка. Если представить полученные результаты в виде зависимостей динамической поверхностной упругости от поверхностного давления (рис. 4), то результаты для всех концентраций оказываются близкими, включая аналогичную зависимость для растворов чистого БСА.
Рис. 4.
Зависимости динамической поверхностной упругости от поверхностного давления растворов БСА концентрацией 5 × 10–7 М (1, 5) и комплексов БСА и наночастиц SiO2 (2–4, 6–8), полученные методами осциллирующей капли (1–4) и осциллирующего кольца (5–8). Концентрация белка: 5 × 10–8 (2, 6), 5 × 10–7 (3, 7), 5 × 10–6 М (4, 8).
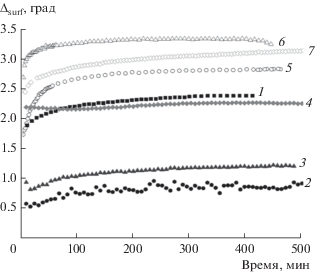
Кинетические зависимости эллипсометрического угла ∆surf заметно отклоняются от результатов для воды, только если концентрация белка в растворе выше примерно 5 × 10–7 М (рис. 5). Полученные значения, однако, меньше соответствующих данных для растворов чистого белка и только в случае самой высокой исследованной концентрации БСА, равной 5 × 10–6 М, приближаются к ним. Таким образом, отрицательно заряженный БСА и отрицательно заряженные наночастицы кремнезема образуют комплекс с большим абсолютным зарядом, который вследствие высокого электростатического барьера адсорбции не может адсорбироваться на границе жидкость/газ. Изменение поверхностных свойств в этом случае вызвано адсорбцией свободного белка, не входящего в состав комплекса.
Рис. 5.
Кинетические зависимости эллипсометрического угла Δsurf раствора БСА концентрацией 5 × 10–7 М (1) и растворов комплексов БСА и наночастиц SiO2 в отсутствие NaCl (сплошные символы) и в присутствии 0.1 М NaCl (открытые символы). Концентрация белка: 5 × 10–8 (2, 5), 5 × 10–7 (3, 6), 5 × 10–6 М (4, 7).
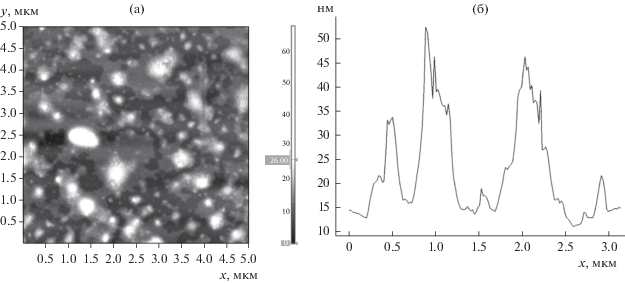
Адсорбционные слои, формирующиеся при высокой концентрации БСА (1 × 10–6 и 5 × 10–6 М), переносились с водной поверхности на поверхность слюды по методу Ленгмюра–Шеффера и были исследованы с применением метода атомно-силовой микроскопии (АСМ). На полученных АСМ-изображениях (рис. 6) видна неоднородная рыхлая пленка с большими просветами и отдельными агрегатами; размеры некоторых из них близки к размеру наночастиц. Концентрация этих агрегатов в пленке невелика, расстояния между ними намного превышают их размеры. Таким образом, в поверхностном слое присутствуют отдельные наночастицы кремнезема, но их количество недостаточно для заметного изменения поверхностных свойств.
Рис. 6.
АСМ-изображение адсорбционной пленки, перенесенной на поверхность слюды по методу Ленгмюра–Шеффера с поверхности водной дисперсии комплексов БСА и наночастиц SiO2. Концентрация белка 5 × 10–6 М.
Добавление NaCl к дисперсиям комплексов белка и наночастиц приводит к изменению поверхностных свойств (рис. 7 и 8). Наблюдается некоторое расхождение между результатами, полученными методами осциллирующего кольца и осциллирующей капли. Это расхождение, вероятно, связано с особенностями способа деформации поверхности, используемого в этих методах. В случае осциллирующего кольца колебания осуществляются без перерыва, и этот процесс может приводить к увеличению скорости переноса вещества к межфазной границе. Также площадь поверхности в методе осциллирующего кольца заметно превышает площадь поверхности в методе осциллирующей капли. Тем не менее, несмотря на различие в измеренных значениях, наблюдается качественное согласие результатов, полученных двумя этими методами.
Рис. 7.
Кинетические зависимости динамической поверхностной упругости (а) и динамического поверхностного натяжения (б) растворов комплексов БСА и наночастиц SiO2 в присутствии 0.1 М NaCl, полученные методом осциллирующего кольца. Концентрация белка: 5 × 10–8 (1), 1 × 10–7 (2), 5 × 10–7 (3), 1 × 10–6 (4), 5 × 10–6 М (5).
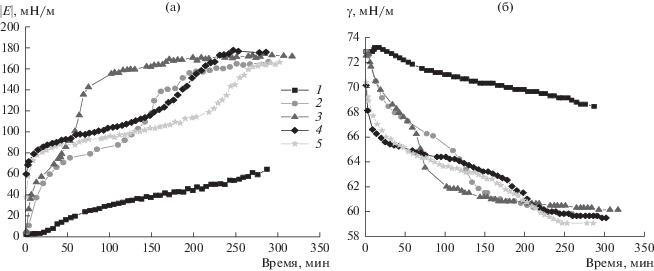
Рис. 8.
Кинетические зависимости динамической поверхностной упругости (а) и динамического поверхностного на-тяжения (б) растворов комплексов БСА и наночастиц SiO2 в присутствии 0.1 М NaCl, полученные методом осцил-лирующей капли. Концентрация белка: 5 × 10–8 (1), 1 × 10–7 (2), 5 × 10–7 (3), 1 × 10–6 (4), 2 × 10–6 (5), 5 × 10–6 (6), 1 × 10–5 М (7).
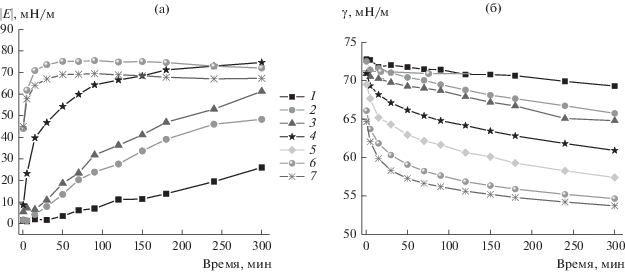
Скорость изменения динамической поверхностной упругости и динамического поверхностного натяжения растет по сравнению с растворами с низкой ионной силой. В области малых концентраций БСА (5 × 10–8 М для осциллирующего кольца и до 1 × 10–7 М для осциллирующей капли) этот рост не превышает значений для чистого белка, однако дальнейшее увеличение концентрации БСА приводит к более высоким значениям. В обоих случаях динамическая поверхностная упругость достигает примерно 90 мН/м в случае метода осциллирующей капли (рост на 30%) и 170 мН/м в случае метода осциллирующего кольца (рост на 60%). Малая скорость изменения поверхностных свойств при низкой ионной силе связана с большим по абсолютной величине зарядом образующегося комплекса и, как следствие, с высоким электростатическим барьером адсорбции. Добавление NaCl в концентрации 0.1 М снижает этот барьер, и рост поверхностной упругости происходит уже не только за счет присутствия молекул БСА в поверхностном слое, но и за счет адсорбции комплексов.
Другой интересной особенностью кинетических зависимостей динамической поверхностной упругости и динамического поверхностного натяжения, полученных с помощью метода осциллирующего кольца, оказываются точки перегиба при значениях, характерных для раствора чистого белка (рис. 7). Можно предположить, что вначале динамические поверхностные свойства растворов изменяются за счет адсорбции свободного БСА, поскольку его коэффициент диффузии больше, чем большего по размеру комплекса. Адсорбция несвязанного БСА приводит к росту значений динамической поверхностной упругости до 80 мН/м. Затем наблюдается некоторое замедление скорости изменения поверхностных свойств. На этом этапе белок в поверхностном слое вытесняется адсорбирующимися комплексами. На взаимодействие между БСА в свободном состоянии и БСА, находящемся в составе короны, наночастицы кремнезема практически не влияют. На зависимостях динамической поверхностной упругости и динамического поверхностного натяжения этот процесс соответствует области плато со значениями 80–90 и 65–62 мН/м соответственно. Дальнейший рост поверхностной упругости связан с увеличением концентрации комплексов белок–наночастица в поверхностном слое. В этом случае на взаимодействие комплексов белок–наночастица в поверхностном слое сильно влияет твердое ядро комплекса, что проявляется в росте значений динамической поверхностной упругости вплоть до 170 мН/м. Наибольшая скорость формирования адсорбционной пленки комплексов БСА и наночастиц кремнезема достигается при концентрации белка 5 × 10–7 М. Вероятно, в этом случае достигается оптимальное соотношение между компонентами в растворе (на одну частицу приходится примерно 5 молекул белка), при котором число молекул белка, входящих в состав комплекса, оказывается достаточным, чтобы обеспечить поверхностную активность комплекса, но при этом размер и заряд комплекса не превышают некоторой пороговой величины, при которой процессы агрегации препятствуют быстрой адсорбции комплексов.
Если представить полученные результаты в виде зависимостей динамической поверхностной упругости от поверхностного давления (рис. 9), то видно различие между кривыми, полученными методами осциллирующего кольца и осциллирующей капли, однако внутри каждой группы полученные кривые оказываются близкими. Кроме того, если сравнить полученные данные с зависимостями, полученными с помощью соответствующего метода для чистого белка (рис. 4), то окажется, что эти результаты совпадают в области малых и средних значений поверхностного давления, до π = 10–12 мН/м. По достижении указанного поверхностного давления начинается рост динамической поверхностной упругости. В случае метода осциллирующего кольца он более выражен, и обсуждаемые зависимости можно разделить на два линейных участка. Первый участок не отличим от зависимостей для чистого БСА, второй характеризуется быстрым ростом поверхностной упругости в узкой области значений π и, вероятно, отражает интенсивное взаимодействие между комплексами белок–наночастица в поверхностном слое. Важно отметить, что все зависимости динамической поверхностной упругости не имеют экстремумов, которые могли бы указывать на образование мультислоев или разворачивание белка в поверхностном слое. Таким образом, можно заключить, что взаимодействие отрицательно заряженных БСА и наночастицы кремнезема не приводит к заметным изменениям структуры белка при его адсорбции.
Рис. 9.
Зависимости динамической поверхностной упругости от поверхностного давления растворов комплексов БСА и наночастиц SiO2 в присутствии 0.1 М NaCl, полученные методами осциллирующей капли (заполненные символы) и осциллирующего кольца (пустые символы). Концентрация белка: 5 × 10–8 (1, 7), 1 × 10–7 (2, 8), 5 × 10–7 (3, 9), 1 × 10–6 (4, 10), 2 × 10–6 (5), 5 × 10–6 М (6, 11).
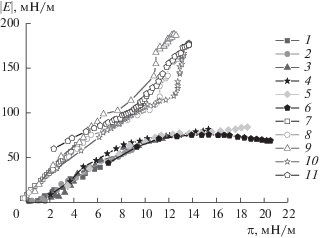
Кинетические зависимости эллипсометрического угла Δsurf (рис. 5) указывают на заметный рост величины адсорбции для дисперсий комплексов по сравнению с результатами для растворов чистого белка. Даже при самой низкой концентрации белка в дисперсии (5 × 10–8 М) достигаются более высокие значения. Этот эффект, по-видимому, связан не только с увеличением толщины адсорбционной пленки в результате адсорбции частиц с диаметром, на один десятичный порядок превосходящим размеры глобул БСА, но и с различием показателей преломления SiO2 и БСА (${{n}_{{{\text{Si}}{{{\text{O}}}_{2}}}}}$ = 1.475 [32] и nprotein = 1.38 [33]), что также, наряду с ростом динамической поверхностной упругости, указывает на значительную концентрацию наночастиц кремнезема в поверхностном слое.
Таким образом, можно предложить, что механизм образования адсорбционной пленки в исследованной системе аналогичен предложенному ранее для растворов комплексов лизоцима и наночастиц кремнезема [14], но влияние наночастиц в нашем случае выражено слабее вследствие электростатического отталкивания, так как, в отличие от лизоцима, БСА отрицательно заряжен при нейтральном pH. На первой стадии адсорбируется свободный, не входящий в состав комплексов белок, поскольку его коэффициент диффузии и, следовательно, скорость адсорбции больше. Затем с увеличением возраста поверхности он вытесняется комплексами белок–наночастица. При больших временах жизни поверхности (около двух часов и концентрации БСА в интервале 1 × 10–7–1 × 10–6 М), когда комплексы белок–наночастица начинают взаимодействовать друг с другом, рост динамической поверхностной упругости ускоряется.
ВЫВОДЫ
Показано, что взаимодействие наночастиц кремнезема и БСА в водном растворе приводит к образованию комплексов с низкой поверхностной активностью из-за высокого абсолютного заряда комплекса и, следовательно, высокого электростатического адсорбционного барьера. В этом случае изменение поверхностных свойств возможно только за счет адсорбции несвязанного БСА. Понижение адсорбционного барьера за счет повышения ионной силы приводит к увеличению адсорбции комплексов. В результате динамическая поверхностная упругость и динамическое поверхностное давление достигают значений, в два раза превышающих соответствующие значения для растворов чистого БСА.
Полученные результаты позволяют выделить две основные стадии адсорбции. На первой стадии взаимодействие адсорбированных комплексов и глобул БСА не приводит к заметным отличиям поверхностных свойств от результатов для растворов чистого белка. Динамическая поверхностная упругость и динамическое поверхностное давление растут, достигая значений, характерных для глобулярных белков, и затем почти не изменяются. При этом комплексы, по-видимому, вытесняют относительно быстро адсорбирующийся белок из поверхностного слоя. Рост эллипсометрического угла Δsurf указывает на присутствие наночастиц в поверхностном слое. На второй стадии адсорбция комплексов продолжается, и адсорбционный слой становится более плотным. Это снова приводит к быстрому росту динамической поверхностной упругости и поверхностного давления, достигающих примерно 170 и 27 мН/м соответственно. Зависимости динамической поверхностной упругости от поверхностного давления не имеют экстремумов во всей исследованной области значений варьируемых параметров. Этот факт позволяет заключить, что глобулярная структура БСА сохраняется в оболочке наночастиц при их адсорбции и последующем сжатии адсорбционной пленки.
Список литературы
Mahmoudi M., Sahraian M.A., Shokrgozar M.A., Laurent S. // ACS Chem. Neurosci. 2011. V. 2. P. 118.
Ragnaill M.N., Brown M., Ye D., Bramini M., Callanan S., Lynch I., Dawson K.A. // Eur. J. Pharm. Biopharm. 2011. V. 77. P. 360.
Cedervall T., Lynch I., Lindman S., Berggård T., Thulin E., Nilsson H., Dawson K.A, Linse S. // Proc. Natl. Acad. Sci. U. S. A. 2007. V. 104. P. 2050.
Mahmoudi M., Sant S., Wang B., Laurent S., Sen T. // Adv. Drug Deliv. Rev. 2011. V. 63. P. 24.
Norde W., Gags D. // Langmuir. 2004. V. 20. P. 4162.
Casals E., Puntes V.F. // Nanomedicine (Lond). 2012. V. 7. P. 1917.
Mehan S., Chinchalikar A.J., Kumar S., Aswal V.K., Schweins R. // Langmuir. 2013. V. 29. P. 11290.
Deng Z.J., Liang M., Monteiro M., Toth I., Minchin R.F. // Nat. Nanotechnol. 2011. V. 6. P. 39.
Kendall M., Ding P., Kendall K. // Nanotoxicology. 2011. V. 5. P. 55.
Ang J.C., Henderson M.J., Campbell R.A., Lin J.-M., Yaron P.N., Nelson A., Faunce T., White J.W. // Phys. Chem. Chem. Phys. 2014. V. 16. P. 10157.
Dawson K.A, Salvati A., Lynch I. // Nat. Nanotechnol. 2009. V. 4. P. 84.
Faunce T.A., White J., Matthaei K.I. // Nanomedicine (Lond). 2008. V. 3. P. 859.
Röcker C., Pötzl M., Zhang F., Parak W.J., Nienhaus G.U. // Nat. Nanotechnol. 2009. V. 4. P. 577.
Milyaeva O.Yu., Campbell R.A., Gochev G., Loglio G., Lin S.-Y., Miller R., Noskov B.A. // J. Phys. Chem. B. 2019. V. 123. P. 4803
Baowan D., Helms V. // J. Math. Chem. 2015. V. 53. P. 29.
Yadav I., Aswal V.K., Kohlbrecher J. // Phys. Rev. E. 2016. V. 93. 052601.
Kumar S., Aswal V.K., Kohlbrecher J. // AIP Conf. Proc. 2012. V. 1447. P. 181.
Maldonado-Valderrama J., Wege H.A., Rodríguez-Valverde M.A., Gálvez-Ruiz M.J., Cabrerizo-Vílchez M.A. // Langmuir. 2003. V. 19. P. 8436.
Bantchev G.B., Schwartz D.K. // Langmuir. 2004. V. 20. P. 11 692.
Yazhgur P.A., Noskov B.A., Liggieri L., Lin S.-Y.Y., Loglio G., Miller R., Ravera F. // Soft Matter. 2013. V. 9. P. 3305.
Peters T. // Adv. Protein Chem. 1985. V. 37. P. 161.
Cascão Pereira L.G., Théodoly O., Blanch H.W., Radke C.J. // Langmuir. 2003. V. 19. P. 2349.
Noskov B., Mikhailovskaya A. // Soft Matter. 2013. V. 9. P. 9392.
Ge C., Tian J., Zhao Y., Chen C., Zhou R., Chai Z. // Arch. Toxicol. 2015. V. 89. P. 519.
Satzer P., Svec F., Sekot G., Jungbauer A. // Eng. Life Sci. 2016. V. 16. P. 238.
Noskov B.A., Akentiev A.V., Loglio G., Miller R. // J. Phys. Chem. B. 2000. V. 104. P. 7923.
Noskov B.A., Akentiev A.V., Bilibin A.Y., Zorin I.M., Miller R. // Adv. Colloid Interface Sci. 2003. V. 104. P. 245.
Bykov A.G., Lin S.-Y., Loglio G., Miller R., Noskov B.A. // J. Phys. Chem. C. 2009. V. 113. P. 5664.
Noskov B.A., Loglio G., Miller R. // J. Phys. Chem. B. 2004. V. 108. P. 18 615.
Motschmann H., Teppner R. // Studies in Interface Science. 2001. V. 11. P. 1.
Kubiak-Ossowska K., Jachimska B., Mulheran P.A. // J. Phys. Chem. B. 2016. V. 120. P. 10463.
Khlebtsov B.N., Khanadeev V.A., Khlebtsov N.G. // Langmuir. 2008. V. 24. P. 8964.
Malmstein M. // J. Colloid Interface Sci. 1994. V. 166. P. 333.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


