Коллоидный журнал, 2021, T. 83, № 3, стр. 352-359
Оценка константы ионообменного равновесия по данным мембранной кондуктометрии
И. В. Фалина 1, *, Н. А. Кононенко 1, О. А. Демина 1, Е. В. Тицкая 1, С. А. Лоза 1
1 Кубанский государственный университет
350040 Краснодар, Ставропольская ул., 149, Россия
* E-mail: irina_falina@mail.ru
Поступила в редакцию 24.11.2020
После доработки 25.12.2020
Принята к публикации 29.12.2020
Аннотация
Изучена возможность расчета ионного состава мембраны и константы ионообменного равновесия в системе ионообменная мембрана–раствор, содержащей два сорта противоионов и общий коион, на основании концентрационных зависимостей удельной электропроводности мембраны в индивидуальных и смешанных растворах. Расчет выполнен для мембран МФ-4СК и МК-40 в смешанном растворе хлоридов кальция и натрия, и показано удовлетворительное согласие полученных значений с представленными в литературе. Данный подход применен для оценки константы ионообменного равновесия после модифицирования мембран МФ-4СК и МК-40 полианилином, и показана корреляция между результатами кондуктометрических исследований и оценки потоков противоионов при электродиализе смешанных растворов.
ВВЕДЕНИЕ
Проблема описания ионообменного равновесия актуальна не только в связи с широким использованием ионного обмена для целей водоподготовки, но и для оценки селективности ионитов в системах, содержащих два и более сорта противоионов. Информация о константе ионообменного равновесия также необходима при моделировании неравновесных потоков в электромембранной системе с несколькими противоионами. Хорошо известно, что коэффициент распределения, найденный непосредственно из эксперимента по изучению ионообменного равновесия, позволяет получить информацию об избирательной проницаемости мембраны в процессе электродиализного разделения двух сортов противоионов [1–4]. Кроме того, достаточно часто при описании электромассопереноса в системе, состоящей из ионообменной мембраны и контактирующих с ней растворов, содержащих различные противоионы, в качестве граничного условия используется наступление ионообменного равновесия [5].
Количественными характеристиками ионообменного равновесия являются изотерма ионного обмена, коэффициент равновесного распределения и константа ионного обмена (константа Никольского), для расчета которых необходима информация о составе равновесного раствора, содержащего два сорта противоионов, и содержании каждого из них в мембране. Традиционным методом изучения ионообменного равновесия являются эксперименты по определению состава раствора до и после контакта с мембраной [6, 7]. При этом используют различные методы расчета константы ионного обмена на основании сорбционного эксперимента. Так, например, авторы [5] определяют константу равновесия из логарифмической формы представления изотермы ионного обмена.
Достаточно широко используется способ оценки коэффициента распределения на основании изучения неравновесных характеристик мембраны, таких как удельная электропроводность в индивидуальных и смешанных растворах, содержащих два сорта противоионов и общий коион, при допущении о том, что подвижность катиона в фазе мембраны не зависит от ее ионного состава [2, 8–11]. Авторами работы [2] при изучении проводимости мембран на основе сульфированного полиэфирэфиркетона (SPEEK) и Neosepta CMX в смешанных ионных формах c различным соотношением ионов Na+/K+ и Na+/Mg2+ показано, что данные зависимости имеют линейный вид, что указывает на возможность использования кондуктометрии для оценки доли противоионов в мембране.
Оригинальный способ определения ионного состава мембраны в состоянии равновесия с растворами, содержащими два сорта противоионов, предложен в работах [8, 9] на основании концентрационных зависимостей удельной электропроводности мембраны в индивидуальных и смешанных растворах. Его отличительной чертой является использование эквимолярных растворов двух электролитов, содержащих общий коион. Этот подход является развитием двухфазной микрогетерогенной модели и базируется на представлении мембраны как микрогетерогенной системы, состоящей из фаз геля и межгелевого раствора. Достоинством данного метода является возможность оценить не только ионный состав гелевой фазы мембраны, но и такие транспортно-структурные параметры, как объемные доли проводящих фаз и коэффициенты диффузии противоионов в геле. Авторами [8, 9] показана возможность расчета константы ионообменного равновесия в системе катионообменная мембрана МК-40–раствор, содержащий хлорид щелочного металла и соляную кислоту. Однако применимость данного метода для оценки константы ионообменного равновесия в системах, содержащих двухзарядные противоионы, а также для модифицированных мембран ранее не исследовалась. В то же время именно эти вопросы в настоящее время являются наиболее актуальными, поскольку модифицированные мембраны все чаще применяются для обработки смешанных растворов, содержащих многозарядные ионы. В связи с этим целью настоящей работы являлось изучение возможности расчета константы ионообменного равновесия в системе ионселективная мембрана/растворы хлоридов кальция и натрия или хлорида кальция и соляной кислоты из концентрационных зависимостей удельной электропроводности сульфокатионитовых мембран разных структурных типов, в том числе модифицированных полианилином (ПАНИ).
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Для реакции ионного обмена
(1)
$K_{1}^{2} = \frac{{\bar {a}_{2}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{2}}}}} \right. \kern-0em} {{{z}_{2}}}}}}a_{1}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{1}}}}} \right. \kern-0em} {{{z}_{1}}}}}}}}{{\bar {a}_{1}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{1}}}}} \right. \kern-0em} {{{z}_{1}}}}}}a_{2}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{2}}}}} \right. \kern-0em} {{{z}_{2}}}}}}}},$Принимая коэффициенты активности ионов в мембране равными 1, а также учитывая, что концентрация противоионов в мембране определяется главным образом ее обменной емкостью (Q), константу Никольского $K_{1}^{2}$ можно записать в виде
(2)
$\frac{{\theta _{2}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{2}}}}} \right. \kern-0em} {{{z}_{2}}}}}}{{{\bar {C}}}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{2}}}}} \right. \kern-0em} {{{z}_{2}}}} - {1 \mathord{\left/ {\vphantom {1 {{{z}_{1}}}}} \right. \kern-0em} {{{z}_{1}}}}}}}}}{{\theta _{1}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{1}}}}} \right. \kern-0em} {{{z}_{1}}}}}}}} = K_{1}^{2}\frac{{C_{2}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{2}}}}} \right. \kern-0em} {{{z}_{2}}}}}}\gamma _{2}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{2}}}}} \right. \kern-0em} {{{z}_{2}}}}}}}}{{C_{1}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{1}}}}} \right. \kern-0em} {{{z}_{1}}}}}}\gamma _{1}^{{{1 \mathord{\left/ {\vphantom {1 {{{z}_{1}}}}} \right. \kern-0em} {{{z}_{1}}}}}}}},$(3)
$\frac{{{{\theta }_{2}}}}{{{{\theta }_{1}}}} = K_{1}^{2}\frac{{{{C}_{2}}{{\gamma }_{2}}}}{{{{C}_{1}}{{\gamma }_{1}}}}.$Полагая, что в исследуемой области концентраций выполняется первое приближение теории Дебая–Хюккеля, уравнение (3) можно записать в виде
Данная форма уравнения Никольского традиционно используется для описания состояния ионообменного равновесия.
Для расчета константы равновесия основным экспериментальным затруднением является необходимость оценки ионного состава мембраны. Предлагаемый подход заключается в оценке соотношения противоионов в гелевой фазе мембраны из концентрационных зависимостей ее удельной электропроводности в индивидуальных растворах и их эквимолярной смеси.
Согласно микрогетерогенной модели, ионообменный материал может быть представлен как разупорядоченная смесь двух псевдофаз: гелевой фазы, включающей полимерные цепи и гидратированные фиксированные группы, и фазы внутреннего равновесного раствора, идентичного по свойствам раствору за пределами мембраны. Электропроводность такой системы может быть выражена через электропроводности ее отдельных фаз с помощью уравнения [13]
(5)
${{\kappa }_{{\text{m}}}} = {{\bar {\kappa }}^{{{{f}_{1}}}}}\kappa _{{{\text{sol}}}}^{{{{f}_{2}}}},$В смешанном растворе электропроводность мембраны зависит от концентрации и подвижности каждого сорта противоионов в геле. Подобное допущение использовалось также авторами [10] при изучении электропроводности гетерогенной мембраны МК-40 в смешанном растворе, содержащем соляную кислоту и хлорид щелочного металла. В таком случае электропроводность мембраны в смешанном растворе описывается уравнением вида
(6)
${{\bar {\kappa }}_{\Sigma }} = {{\bar {\kappa }}_{1}}{{\beta }_{1}} + {{\bar {\kappa }}_{2}}{{\beta }_{2}},$(7)
${{\beta }_{{\text{2}}}} = \frac{{{{{\bar {\kappa }}}_{1}} - {{{\bar {\kappa }}}_{\Sigma }}}}{{{{{\bar {\kappa }}}_{1}} - {{{\bar {\kappa }}}_{2}}}}.$Тогда константа ионообменного равновесия для смеси 1 : 1-валентных катионов принимает вид
(8)
$K_{1}^{2} = \frac{{{1 \mathord{\left/ {\vphantom {1 {{{\alpha }_{2}} - 1}}} \right. \kern-0em} {{{\alpha }_{2}} - 1}}}}{{{1 \mathord{\left/ {\vphantom {1 {{{\beta }_{2}} - 1}}} \right. \kern-0em} {{{\beta }_{2}} - 1}}}},$Для реакции обмена с участием одно- и двухвалентных катионов уравнение Никольского принимает вид
(9)
$\frac{{\bar {C}_{2}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}{{{{{\bar {C}}}_{1}}}} = K_{1}^{2}\frac{{C_{2}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}\gamma _{2}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}{{{{C}_{1}}{{\gamma }_{1}}}}.$(10)
$\frac{{\theta _{2}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}{{{{\theta }_{1}}{{Q}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{\rho }^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}} = K_{1}^{2}\frac{{C_{2}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}{{{{C}_{1}}}}.$(11)
$K_{1}^{2} = \frac{{({1 \mathord{\left/ {\vphantom {1 {\sqrt {{{\alpha }_{2}}} }}} \right. \kern-0em} {\sqrt {{{\alpha }_{2}}} }} - \sqrt {{{\alpha }_{2}}} ){\kern 1pt} {{C}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{\gamma }_{1}}}}{{({1 \mathord{\left/ {\vphantom {1 {\sqrt {{{\beta }_{2}}} }}} \right. \kern-0em} {\sqrt {{{\beta }_{2}}} }} - \sqrt {{{\beta }_{2}}} ){\kern 1pt} {{Q}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{\rho }^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}\gamma _{2}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}.$Таким образом, основными допущениями предлагаемого подхода являются: выполнение показательного уравнения (5) для смешанных растворов, независимость объемной доли гелевой фазы мембраны от ее ионной формы, зависимость электропроводности гелевой фазы только от концентрации и подвижности каждого сорта противоионов, отсутствие коионов в гелевой фазе мембраны.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектами исследования служили катионообменные мембраны МК-40 (ОАО “Щекиноазот”, Щекино) и МФ-4СК (ОАО “Пластполимер”, Санкт-Петербург), а также эти мембраны, модифицированные полианилином. Мембрана МК-40 изготавливается из сульфированного сополимера стирола и дивинилбензола (ионообменная смола КУ-2), полиэтилена в качестве инертного связующего и капроновой армирующей сетки. Мембрана МФ-4СК является аналогом мембраны Нафион и представляет собой сульфированный сополимер перфторвинилового эфира и тетрафторэтилена. Физико-химические характеристики мембран МК-40 и МФ-4СК в Na+-форме, такие как обменная емкость в расчете на единицу массы набухшей мембраны (Q), влагосодержание (W), плотность (ρ) и удельная влагоемкость (n), представлены в табл. 1.
Таблица 1.
Физико-химические характеристики исследуемых катионообменных мембран
| Мембрана | Q, ммоль/г | W, % | ρ, г/см3 | n, моль Н2О/моль ${\text{SO}}_{3}^{ - }$ |
|---|---|---|---|---|
| МК-40 | 1.54 ± 0.04 | 37 | 1.17 | 13 |
| МФ-4СК | 0.68 ± 0.04 | 20 | 1.70 | 16 |
Мембраны перед исследованием кондиционировали по методике, описанной в [14], и отмывали дистиллированной водой с контролем сопротивления воды над мембраной. Модифицирование мембран МК-40 и МФ-4СК полианилином осуществляли непосредственно в электродиализном аппарате согласно методике, предложенной в [15]. Для этого была собрана электродиализная ячейка, состоящая из 6 парных камер, образованных катионо- и анионообменными мембранами. В камеру обессоливания подавали раствор сернокислого анилина, а в камеру концентрирования – персульфата аммония в присутствии серной кислоты. Модифицирование проводилось при плотности тока 2 А/дм2 в течение 10 мин, а затем 1 А/дм2 в течение 120 мин.
Массообменные характеристики мембран изучали на лабораторном электродиализаторе, состоящем из 5 парных камер, каждая из которых состоит из камеры обессоливания и камеры концентрирования. Размеры рабочей области мембран – 5 × 20 см2, расстояние между мембранами – 0.1 см, линейная скорость протока раствора – 1.3 см/с. Опыты проводили в потенциостатическом режиме при падении напряжения на парной камере 0.75–6 В. Для изучения конкурентного переноса ионов через базовые и модифицированные полианилином катионообменные мембраны использовали два раствора. Первый раствор содержал по 0.1 моль-экв/л хлоридов натрия и кальция, второй – по 0.1 моль-экв/л соляной кислоты и хлорида кальция. Содержание соляной кислоты в пробах анализировали титриметрически, ионов кальция и натрия – на ионном хроматографе “Стайер”.
Удельную электропроводность мембран определяли на основании их сопротивления, измеренного ртутно-контактным методом, как активную часть импеданса ячейки, которая соответствует частоте переменного тока более 100 кГц. Использование тока высокой частоты при измерении электросопротивления отвечает малому отклонению системы от состояния равновесия. Перед измерением мембраны приводили в равновесие с раствором индивидуального электролита заданной концентрации или эквимолярной (здесь и далее в моль-эквивалентах) смеси двух электролитов. Кондуктометрические измерения проводили при температуре 25°C. Погрешность эксперимента не превышала 5%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для исследования возможности расчета соотношения одно- и двухзарядных противоионов в мембране на основании кондуктометрических измерений экспериментально получены концентрационные зависимости удельной электропроводности гетерогенной МК-40 и гомогенной МФ-4СК мембран в растворах хлоридов натрия и кальция и соляной кислоты, а также их эквимолярной смеси, которые представлены на рис. 1. Видно, что зависимость проводимости мембраны в смешанных растворах находится между соответствующими кривыми для индивидуальных растворов.
Рис. 1.
Экспериментальные концентрационные зависимости удельной электропроводности мембран МК-40 (а) и МФ‑4СК (б) в растворах HCl (1), NaCl (2), CaCl2 (5) и их эквимолярных смесей HCl + 1/2 CaCl2 (3), NaCl + 1/2 CaCl2 (4).
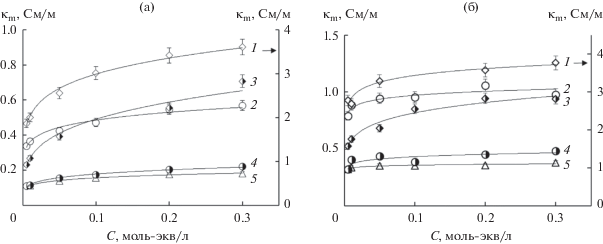
Данные концентрационные зависимости использовали для расчета объемной доли межгелевого раствора f2 и электропроводности гелевой фазы мембраны. Полученные на основании логарифмической формы уравнения (5) значения представлены в табл. 2. Видно, что для солевых форм ионообменных мембран объемная доля фазы геля практически не зависит от ее ионной формы. В растворе кислоты наблюдается завышенное значение объемной доли межгелевого раствора. Авторами [16] на основании анализа значений параметра f2, рассчитанного из кондуктометрических и сорбционных экспериментов, показано, что это завышение является кажущимся и обусловлено особым механизмом переноса протона. Таким образом, предположение о постоянстве объемных долей фаз геля и межгелевого раствора являются достаточно корректными в случае солевых форм мембраны.
Таблица 2.
Транспортно-структурные параметры исследованных мембран
| Электролит | МК-40 | МФ-4СК | МК-40/ПАНИ | МФ-4СК/ПАНИ | ||||
|---|---|---|---|---|---|---|---|---|
| $\bar {\kappa }$, См/м | f2 | $\bar {\kappa }$, См/м | f2 | $\bar {\kappa }$, См/м | f2 | $\bar {\kappa }$, См/м | f2 | |
| NaCl | 0.43 | 0.14 | 0.98 | 0.05 | 0.35 | 0.18 | 0.62 | 0.09 |
| HCl | 2.82 | 0.17 | 3.37 | 0.08 | 1.86 | 0.30 | 0.65 | 0.10 |
| CaCl2 | 0.11 | 0.16 | 0.34 | 0.03 | 0.065 | 0.23 | 0.14 | 0.08 |
| ½CaCl2 + NaCl | 0.12 | 0.19 | 0.43 | 0.05 | 0.10 | 0.22 | 0.32 | 0.09 |
| ½CaCl2 + HCl | 0.26 | 0.27 | 0.67 | 0.16 | 0.070 | 0.30 | 0.17 | 0.03 |
На основании анализа значений электропроводности мембран в точке изоэлектропроводности ($\bar {\kappa }$) в индивидуальных растворах электролитов можно оценить отношение подвижностей ионов в гелевой фазе мембраны, позволяющее судить о селективности мембраны. Отношения подвижностей противоионов в геле, рассчитанные как отношения $\bar {\kappa }$ для различных ионных форм, представлены в табл. 3. В этой же таблице приведено отношение подвижностей противоионов в растворе. Как следует из табл. 3, отношение подвижностей катионов Ca2+/Na+ и Ca2+/H+ в мембране существенно меньше, чем в растворе, что обусловлено более сильным электростатическим взаимодействием двухзарядных противоионов с фиксированными группами по сравнению с однозарядными противоионами. При этом данный эффект более выражен для гетерогенной мембраны, чем для гомогенной.
Таблица 3.
Транспортные и равновесные характеристики исследованных мембран в смешанных растворах
| Мембрана | Ca2+/H+ | Ca2+/Na+ | |||||
|---|---|---|---|---|---|---|---|
| $\frac{{{{{\bar {u}}}_{{{\text{C}}{{{\text{a}}}^{{2 + }}}}}}}}{{{{{\bar {u}}}_{{{{{\text{H}}}^{ + }}}}}}}$ | β2 | $K_{{{{{\text{H}}}^{{\text{ + }}}}}}^{{{\text{C}}{{{\text{a}}}^{{{\text{2 + }}}}}}}$ | $\frac{{{{{\bar {u}}}_{{{\text{C}}{{{\text{a}}}^{{2 + }}}}}}}}{{{{{\bar {u}}}_{{{\text{N}}{{{\text{a}}}^{ + }}}}}}}$ | β2 | $K_{{{\text{N}}{{{\text{a}}}^{{\text{ + }}}}}}^{{{\text{C}}{{{\text{a}}}^{{{\text{2 + }}}}}}}$ | $K_{{{\text{N}}{{{\text{a}}}^{{\text{ + }}}}}}^{{{\text{C}}{{{\text{a}}}^{{{\text{2 + }}}}}}}$ [5] | |
| МК-40 | 0.039 | 0.94 | 1.09 | 0.26 | 0.97 | 2.33 | 2.75 |
| МФ-4СК | 0.10 | 0.90 | 1.10 | 0.36 | 0.91 | 1.62 | 1.56 |
| МК-40/ПАНИ | 0.036 | 0.99 | 10.3 | 0.19 | 0.89 | 0.45 | – |
| МФ-4СК/ПАНИ | 0.22 | 0.92 | 1.48 | 0.23 | 0.63 | 0.29 | – |
| Смешанный раствор | 0.17 | – | – | 1.18 | – | – | – |
Значения $\bar {\kappa }$ использовали для расчета значений β2 по формуле (7) и констант ионообменного равновесия по формуле (11), значения которых также приведены в табл. 3. Значения α2 во всех случаях составляли 0.5, т.к. в эксперименте использовали смешанные растворы с одинаковым содержанием катионов в моль-эквивалентах. В этой же таблице представлены результаты независимого определения константы равновесия в системе мембрана МК-40/раствор смеси хлоридов натрия и кальция на основании сорбционных экспериментов, найденные в литературе [5]. Согласно данным табл. 3, наблюдается удовлетворительное согласие между значениями констант Никольского в системе Na+/Ca2+, полученными из данных мембранной кондуктометрии и имеющимися в литературе. Уменьшение значений констант равновесия при переходе от Na+ к H+ соответствует более высокой селективности сульфокатионитовых мембран по отношению к катиону водорода по сравнению с катионом натрия. На основании сорбционных экспериментов изученные катионы можно расположить в ряд Ca2+ > > H+ > Na+, который согласуется с рядом селективности сульфокатионитовых мембран к этим катионам, полученным в работе [2] при электродиализном разделении растворов, содержащих два катиона и общий анион.
Таким образом, на примере гомогенной и гетерогенной сульфокатионитовых мембран показана возможность расчета константы ионообменного равновесия из концентрационных зависимостей удельной электропроводности этих мембран в гомо- и гетероионной формах, позволяющей судить об избирательности мембраны по отношению к ионам определенного сорта. В связи с этим данный подход был применен для оценки константы равновесия указанных мембран, модифицированных полианилином. Модифицирование ионообменных мембран путем нанесения на их поверхность слоя модификатора, имеющего заряд, противоположный заряду базовой матрицы, широко используется для уменьшения селективности мембран по отношению к многозарядным противоионам [1, 17–19]. Хорошо известны работы [1, 18, 19], в которых для этих целей на поверхность мембраны наносят слой сопряженного полимера.
На рис. 2 представлены концентрационные зависимости удельной электропроводности модифицированных полианилином мембран, МК-40/ ПАНИ и МФ-4СК/ПАНИ, в растворах HCl, NaCl, CaCl2 и их эквимолярных смесях, полученные в данной работе. Как следует из рисунка, синтез слоя полианилина на поверхности мембран приводит к снижению электропроводности МК-40 примерно на 20–50% во всех электролитах, а МФ-4СК – в 1.3–2 раза в солевых растворах и в 4–5 раз в кислых растворах, что наблюдалось ранее для мембран, полученных в сходных условиях [15, 20]. Для обеих модифицированных мембран наиболее существенное снижение электропроводности наблюдается в смешанном растворе, содержащем хлорид кальция и соляную кислоту.
Рис. 2.
Экспериментальные концентрационные зависимости удельной электропроводности мембран МК-40/ПАНИ (а) и МФ-4СК/ПАНИ (б) в растворах HCl (1), NaCl (2), CaCl2 (5) и их эквимолярных смесей HCl + 1/2 CaCl2 (3), NaCl + + 1/2 CaCl2 (4).
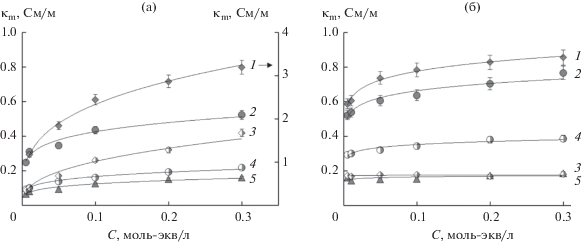
Оценка отношения подвижностей катионов кальция и натрия в фазе мембраны показала, что модифицирование сульфокатионитовых мембран полианилином, как и ожидалось, приводит к дополнительному снижению подвижности двухзарядных катионов в мембране. Это позволяет предположить, что в процессе электродиализа с использованием модифицированных мембран поток двухзарядных ионов будет меньше, чем в случае немодифицированных. При этом происходит снижение констант равновесия для мембран в солевых растворах. В то же время в смешанном растворе хлорида кальция и соляной кислоты соотношение подвижностей противоионов практически не изменяется для гетерогенной мембраны МК-40 и возрастает для МФ-4СК после их модифицирования. Аномально высокое значение константы ионообменного равновесия для модифицированных мембран в смешанном растворе, содержащем кислоту, может быть обусловлено дополнительным переносом ионов водорода по цепям полианилина. Таким образом, для мембран, модифицированных полианилином, требуется учет природы модификатора при расчете константы равновесия указанным способом в растворах, содержащих кислоту.
Изменение ионного состава мембраны должно влиять на соотношение потоков противоионов через мембрану при электродиализе. Известно, что селективность мембраны по отношению к определенному сорту противоионов в присутствии других противоионов в условиях электромиграции описывается коэффициентом избирательной проницаемости ($P_{{\text{1}}}^{{\text{2}}}$) [1, 2, 21]:
(13)
$P_{{\text{1}}}^{{\text{2}}} = \frac{{{{{{{\bar {t}}}_{{\text{2}}}}} \mathord{\left/ {\vphantom {{{{{\bar {t}}}_{{\text{2}}}}} {{{{\bar {t}}}_{{\text{1}}}}}}} \right. \kern-0em} {{{{\bar {t}}}_{{\text{1}}}}}}}}{{{{{{C}_{{\text{2}}}}} \mathord{\left/ {\vphantom {{{{C}_{{\text{2}}}}} {{{C}_{{\text{1}}}}}}} \right. \kern-0em} {{{C}_{{\text{1}}}}}}}},$В то же время взаимосвязь между коэффициентом избирательной проницаемости и коэффициентом распределения в пренебрежении влиянием диффузионных слоев на межфазной границе мембрана–раствор электролита описывается формулой [1, 2, 5, 22]
Коэффициент равновесного распределения можно рассчитать на основании значений β2, зная соотношение противоионов в растворе, по формуле
(15)
$T_{1}^{2} = \frac{{{{{{\beta }_{2}}} \mathord{\left/ {\vphantom {{{{\beta }_{2}}} {(1 - }}} \right. \kern-0em} {(1 - }}{{\beta }_{2}})}}{{{{{{\alpha }_{2}}} \mathord{\left/ {\vphantom {{{{\alpha }_{2}}} {(1 - }}} \right. \kern-0em} {(1 - }}{{\alpha }_{2}})}}.$(16)
$P_{{\text{1}}}^{{\text{2}}} = \frac{{{{{{j}_{{\text{2}}}}} \mathord{\left/ {\vphantom {{{{j}_{{\text{2}}}}} {{{j}_{{\text{1}}}}}}} \right. \kern-0em} {{{j}_{{\text{1}}}}}}}}{{{{{{C}_{{\text{2}}}}} \mathord{\left/ {\vphantom {{{{C}_{{\text{2}}}}} {{{C}_{{\text{1}}}}}}} \right. \kern-0em} {{{C}_{{\text{1}}}}}}}}.$Рис. 3.
Экспериментальные зависимости коэффициентов избирательной проницаемости мембран (точки и сплошные кривые) от падения напряжения на парной камере в процессе электродиализного концентрирования раствора, содержащего эквимолярную смесь 1/2CaCl2 + NaCl (а) и 1/2CaCl2 + HCl (б): 1 – МК-40, 2 – МК-40/ПАНИ, 3 – теоретический расчет для идеально селективной мембраны.
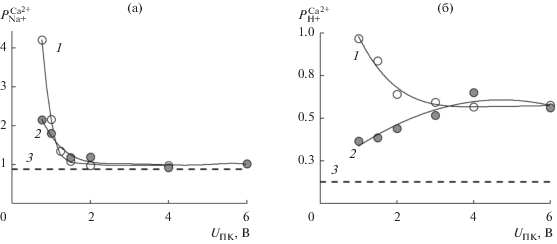
Анализ экспериментальных данных, представленных на рис. 3, показал, что при низких значениях падения напряжения на парной камере (0.75–1.5 В) в смеси Ca2+/Na+ преимущественно переносятся ионы Ca2+, в то же время в смеси хлорида кальция и соляной кислоты преимущественно переносятся ионы H+. С увеличением разности потенциалов на парной камере значение $P_{{\text{1}}}^{{\text{2}}}$ уменьшается и выходит на постоянное значение, которое для смеси хлоридов кальция и натрия соответствует теоретической величине. Данный эффект связан с наступлением предельного, а затем и сверхпредельного состояния на катионообменных мембранах и потерей ими селективности при падении напряжения на парной камере, превышающем 2 В [22]. Анализ результатов электродиализного обессоливания показывает, что поверхностное модифицирование гетерогенной мембраны МК-40 полианилином приводит к уменьшению коэффициента избирательной проницаемости как для смеси Ca2+/Na+, так и для смеси Ca2+/H+ при низких значениях падения напряжения на парной камере (Uпк < 2 В), что соответствует снижению потока двухзарядных катионов. Однако при увеличении напряжения выше 2 В значения $P_{{\text{1}}}^{{\text{2}}}$ для модифицированного образца становятся близкими к таковым для исходной мембраны. Это позволяет выбрать оптимальный режим использования сульфокатионитовых мембран, модифицированных полианилином, в электродиализе.
Совместный анализ результатов, полученных из кондуктометрических измерений, и данных рис. 3 показывает, что они хорошо согласуются на качественном уровне: снижение значения константы ионообменного равновесия сопровождается возрастанием потока однозарядных противоионов при электромиграции. Исключение составляют модифицированные мембраны в смешанном растворе, содержащем, хлорид кальция и соляную кислоту. Одной из причин наблюдаемого эффекта может быть формирование внутренней биполярной границы между модифицирующим слоем и поверхностью самой ионообменной мембраны [23], что приводит к возрастанию потока катионов водорода через мембрану.
ЗАКЛЮЧЕНИЕ
Изучена возможность оценки ионного состава мембраны в растворах, содержащих два сорта противоионов и общий коион, на основании концентрационных зависимостей удельной электропроводности мембраны в индивидуальных и смешанных растворах. Выполненные расчеты константы ионообменного равновесия для мембран МК-40 и МФ-4СК в растворах хлоридов натрия и кальция показали удовлетворительное совпадение с ее величиной, полученной из результатов сорбционных экспериментов.
Изучено влияние модифицирования гетерогенной мембраны полианилином на величину константы ионного обмена и показано, что нанесение слоя полимера-модификатора приводит к снижению селективности мембраны к двухзарядным катионам в растворах солей. Это сопровождается возрастанием потока однозарядных противоионов через мембрану при электродиализе смешанных растворов. В случае растворов, содержащих кислоту, вопрос о возможности расчета константы ионообменного равновесия для мембраны, модифицированной полианилином, остается открытым.
Список литературы
Sata T., Yang W. // J. Membr. Sci. 2002. V. 206. P. 31–60.
Luo T., Roghmans F., Wessling M. // J. Membr. Sci. 2020. V. 597. 117645.
Luo T., Abdu S., Wessling M. // J. Membr. Sci. 2018. V. 555. P. 429.
Заболоцкий В.И., Гнусин Н.П., Репринцева С.Л., Никоненко В.В. // Электрохимия. 1979. Т. 15. С. 1124.
Zabolotsky V.I., Achoh A.R., Lebedev K.A., Melnikov S.S. // J. Membr. Sci. 2020. V. 608. Article 118152.
Золотухина Е.В., Кравченко Т.А. // Журн. физ. химии. 2001. Т. 83. С. 934.
Mahmoud A., Hoadley A.F.A. // Water Res. 2012. V. 46. P. 3364.
Гнусин Н.П., Карпенко Л.В., Демина О.А., Березина Н.П. // Журн. физ. химии. 2001. Т. 75. С. 1697.
Karpenko-Jereb L.V., Berezina N.P. // Desalination. 2009. V. 245. P. 587.
Караванова Ю.А., Ярославцев А.Б. // Неорг. материалы. 2010. Т. 46. С. 880.
Караванова Ю.А., Федина К.Г., Ярославцев А.Б. // Неорг. материалы. 2011. Т. 47. С. 380.
Helfferich F. Ionenaustauscher. Weinheim: Verlag Chemie, 1959.
Zabolotsky V.I., Nikonenko V.V. // J. Membr. Sci. 1993. V. 79. P. 181.
Berezina N.P., Kononenko N.A., Dyomina O.A., Gnusin N.P. // Adv. Colloid Interface Sci. 2008. V. 139. P. 3.
Лоза Н.В., Лоза С.А., Кононенко Н.А., Магалянов А.В. // Мембраны и мембранные технологии. 2015. Т. 5. С. 202.
Демина О.А., Фалина И.В., Кононенко Н.А., Заболоцкий В.И. // Коллоид. журн. 2020. Т. 82. С. 148.
Golubenko D., Yaroslavtsev A. // J. Membr. Sci. 2020. V. 612. Article 118 408.
Tan S., Tieu J.H., Belanger D. // J. Phys. Chem. B. 2005. V. 109. P. 14085.
Nagarale R.K., Gohil G.S., Shahi V.K., Trivedi G.S., Rangarajan R. // J. Colloid Interface Sci. 2004. V. 277. P. 162.
Шкирская С.А., Сенчихин И.Н., Кононенко Н.А., Ролдугин В.И. // Электрохимия. 2017. Т. 53. С. 89.
Golubenko D.V., Karavanova Yu.A., Melnikov S.S., Achoh A.R., Pourcelly G., Yaroslavtsev A.B. // J. Membr. Sci. 2018. V. 563. P. 777.
Заболоцкий В.И., Никоненко В.В. Перенос ионов в мембранах. М.: Наука, 1996.
Кононенко Н.А., Долгополов С.В., Лоза Н.В., Шельдешов Н.В. // Электрохимия. 2015. Т. 51. С. 23.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


