Коллоидный журнал, 2021, T. 83, № 3, стр. 344-351
Молекулярное моделирование бинарных газовых гидратов CO2/CH4, CO2/N2 и N2/CH4
А. А. Сизова 1, *, С. А. Гринцевич 1, М. А. Кочурин 1, В. В. Сизов 1, Е. Н. Бродская 1
1 Санкт-Петербургский государственный университет
198504 Санкт-Петербург, Университетский просп., 26, Россия
* E-mail: shapovalovaaa@mail.ru
Поступила в редакцию 22.12.2020
После доработки 28.12.2020
Принята к публикации 30.12.2020
Аннотация
Моделирование методом Монте-Карло в большом каноническом ансамбле было проведено с целью изучения заполнения многокомпонентных газовых гидратов структуры I бинарными газовыми смесями CO2/CH4, CO2/N2 и N2/CH4 различного состава при температуре 270 K и значениях давления до 70 атм. Присутствие азота в газовой смеси позволяет увеличить как селективность гидратного каркаса по отношению к CO2, так и количество углекислого газа, заключенного в полостях гидрата, по сравнению с гидратом CO2/CH4. Несмотря на то, что гидрат N2/CH4 демонстрирует селективность к молекулам CH4, азот может конкурировать с метаном, если газовая смесь содержит, по крайней мере, 70% N2.
ВВЕДЕНИЕ
Газовые гидраты представляют собой кристаллические твердые тела, состоящие из молекул газа, заключенных в полостях решетки, образованной водой. В природе наиболее распространенны гидраты метана [1]. Известно, что метан образует гидраты структуры I (sI), элементарная ячейка которой состоит из 46 молекул воды и 8 молекул газа, расположенных в 6 больших (51262) и 2 малых (512) полостях [2, 3].
Захоронение CO2 в гидратах признано потенциально привлекательной технологией улавливания углекислого газа [4]. Среди других возможных методов масштабного производства гидратов CO2 рассматривают внедрение углекислого газа в природные месторождения гидратов метана. В процессе внедрения происходит замещение метана углекислым газом в полостях клатрата. Это повышает эффективность добычи метана и приводит к формированию стабильных гидратов CO2 [5, 6]. Однако введение чистого CO2, скорее всего, является нецелесообразным, поскольку для этого требуется предварительное отделение его от других компонентов топочного газа с последующим сжатием. Решить эту проблему можно, если вместо чистого углекислого газа использовать его смесь с азотом [7], которая является основной составляющей топочного газа. Более того, экспериментальные исследования показали, что использование смеси CO2/N2 приводит к более эффективному выделению метана в сравнении с внедрением чистого CO2 [7–9]. Эти выводы были недавно проверены в промышленном масштабе [10].
Механизм замены в гидратах метана углекислым газом или азотом во многом опирается на конкуренцию молекул газов в занятии различных полостей клатрата. Согласно экспериментальным данным для чистых и смешанных гидратов, молекулы метана способны занимать как малые (512), так и большие (51262) полости, хотя заполнение больших полостей, как правило, несколько выше, особенно при более высоких температурах [11]. Молекулы углекислого газа заметно больше молекул метана, вследствие чего они хуже подходят для занятия малых полостей. В ранних исследованиях предполагалось, что в чистых гидратах CO2 структуры I малые полости остаются незанятыми [11, 12], однако в более поздних экспериментальных работах сообщалось о 70%-ом заполнении малых полостей углекислым газом [13, 14]. Молекулы азота имеют наименьший размер из трех представленных газов, что потенциально позволяет им успешно конкурировать при занятии малых полостей.
Экспериментальные исследования состава и распределения газов по полостям различного типа в смешанных гидратах фокусируются, в основном, на свойствах гидратов CO2/CH4 и, в меньшей степени, CO2/N2, в то время как другие смеси изучены намного меньше. В случае гидрата CO2/CH4 метан проигрывает в конкуренции за большие полости углекислому газу, что проявляется в уменьшении отношения заполнений метаном больших и малых полостей при формировании смешанных гидратов [6]. Согласно рамановским спектрам гидратов CO2/N2 [15], молекулы азота могут находиться как в малых, так и в больших полостях независимо от состава газовой смеси. Углекислый газ занимает преимущественно большие полости, и количество CO2 в этих полостях увеличивается с ростом его содержания в газовой смеси. В исследованиях методом ядерного магнитного резонанса часто возникают проблемы при фиксации сигнала от CO2 в малых полостях, на основании чего также можно предположить, что углекислый газ концентрируется в больших полостях [16, 17]. В тройных гидратах CH4/CO2/N2 азот преобладает над двумя другими газами при занятии малых полостей, в то время как CO2 аналогично ведет себя относительно больших полостей [18]. Показано, что метан в большей степени занимает малые полости, чем большие [19].
На молекулярном уровне информация о механизмах конкуренции газов при занятии полостей в гидратах может быть получена с помощью молекулярного моделирования. Однако, несмотря на успешное применение методов молекулярной динамики и Монте-Карло при изучении однокомпонентных гидратов, включая гидраты CH4, CO2 и N2, известно очень ограниченное число работ, посвященных моделированию свойств смешанных гидратов [20–22]. Сравнение данных молекулярно-динамического моделирования однокомпонентных гидратов CH4 и CO2 и смешанных CH4/CO2 показывает, что смешанные гидраты могут быть более стабильными относительно любого однокомпонентного гидрата [23]. Оценки свободной энергии замены метана молекулами CO2 или N2, полученные с помощью молекулярно-динамических расчетов, показывают, что она оказывается отрицательной только при замене метана углекислым газом в больших полостях гидрата sI [24]. Поэтому, в согласии с экспериментальными исследованиями [6], полная замена метана в гидратах другим газом неосуществима, так как некоторое количество молекул CH4 с большой долей вероятности останется в малых полостях. При молекулярно-динамическом моделировании замещения метана углекислым газом в гидрате sI наблюдали образование аморфного гидрата CO2 на поверхности гидрата CH4, происходящее одновременно с разрушением последнего [25]. Моделирование методом Монте-Карло однокомпонентных и смешанных гидратов метана и углекислого газа проводилось в [26]. Согласно полученным данным, малые полости преимущественно заняты метаном; большие полости не демонстрируют предпочтения к какому-либо газу, за исключением случая высоких давлений (больше 100 атм.), когда наблюдается их предпочтительное заполнение молекулами CH4. Наконец, энергетические барьеры для диффузии газа через кольца молекул воды между соседними полостями в гидрате sI были рассчитаны в [27]. Данные моделирования предполагают, что азот способен легче, чем углекислый газ, диффундировать в большие полости, уже занятые метаном, хотя эффект является довольно слабым.
В настоящей работе моделирование методом Монте-Карло применено для изучения природы конкурентного заполнения полостей в смешанных sI-гидратах CO2/CH4, CO2/N2, и N2/CH4. При описании результатов будут использованы полные и парциальные изотермы заполнения, на основании которых будет выявлено влияния состава газовых смесей и их давления на состав бинарных гидратов, получено распределение молекул газов по полостям различного типа и рассчитана селективность гидратного каркаса к компонентам газовой смеси.
МЕТОДИКА МОДЕЛИРОВАНИЯ
Метод и модели
Моделирование проводилось методом Монте-Карло в большом каноническом ансамбле с использованием авторского программного обеспечения. Дисперсионные взаимодействия в системе описывались леннард-джонсовским потенциалом, а электростатические взаимодействия между эффективными атомными зарядами учитывались с помощью кулоновского потенциала. Трехмерные периодические граничные условия накладывались на систему для моделирования объемной фазы гидрата. Энергии взаимодействия рассчитывались в приближении ближайшего образа.
Для проведения моделирования были выбраны полноатомные жесткие модели воды и газов, а именно, TIP4P/ice для H2O [28], OPLS-AA для метана [29] и TraPPE для диоксида углерода и азота [30].
Гидратный каркас был представлен 4 × 4 × 4 элементарными ячейками структуры I с 2944 молекулами воды (рис. 1). В целом, ячейка гидрата содержала 512 полостей, доступных для молекул газов, включая 128 малых и 384 больших полостей. Гидратный каркас был полностью жестким и не изменялся в ходе моделирования.
Заполнение гидрата было изучено при 270 K и значениях давления от 1 до 50–70 атм в зависимости от системы. Были рассмотрены три бинарные смеси: CO2/CH4, CO2/N2, N2/CH4, содержащие 10, 30, 50, 70, 90 мол. % первого компонента.
С методологической точки зрения, моделирование заполнения гидрата напоминает моделирование адсорбции газа методом Монте-Карло в большом каноническом ансамбле, т.е. количество газа в твердой фазе определяется его химическим потенциалом. Значения химических потенциалов, обеспечивающих необходимый состав газовой смеси в заданном интервале давлений, были получены на основе большого количества предварительных расчетов объемных газовых смесей без гидратного каркаса. Продолжительность моделирования методом Монте-Карло варьировалась от 15–20 млн шагов для предварительных расчетов объемного газа до 30 млн шагов при моделировании гидратов. Все рассчитанные свойства усреднялись по равновесной части траектории, которая составила не менее 15 млн шагов.
Заполнение
Количество газа, содержащегося в гидрате, описывается заполнением Θ, которое определяется как число молекул газа, отнесенное к числу полостей:
При расчете общего заполнения Ngas определяется числом всех молекул газа в системе, тогда как для парциальной емкости используется число молекул газа одного сорта. Аналогично, для расчета заполнения всего гидрата используется число всех полостей каркаса (в настоящей работе 512), а при оценке заполнения определенного типа полостей Ncages равно количеству соответствующих полостей в ячейке моделирования (128 малых и 384 больших полостей).
Селективность
Селективность гидратного каркаса относительно какого-либо компонента бинарной газовой смеси определяется так же, как и в адсорбционных расчетах, и описывается коэффициентом селективности Si, который равен отношению мольных долей газов в гидрате и в газовой фазе:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Общее заполнение и селективность гидратного каркаса
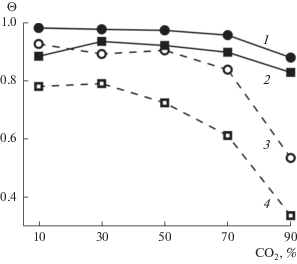
Изотермы заполнения бинарного гидрата CO2/CH4 до давления 50 атм приведены на рис. 2а. Для всех рассмотренных составов смеси общая степень заполнения гидрата достаточно высока (более 0.7) даже при низком давлении и быстро увеличивается с его ростом. При давлениях выше 25–30 атм гидратный каркас практически полностью заполнен. Если смесь содержит менее 70% CO2, предельное заполнение близко к 1 (0.97 и более). Для смесей, содержащих более 70% углекислого газа, наблюдается заметное снижение предельного заполнения. Зависимость заполнения от давления для смеси CO2/N2 в целом аналогична полученной для смеси CH4/CO2, хотя абсолютные значения Ѳ становятся несколько ниже.
Рис. 2.
Общее заполнение гидратного каркаса для смесей CO2/CH4 (а) и N2/CH4 (б). Содержание CH4 в смесях: 1 – 90%, 2 – 70%, 3 – 50%, 4 – 30%, 5 – 10%.
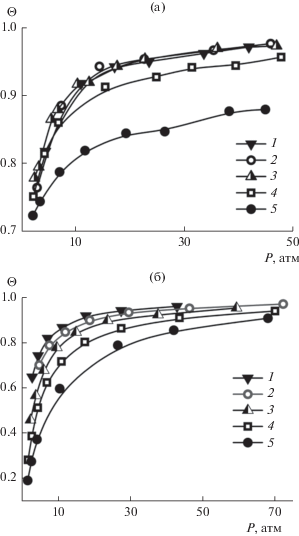
В случае смеси N2/CH4 (рис. 2б) заполнение гидрата при давлениях ниже 10 атм заметно меньше, чем для смесей CO2/CH4 или CO2/N2. Изотермы заполнения достигают предела при более высоких значения давления, чем для двух других смесей (около 30–40 атм).
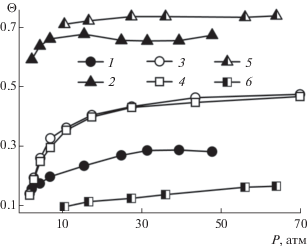
Наряду с общим заполнением, были получены парциальные заполнения по компонентам для всех трех смесей. Зависимости парциальных заполнений от давления показаны на рис. 3 для смесей со схожим составом (70% углекислого газа для CO2/CH4 и CO2/N2, 70% азота для N2/CH4). В смесях, содержащих углекислый газ, его количество в гидрате значительно превышает количество второго компонента и слабо изменяется с давлением. Заметная зависимость от давления наблюдается только для парциального заполнения метана. В случае смеси N2/CH4 с 70% азота парциальные заполнения для обоих газов очень близки, т.е. смешанный гидрат содержит больше метана в сравнении с исходным составом газовой фазы.
Рис. 3.
Парциальные заполнения гидратных каркасов для смесей CO2/CH4 (70% CO2) – закрашенные символы, CO2/N2 (70% CO2) – полузакрашенные символы и N2/CH4 (70% N2) – незакрашенные символы: 1, 3 – метан, 2, 5 – углекислый газ, 4, 6 – азот.
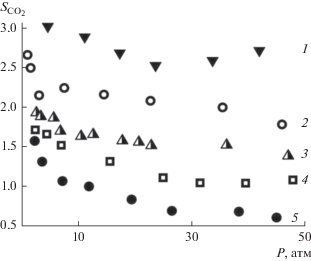
Разность в составах гидрата и исходной газовой смеси удобно характеризовать коэффициентом селективности Si, который рассчитывается как отношение мольных долей газа в гидрате и объемной газовой фазе.
На рис. 4 приведена зависимость от давления коэффициента селективности гидрата к CO2 для смесей CO2/CH4 различного состава. Для большинства рассмотренных условий гидратный каркас демонстрирует селективность к углекислому газу (${{S}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$ > 1), что означает повышенное его содержание в гидрате относительно равновесной газовой фазы. В случае смеси с 90% CO2 гидрат становится селективным к метану (${{S}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$ < 1), т.е. количество метана в гидрате больше, чем в газе. Увеличение давления приводит к небольшому уменьшению коэффициентов селективности, которые становятся почти постоянными при высоких давлениях.
Рис. 4.
Коэффициенты селективности гидрата к CO2 для смесей CO2/CH4 различного состава. Содержание CH4 в смесях: 1 – 90, 2 – 70, 3 – 50, 4 – 30, 5 – 10%.
Для смеси CO2/N2 поведение селективности к CO2 качественно схоже с поведением смеси CO2/CH4. Однако значения коэффициента селективности ${{S}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$ для гидратов CO2/N2 в два раза выше, и ни при каких условиях гидрат не становится селективным к азоту. Следует отметить, что только большие полости гидрата демонстрирует селективность к углекислому газу, а в малых полостях значения коэффициента селективности ${{S}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$ на два порядка ниже, чем в больших. Распределение молекул по полостям гидратного каркаса будет детально обсуждаться в следующем разделе.
Селективность гидратного каркаса к метану для смеси N2/CH4 практически не зависит от ее состава и давления. Значения коэффициента селективности ${{S}_{{{\text{C}}{{{\text{H}}}_{{\text{4}}}}}}}$ в рассмотренных условиях находятся в пределах 2.3–2.6.
Полученные результаты качественно и количественно хорошо согласуются с доступными экспериментальными данными [6, 16]. Сравнение рассчитанных и экспериментально измеренных [31] коэффициентов селективности ${{S}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$ для смеси CO2/CH4 приведено в табл. 1.
Таблица 1.
Сравнение экспериментальных и рассчитанных значений коэффициентов селективности гидрата sI к углекислому газу $({{S}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}})$ в смеси CO2/CH4
| Эксперимент, 277.15 K [31] |
Моделирование, 270.00 K (настоящая работа) |
||||
|---|---|---|---|---|---|
| P, атм. | % CO2 | ${{S}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$ | P, атм. | % CO2 | ${{S}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$ |
| 23.3 | 64 | 1.88 | 23.3 | 70 | 1.20 |
| 25.2 | 52 | 1.96 | 25.2 | 50 | 1.53 |
| 27.6 | 36 | 2.09 | 27.6 | 30 | 2.06 |
| 35.0 | 11 | 2.15 | 35.0 | 10 | 2.59 |
Максимальное расхождение между рассчитанными и экспериментальными значениями составляет около 35%, что хотя бы отчасти может быть объяснено разницей в температуре и составе смесей, использованных в моделировании и эксперименте. Хотя основные тенденции в обоих случаях схожи, данные моделирования показывают более заметное увеличение значений ${{S}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$ с ростом давления и уменьшением мольной доли углекислого газа.
Наблюдаемое различие в поведении смеси N2/CH4 и смесей, содержащих CO2, обусловлено природой углекислого газа. Углекислый газ, который обладает заметным квадрупольным моментом, взаимодействует с молекулами воды намного сильнее, чем неполярные молекулы азота и метана. Вследствие этого, углекислый газ имеет преимущество в процессе заполнения полостей гидрата, что можно видеть на барических зависимостях парциальных заполнений (рис. 3) и коэффициентов селективности (рис. 4). Более того, даже при низких давлениях заполнение гидрата молекулами CO2 достаточно близко к предельному заполнению каркаса. Более слабые взаимодействия воды с молекулами CH4 и N2 приводят к низким заполнениям при давлениях ниже 15 атм. (рис. 2а и 2б). Как видно на рис. 2б, наиболее “нежелательным” газом для заполнения гидрата sI является азот. Таким образом, разница в заполнении гидрата, вызванная взаимодействиями молекул-гостей с водой, более выражена при низких давлениях, тогда как при высоких давлениях заполнение в основном зависит от размера молекул.
Хотя участок низких давлений на изотермах заполнения важен для получения полного описания поведения моделируемых систем, он расположен вне области стабильности гидрата, наблюдаемой экспериментально. Область стабильности гидрата CO2/CH4 при 273.7 K расположена выше 14 и 25 атм для смесей, содержащих 79 и 10% CO2 соответственно [32]. Для смеси CO2/N2 (25% CO2) при 274 K гидраты наблюдаются при 59 атм, однако было обнаружено, что это давление значительно снижается с понижением температуры и увеличением содержания углекислого газа в смеси [33]. Предел устойчивости смеси N2/CH4 при 273 K возрастает от 35 до примерно 140 атм при увеличении количества азота в смеси [34], но при температуре 270 K, при которой были проведены расчеты в настоящей работе, давление также должно быть ниже. Следует отметить, что приведенные экспериментальные значения давления не могут быть напрямую применены в моделировании в качестве точных условий устойчивости гидратов, поскольку значения давления, полученные экспериментально и с помощью моделирования, могут существенно различаться. Однако точное расположение нижнего предела устойчивости не является высокоприоритетной задачей для данного конкретного исследования, и дальнейшее обсуждение будет опираться в основном на данные моделирования, которые получены для высоких заполнений и давлений, т.е. при условиях, в которых гидрат должен быть гарантированно устойчив.
Заполнения полостей
Как показано на рис. 2, общая степень заполнения достигает предельного значения при высоких давлениях, а именно, примерно при 50 атм для гидратов CO2/CH4 и CO2/N2 и примерно при 70 атм для гидратов N2/CH4. Это позволяет оценить максимальное заполнение для каждого состава смеси. Кроме того, можно также рассчитать максимальные заполнения отдельно для больших и малых полостей. Результат представлен на рис. 5.
Рис. 5.
Предельное общее заполнение гидратного каркаса (закрашенные символы) и заполнение малых полостей (незакрашенные символы) для смесей CO2/CH4 (1, 3) и CO2/N2 (2, 4) при 50 атм.
Было получено, что предельные общие заполнения гидратного каркаса для смесей CO2/CH4 и N2/CH4 имеют самые высокие значения и близки между собой. Предельное заполнение для смешанного гидрата CO2/N2 имеет более низкие значения из-за невыгодности размещения в малых полостях. Большие полости практически полностью заполнены при всех условиях. Заполнение малых полостей значительно ниже и уменьшается с увеличением доли CO2 в смеси.
Полученные результаты могут быть объяснены с учетом парциальных заполнений (рис. 6). Парциальные заполнения малых полостей углекислым газом почти равны нулю, таким образом, все молекулы CO2 заключены в больших полостях (рис. 6а, 6б). Заполнение малых полостей углекислым газом увеличивается при 90%-ном его содержания в смеси, что сопровождается резким снижением содержания второго компонента в малых полостях. При таком составе смеси (90% CO2) количество молекул второго компонента в больших полостях пренебрежимо мало. В гидратах CO2/N2 и CO2/CH4 азот и метан заполняют как большие, так и малые полости, причем количество молекул N2 в полостях меньше, чем метана. Очевидно, молекулы углекислого газа слишком большие, чтобы занимать малые полости в заметном количестве. Молекулы азота и метана меньше по размерам и могут занимать полости обоих типов. Итак, в гидрате sI поведение азота больше напоминает поведение метана, а не углекислого газа, что и является причиной схожести свойств гидратов CO2/N2 и CO2/CH4.
Рис. 6.
Парциальная емкость малых (1, 3) и больших (2, 4) полостей при примерно 50 атм для смесей CO2/CH4 (а) и CO2/N2 (б) и для смесей N2/CH4 при примерно 70 атм (в).
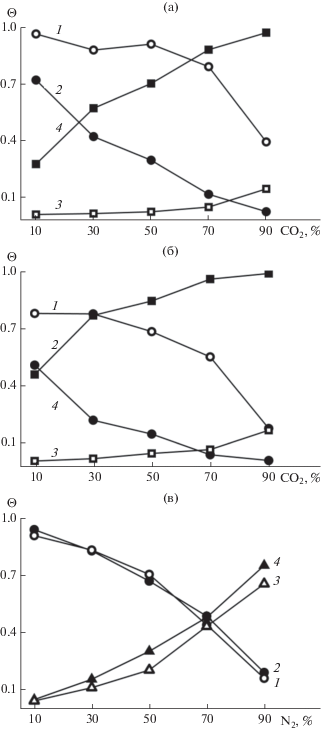
Для гидратов CO2/N2 аналогичное полученному в моделировании распределение молекул по различным полостям наблюдалось экспериментально [15]. Как показано в [6] для гидрата CO2/CH4, отношение равновесных заполнений различных полостей (Θlarge/Θsmall) для метана изменяется от 1.26 (чистый CH4) до 0.23 (очень низкое содержание CH4), что сравнимо со значениями, полученными в настоящей работе (0.7 для 90% CH4 и 0.1 для 10% CH4).
Результаты моделирования смешанного гидрата N2/CH4 (рис. 6в) показывают, что все полости заняты в основном метаном, за исключением смесей с наиболее высоким содержанием азота (70% или более). Различия в заполнении больших и малых полостей обоими компонентами не наблюдается.
Следует отметить, что предельные значения общего заполнения гидратов CO2/CH4 и N2/CH4 очень близки, но поведение парциальных емкостей принципиально различается.
ВЫВОДЫ
Моделирование методом Монте-Карло в большом каноническом ансамбле проведено с целью сравнения заполнения гидратного каркаса структуры I тремя бинарными газовыми смесями, CO2/CH4, CO2/N2 и N2/CH4, при 270 K и значениях давления до 70 атм.
Смешанные гидраты CO2/CH4 и CO2/N2 селективны к углекислому газу, причем коэффициенты селективности ${{S}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}$ в случае смеси CO2/N2 почти в два раза выше. Углекислый газ в смешанных гидратах занимает преимущественно большие полости и только незначительную часть малых полостей (Θsmall < 0.1). Азот и метан не демонстрируют предпочтения относительно размера полостей и с равной вероятностью могут быть обнаружены как в малых, так и в больших полостях. Гидрат N2/CH4 оказывается селективен к метану.
Анализ результатов моделирования позволяет сделать вывод о малой вероятности полного замещения метана только внедрением чистого углекислого газа, поскольку заполнение малых полостей молекулами CO2 является невыгодным. Добавление смеси CO2/N2 должно приводить к лучшим результатам, так как метан в малых полостях может быть замещен азотом, если его содержание в смеси будет достаточно высоким, более чем 70%, что близко к типичному составу топочного газа.
Список литературы
Hester K.C., Brewer P.G. // Annu. Rev. Mar. Sci. 2009. V. 1. P. 303.
Koh C.A. // Chem. Soc. Rev. 2002. V. 31. P. 157.
Sloan E.D. Jr. // Nature. 2003. V. 426. P. 353.
Brewer P.C., Friederich C., Peltzer E.T., Orr F.M. Jr. // Science. 1999. V. 284. P. 943.
Ohgaki K., Takano K., Sangawa H., Matsubara T., Nakano S. // J. Chem. Eng. Jpn. 1999. V. 29. P. 478.
Lee H., Seo Y., Seo Y.-T., Moudrakovski I.L., Ripmeester J.A. // Angew. Chem. Int. Ed. 2003. V. 42. P. 5048.
Park Y., Kim D.-Y., Lee J.-W., Huh D.-G., Park K.-P., Lee J., Lee H. // PNAS. 2006. V. 103. P. 12690.
Mu L., von Solms N. // Energy Fuels. 2017. V. 31. P. 3338.
Zhou X., Liang D.-Q., Liang S., Yi L.-Z., Lin F.-H. // Energy Fuels. 2015. V. 29. P. 1099.
Boswell R., Schoderbek D., Collett T.S., Ohtsuki S., White M.D., Anderson B.J. // Energy Fuels. 2016. V. 31. P. 140.
Sum A.K., Burruss R.C., Sloan E.D. Jr. // J. Phys. Chem. B. 1997. V. 101. P. 7371.
Ratcliffe C.I., Ripmeester J.A. // J. Phys. Chem. 1986. V. 90. P. 1259.
Ripmeester J.A., Ratcliffe C.I. // Energy Fuels. 1998. V. 12. P. 197.
Udachin K.A., Ratcliffe C.I., Ripmeester J.A. // J. Phys. Chem. B. 2001. V. 105 P. 4200.
Petuya C., Damay F., Desplanche S., Talaga D., Desmedt A. // Chem. Comm. 2018. V. 54. P. 4290.
Seo Y.-T., Lee H. // J. Phys. Chem. B. 2004. V. 108. P. 530.
Cha M., Shin K., Lee H., Moudrakovski I.L., Ripmeester J.A., Seo Y. // Environ. Sci. Technol. 2015. V. 49. P. 1964.
Sun Y., Li S.-L., Zhang G.-B., Guo W., Zhu Y.-H. // Ind. Eng. Chem. Res. 2017. V. 56. P. 8133.
Lee H.-H., Ahn S.-H., Nam B.-U., Kim B.-S., Lee G.-W., Moon D., Shin H.J., Han K.W., Yoon J.-H. // Environ. Sci. Technol. 2012. V. 46. P. 4184.
Tsimpanogiannis I.N., Economou I.G. // J. Supercrit. Fluids. 2018. V. 134. P. 51.
Tsimpanogiannis I.N., Kastanidis J.C.P., El Meragawi S., Michalis V.K., Papadimitriou N.I., Karozis S.N., Diamantonis N.I., Moultos O.A., Romanos G.E., Stubos A.K., Economou I.G. // Mol. Phys. 2018. V. 116. P. 2041.
Qiu N., Bai X., Sun N., Yu X., Yang L., Li Y., Yang M., Huang Q., Du S. // J. Phys. Chem. B. 2018. V. 122. P. 9724.
Geng C.-Y., Wen H., Zhou H. // J. Phys. Chem. A. 2009. V. 113. P. 5463.
Dornan P., Alavi S., Woo T.K. // J. Chem. Phys. 2007. V. 127. P. 124510.
Bai D., Zhang X., Chen G., Wang W. // Energy Environ. Sci. 2012. V. 5. P. 7033.
Glavatskiy K.S., Vlugt T.J.H., Kjelstrup S. // J. Phys. Chem. B. 2012. V. 116. P. 3745.
Waage M.H., Trinh T.T., van Erp T.S. // J. Chem. Phys. 2018. V. 148. 214701.
Abascal J.L.F., Sanz E., Fernández García R., Vega C. // J. Chem. Phys. 2005. V. 122. 234511.
Jorgensen W.L., Maxwell D.S., Tirado-Rives J. // J. Am. Chem. Soc. 1996. V. 118. P. 11225.
Potoff J.J., Siepmann J.I. // AIChE J. 2001. V. 47. P. 1676.
Herri J.-M., Bouchemoua A., Kwaterski M., Fezoua A., Ouabbas Y., Cameirao A. // Fluid Phase Equilib. 2011. V. 301. P. 171.
Adisasmito S., Frank III R.J., Sloan Jr. E.D. // Chem. Eng. Data. 1991. V. 36. P. 68.
Jarrahian A., Nakhaee A. // Fuel. 2019. V. 237. P. 769.
Jhaveri J., Robinson D.B. // Can. J. Chem. Eng. 1965. V. 43. P. 75.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал