Коллоидный журнал, 2021, T. 83, № 3, стр. 320-329
Получение дисперсных композиций магнетит–бентонит и адсорбция на них казкаина
Г. Курмангажи 1, С. М. Тажибаева 1, *, К. Б. Мусабеков 1, И. С. Левин 2, М. С. Кузин 2, Л. Э. Ермакова 3, В. К. Ю 4
1 Казахский национальный университет им. аль-Фараби
050040 Алматы, просп. Аль-Фараби, 71, Казахстан
2 Институт нефтехимического синтеза им. А.В. Топчиева РАН
119071 Москва, Ленинский просп., 29, стр. 2, Россия
3 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
4 Институт химических наук им. А.Б. Бектурова
Алматы, ул. Валиханова, 106, Казахстан
* E-mail: tazhibayeva_s@mail.ru
Поступила в редакцию 13.02.2019
После доработки 01.10.2020
Принята к публикации 11.11.2020
Аннотация
Осаждением аммиаком из смешанного водного раствора FeCl2 и FeCl3 получены частицы магнетита, а из смешанной дисперсии магнетита и бентонита – частицы композита магнетит–бентонит. Дисперсии исследованы методами рентгенографии, просвечивающей электронной микроскопии, ИК-спектроскопии, динамического рассеяния света и электрофореза. В присутствии магнетита на дифрактограмме бентонита базальный рефлекс при 2θ = 6.06° смещается до 7.14°, что обусловлено обменом ионов K+, Na+ и Mg2+ на ионы Fe3+. Кроме того, на дифрактограмме появляются пики, соответствующие соединениям железа, а в ИК-спектре композитных частиц – полоса поглощения при 1405 см–1, отвечающая связи Fe–O, что может указывать на формирование малых частиц магнетита и между слоями бентонита. Наряду с указанными изменениями при переходе от исходного бентонита к композиту магнетит–бентонит обнаружено повышение ζ-потенциала частиц от –35.1 до –25.7 мВ и уменьшение их размера от 300 до 220 нм. Последний эффект объяснен ионным обменом, удалением воды из межпакетного пространства, а также вкладом более мелких частиц магнетита. Для проверки функциональных возможностей полученных композитных частиц изучена адсорбция на них лекарственного вещества – казкаина, и показано, что его максимальная адсорбция достигает 74.65 мг/г. По результатам анализа кинетики адсорбции казкаина при разной температуре определены термодинамические параметры процесса, и установлено, что его можно описать кинетическим уравнением псевдовторого порядка. Наиболее приемлемой для описания механизма адсорбции является модель Ленгмюра.
1. ВВЕДЕНИЕ
Магнитные сорбенты характеризуются простотой получения и возможностью управлять их движением извне с помощью магнитного поля. Они сочетают в себе высокую сорбционную способность благодаря развитой удельной поверхности и магнитные свойства, характерные для оксидов железа. Так, наночастицы магнетита, имеющие удельную поверхность порядка 100 м2/г, проявляют высокую сорбционную емкость по отношению к ионам металлов [1, 2]: максимальная адсорбция ионов металлов на поверхности Fe3O4 составляет 10–100 мг/г [1, 2]. Модификация поверхности наночастиц магнетита с помощью полимеров позволяет получить сорбенты, эффективные при сорбции красителей [3–5]. При этом максимальная адсорбция, рассчитанная по Ленгмюру, превышает 100 мг/г, а адсорбционное равновесие достигается уже через 5 мин после смешения адсорбента с раствором. Композиции на основе гидрогелей сшитого хитозана и магнетита менее эффективны при адсорбции ионов металлов – время достижения адсорбционного равновесия увеличивается до 30 мин [6], что может быть обусловлено уменьшением доступности магнетита в сетке хитозана.
Наиболее широко магнетит как адсорбент используется в композициях с другими соединениями и минералами. Созданы так называемые гибридные материалы на основе магнетита, полимеров и глинистых минералов, которые прошли успешную апробацию в процессах извлечения ионов металлов и красителей из растворов [7, 8]. Вместе с тем, наночастицы Fe3O4 и сами могут служить в качестве модификаторов поверхности дисперсных частиц [9, 10]. Для нанесения наночастиц магнетита на поверхность твердых носителей используют способы ультразвуковой и термической обработки [11].
Эффективным путем получения магнитных сорбентов является включение магнетита в структуру глин. Удобство использования в качестве носителей глинистых минералов связано с их пористостью и слоистым строением, что позволяет иммобилизовать или даже синтезировать в них частицы магнетита. Немаловажное значение имеют также доступность и низкая стоимость глин. Опыт показывает [12–15], что монтмориллонитовые глины, модифицированные оксидом железа, являются высокоэффективными адсорбентами ионов металлов и красителей. Необходимо отметить, что магнитные композиты на основе глин, в отличие от индивидуального магнетита, сохраняют лиофильность, а это, в свою очередь, обусловливает устойчивость их суспензий.
Таким образом, создание композитов на основе магнетита и глинистых минералов может способствовать созданию эффективных адсорбентов различных соединений и расширению сферы их применения, в частности, в медицине. Кроме того, до сих пор не выявлен механизм взаимодействия магнетита и слоистых силикатов. Поэтому целью работы является получение композитных частиц магнетит–бентонит, их анализ различными физическими методами и изучение адсорбции на них лекарственного вещества казкаина.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Объекты исследования
Магнетит получали методом осаждения аммиаком из смешанного водного раствора FeCl2 и FeCl3 [16]. Использовали растворы солей с концентрацией 1.0 моль/л в стехиометрическом соотношении 1 : 2. С помощью 15%-ного раствора аммиака pH смеси доводили до 9.3–9.5. Синтез проводили в атмосфере азота при температуре 333 К.
В качестве носителя магнетита использовали бентонитовую глину Таганского месторождения (Казахстан). Глину отделяли от примесей, промывали дистиллированной водой, затем сушили при температуре 383 К в течение 2 ч и измельчали.
Для получения композитов магнетит–бентонит готовили 200 мл 6%-ной водной суспензии бентонита. В суспензию добавляли при перемешивании в атмосфере азота 20 мл раствора FeCl3 с концентрацией 1.0 моль/л и смесь выдерживали в течение 60 мин. Затем при перемешивании добавляли 10 мл раствора FeCl2 с концентрацией 1.0 моль/л, с помощью раствора NH4OH доводили pH смеси до 9.3–9.5 и, перемешивая, выдерживали 30 мин при 333 К. Полученный композит отделяли центрифугированием, дважды промывали дистиллированной водой, а затем этанолом и сушили при температуре 313 К.
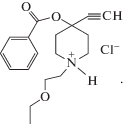
Казкаин – производное пиперидина с местноанестезирующей и антиаритмической активностью [17]. Его химическое название – гидрохлорид 1-(2-этоксиэтил)-4-этинил-бензоилоксипиперидина; химическая формула приведена ниже.
Казкаин может быть введен в организм как перорально, так и путем инъекции. И в том и в другом случае для пролонгированного действия лекарства необходимо постепенное его поступление в кровяное русло. Это означает, что весьма перспективно использование твердых биосовместимых носителей, с которыми казкаин связан адсорбционными силами, тогда взаимодействие с биологическими жидкостями организма будет способствовать его постепенному выделению. Мы не говорим сейчас о доставке лекарства на магнитном носителе в зону больного органа путем воздействия внешним магнитным полем, хотя такая возможность тоже не исключается.
2.2. Методы исследования
Рентгеновские дифрактограммы магнетита, бентонита и их композитов получены на установке Rotaflex-RC (Rigaku, Япония), оснащенной вращающимся медным анодом (режим работы источника: 30 кВ, 100 мА, длина волны характеристического CuKα-излучения λ = 1.542 Å), горизонтальным гониометром D-MAX/B и сцинтилляционным детектором.
Размеры частиц магнетита, бентонита и композитов определены методом динамического рассеяния света (ДРС) на приборе Zetasizer ZS (Malvern Panalytical, Великобритания). С помощью этого же прибора определяли электрокинетический потенциал и знак заряда частиц. Ошибки измерений размера и ζ-потенциала частиц составляют ±2% и ±0.12 (мкм см)/(В с–1) соответственно.
Изображения образцов композицита бентонит–магнетит получены в просвечивающем электронном микроскопе (ПЭМ) LEO 912 AG Оmega (Karl Ceiss, Германия).
ИК-cпeктpы обpaзцов магнетита, бентонита и композита магнетит–бентонит регистрировали нa ИК-фуpьe-cпeктpoмeтpe Nicolet Avatar 370-CsI (Thermo Electron Corp., США) в тaблeткax c KBr. Измерения проводили в диапазоне 400–4000 см–1.
Опыты по адсорбции казкаина на бентоните и композите магнетит–бентонит проводили следующим образом. Сначала готовили раствор казкаина с концентрацией 1.0 × 10–2 моль/л, затем разбавляли этот раствор до концентрации 1.0 × × 10–3 моль/л с шагом (0.1–0.2) × 10–3 моль/л, получая рабочие растворы объемом 20 мл каждый. В эти растворы вводили по 1 г частиц адсорбента, полученные смеси перемешивали и оставляли на 120 мин при температуре 298 К. Затем надосадочную жидкость отделяли от адсорбента, фильтровали и анализировали на содержание казкаина.
Адсорбцию казкаина рассчитывали по формуле A = (C1 – C2)V/m, где C1 и C2 – исходная и конечная концентрации казкаина (мг/л), V – объем раствора (л), m – масса адсорбента (г). Концентрацию казкаина находили по зависимости оптической плотности его растворов от концентрации при длине волны 290 нм. Оптическую плотность растворов измеряли на спектрофотометре UV-3600 (Shimadzu, Япония).
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
3.1. Характеристики композитов магнетит–бентонит
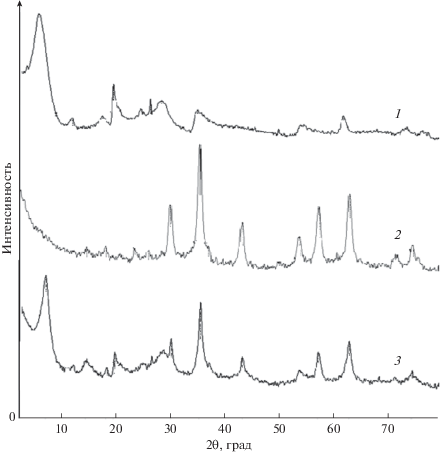
На рис. 1 приведены рентгеновские дифрактограммы бентонита, магнетита и смеси магнетит–бентонит. На дифрактограмме исходного бентонита присутствуют пики при значениях угла 2θ = = 6.06°, 19.78°, 26.57°, 35.18° и 61.98°. Среди них наиболее выражены пики при углах дифракции 6.06° и 19.78°, причем первый является базальным рефлексом, характеризующим расстояние между слоями глины, которое оказалось равным 14.57 Å [8].
На дифрактограмме синтезированного магнетита обнаружены пики при значениях 2θ, равных 30.09°, 35.47°, 43.37°, 53.80°, 57.60°, 62.60° и 74.22°. Аналогичные результаты были получены авторами работ [1, 12] и они отнесены к кристаллической структуре Fe3O4.
В случае композиций магнетит–бентонит происходит снижение интенсивности и некоторое изменение углового положения пиков, характерных для силикатов, и проявляются пики, свойственные магнетиту. Поскольку они полностью совпадают с таковыми для иходного магнетита, можно констатировать отсутствие специфического взаимодействия, например формирования магнетитом и глиной смешанных структур. Сдвиг базального рефлекса глины в сторону бóльших углов (от 6.06° до 7.14°) свидетельствует об уменьшении межпакетного расстояния до 12.37 Å. Это может быть обусловлено заменой катионов K+, Na+ и Mg2+, стабилизирующих слоевую структуру бентонита, на менее объемные ионы Fe3+ при контакте бентонита с раствором FeCl3. Согласно [18], радиусы ионов K+, Na+, Mg2+ и Fe3+ равны 1.33, 0.98, 0.74 и 0.67 Å соответственно.
Уменьшение межслоевого пространства монтмориллонита при синтезе в его суспензиях магнетита было обнаружено также в работе [14]. Авторы высказали предположение, что обменные катионы замещаются ионами Н+, хотя никаких серьезных доказательств в пользу такого объяснения не привели. Таким образом, можно полагать, что в смеси магнетит–бентонит происходит частичная интеркаляция свободных ионов Fe3+ в межслоевые пространства глины, и, следовательно, есть вероятность образования в них молекул и/или кластеров Fe3O4. Одновременно не исключена адсорбция частиц магнетита на поверхности частиц глины.
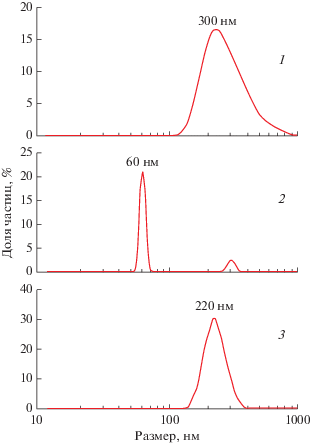
Эти процессы должны влиять на размер частиц дисперсной системы. Как следует из кривых распределения частиц по размерам (рис. 2), полученных методом ДРС, наиболее вероятный размер частиц бентонита составляет 300 нм, композитных частиц магнетит–бентонит – примерно 220 нм, частиц магнетита – около 60 нм (оксид Fe3O4 склонен к агрегации, поэтому на кривых распределения заметен и пик малой интенсивности при 300 нм, который может быть отнесен к агрегатам).
Рис. 2.
Кривые распределения по размерам частиц бентонита (1), магнетита (2) и композита магнетит–бентонит (3) в их дисперсиях.
Эффект агрегации наночастиц магнетита был изучен подробнее. Прежде всего, была исследована эволюция размеров наночастиц во времени. Приготовление образца и первое ДРС-измерение занимают примерно 5 мин, повторные измерения проводили с интервалом 2 мин. На рис. 3 приведены соответствующие экспериментальные данные об изменении интенсивности рассеяния и положения главных пиков.
Рис. 3.
Распределение по размерам частиц магнетита в водной дисперсии спустя 5 (1), 7 (2), 9 (3) и 11 мин (4) после приготовления образца.
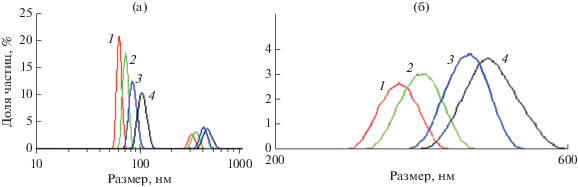
Как следует из этих данных, частицы магнетита постепенно агрегируют, в результате чего снижается интенсивность пика рассеяния в области малых размеров и он сдвигается вправо (рис. 3а). В то же время пик в области больших размеров становится интенсивнее и уширяется, также сдвигаясь вправо (рис. 3б). Учитывая это обстоятельство, можно считать, что размер частиц магнетита, равный примерно 60 нм, наиболее правдоподобен в качестве начального.
На первый взгляд кажется удивительным то, что размер частиц композита, состоящего из двух компонентов, оказался меньше размера частиц носителя – бентонита. Однако следует учитывать следующие обстоятельства: частичную интеркаляцию в межслоевое пространство бентонита меньших, чем ионы Na+, ионов Fe3+, присутствие в системе свободных (не адсорбировавшихся на бентоните) более мелких частиц магнетита, а также перераспределение воды в процессе ионного обмена в структуре бентонита [14]. Эти эффекты могут, по-видимому, вызвать уменьшение размера композитных частиц по сравнению с исходными частицами глины.
С другой стороны, наличие отрицательно заряженных групп ≡SiO– на поверхности элементарных пластин глины может способствовать изменению электростатического взаимодействия и уменьшению взаимного отталкивания силикатных групп в бентоните при изменении состава положительно заряженных ионов вследствие ионного обмена. Доказательством такого изменения могут служить данные по измерению электрокинетического потенциала композитных частиц по сравнению с частицами бентонита (табл. 1). Если ζ-потенциал частиц исходного бентонита равен –35.1 мВ, то в присутствии магнетита его значение повышается до –25.7 мВ.
Таблица 1.
Характеристики исследованных дисперсий по данным ДРС
| Система | Размер частиц, нм | ζ-потенциал, мВ |
|---|---|---|
| Бентонит | 300 | –35.1 |
| Магнетит | 60 | +18.9 |
| Магнетит–бентонит | 220 | –25.7 |
На рис. 4а приведено ПЭМ-изображение системы магнетит–бентонит. Видно, что в большинстве своем наночастицы магнетита (светящиеся точки) связаны с частицами (агрегатами) глины. При этом, согласно данным электронографии (рис. 4б), наночастицы являются кристаллическими и имеют кубическую сингонию.
Анализ ПЭМ-изображений, в том числе полученных при большем увеличении, позволил сделать вывод, что “связанные” наночастицы магнетита присутствуют как внутри частиц бентонита, так и на их поверхности. Очевидно, это результат двух процессов – восстановления ионов Fe в межслоевом пространстве глины и в дисперсионной среде (с последующей гетерокоагуляцией образовавшихся наночастиц магнетита и частиц бентонита). В целом, полученные данные можно трактовать как иммобилизацию частиц магнетита в/на частицах бентонита, т.е. как формирование композита.
Для анализа механизма взаимодействия магнетита и бентонита проведено ИК-спектроскопическое исследование исходных компонентов и композита (рис. 5). В ИК-спектре 1 исходного бентонита обнаружены пики, характерные для силикатных групп. Так, полосы поглощения при 1639 и 3433 см–1 соответствуют деформационным колебаниям групп О–Н молекул адсорбированной воды и SiOH-групп минерала. При 1039 см–1 проявляются деформационные колебания связей Si–O–Si [19]. Малоинтенсивные пики при 698 и 630 см–1 могут быть отнесены к связям Si–O и Al–O [8], а при 524 и 469 см–1 – к связям Al–O–Si [3].
Рис. 5.
ИК-спектры бентонита (1), композита магнетит–бентонит (2) и системы магнетит–бентонит–казкаин (3).
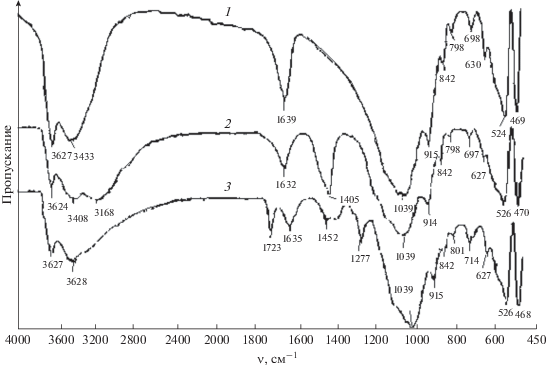
В ИК-спектре 2 композита магнетит–бентонит изменяются интенсивность и положение указанных пиков и, наряду с этим, наблюдаются новые пики при 1632 и 1405 см–1. Появление пика при 1632 см–1 можно рассматривать как результат смещения пика при 1639 см–1, соответствующего молекулам адсорбированной на бентоните воды [1, 20]. Снижение его интенсивности подтверждает предположение о потере молекул воды из межслоевого пространства глины при переходе от бентонита к его композиту с магнетитом. В области 400–1400 см–1 проявляются деформационные и валентные колебания связи Fe–O [8, 14, 15, 20, 21]. По всей вероятности, заметный пик при 1405 см–1 также может быть отнесен к деформационным колебаниям связи Fe–O.
3.2. Адсорбция казкаина на композитe магнетит–бентонит
Обсудим сначала изменения в ИК-спектре композита магнетит–бентонит после адсорбции казкаина. Очевидно, что происходит заметное сужение и смещение пиков в области 3600–3100 см–1, соответствующих образованию Н-связей (рис. 5, спектр 3). Однако наиболее значительные изменения наблюдаются в диапазоне 1800–1000 см–1. Полоса поглощения, характерная для адсорбированной воды, смещается от 1632 до 1635 см–1, и хотя интенсивность ее неизменна, ширина заметно уменьшается. Кроме того, появляются новые пики при 1723, 1452 и 1277 см–1. Полоса при 1723 см–1 относится к поглощению сложноэфирного карбонила (С=О), при 1277 см–1 – к валентным колебаниям простой эфирной связи (С–О–С) этоксиэтильного радикала [16], а при 1452 см–1 – к деформационным колебаниям фрагмента NH+ казкаина [19]. Примечательно также, что возрастает интенсивность пика при 1039 см–1, характеризующего связи Si–O–Si. Полоса поглощения при 1405 см–1, резко изменяет форму, трансформируясь в широкую полосу с двумя слабовыраженными максимумами при 1452 и 1380 см–1. В то же время ИК-спектр системы магнетит–бентонит–казкаин в интервале 1000–450 см–1 остается почти неизменным. Изменения в средней части ИК-спектра могут быть свидетельством адсорбции казкаина на композите магнетит–бентонит. Основным механизмом взаимодействия казкаина с поверхностью композита может быть электростатическое притяжение между аминогруппой лекарственного вещества и отрицательно заряженными силикатными группами глины.
3.3. Изотермы адсорбции казкаина и их анализ
Изотермы адсорбции казкаина на бентоните и на композите магнетит–бентонит сильно различаются (рис. 6). Если кривая адсорбции лекарственного вещества на бентоните начинается с резкого подъема уже при самых низких концентрациях, то адсорбция на композите при малых концентрациях незначительна, и сама кривая имеет S-образную форму. Очевидно, наличие большого количества свободных групп ≡Si–O– в бентоните способствует его электростатическому взаимодействию с аминогруппами казкаина. В то же время наличие на кривой адсорбции казкаина на композите магнетит–бентонит начального участка, почти параллельного оси концентрации, может свидетельствовать о том, что в силу нейтрализации заряда части групп ≡Si–O– частицами магнетита молекулы казкаина могут связываться только с оставшимися свободными силикатными группами минерала.
Рис. 6.
Изотермы адсорбции казкаина на поверхности бентонита (1) и композита магнетит–бентонит (2) при T = 298 К.
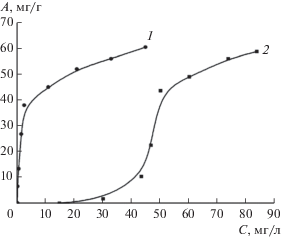
Не исключено, что адсорбция осуществляется преимущественно путем взаимодействия молекул казкаина с уже адсорбированными его молекулами. В таком случае процесс адсорбции может протекать в 2 стадии. На первой стадии молекулы казкаина взаимодействуют с поверхностью композита вследствие электростатического притяжения к свободным, не блокированным магнетитом отрицательно заряженным функциональным группам бентонита. На второй стадии они связываются с адсорбированными ранее молекулами за счет гидрофобных взаимодействий.
Однако значения максимальной адсорбции (A∞), полученные путем линеаризации изотерм адсорбции по Ленгмюру, близки для бентонита и его композита с магнетитом и равны 80.65 и 74.65 мг/г соответственно (табл. 2). Что касается константы адсорбции, то в случае бентонита ее значение (0.0590 л/мг) почти в 2 раза больше, чем для композита (0.0314 л/мг). В итоге, хотя значения максимальной адсорбции казкаина на бентоните и композите магнетит–бентонит и близки, адсорбционное сродство гораздо выше в случае бентонита.
Таблица 2.
Параметры адсорбции казкаина на поверхности бентонита и композита магнетит–бентонит, рассчитанные по моделям Ленгмюра и Фрейндлиха
| Адсорбент | Модель Ленгмюра | Модель Фрейндлиха | ||||
|---|---|---|---|---|---|---|
| A∞, мг/г | K, л/мг | R2 | K, мг/г | 1/n | R2 | |
| Бентонит | 80.65 | 0.0590 | 0.934 | 1.63 | 0.58 | 0.860 |
| Композит магнетит–бентонит | 74.65 | 0.0314 | 0.995 | 5.25 | 0.49 | 0.866 |
Обработка адсорбционных данных по уравнению Фрейндлиха
Сравнение двух моделей адсорбции показывает, что модель Ленгмюра более предпочтительна для описания адсорбции казкаина на бентоните и его композите с магнетитом. Приближение значений среднеквадратичной регрессии R 2 к 1.0 в случае модели Ленгмюра также свидетельствует об этом. Однако следует отметить, что в модели Ленгмюра адсорбция должна быть мономолекулярной, а взаимодействия между адсорбированными молекулами отсутствуют. В то же время в случае адсорбции на композите нельзя исключать, как уже было сказано выше, возможность взаимодействий между молекулами адсорбата. Из этого следует, что обе модели, Ленгмюра и Фрейндлиха, с определенными допущениями могут быть использованы для описания адсорбции казкаина на бентоните и композите магнетит–бентонит. Однако данные обработки результатов по Ленгмюру лучше согласуются с результатами эксперимента и поэтому более приемлемы.
3.4. Кинетика адсорбции казкаина
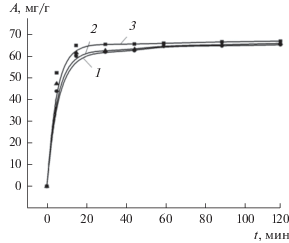
Кинетические кривые адсорбции казкаина на композите магнетит−бентонит при разных значениях температуры представлены на рис. 7. Видно, что температура очень слабо влияет на количество адсорбированного вещества, и при времени 15–20 мин изотермы выходят на плато, что свидетельствует о высокой скорости процесса. Кинетика адсорбции рассмотрена в рамках моделей процессов псевдопервого и псевдовторого порядков.
Рис. 7.
Кинетические кривые адсорбции казкаина на композите магнетит–бентонит при температуре 298 (1), 303 (2) и 310 К (3).
Для описания процесса псевдопервого порядка используют выражение [23]
В случае использования кинетического уравнения псевдовторого порядка справедливо выражение
Кинетические параметры адсорбции казкаина на бентоните и композите магнетит–бентонит приведены в табл. 3. Сравнение результатов расчета с использованием кинетических моделей псевдопервого и псевдовторого порядка показывает, что последняя дает значения адсорбции, близкие к данным адсорбции по Ленгмюру (табл. 2) и к экспериментальным данным. Как следует из рис. 7, равновесные значения адсорбции близки к 65.0 мг/г. Можно предположить, что величина адсорбции зависит как от количества функциональных групп на поверхности адсорбента, обеспечивающих электростатическое притяжение положительно заряженного казкаина, так и от концентрации адсорбата.
Таблица 3.
Кинетические параметры адсорбции казкаина на бентоните и композите магнетит–бентонит
| Система | Модель кинетики псевдопервого порядка | Модель кинетики псевдовторого порядка |
||||
|---|---|---|---|---|---|---|
| Ae, мг г–1 | k1,мин–1 | R2 | Ae, мг г–1 | k2, г мг–1 мин–1 | R2 | |
| Бентонит | 34.8 | 0.0067 | 0.878 | 97.1 | 0.0019 | 0.998 |
| Композит магнетит–бентонит | 25.7 | 0.0064 | 0.857 | 77.0 | 0.0024 | 0.995 |
Следует отметить, что кинетические параметры адсорбции казкаина (табл. 3) близки к значениям, полученным при адсорбции красителя метиленового голубого на поверхности композитов магнетита и хитозана [3] и монтмориллонита, модифицированного магнетитом [15]. Сходство казкаина и метиленового голубого состоит в том, что их молекулы имеют положительный заряд на атоме азота аминогрупп.
3.5 Термодинамика адсорбции казкаина
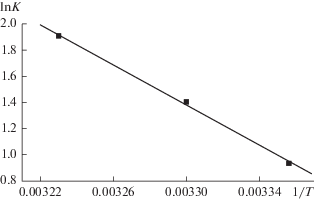
Исходя из зависимости lnK от обратной температуры (рис. 8) определены значения термодинамических параметров адсорбции – энтальпии (‒∆H°), энтропии (∆S°) и изменения энергии Гиббса (∆G°) – с использованием следующих выражений:
Результаты расчетов приведены в табл. 4. Отрицательный знак изменения энергии Гиббса свидетельствует о самопроизвольности процесса адсорбции казкаина на композите магнетит–бентонит, а положительный знак ∆H° указывает на эндотермичность этого процесса. Такие изменения энтальпии характерны для силикатных адсорбентов [23]. Согласно данным табл. 4, в температурном интервале 298–310 К выполняется условие |∆H°| < |T∆S°|. Это означает, что в процессе адсорбции определяющим является изменение энтропии, а не энтальпии.
Таблица 4.
Термодинамические параметры адсорбции казкаина на композите магнетит–бентонит
| ∆Н°, кДж/моль | ∆S°, Дж/моль | ∆G°, кДж/моль | ||
|---|---|---|---|---|
| 298 К | 303 К | 310 К | ||
| 44.67 | 58.59 | –17.46 | –17.75 | –18.16 |
Таким образом, методом осаждения из смешанного водного раствора хлоридов Fe(II) и Fe(III) аммиаком получены частицы магнетита и композита магнетит–бентонит. На основании данныx рентгенографии, ПЭМ и ИК-спектроскопии сделан вывод о включении магнетита в состав композита. Оно сопровождается повышением ζ-потенциала частиц глины и уменьшением их размера, по-видимому, в результате нейтрализации отрицательного заряда групп SiO– силиката частицами магнетита и замещением обменных катионов K+, Na+ и Mg2+ в межпакетных пространствах глины ионами Fe3+ меньшего размера.
Результаты расчета параметров адсорбции казкаина в рамках моделей Ленгмюра и Фрейндлиха показали, что наиболее приемлемой для описания адсорбции является модель Ленгмюра. По результатам исследования адсорбции казкаина на композите при разной температуре определены термодинамические параметры этого процесса. Показано, что кинетика адсорбции казкаина описывается уравнением псевдовторого порядка.
Список литературы
Iconaru S.L., Guédan R., Popa C.L., Motelica-Heino M., Ciobanu C.S., Predoi D. // Appl. Clay Sci. 2016. V. 134. P. 128.
Линников О.Д., Родина И.В. // Вода: химия и экология. 2016. № 2. С. 71.
Cho D.-W., Jeon B.-H., Chon C.-M., Schwartz F.W., Jeong Y., Song H. // J. Ind. Eng. Chem. 2015. V. 28. P. 60.
Mak S.-Y., Chen D.-H. // Dyes Pigments. 2004. V. 61. P. 93.
Inbaraj B.S., Chen B.H. // Bioresour. Technol. 2011. V. 102. P. 8868.
Yu Z., Zhang X., Huang Y. // Ind. Eng. Chem. Res. 2013. V. 52. P. 11956.
Larraza I., López-Gónzalez M., Corrales T., Marcelo G. // J. Colloid Interface Sci. 2012. V. 385. P. 24.
Yang S., Li J., Lu Y., Chen Y., Wang X. // Appl. Radiat. Isotop. 2009. V. 67. P. 1600.
Chen R., Zhi C., Yang H., Bando Y., Zhang Z., Suguir N., Golberg D. // J. Colloid Interface Sci. 2011. V. 359. P. 261.
Li F., Wu X., Ma S., Xu Z., Liu W., Liu F. // JWARP. 2009. V. 1. P. 35.
Zhang W.-B., Deng M., Sun H.X., Wu S.B. // Ind. Eng. Chem. Res. 2014. V. 53. P. 333.
Kalantari K., Ahmad M.B., Masoumi H.R.F., Shameli K., Basri M., Khandanlou R. // J. Taiwan Inst. Chem. Eng. 2015. V. 49. P. 192.
Peng J.-F., Song Y.-H., Yuan P., Cui X.-Y., Qiu G.-L. // J. Hazard. Mater. 2009. V. 161. P. 633.
Chang J., Ma J., Ma Q., Zhang D., Qiao N., Hu M., Ma H. // Appl. Clay Sci. 2015. V. 119. P. 132.
Cottet L., Almeida C.A.P., Naidek N., Viante M.F., Lopes M.C., Debacher N.A. // Appl. Clay Sci. 2014. V. 95. P. 25.
Du Y., Fan H., Wang L., Wang J., Wu J., Dai H. // J. Mater. Chem. A. 2013. V. 1. P. 7729.
Пралиев К.Д., Ю В.К., Тараков С.А., Босяков Ю.Г., Утепбергенова Р.К., Шин С.Н., Кадырова Д.М. Пат. 3137 РК // Б.И. 1996. № 1.
Бокий Г.Б. Кристаллохимия. М.: Наука, 1971.
Тарасевич Б.Н. ИК-спектры основных классов органических соединений / Справочные материалы. М.: МГУ, 2012. С. 11. http://www.chem.msu.su/rus/ teaching/tarasevich/Tarasevich_IR_tables_29-02-2012.pdf
Dorigon L., de Almeida de Frota J.P.R., Kreutz J.C., Giona R.M., Moises M.P., Bail A. // Appl. Surf. Sci. 2017. V. 420. P. 954.
Накамото К. Инфракрасные спектры неорганических и координационных соединений. М.: Мир, 1966.
Tavengwa N.T., Cukrowska E., Chimuka L. // Water SA. 2014. V. 40. P. 623.
Atia A.A., Donia A.M., Al-Amrani W.A. // Chem. Eng. J. 2009. V. 150. P. 55.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал