Коллоидный журнал, 2021, T. 83, № 3, стр. 330-334
Бромированный наноалмаз как платформа для закрепления изониазида
П. Г. Мингалёв 1, *, А. С. Сурмилло 1, Г. В. Лисичкин 1
1 Химический факультет Московского государственного университета
им. М.В. Ломоносова
119991 Москва, Воробьевы горы, 1, стр. 3, Россия
* E-mail: uuk2@mail.ru
Поступила в редакцию 16.11.2020
После доработки 10.12.2020
Принята к публикации 17.12.2020
Аннотация
Статья посвящена исследованию синтеза бромированного наноалмаза и его реакционной способности по отношению к N-нуклеофилам (противотуберкулезному препарату изониазиду и 2,4-динитрофенилгидразину). Показано, что бромированная поверхность наноалмаза может быть легко получена из гидрированной путем обработки бромом при нагревании и освещении видимым светом. В результате работы получен конъюгат наноалмаза с изониазидом как потенциальное средство для лечения туберкулеза.
ВВЕДЕНИЕ
В настоящее время углеродные наноматериалы привлекают большое внимание исследователей. Одним из таких материалов является детонационный наноалмаз (ДНА), получаемый при детонации взрывчатых веществ с отрицательным кислородным балансом в неокислительной среде. ДНА находит применение в гальванике, гетерогенном катализе, производстве различных полимеров, в оптоэлектронике, финишном полировании. Однако все чаще внимание исследователей привлекают биологические свойства ДНА [1]. Будучи нетоксичным, ДНА отличается своей превосходной биосовместимостью. Поэтому ДНА представляет интерес как платформа для доставки лекарственных средств в организм, поскольку размер частиц ДНА позволяет им проникать сквозь мембрану клетки [2].
Поверхность частиц исходного ДНА включает большой набор функциональных групп, что препятствует проведению селективного химического модифицирования. Для устранения этого недостатка предложено либо окислять поверхность (с образованием карбоксильного покрова) [3], либо восстанавливать ее (с образованием гидридных групп) [4]. Однако гидрированная поверхность алмаза химически инертна, что затрудняет проведение реакций химического модифицирования. Для проведения таких реакций требуется активация поверхности, и наиболее часто для этого применяют галогенирование.
Опубликованы методики фторирования поверхности ДНА [5, 6]. Фторированная поверхность ДНА способна реагировать с различными нуклеофилами (например, аминами [7]). Однако реакционная способность фторированного наноалмаза не слишком велика, поэтому для прививки различных нуклеофильных агентов к его поверхности предпочитают использовать хлорированные образцы. Синтез их хорошо отработан, а получаемая поверхность способна реагировать с большим количеством нуклеофилов. В то же время методики хлорирования ДНА осложнены необходимостью работы с газообразным хлором или парами хлорсодержащих соединений (например, четыреххлористого углерода [8]), а реакционная способность поверхности в ряде случаев оказывается все-таки недостаточной.
Как известно, активность галогеналканов в реакции нуклеофильного замещения обычно возрастает с увеличением атомной массы галогена. Этот эффект наблюдается и для поверхности ДНА – фторированная поверхность менее реакционноспособна, чем хлорированная. Соответственно, можно было бы ожидать, что бромированный ДНА будет еще более активным, чем хлорированный. С другой стороны, его синтез не связан с необходимостью применения газообразных реагентов, что упрощает аппаратурное оформление процесса. Бромированию ДНА посвящены лишь единичные работы, а активность полученной поверхности по отношению к нуклеофилам не исследована вовсе. Так, в работе [9] осуществлено бромирование алмазного микропорошка молекулярным бромом при нагревании до 50°C в течение 8 ч. В работе [10] проведено частичное бромирование гидроксилированной поверхности наночастиц алмаза с помощью N-бромсукцинимида в качестве мягкого бромирующего агента. Согласно литературным данным, из-за стерических затруднений полное бромирование гидрированной поверхности алмаза невозможно [11]. Также отмечается высокая чувствительность бромированного наноалмаза к гидролизу [12].
Целью настоящей работы была отработка методики жидкофазного бромирования ДНА и исследование реакционной способности ДНА-Br по отношению к различным нуклеофилам. Последнюю оценивали по прививке 2,4-динитрофенилгидразина (DNPhH) и гидразида изоникотиновой кислоты (изониазида, isoniazid). Изониазид является противотуберкулезным препаратом I ряда, обладает высокой активностью, но и чрезвычайной токсичностью [13]. Поэтому его направленная доставка в легкие с использованием частиц ДНА как платформы для закрепления могла бы способствовать уменьшению побочного воздействия на организм [14].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Содержание галогенов и азота в исследованных образцах наноалмаза определяли на автоматическом анализаторе vario Micro cube (Elementar, Германия). ИК-спектры образцов регистрировали в таблетках бромида калия на спектрометре с фурье-преобразованием Nicolet IR 200 (Thermo Scientific, США).
Для получения бромированной поверхности навеску восстановленного ДНА кипятили 4 часа в броме при постоянном перемешивании и облучении двумя лампами накаливания мощностью 200 Вт каждая. Далее полученный продукт промывали гексаном и сушили под вакуумом. Все стадии синтеза осуществлялись без доступа воды.
Для прививки 2,4-динитрофенилгидразина навеску бромированного ДНА кипятили 48 часов с раствором этого нуклеофила в сухом ацетонитриле в присутствии эквимолярного количества сухого диизопропилэтиламина. Полученный продукт отмывали ацетонитрилом (для навески в 0.5 г – 15 раз по 15 миллилитров) и сушили на воздухе. Прививку изониазида к бромированной поверхности частиц ДНА и прививку обоих нуклеофилов к хлорированному поверхности его частиц проводили аналогично. Хлорированный ДНА получали по методике [6]. Помимо этого, изониазид прививали к поверхности галогенированных носителей в трет-бутаноле, в качестве основания вместо диизопропилэтиламина использовали трет-бутилат натрия. Реакцию в этом случае также вели на протяжении 48 ч при кипячении, первые три промывки осуществляли трет-бутанолом, а затем ацетонитрилом.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Были приготовлены образцы галогенированных частиц ДНА, на поверхность которых производили прививку N-нуклеофилов. Бромирование ДНА предположительно происходило по радикальному механизму по следующей схеме:
В общем виде реакцию можно представить в виде:
Возможно присоединение двух атомов брома к одному атому углерода, однако из-за стерических затруднений это маловероятно. В присутствии кислот Льюиса бромирование может осуществляться по ионному механизму, однако в условиях нашего эксперимента реализация этого механизма практически невозможна. Полученный образец по результатам элементного анализа содержал 7.8 мас. % брома, что при удельной поверхности ДНА, равной 260 м2/г, соответствует плотности прививки 2.3 атом/нм2. Содержание в ДНА Cl, Br и N после модификации и соответствующие расчетные данные о плотности прививки приведены в табл. 1.
Таблица 1.
Содержание азота и галогенов в образцах наноалмаза (ND) с предварительно галогенированной поверхностью. Плотность прививки рассчитана исходя из значения удельной поверхности ДНА, равного 260 м2/г
| Образец | Содержание элемента, мас. % | Плотность прививки | ||
|---|---|---|---|---|
| Cl | Br | N | ||
| ND–Cl | 5.4 | – | 2.4 | 3.7 атом/нм2 |
| ND–Br | – | 7.8 | 2.3 | 2.3 атом/нм2 |
| ND–Cl–DNPhH | 1.7 | – | 3.1 | 0.5 молекула/нм2 |
| ND–Br–DNPhH | – | 0 | 3.1 | 0.5 молекула/нм2 |
| ND–Cl–isoniazid | <0.2 | – | 2.5 | <0.1 молекула/нм2 |
| ND–Br–isoniazid | – | <0.2 | 3.1 | 0.5 молекула/нм2 |
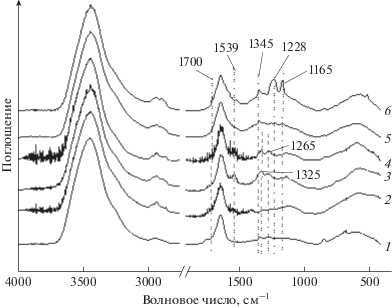
В ИК-спектрах галогенированных образцов традиционно не проявляются связи C–Br и C–Cl, о чем свидетельствует отсутствие характеристичных колебаний в области 500–800 см–1 (рис. 1, спектры 1, 2).
Рис. 1.
ИК-спектры модифицированных образцов ДНА. Нумерация спектров соответствует порядку образцов в табл. 1.
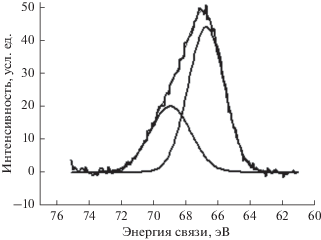
Для выяснения природы связывания брома с поверхностью алмаза был снят рентгеновский фотоэлектронный спектр. На рис. 2 представлено разложение спектра высокого разрешения Br 3d на компоненты с энергиями связи 68.9 и 66.7 эВ и относительными интенсивностями 64 и 122, которые приписаны соответственно брому, ковалентно связанному с углеродом, и бромид-иону.
Таким образом, показано, что жидкофазное бромирование ДНА аппаратурно проще, чем его хлорирование, и не требует ни дополнительной стадии получения хлора, ни специальных предосторожностей при хранении синтезированного материала. Можно поэтому сказать, что частицы бромированного ДНА являются перспективной платформой для закрепления лекарственных веществ.
Как известно, стандартным методом, позволяющим установить содержание того или иного элемента в образце, является элементный анализ. Однако в случае углеродных материалов определять полноту их модификации по содержанию углерода в образце не представляется возможным. В то же время одним из наиболее широко применяемых в органическом синтезе классов нуклеофилов являются соединения азота. Поэтому для исследования реакционной способности бромированного ДНА логично было бы использовать N-нуклеофил, содержащий в составе молекулы большое количество атомов азота. В качестве такого реагента нами был выбран DNPhH.
Было обнаружено, что DNPhH успешно прививается на бромированную поверхность ДНА, плотность прививки по данным элементного анализа составляет 0.5 молекула/нм2. ИК-спектр этого образца приведен на рис. 1 (кривая 4). В ИК-спектре хорошо видны полосы поглощения динитрофенилгидразильной группы при 1265, 1325 и 1539 см–1, которые смещены относительно соответствующих полос в спектре нативного DNPhH (максимумы при 1222, 1336 и 1557 см–1). Реакция DNPhH с хлорированной поверхностью ДНА приводит практически к тем же результатам. В ИК-спектре DNPhH, привитого на такую поверхность, присутствуют аналогичные полосы поглощения (рис. 1, кривая 3).
Как было отмечено во введении, ДНА является удобным носителем для создания лекарственных форм пролонгированного действия. Большой интерес такие формы представляют при лечении туберкулеза. В то же время один из наиболее широко применяемых противотуберкулезных препаратов, гидразид никотиновой кислоты (изониазид, тубазид), содержит в составе молекулы 3 атома азота, вследствие чего является удобным объектом для прививки на поверхность наночастиц алмаза. Эксперименты по прививке изониазида из ацетонитрила в присутствии диизопропилэтиламина, однако, не увенчались успехом. Это можно объяснить двумя причинами. Во-первых, изониазид очень плохо растворим в апротонных растворителях; использование же протонных растворителей (воды, спирта) нежелательно, поскольку галогенированный наноалмаз может с ними взаимодействовать. Во-вторых, можно предположить, что активным в нуклеофильном замещении является N-анион. Образование такого аниона в случае изониазида менее вероятно, чем в случае DNPhG, поскольку его стабилизация должна достигаться одной только карбонильной группой, а не ароматическим кольцом с двумя нитрогруппами, как в случае с DNPhG. Сопряжения с пиридильной группой в данном случае нет, и возможна только индуктивная стабилизация аниона пиридиновым кольцом. Это подтверждается тем фактом, что 2,4-динитрофенол является более сильной кислотой, чем даже протонированная по пиридиновому азоту никотиновая кислота (сравнение с чистой никотиновой кислотой невозможно, поскольку она существует в цвиттер-ионной форме).
По этой причине иммобилизация изониазида на поверхности ДНА была проведена в присутствии трет-бутилата натрия, который является несравнимо более сильным основанием, чем диизопропилэтиламин, и равновесная концентрация N-аниона в этом случае должна быть существенно выше. В то же время трет-бутанол, служащий растворителем, по стерическим причинам обладает весьма слабыми нуклеофильными свойствами. В результате этого эксперимента было обнаружено, что изониазид прививается на бромированную поверхность наночастиц алмаза и плотность прививки составляет 0.5 молекула/нм2, тогда как прививка изониазида на хлорированную поверхность наночастиц алмаза очень мала (табл. 1).
ИК-спектр образца бромированного ДНА с привитым изониазидом приведен на рис. 1 (кривая 6). На нем хорошо видны полосы поглощения при 1165, 1228 и 1345 см–1, соответствующие колебаниям связей в молекуле изониазида. Отметим, что ИК-спектр нативной молекулы изониазида в этой области спектра имеет максимумы поглощения при 1147, 1226 и 1333 см–1. Данные элементного анализа изониазида, привитого на хлорированную поверхность ДНА, не позволяют утверждать, что в этом случае прививка действительно произошла (изменение содержания азота находится в пределах ошибки измерения), однако в ИК-спектре этого образца видны слабые полосы поглощения изониазида (рис. 1, кривая 5), что позволяет оценить плотность прививки как не превышающую 0.1 молекула/нм2.
На основании проведенных экспериментов можно сделать вывод о том, что бромирование гидрированного ДНА по радикальному механизму проходит вполне успешно, а получающийся в результате бромированный ДНА можно использовать для иммобилизации на поверхности его частиц N-нуклеофилов. Активность бромированного ДНА не уступает активности хлорированного, а в некоторых случаях превосходит ее. Подобраны условия прививки на бромированный ДНА противотуберкулезного препарата изониазида, что позволит в дальнейшем изучать этот конъюгат как потенциальное средство для лечения туберкулеза.
Список литературы
Nanodiamond // Ed. by Williams O.A. Cambridge: Royal Soc. Chem., 2014.
Karpukhin A.V., Avkhacheva N.V., Yakovlev R.Y., Kulakova I.I., Yashin V.A., Lisichkin G.V., Safronova V.G. // Cell Biol. Int. 2011. V. 35. P. 727.
Mochalin V.N., Shenderova O., Ho D., Gogotsi Y. // Nat. Nanotechnol. 2012. V. 7. № 1. P. 11.
Yakovlev R.Y., Osipova A.S., Solomatin A.S., Kulakova I.I., Murav’eva G.P., Avramenko N.V., Lisichkin G.V. // Russ. J. General Chem. 2015. V. 85. P. 1565.
Liu Y., Khabashesku V.N., Halas N.J. // J. Amer. Chem. Soc. 2005. V. 127. P. 3712.
Lisichkin G.V., Kulakova I.I., Gerasimov Y.A., Karpukhin A.V., Yakovlev R.Y. // Mendeleev Commun. 2009. V. 19. P. 309.
Liu Y., Gu Z., Margrave J.L., Khabashesku V.N. // Chem. Mater. 2004. V. 16. P. 3924.
Spitsyn B.V. Davidson J.L., Gradoboiev M.N., Galushko T.B., Serebryakova N.V., Karpukhina T.A., Kulakova I.I., Melnik N.N. // Diam. Relat. Mater. 2006. V. 15. P. 296.
Ikeda Y., Saito T., Kusakabe K., Morooka S., Maeda H., Taniguchi Y., Fujiwara Y. // Diam. Relat. Mater. 1998. V. 7. P. 830.
Martin, R., Heydorn, P.C., Alvaro, M., Garcia, H. // Chem. Mater. 2009. V. 21. P. 4505.
Tiwari A. K., Goss J.P., Briddon P.R., Wright N.G., Horsfall A.B., Rayson M.J. // Phys. Status Solidi. A. 2012. V. 209. P. 1703.
Krueger A. // Nanodiamonds. Ed. by Arnault J.-C. Elsevier, 2017. P. 183.
Wang P., Pradhan K., Zhong X.B., Ma X. // Acta Pharm. Sin. B. 2016. V. 6. P. 384.
Yakovlev R.Y., Solomatin A.S., Leonidov N.B., Kulakova I.I., Lisichkin G.V. // Rus. J. General Chem. 2014. V. 84. P. 379.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал