Коллоидный журнал, 2021, T. 83, № 3, стр. 335-343
Протомицеллы додецилсульфата натрия в сильно разбавленном водном растворе краунзамещенного фталоцианината магния
Т. Г. Мовчан 1, *, А. И. Русанов 1, 2, Е. В. Плотникова 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
2 Менделеевский центр, Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: movchan_tamara@mail.ru
Поступила в редакцию 01.01.2021
После доработки 07.01.2021
Принята к публикации 10.01.2021
Аннотация
Протомицеллы – новое понятие коллоидной науки, относящееся к мицеллоподобным агрегатам ПАВ в растворах. В отличие от обычных мицелл протомицеллы не требуют критической концентрации мицеллообразования (ККМ) и образуются постепенно путем адсорбции молекул или ионов ПАВ на солюбилизационном ядре при концентрациях значительно ниже ККМ. Полностью сформировавшаяся протомицелла выглядит как обычная мицелла с солюбилизатом. Протомицеллы могут образовываться на мономерах и димерах фталоцианинов. В настоящей работе спектрофотометрически исследовалась роль протомицелл в процессе мономеризации краунзамещенного фталоцианината магния (I) при концентрациях 0.38 и 1.2 мкМ в водном растворе додецилсульфата натрия (II). Разработаны эмпирические методы нахождения нового параметра – концентрации мономеризации (концентрации II, необходимой для запуска мономеризации I), и показано, что с увеличением концентрации I концентрация мономеризации уменьшается. Еще один новый параметр – концентрация II, отвечающая практическому завершению мономеризации I, – изучен в сравнении с ККМ II, для чего впервые произведено измерение ККМ (кондуктометрическим методом) в присутствии протомицелл. Последнее, как показано, приводит к понижению ККМ. Одновременно установлено, что концентрация завершения мономеризации в исследованной системе практически совпадает с ККМ.
ВВЕДЕНИЕ
В классическом опыте по исследованию адсорбции из раствора адсорбент обычно используется в мелкораздробленном состоянии с целью увеличить поверхность адсорбента и облегчить измерение адсорбции. Если частица адсорбента находится в наноразмерном диапазоне, а растворенным веществом и адсорбатом является ПАВ, то при полном монослойном заполнении поверхности молекулами ПАВ такая частица напоминает мицеллу с солюбилизатом. Аналогия усиливается в случае, когда в роли такой частицы выступает просто крупная молекула какого-то вещества или ее ассоциаты. Термин “протомицелла” использовался в работе [1] (см. также [2–5]) применительно к димеру краунзамещенного фталоцианината магния (I), покрытого ионами додецилсульфата натрия (II). Такая структура образуется при концентрациях значительно ниже критической концентрации мицеллообразования (ККМ) II и как бы предшествует образованию обычных мицелл (отсюда и название “протомицелла”).
Подобных структур в природе и коллоидной науке множество, и они вполне заслуживают отдельного классифицирующего названия. Поэтому понятие протомицеллы можно расширить как относящееся к мицеллоподобной структуре (самопроизвольного агрегата ПАВ в жидком растворе), обладающей следующими особенностями. (1) Постепенное формирование, не требующее ККМ и начинающееся при концентрациях значительно ниже ККМ (если речь идет о коллоидных ПАВ). (2) Наличие в растворе некоторого ядра, с которого и начинается построение протомицеллы. Если говорить о фталоцианинах, то в таком расширительном толковании в роли подобного ядра может выступать не только димер, но и мономер фталоцианина. Теперь мы будем придерживаться этой трактовки, и, поскольку речь пойдет о домицеллярной концентрационной области ПАВ, предметом рассмотрения будут именно протомицеллы.
Поскольку благодаря гидрофобному эффекту фталоцианины находятся в водном растворе в агрегированном состоянии (в основном, в виде димеров), а для их практического использования должны приводиться к мономерной форме, большой интерес вызвало использование ПАВ для этой цели с привлечением мицеллярных систем [6–13]. Явление мономеризации фталоцианинов в растворах ПАВ представляет большой интерес и для коллоидной науки. Совсем недавно, в частности, это выразилось в создании отдельной теории данного явления [5], включающей и рассмотрение протомицелл. Можно сказать, что роль последних весьма существенна в процессе мономеризации фталоцианинов.
В данном сообщении мы продолжим исследование системы I–II–вода, начатое в работах [1, 3], но теперь вместо условия постоянства химического потенциала I будет применяться закрепление концентрации фталоцианина. При изучении той же системы аналогичное условие использовалось в экспериментах работы [6], но упор делался на ККМ и ее связь с мономеризацией I. Мы же обратимся к малым концентрациям. Описанию результатов будет предшествовать небольшая теоретическая часть. Это связано с тем, что в работе [5], направленной в значительной мере на интерпретацию результатов работ [1, 3, 4], теория строилась в предположении постоянства химического потенциала фталоцианина. Теперь мы работаем в условиях постоянства концентрации фталоцианина, что требует некоторого обобщения теории.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Ранее мы искали взаимосвязь между концентрациями I $({{c}_{2}})$ и II $({{c}_{1}}),$ но, поскольку концентрация ${{c}_{2}}$ теперь фиксирована, эта задача утрачивает смысл. Остается установить зависимость числа агрегации ПАВ n в протомицелле от концентрации ПАВ в растворе ${{c}_{1}}$ в этих условиях, чем мы сейчас и займемся.
Обратимся к нашей системе I–II–вода. В условиях равновесия при постоянстве температуры и давления химические потенциалы ПАВ $({{\mu }_{1}}),$ фталоцианина $({{\mu }_{2}})$ и воды $({{\mu }_{3}})$ связаны уравнением Гиббса–Дюгема
Поскольку вода у нас в огромном избытке, изменением ее химического потенциала можно пренебречь (можно и строго закрепить величину ${{\mu }_{3}},$ наложив, например, условие равновесия с воздухом заданной влажности). Тогда третье слагаемое в (1) можно опустить, что приводит к соотношению Используем известное выражение для разбавленного раствора (в расчете на одну молекулу) где ${{\mu }_{{1\operatorname{s} }}}$ – стандартный химический потенциал (при ${{c}_{1}}$ = 1), k – постоянная Больцмана и T – температура. Подстановка (3) в (2) дает Для ${{\mu }_{2}}$ возьмем выражение (снова применительно к разбавленному раствору) из арсенала статистической механики:(5)
${{\mu }_{2}} = \mu _{2}^{\operatorname{v} } + {{w}_{2}} + kT\ln \left( {{{c}_{2}}\Lambda _{i}^{3}} \right),$Теперь из (7) и (8) находим искомое соотношение
Работа u сама зависит от n, ведь по мере заполнения поверхности фталоцианина молекулы ПАВ начинают взаимодействовать друг с другом. Лишь при малых n, когда латеральными взаимодействиями можно пренебречь, работа u становится постоянной, и соотношение (9) принимает форму Ввиду того, что концентрация ${{c}_{2}}$ фталоцианина постоянна по условию задачи, вся правая часть (10) постоянна. Таким образом, здесь мы имеем дело с линейной зависимостью n от ${{c}_{1}},$ как и в классической теории адсорбции ПАВ при малых концентрациях.ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методики
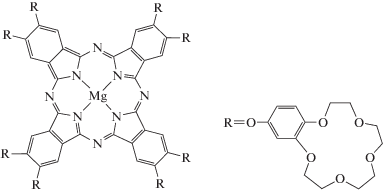
Использовались те же реактивы, что в работах [1, 3]. Главной методикой по-прежнему была спектрофотометрия – измерение оптической плотности A раствора в зависимости от длины световой волны λ и наблюдение за характерными длинами волн для мономеров и димеров фталоцианина. Ранее было установлено, что в диапазоне λ 550–900 нм димерам I соответствует максимум A при λ = 634 нм [1, 3, 9], а мономерам I (структурная формула показана на рис. 1) – максимум A при λ = 682 нм, часто сопровождающийся пиком небольшой интенсивности при λ = 616 нм [1, 3, 10]. Измерения проводились при задании двух концентраций I – 0.38 и 1.2 мкМ и изменении концентрации II в диапазоне 0.69–15 мМ.
В методическом отношении небольшим добавлением является лишь определение ККМ II стандартным методом кондуктометрии. Измерение удельной электропроводности водных растворов II как в отсутствие, так и присутствии I проводилось с помощью кондуктометра Seven Easy Cond (Швейцария) с высокочувствительным датчиком InLab 710 при 25°C (подробное описание методики дано в работе [15]).
Результаты и их обсуждение
На рис. 2 приведены электронные спектры поглощения системы I–II–вода при постоянной концентрации I с2 = 0.38 мкМ и изменяющейся концентрации II (с1). Спектры для той же системы, но при концентрации I с2 = 1.2 мкМ изображены на рис. 3. Для удобства обсуждения каждый из рис. 2 и 3 разделен на три части. Часть “а” соответствует самым малым концентрациям ПАВ, когда возможно сосуществование мономеров и димеров I в растворе, и иллюстрирует плавный переход от преобладания димеров к преобладанию мономеров с ростом концентрации ПАВ (как уже отмечалось, теория этого явления сформулирована в [5]). Видно, что на обоих рисунках кривая 1 для минимальной концентрации ПАВ указывает на наличие димеров I (максимум экстинции при λ = 634 нм) и отсутствие мономеров. С ростом концентрации ПАВ появляется характерный максимум мономеров I (при λ = 683 нм), который растет, сравнивается с максимумом для димеров, а на кривых 5 (рис. 2) и 4 (рис. 3) уже превосходит его. Заметим, что, поскольку все это происходит в растворах ПАВ, речь идет не просто о мономерах и димерах I, а о соответствующих протомицеллах на их основе.
Рис. 2.
Электронные спектры поглощения системы I–II–вода в диапазоне длин волн 550–900 нм при концентрации I 0.38 мкМ. (а) В области перехода от димеров к мономерам I при концентрации II (мМ) 1 (1), 1.66 (2), 2.6 (3), 3.5 (4) и 3.86 (5); (б) в домицеллярной области доминирования мономеров при концентрации II (мМ) 5.2 (6) и 5.63 (7); (в) в области перехода системы через ККМ при концентрации II (мМ) 6.98 (8), 8.19 (9), 9.2 (10), 12.8 (11) и 15.1 (12). Длина оптического пути l = 1 см.

Рис. 3.
Электронные спектры поглощения системы I–II–вода в диапазоне длин волн 550–900 нм при концентрации I 1.2 мкМ. (а) В области перехода от димеров к мономерам I при концентрации II (мМ) 0.69 (1), 1.8 (2), 2.23 (3) и 3.62 (4); (б) в домицеллярной области доминирования мономеров при концентрации II (мМ) 4.39 (5) и 5.27 (6); (в) в области перехода системы через ККМ при концентрации II (мМ) 6.24 (7), 6.84 (8), 8.19 (9), 9.2 (10), 12.8 (11) и 15.1 (12). Длина оптического пути l = 1 см.
Часть “б” рис. 2 и 3 отвечает той концентрационной области ПАВ, где спектрофотометрически идентифицируются только мономеры I, а концентрация ПАВ все еще ниже ККМ. Иными словами, в растворе присутствуют лишь протомицеллы II на основе мономеров I, а настоящих мицелл II еще нет (строго говоря, они есть, но их концентрация неощутима). Наконец, часть “в” рис. 2 и 3 связана с переходом системы через ККМ. Данные спектрофотометрии свидетельствуют о сохранении мономеров I (т.е. протомицелл на основе мономеров I), но в условиях замедления роста их числа. Кроме того, появляется новый небольшой и лишь слабо варьируемый максимум экстинции при λ = 615 нм. Сказать точно к чему он относится, мы затрудняемся. Принципиально область “в” отличается тем, что в ней происходит массовое образование обычных (солюбилизационно “пустых”, т.е. не содержащих ядер I) мицелл II, которые слабо влияют на экстинцию системы. Однако нужно отметить, что данный небольшой пик ранее наблюдался и в домицеллярной области [1].
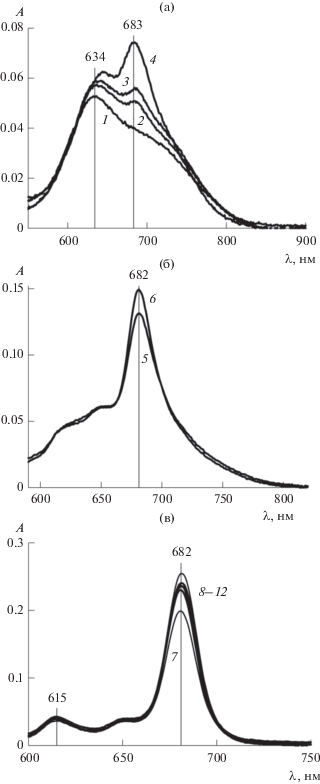
На основе приведенных спектральных данных можно построить (отдельно для димеров и мономеров I) графики зависимости оптической плотности (А) от концентрации II (с1) при постоянной концентрации I (с2). Это показано на рис. 4 (при с2 = 0.38 мкМ) и рис. 5 (при с2 = 1.2 мкМ) соответственно рис. 2 и 3. Точки, отвечающие димерам, изображены черными кружками, а мономерам – белыми. Представление материала в такой форме наиболее удобно для обсуждения.
Рис. 4.
Зависимость оптической плотности (A) в максимумах поглощения для димеров I (черные кружки) и мономеров I (белые кружки) от концентрации II (с1) по спектроскопическим данным рис. 2 при концентрации I 0.38 мкМ.

Рис. 5.
Зависимость оптической плотности (A) в максимумах поглощения для димеров (черные кружки) и мономеров (белые кружки) от концентрации II (с1) по спектроскопическим данным рис. 3 при концентрации I 1.2 мкМ.
Начнем с димеров I в области малых концентраций ПАВ. На обоих рис. 4 и 5 видно, что при самых малых концентрациях II, когда мономеры I практически отсутствуют и господствуют димеры, их число слабо возрастает с прибавлением II, проходит через максимум и далее падает. Первоначальный рост концентрации димеров наблюдался и в работах [1, 3]. Однако там наши опыты проводились в условиях постоянства химического потенциала I и, следовательно, открытости системы. Компонент I непрерывно поступал в раствор из находящейся с ним в равновесии твердой фазы I, а потому вопрос “откуда берутся дополнительные димеры?” не возникал. Теперь же он просто повисает в воздухе, ибо количество (практически и концентрация) I строго фиксировано, и система закрыта в отношении этого компонента. Очевидно, единственным источником дополнительных димеров могут быть только агрегаты I более высоких порядков в процессе их распада под влиянием ПАВ (пока такие агрегаты существуют, и не развился процесс распада самих димеров). Заметим, что в работе [1] мы взяли под сомнение ощутимость в растворе агрегатов I выше димеров при столь малой брутто-концентрации I. Теперь мы должны смягчить эту позицию и признать, что агрегаты I крупнее димеров находятся хоть и в малом, но все же настолько ощутимом числе, что проявляют себя в эксперименте. Итак, возвращаясь к черным точкам на рис. 4 и 5, можем сказать, что слабое возрастание концентрации димеров I при самых малых концентрациях II происходит в результате распада более крупных агрегатов I. Слабое же понижение концентрации димеров I после прохождения максимума связано с началом распада самих димеров.
Обратимся теперь к белым точкам на рис. 4 и 5. Их появление означает переход к мономеризации I. Еще в работах [1, 3] мы писали о возможности введения специального параметра “концентрация мономеризации” как значения концентрации ПАВ, знаменующего “запуск” процесса мономеризации фталоцианинов в растворах ПАВ. В работе [5] было дано теоретическое обоснование этой концепции и выведено уравнение, дающее определение концентрации мономеризации (обозначена как $с_{1}^{*}$). Хотя решить это уравнение пока невозможно, оно принципиально важно как подтверждение существования такой величины и открывает возможность ее эмпирического поиска, чем мы сейчас и займемся.
Укажем два простейших способа с использованием рис. 4 и 5. Первый – по кривой из черных точек, максимум на которой обеспечивается распадом димеров и, следовательно, соответствует началу мономеризации I. Не утруждаясь построением плавной кривой и анализом экстремума (такая точность нам пока не нужна), возьмем в качестве $с_{1}^{*}$ абсциссу черной точки с максимальным значением оптической плотности. Для рис. 4 это будет $с_{1}^{*}$ = 5.2 мМ, а для рис. 5 – $с_{1}^{*}$ = 4.39 мМ.
Другой способ состоит в следующем. Ввиду пологости максимума через черные точки можно провести прямую линию (методом наименьших квадратов, это и показано на рис. 4 и 5) и, проделав то же самое с белыми точками, искать $с_{1}^{*}$ по точке пересечения двух прямых. Поскольку компьютер дает уравнения для обеих линий, задача решается аналитически. Так, для прямой 1, относящейся к черным точкам на рис. 4 и 5, имеем соответственно уравнения
(11)
$\begin{gathered} А = 0.0004{{с}_{1}} + 0.0225 \\ ({{R}^{2}} = 0.3178,\,\,\,\,{{с}_{2}} = 0.38{\text{ мкМ}}), \\ \end{gathered} $(12)
$\begin{gathered} А = 0.0022{{с}_{1}} + 0.0529 \\ ({{R}^{2}} = 0.8964,\,\,\,\,{{с}_{2}} = 1.2{\text{ мкМ}}). \\ \end{gathered} $Возвращаясь к белым точкам на рис. 4 и 5, прежде всего, отметим, что использование для них единой прямой линии привело бы к такой же ситуации как с уравнением (11). Однако достаточно разбить линию на два участка (линии 2 и 3), чтобы их уравнения выглядели приемлемо. Особенно это касается линии 2, для которой получаем хорошие аппроксимации
(13)
$\begin{gathered} А = 0.015{{с}_{1}} - 0.0257 \\ ({{R}^{2}} = 0.9384,\,\,\,\,{{с}_{2}} = 0.38{\text{ мкМ}}), \\ \end{gathered} $(14)
$\begin{gathered} А = 0.036{{с}_{1}} - 0.0299 \\ ({{R}^{2}} = 0.9555,\,\,\,\,{{с}_{2}} = 1.2{\text{ мкМ}}), \\ \end{gathered} $Итак, мы грубо апробировали два эмпирических метода нахождения концентрации мономеризации I в растворах ПАВ. Полученные чисто прикидочные значения для обоих методов, естественно, не совпадают, но уже на таком уровне проглядывает одна закономерность. Концентрация мономеризации I (т.е. определенная концентрация ПАВ) зависит от самой концентрации I, причем с ее уменьшением концентрация мономеризации возрастает. Это можно понять из самых общих соображений. Вспоминая химическую кинетику и закон действия масс, заключаем, что поддержка любого процесса (у нас это развал димеров I под влиянием ПАВ) требует определенного значения произведения концентраций взаимодействующих веществ (у нас это фталоцианин и ПАВ) с соответствующими показателями степеней. Поэтому уменьшение концентрации одного из них требует увеличения концентрации другого.
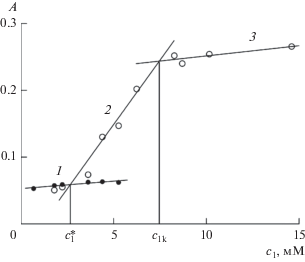
Продолжая обсуждение рис. 4 и 5, обратим теперь внимание на точку пересечения линий 2 и 3. Очевидно, она отражает еще один характеристический параметр, смысл которого также необходимо установить. Заметим, что график такого вида уже исследовался в литературе, а точка излома интерпретировалась как ККМ [6]. С позиций коллоидной науки такая интерпретация не встречает возражений, поскольку выше ККМ ПАВ состояние мицеллярной системы как бы затормаживается: химический потенциал и концентрация мономеров ПАВ хоть и возрастают с брутто-концентрацией ПАВ в соответствии с требованиями условий устойчивости, но настолько медленно, что их можно считать постоянными. С другой стороны, мы имеем дело с графиками оптической плотности, непосредственно связанной с состоянием фталоцианина (конкретно, его мономерами), а не ПАВ. Обрыв быстрого возрастания концентрации мономеров I за счет распада димеров (линия 2) может означать истощение димеров (тем более, при столь малой исходной концентрации I) и практическое завершение процесса мономеризации фталоцианина. Данное объяснение очевидно и действует всегда при фиксированном количестве фталоцианина в системе.
Таким образом, существуют два варианта интерпретации точки пресечения линий 2 и 3, связанные с двумя независимыми явлениями: один с ККМ II, другой с дефицитом димеров I. Какое явление случится раньше при прибавлении ПАВ к системе, такой вариант и вступит в силу. Если еще до ККМ практически кончатся димеры (строго говоря, какое-то малое число их всегда остается), то между абсциссой точки пересечения (она обозначена как ${{с}_{{1к}}})$ и ККМ существует пробел. Этот случай тривиален. Если же ККМ достигается еще до истощения димеров I (тогда ${{с}_{{1к}}} = $ = ККМ), то процесс мономеризации продолжается и выше ККМ. Здесь уже протомицеллы можно трактовать как обычные мицеллы с солюбилизатом в виде крупного мономера I. Посмотрим, какой из вариантов реализуется в нашем случае.
Рассчитаем сначала концентрационную координату ${{с}_{{1к}}}$ на рис. 4 и 5. Линия 3 аппроксимируется уравнениями
(15)
$\begin{gathered} А = 0.0008{{с}_{1}} + 0.0872 \\ ({{R}^{2}} = 0.945,\,\,\,\,{{с}_{2}} = 0.38{\text{ мкМ}}), \\ \end{gathered} $(16)
$\begin{gathered} А = 0.0031{{с}_{1}} + 0.2209 \\ ({{R}^{2}} = 0.7176,\,\,\,\,{{с}_{2}} = 1.2{\text{ мкМ}}). \\ \end{gathered} $Поскольку II – ионное ПАВ, в качестве метода определения ККМ была выбрана кондуктометрия, а для измерений использовалась система I–II–вода при температуре 25°C и значениях концентрации I, равных 0 (контрольный опыт для проверки методики) и 0.38 мкМ. Результаты измерений электропроводности κ представлены на рис. 6, где белые точки относятся к водному раствору только ПАВ (в отсутствие фталоцианина), черные точки – к системе с с2 = 0.38 мкМ. ККМ находится по точке излома на зависимости $\kappa ({{с}_{1}}).$ Видно, что, к сожалению, излом выражен довольно слабо, что не позволяет рассчитывать на высокую точность нахождения ККМ. Чтобы по возможности повысить точность, мы провели расчет аналитически.
Рис. 6.
Экспериментальная зависимость удельной электропроводности (κ) водного раствора II от его концентрации ${{с}_{1}}$ при ${{c}_{2}} = 0$ (белые точки) и ${{c}_{2}}$ = 0.38 мкМ (черные точки) при 25°С.

Зависимость κ(с1) разбивалась на два линейных участка, для которых в отсутствие I (для белых точек на рис. 6) получены уравнения
(17)
$\begin{gathered} \kappa = 0.00653{{с}_{1}} + 0.00226 \\ ({{R}^{2}} = 0.998,\,\,\,\,{{с}_{1}} < 8{\text{ мМ}}), \\ \end{gathered} $(18)
$\begin{gathered} \kappa = 0.00256{{с}_{1}} + 0.03536 \\ ({{R}^{2}} = 0.9986,\,\,\,\,{{с}_{1}} > 8{\text{ Мм}}). \\ \end{gathered} $(19)
$\begin{gathered} \kappa = 0.0065{{с}_{1}} + 0.0019 \\ ({{R}^{2}} = 0.9958,\,\,\,\,{{с}_{1}} < 8{\text{ мМ}}), \\ \end{gathered} $(20)
$\begin{gathered} \kappa = 0.003{{с}_{1}} + 0.0293 \\ ({{R}^{2}} = 0.9967,\,\,\,\,{{с}_{1}} > 8{\text{ мМ}}). \\ \end{gathered} $Рис. 7.
Графическая иллюстрация аналитического определения ККМ. Прямые линии 1–4 соответствуют функциям (17)–(20). ККМ находится как точка пересечения линий 1 и 2, а ККМ' – линий 3 и 4.

Итак, в результате сделанных оценок мы пришли к значениям ${{с}_{{1{\kern 1pt} к}}}$ = 7.95 мМ и ККМ' = 7.83 мМ для растворов II при минимальном содержании I (с2 = 0.38 мкМ). Проделанный выше анализ рис. 4 и 5 привел нас к заключению, что при сравнении значений ${{с}_{{1к}}}$ и ККМ возможны только два случая: ${{с}_{{1к}}}$ < ККМ (если димеры I истощаются раньше достижения ККМ) и ${{с}_{{1к}}}$ = ККМ (если, наоборот, ККМ достигается еще до истощения димеров I). Но у нас ${{с}_{{1к}}}$ немного больше ККМ, и это можно объяснить тем, что на самом деле они равны, а разница их значений обусловлена погрешностью (тем более что не такая уж она существенная). Таким образом, наш анализ подтверждает трактовку точки излома в работе [6] как ККМ.
ЗАКЛЮЧЕНИЕ
Данное исследование показывает, что концентрация мономеризации I в растворе ПАВ $с_{1}^{*}$ зависит от самой концентрации I ${{с}_{2}}.$ Самым грубым методом (по одной черной точке на рис. 4 и 5) мы нашли $с_{1}^{*}$ = 5.2 мМ для ${{с}_{2}}$ = 0.38 мкМ и $с_{1}^{*}$ = 4.39 мМ для ${{с}_{2}}$ = 1.2 мкМ. Тоже грубым методом, но с использованием уже целого ряда точек, мы определили $с_{1}^{*}$ = 3.3 мМ для ${{с}_{2}}$ = 0.38 мкМ и $с_{1}^{*}$ = 2.5 мМ для ${{с}_{2}}$ = 1.2 мкМ. Ранее мы условно приняли $с_{1}^{*}$ = = 1.7 мМ для ${{с}_{2}}$ = 8.2 мкМ [1]. Разнобой полученных величин связан, прежде всего, с тем, что разные методы по существу подразумевают разные определения (в смысле дефиниций) параметра $с_{1}^{*}.$ Такая проблема всегда возникает, когда область изменения какого-то состояния необходимо определить как точку. Напомним, что аналогичное положение касается и ККМ. В [17–19] проанализировано более 20 определений ККМ и получен довольно широкий разброс значений. А уж если вспомнить, что некоторые величины (взять хотя бы химический потенциал – центральную величину всей химической термодинамики) вообще определяются с точностью до постоянной, становится ясным, почему не так важны конкретные значения параметров, как установление законов их изменения. В данном сообщении мы показали, что увеличение содержания фталоцианина в растворе ПАВ приводит к снижению концентрации мономеризации. Кстати, такой же эффект, как известно, характерен и для ККМ.
В нашей работе поднят вопрос и о второй характерной точке ${{с}_{{1к}}}$ процесса мономеризации фталоцианина в растворе ПАВ. Если $с_{1}^{*}$ отмечает начало процесса, то ${{с}_{{1к}}}$ как-то связано с его завершением. Интересно, что ${{с}_{{1к}}}$ может совпадать с ККМ, и в конкретной исследованной системе I–II–вода именно это и происходит. Но будет ли такое положение типичным для других систем, пока не ясно. Сейчас наступает период накопления экспериментальных данных такого рода, и многие наши прикидочные результаты открывают дорогу для исследований в этом направлении.
Список литературы
Русанов А.И., Мовчан Т.Г., Плотникова Е.В. // Докл. РАН. Химия, науки о материалах. 2020. Т. 425. С. 60.
Русанов А.И. // Коллоид. журн. 2021. Т. 83. С. 127.
Мовчан Т.Г., Русанов А.И., Плотникова Е.В. // Коллоид. журн. 2021. Т. 83. С. 75.
Мовчан Т.Г., Русанов А.И. Плотникова Е.В. // Коллоид. журн. 2021. Т. 83. С. 187.
Русанов А.И. // Коллоид. журн. 2021. Т. 83. С. 205.
Гольдшлегер Н.Ф., Черняк А.В., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю. // Журн. общей химии. 2012. Т. 82. С. 856.
Гольдшлегер Н.Ф., Черняк А.В., Лобач А.С., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю.// Физикохимия поверхности и защита материалов. 2015. Т. 51. С. 160.
Гольдшлегер Н.Ф., Гак В.Ю., Калашникова И.П., Баулин В.Е., Иванчихина А.В., Смирнов В.А., Ширяев А.А., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 4. Приложение. С. S3.
Гольдшлегер Н.Ф., Гак В.Ю., Лапшина М.А., Баулин В.Е., Ширяев А.А., Цивадзе А.Ю. // Изв. АН. Сер. хим. 2018. № 12. С. 2205.
Мовчан Т.Г., Аверин А.А., Баулин Д.В., Плотникова Е.В., Баулин В.Е., Цивадзе А.Ю. // Коллоид. журн. 2018. Т. 80. С. 528.
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Аверин А.А., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2018. Т. 80. С. 694.
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2019. Т. 81. С. 750.
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2020. Т. 82. С. 26.
Куни Ф.М. Статистическая физика и термодинамика. М.: Наука, 1981.
Усьяров О.Г., Плотникова Е.В., Мовчан Т.Г. // Коллоид. журн. 2017. Т. 79. С. 340.
Мовчан Т.Г., Русанов А.И., Соболева И.В., Хлебунова Н.Р., Плотникова Е.В., Щёкин А.К. // Коллоид. журн. 2015. Т. 77. С. 511.
Русанов А.И. Мицеллообразование в растворах поверхностно-активных веществ. СПб.: Химия, 1992.
Rusanov A.I. Micellization in Surfactant Solutions. Chemistry Reviews, Vol’pin, M.E., Ed.; Vol. 22, Part 1; Reading: Harwood Academic Publ., 1996. ISBN 90-5702-297-4.
Русанов А.И., Щёкин А.К. Мицеллообразование в растворах поверхностно-активных веществ, 2-е изд., доп. СПб.: Лань, 2016.
Русанов А.И. // Коллоид. журн. 2021. Т. 83. С. 98.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал