Коллоидный журнал, 2021, T. 83, № 4, стр. 423-435
Структурные характеристики и ионный состав коллоидного раствора наночастиц серебра, полученного методом электроискрового разряда в воде
О. В. Криставчук 1, *, А. С. Сохацкий 1, В. И. Козловский 2, В. В. Ской 1, 3, А. И. Куклин 1, 3, В. В. Трофимов 1, В. В. Слепцов 4, А. Н. Нечаев 1, 5, П. Ю. Апель 1, 5
1 Объединенный институт ядерных исследований
141980 Дубна, Московская область, ул. Жолио-Кюри, 6, Россия
2 Филиал федерального исследовательского центра химической физики
им. Н.Н. Семенова Российской академии наук
142432 Черноголовка, Московская область, проспект Академика Семенова, 1, корп. 10, Россия
3 Московский физико-технический институт
141701 Долгопрудный, Московская область, Институтский пер., 9, Россия
4 Московский авиационный институт
125993 Москва, Волоколамское шоссе, 4, Россия
5 Государственный университет “Дубна”
141982 Дубна, Московская область, ул. Университетская, 19, Россия
* E-mail: kristavchuk@jinr.ru
Поступила в редакцию 21.04.2020
После доработки 10.09.2020
Принята к публикации 23.12.2020
Аннотация
Работа посвящена исследованию структурно-морфологических свойств коллоидного раствора серебра, полученного методом электроискрового разряда в дистиллированной воде. Наночастицы серебра образуются в результате распыления металла с поверхности серебряных электродов, между которыми создается импульсный высоковольтный электрический разряд. Стабилизация раствора обеспечивается образованием слоя анионов вокруг наночастиц. Структурные характеристики коллоидного раствора изучали методами малоуглового рентгеновского рассеяния и просвечивающей электронной микроскопии. Качественно ионный состав определяли с помощью электроспрейной масс-спектрометрии, концентрацию серебра оценивали, используя атомно-эмиссионную спектрометрию с индуктивно-связанной плазмой.
1. ВВЕДЕНИЕ
Наночастицы (НЧ) металлов получили широкое распространение во многих областях науки и техники благодаря специфическим свойствам, большому числу способов получения, возможности регулирования физических и химических свойств. К сферам применения НЧ металлов с заданными параметрами относятся многие области. В их числе медицина (адресная доставка лекарств, иммунодиагностика), производство косметики и бытовой химии, каталитическая химия, машиностроение, энергетика, электроника (полупроводники, сенсорные экраны), экология (очистка воды и воздуха) и др. Свойства НЧ металлов активно изучаются и для использования их в аналитической химии – в оптических и сенсорных устройствах. НЧ золота, серебра и меди (и некоторых других металлов) являются ключевым элементом в усиленной поверхностью спектроскопии комбинационного рассеяния (КР) света (спектроскопия гигантского КР, ГКР), основанной на явлении поверхностного плазмонного резонанса [1–3]. Главными факторами, определяющими коэффициент усиления КР света, являются размер и форма НЧ, а также расстояние между ними (максимальное усиление достигается в узких зазорах между НЧ [4, 5]). В качестве рабочего элемента, усиливающего сигнал, может использоваться как коллоидный раствор [6–8], так и поверхность с заданным нанорельефом [9–14].
Известные способы получения нанодисперсий металлов, в том числе серебра, можно разделить на химические и физические. Распространенные химические методы базируются на восстановлении металла из его солей; к ним относятся цитратный [8, 15], борогидридный [7], с помощью диметилформамида [16], этиленгликоля [17], а также взаимодействие плазмы [18] или искрового разряда с водным раствором нитрата серебра [19]. В [20] предложен метод восстановления серебра из перхлората с помощью оксалат-ионов с их последующим разложением ультрафиолетовым светом до карбонат-ионов, стабилизирующих коллоид. Варьируя параметры синтеза и вещества-стабилизаторы, можно регулировать размеры, форму НЧ и концентрацию коллоидов, получать практически монодисперсные системы. Однако в некоторых случаях остатки прореагировавших веществ и стабилизаторов могут давать вклад, искажающий спектры, как, например, в спектроскопии ГКР. Экспресс-методом анализа размеров НЧ является метод абсорбционной спектроскопии. Коллоиды серебра обладают характерной полосой поглощения в области 390–500 нм с максимумом, положение которого зависит от формы, размера и степени полидисперсности НЧ, диэлектрической константы среды, природы введенного стабилизатора [21–23]. Для НЧ, размер которых намного меньше длины волны возбуждающего света, электромагнитное (ЭМ) поле однородно по всей частице, так что все электроны проводимости движутся в одной фазе, что выражается в одной узкой полосе резонансного поглощения [22]. По мере увеличения размера наночастиц ЭМ-поле становится неоднородным, возбуждая мультипольные резонансы, что приводит к появлению нескольких пиков в спектре [22].
Так, например, спектр коллоидного раствора серебра, окрашенного в желтый цвет, с узкой интенсивной полосой при 400 нм свидетельствует о наличии монодисперсных НЧ со средним диаметром около 20 нм [21, 24]. Сдвиг полосы в длинноволновую область, появление плеч и дополнительных пиков и другие изменения в спектре могут дать информацию о процессах агрегирования, происходящих в растворе. Влияние размера и агрегирования НЧ Ag и Au на их оптические свойства детально изучено, например, в [25, 26].
Одним из распространенных физических методов получения НЧ является распыление металла в жидкую среду с поверхности электродов при протекании между ними электрических разрядов разных типов [27–38]. В зависимости от химического состава реакционной среды и материала электродов получают НЧ разного состава – это могут быть металлические или биметаллические частицы, НЧ нитридов, карбидов, оксидов металлов [34]. Существенно то, что можно получать “чистые” НЧ, свободные от стабилизирующих веществ, проводя синтез в воде, что может быть существенно для некоторых их применений, например в спектроскопии ГКР.
Коллоидныe растворы, содержащие НЧ, стабилизируются за счет образования двойных электрических слоев (ДЭС) вокруг НЧ; стабильность определяется суммой сил притяжения Ван-дер-Ваальса и электростатических сил отталкивания ионных атмосфер, окружающих НЧ [39]. Показателем, характеризующим взаимодействие НЧ за счет электростатической силы отталкивания, является величина дзета-потенциала (ζ). Суспензии с ζ-потенциалом частиц в диапазоне 0 ± 10 мВ классифицируются как крайне нестабильные, при ζ = ±(10–20) мВ – как относительно стабильные, при ζ = ±(20–30) мВ – как умеренно стабильные, а при ζ > ±30 мВ – как высокостабильные [39].
Метод электроискрового разряда довольно прост в реализации, однако требует тщательного контроля всех экспериментальных параметров для получения воспроизводимых результатов. Помимо технических параметров установки (расстояние между электродами, их форма, напряжение, ток, тип источника питания), на форму НЧ, их распределение по размерам, концентрацию и стабильность дисперсии влияют свойства реакционной среды (ее химический состав, растворенные газы, температура). Продолжительность и скважность импульсов электроискрового разряда в деионизованной (ДИ) воде влияют на концентрацию и ζ-потенциал НЧ серебра: диапазон получаемых значений ζ составляет от –30.7 до ‒42.3 мВ [27]. Однако, как показано в ряде работ, синтез в ДИ-воде приводит к довольно быстрому (в течение 2–3 недель) осаждению НЧ из суспензии [36–38], ввиду отсутствия достаточного количества ионов в реакционной среде. Поэтому требуется введение стабилизирующих веществ для продления “времени жизни” наносуспензии [37, 40]. Так, при введении цитрата натрия в ДИ-воду при электроискровом синтезе НЧ их ζ-потенциал увеличивался (по абсолютному значению) с –35.3 до –55.7 мВ по сравнению с синтезом в чистой ДИ-воде [40]. Спустя 1.5 года наносуспензия сохранила свои свойства, в ней не было обнаружено осадка, ζ-потенциал НЧ уменьшился лишь до ‒50 мВ.
Состав ДЭС в наносуспензии, полученной в ДИ-воде, чрезвычайно важен для понимания механизма стабилизации и управления этим явлением, что, однако, редко обсуждается в литературе. Нами было найдены две модели, описывающие НЧ серебра, синтезированные электроискровым методом. В одной из них [35] предполагается, что стабилизация дисперсии НЧ на срок до нескольких месяцев происходит благодаря растворенному углекислому газу, и представлена модель отрицательно заряженной мицеллы серебра, в которой потенциалопределяющим является слой карбонат-ионов. В следующей работе этой группы [29] это предположение было подтверждено обнаружением Ag2CO3 методом рентгеновской дифракции от осадка НЧ. Надо отметить, что согласно схеме синтеза, приведенной в статье, процесс проходил в открытой емкости, в отличие от вышеупомянутой работы [37]. Этим же коллективом авторов установлено, что в процессе синтеза наряду с НЧ образуется серебро в ионной форме Ag+ [30]. Согласно другой модели, стабилизация дисперсии НЧ серебра осуществляется за счет оболочек из гидроксид-ионов [18]. В [18] наблюдали стабилизацию наносуспензии при росте pH (при pH 8 ζ-потенциал составлял –41 мВ, и она сохраняла свои свойства месяцы).
Учитывая все сказанное выше, можно заключить, что идея использовать в качестве реакционной среды дистиллированную воду была достаточно обоснованной [28]. Синтез в такой среде позволил получить наносуспензию, стабильную более 3-х месяцев, благодаря тому, что она содержит достаточное для формирования ДЭС количество ионов. Диаметр НЧ серебра составил 5 нм сразу после их синтеза, по мере старения суспензии это значение росло [28]. Электроискровой метод получения суспензии НЧ серебра в дистиллированной воде относительно прост, не требует использования дорогих реагентов и внесения посторонних компонентов (например, ПАВ) в систему. Несмотря на практическую востребованность этого метода, понимание процесса синтеза, стабилизации и свойств получаемой наносуспензии остается неполным.
Целью настоящей работы стало расширение и углубление имеющейся информации о структурно-морфологических параметрах и составе коллоидного раствора серебра, полученного методом электроискрового разряда в дистиллированной воде. Подчеркнем еще раз, что от этих характеристик зависит эффективность функционирования НЧ, например, в спектроскопии ГКР. Известно, что умеренная агрегация НЧ в коллоидном растворе является необходимым условием его использования для решения тех задач, где используется эффект коллективного плазмонного резонанса [41]. Как было обнаружено нами ранее, такую наносуспензию можно применять как источник ГКР-активных структур, осаждаемых на поверхность трековой мембраны из полиэтилентерефталата [9].
2. МАТЕРИАЛЫ И МЕТОДЫ
2.1. Коллоидный раствор серебра
Коллоидный раствор серебра получали методом импульсного электрического разряда между серебряными электродами, погруженными в дистиллированную воду (с удельной электропроводностью 13 мкСм/см, pH 6.9 при температуре 22°C). Принцип действия установки для генерации разрядов в жидкой среде поясняет рис. 1. Высоковольтный трансформатор (не показан на рисунке) обеспечивает требуемый для работы реактора диапазон напряжений 4–10 кВ. Высокое напряжение с трансформатора заряжает разрядный конденсатор C до установленного на высоковольтном коммутаторе P амплитудного значения напряжения. При достижении заданного на высоковольтном коммутаторе пробивного напряжения через систему электродов, помещенных в рабочую жидкость, проходит искровой разряд, вызывая их эрозию. Электрические параметры разряда контролируются осциллографом (Agilent 54621А). Один из электродов вращается с постоянной скоростью около 10 об./с. Вода подается насосом в полость между электродами и выходит через зазор (60–100 мкм) между ними. Скорость подачи воды регулируется в пределах от 0.2 до 1 л/мин, обычно использовали скорость 0.5 л/мин. Подробнее с процессом синтеза можно ознакомиться в [28].
Рис. 1.
Схема установки для получения коллоидного раствора серебра в воде: С – высоковольтный конденсатор 15 кВ (емкость 2–6 пФ), Р – разрядник воздушный (высоковольтный коммутатор), О – осциллограф, КР – камера разрядная, 1 – серебряные электроды, 2 – коллоидный раствор серебра.
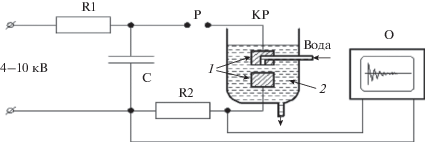
Получаемые коллоидные растворы хранили в закрытых полиэтилентерефталатных бутылях объемом 5 л в защищенном от света месте. При температуре 22°C их удельная электропроводность составляла 17 мкСм/см, pH 7.
2.2. Методы исследования
Спектры поглощения коллоидного раствора серебра в ультрафиолетовой и видимой областях регистрировали с помощью двухлучевого спектрофотометра Evolution 600 (Thermo Scientific).
Дзета-потенциал НЧ серебра измеряли на приборе Zetasizer Nano ZSP (Malvern), используя U-образную кювету с встроенными золотыми электродами.
Геометрические параметры (размер, форму) и кристаллическую структуру НЧ изучали методом просвечивающей электронной микроскопии (ПЭМ) на приборе JEOL JEM2100 с катодом из LaB6. В качестве подложек использовали стандартные сеточки для ПЭМ, покрытые тонкой пленкой аморфного SiO2 или аморфного углерода (SPI Supplies). Для осаждения НЧ на подложки применяли два способа. Согласно первому из них сеточку помещали в наносуспензию на 3 дня, во втором на сеточку последовательно наносили и высушивали две капли наносуспензии (по 8 мкл).
Общее количество серебра в ионной и кристаллической формах определяли методом атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой (АЭС ИСП) на приборе ICPE-9000 (Shimadzu). Качественный состав катионов и анионов коллоидного раствора анализировали с помощью масс-спектрометра Exactive (ThermoFisher Scientific) с самодельным ионным источником, в котором ионизация стимулируется распылением раствора потоком азота с околозвуковой скоростью [42]. Используемый масс-спектрометр характеризуется высокой точностью определения отношения массы иона к его заряду (m/z); масс-спектры регистрировались в режиме с разрешением 10000 FWHM, позволяющим получить хорошо разрешенную изотопную картину исследуемых катионов и анионов и определить значение m/z моноизотопных пиков с точностью 0.002 Да. Ионный источник [42] состоял из двух коаксиальных капилляров. По внутреннему кварцевому капилляру подавался исследуемый коллоидный раствор, а в тонкий зазор между внутренним капилляром и внешним металлическим капилляром поступал азот под давлением 7–10 бар. НЧ при прохождении интерфейса масс-спектрометра с большой вероятностью задерживались и не достигали масс-анализатора. В случае прохождения единичных заряженных частиц их пики терялись в пиках химического шума случайных одиночных ионов.
Оценку структурных параметров НЧ серебра – их размеров, формы, агрегации – проводили методом малоуглового рентгеновского рассеяния (МУРР) на рентгеновской станции Rigaku X-Ray HighFlux HomeLab с вращающимся анодом [43]. Шкалу по переданному импульсу калибровали с использованием бегената серебра [44].
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
3.1. Стабильность коллоидного раствора
Цвет получаемого нами коллоидного раствора – бледно-желтый, полоса плазмонного резонанса (ППР) – узкая и симметричная (рис. 2 кривая 1). Он стабилен в течение длительного времени, как правило, около года, а при хранении в месте, защищенном от света, и дольше. Процесс старения коллоидного раствора выражается в изменении его цвета от бледно-желтого до желтого. В спектре поглощения при этом происходит небольшой сдвиг полосы поглощения в длинноволновую область, что свидетельствует об увеличении размера НЧ (рис. 2 кривая 2). Также возрастает рассеяние во всем диапазоне длин волн спектра.
Рис. 2.
Спектры поглощения коллоидного раствора серебра: 1 – возраст раствора 1 мес. (ППР 400 нм), 2 – возраст раствора 11 мес. (ППР 405 нм).
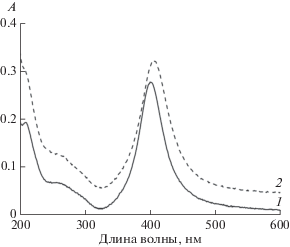
Согласно [24] по положению максимума ППР можно определить размер и концентрацию сферических НЧ серебра, стабилизированных цитрат-ионами. Для НЧ, стабилизированных иными ионами, необходима соответствующая калибровка. Однако ориентировочные расчеты по предложенной методике [24] могут быть выполнены и для нашей системы. Так, для коллоидного раствора возрастом 1 мес. максимум ППР находится при 400 нм, что соответствует диаметру НЧ 20 нм. Для раствора возрастом 11 месяцев максимум ППР сместился к 405 нм, что соответствует диаметру частиц 30 нм [24].
Значение ζ-потенциала НЧ серебра составляет –25 мВ. Это значение незначительно изменяется в зависимости от возраста наносуспензии (на несколько милливольт). От величины этого параметра зависит стабильность коллоидного раствора, т.к. он определяет силу кулоновского отталкивания, предотвращающую слипание НЧ. Вероятно, такое невысокое по абсолютной величине значение ζ-потенциала объясняет постепенную деградацию наносуспензии, а также образование цепочечных агрегатов, обнаруженное методом МУРР (см. ниже). В работе [35] ζ-потенциал НЧ серебра, полученных дуговым разрядом в деионизованной воде, составил –45 мВ, а при восстановлении серебра с помощью оксалат-ионов с последующим разложением их до карбонат-ионов достигнуто значение ζ-потенциала, равное –68.3 мВ [20]. При внесении карбоната серебра (в количестве, соответствующем его растворимости) в наш коллоидный раствор наблюдалось изменение ζ-потенциала НЧ серебра от –25 до –35 мВ, что способствовало его стабилизации, а также подтверждает дефицит стабилизирующих ионов в исходной системе.
3.2. Просвечивающая электронная микроскопия
Как уже было сказано выше, в качестве подложек для исследования высушенных золей в ПЭМ использовали нанесенные на стандартные сеточки тонкие пленки аморфного SiO2 (а-SiO2) или аморфного углерода. Осаждение НЧ серебра из коллоидного раствора на подложки производили либо погружением сеток в раствор на длительное время с последующим их извлечением и высушиванием, либо нанесением на сетку и высушиванием маленьких (8 мкл) капель раствора.
Первый подход применяли для того, чтобы по возможности увеличить толщину осадка на подложке и, тем самым, попытаться получить для него более четкую дифракционную картину. Действительно, в этом случае на углеродной пленке обнаруживались крупные скопления НЧ, в которых было трудно визуализировать отдельные НЧ (рис. 3а). Однако значительная толщина таких скоплений и большое число НЧ в них оказались удобными для определения материала частиц с помощью дифракции электронов.
Рис. 3.
(а) ПЭМ-изображение скопления НЧ серебра на углеродной подложке, образовавшегося в результате погру-жения сеточки в коллоидный раствор на 3 сут; (б–г) картины дифракции электронов: из конгломерата наночастиц A, пластинки в центре скопления B и участка пластинки, покрытого НЧ (A + B).

На рис. 3б показана дифракционная картина (электронограмма) от НЧ, полученная для наносуспензии серебра возрастом 4.5 месяца. Данная электронограмма представляет собой совокупность многоточечных колец и является типичной для нанозернистого поликристалла или нанопорошка. Последовательность радиусов колец или обратных межплоскостных расстояний (табл. 1, левый столбец) соответствует гранецентрированной кубической (ГЦК) структуре и почти совпадает с данными рентгеновской дифракции как для обычного порошка серебра (табл. 1, правый столбец), так и для нанопорошков, получаемых методом электроискрового разряда [31, 32]. Довольно большой разброс (до 0.5%) значений радиусов для отдельных точек в кольцах типичен для нанопорошка. Завышенные примерно на 2% по сравнению с рентгеновскими данными значения 1/d, возможно, обусловлены наличием в НЧ больших напряжений, вызванных лапласовым давлением.
Таблица 1.
Измерение дифракции от НЧ серебра
| Средние обратные межплоскостные расстояния $\left\langle {{1 \mathord{\left/ {\vphantom {1 d}} \right. \kern-0em} d}} \right\rangle $ для НЧ по данным ПЭМ, 1/нм | Стандартное отклонение, 1/нм |
hkl | Значения ${1 \mathord{\left/ {\vphantom {1 d}} \right. \kern-0em} d}$ для обычного порошка серебра (простр. группа Fm3m) по данным рентгеновской дифракции, 1/нм |
|---|---|---|---|
| 4.33 | 0.07 | 1 1 1 | 4.239 |
| 5.04 | 0.02 | 0 0 2 | 4.895 |
| 7.06 | 0.05 | 0 2 2 | 6.922 |
| 8.31 | 0.02 | 1 1 3 | 8.117 |
| 8.73 | 0.12 | 2 2 2 | 8.478 |
| 10.02 | 0.06 | 0 0 4 | 9.790 |
Погружение в коллоидный раствор сеточек, покрытых пленками из a-SiO2, на длительное время также приводило к осаждению на них больших скоплений НЧ. Однако в этом случае такие скопления представляли собой преимущественно монослойные образования, благодаря чему НЧ хорошо визуализировались в ПЭМ (рис. 4а). Еще меньшую плотность НЧ в скоплениях удавалось получить путем последовательного нанесения и высушивания на сеточках с пленками из а-SiO2 отдельных капелек коллоидного раствора (рис. 4б). Таким образом было определено, что в образцах коллоидных растворов преобладают сферические частицы серебра со средним размером около 17 нм (и среднеквадратичным разбросом по размерам ±4 нм). Возраст коллоидного раствора и время нахождения подложки в контакте с ним не оказали заметного влияния ни на морфологию, ни на размеры НЧ серебра в осадках. В частности, не было замечено каких-либо существенных различий между НЧ в растворах, приготовленных за 4 дня или за 4.5 мес. до анализа.
Рис. 4.
ПЭМ-изображения отдельных скоплений НЧ серебра, осажденных на сеточки, покрытые слоем а-SiO2, в результате: (а) погружения сеточки в коллоидный раствор на неделю и (б) последовательного высушивания на сеточке 2-х капель (по 8 мкл) раствора. В обоих случаях коллоидный раствор был одним и тем же, возрастом около 4.5 месяца.
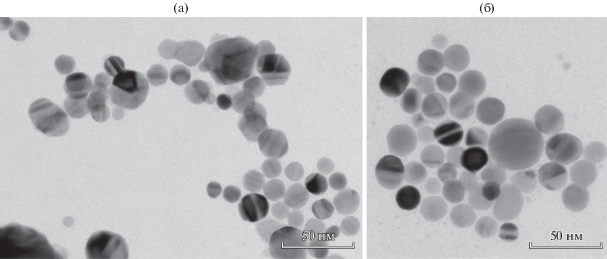
Необходимо отметить, однако, что при описанных способах осаждения золей для ПЭМ-исследований НЧ коллоидного серебра являлись не единственными образованиями, наблюдаемыми на подложках. Напротив, сферические НЧ Ag составляли только часть осадка наряду с другими, морфологически отличными от них образованиями. Так, на всех подложках, погружавшихся в коллоидный раствор, обнаруживалось присутствие большого числа крупных монокристаллических фрагментов пластинчатой формы размером от долей микрона до единиц микрон, ориентированных параллельно плоскости подложки. Одну такую пластинку можно видеть на рис. 3а (она обозначена буквой В) в окружении конгломератов из НЧ (А), в центре всего скопления. Электронограмма, полученная для любой части пластинки (рис. 3в), изображает единственную обратную решетку, т.е. вся пластинка является монокристаллом. Части пластинки, покрытые конгломератами из НЧ серебра (участок A + B на рис. 3а), дают электронограммы, которые включают как обратную решетку монокристаллической пластинки, так и наложенные на нее кольца, состоящие из рефлексов от нанопорошка серебра (рис. 3г).
На рис. 5 показаны различные морфологические типы пластинок Ag, образующиеся на ПЭМ-подложках в зависимости от условий приготовления наносуспензий и времени их контакта с подложкой. Из свежеприготовленной наносуспензии на подложках из a-SiO2 формируются тонкие островковые пленки с разветвленной (дендритоподобной) структурой (рис. 5а, 5б), являющиеся, между тем, монокристаллами (рис. 5в). Однако из суспензии возрастом 4.5 мес. на подложках при тех же условиях осаждения возникают большие ограненные пластинчатые кристаллы (рис. 5г и 5д). Островковые монокристаллические пленки образуются также и при высыхании капли суспензии на сеточке при условии, что процесс сушки затягивается на несколько часов (например, при сушке в небольшом замкнутом объеме, рис. 5е–5з).
Рис. 5.
ПЭМ-анализ пластинок серебра (В), образующихся в различных условиях. (а–д) Образцы получены погружением сеточки, покрытой a-SiO2, в наносуспензию на неделю. (а–в) Свежая суспензия, (г, д) состаренная суспензия. (е–з) Образец получен высушиванием 3-х капель состаренной суспензии на сеточке с углеродной пленкой в пластиковом контейнере в течение дня.

Во всех случаях дифракционные картины из пластинок (рис. 3в, 5в, вставки на рис. 5г и 5д, рис. 5з), независимо от их морфологии, представляют собой одну и ту же плоскость (001) обратной решетки серебра с гексагональной плотноупакованной (ГПУ) структурой типа Ag-4H (пространственная группа $P{{{{{\text{6}}}_{{\text{3}}}}} \mathord{\left/ {\vphantom {{{{{\text{6}}}_{{\text{3}}}}} {mmc}}} \right. \kern-0em} {mmc}}$). Это означает, что серебряные пластинки первоначально в растворе не присутствовали, а выросли на плоских подложках из содержащего серебро раствора в процессе пробоподготовки. На это указывает идентичный габитус всех лежащих на подложке пластинок, совпадающий с плоскостью (001) гексагональной структуры, нормаль к которой обычно является направлением роста для гексагональных кристаллов. Исследование механизма роста серебряных пластинок на сетке не являлось целью данной работы, тем не менее, можно предположить, что он обусловлен восстановлением ионов серебра присутствующих в дисперсионной среде наносуспензии. Так, схожее явление наблюдали авторы [45], когда на медной сетке очень быстро (в течение нескольких минут) вырастали серебряные дендриты из 0.1 М раствора нитрата серебра (при комнатной температуре).
Как показал анализ дифракционных картин от осадков, полученных на подложках всеми способами, в них, помимо серебра, присутствует также вещество неизвестного состава (обозначенное нами n-Х). Предположительно, ему соответствуют мелкие круглые НЧ с более светлым, чем у НЧ серебра контрастом, видимые на ПЭМ-снимках после высушивания маленьких капель суспензии (рис. 6). Согласно данным электронной дифракции эти НЧ с большой долей вероятности имеют состав AgCl. На это указывают первые наиболее интенсивные отражения для n-Х, которые с хорошей точностью совпадают с отражениями 111, 002 и 022 от порошка AgCl.
3.3. Электроспрейная масс-спектрометрия
Среди анионов было обнаружено преобладающее количество динитроаргентата ${\text{Ag}}({\text{N}}{{{\text{O}}}_{{\text{2}}}})_{2}^{ - }$ (рис. 7), пики с m/z 198.8877 и 200.8873. Также наблюдается некоторое количество нитратных $\left( {{\text{NO}}_{3}^{ - }} \right)$ и гидросульфатных $\left( {{\text{HSO}}_{4}^{ - }} \right)$ анионов, пики c m/z 61.9861 и 96.9574 соответственно. Гидрокарбонатные анионы ${\text{HCO}}_{3}^{ - }$ (m/z 60.96) присутствуют в небольшом количестве, на основании чего можно предположить, что значительная их часть находится в составе ДЭС. Это предположение подтверждается масс-спектром исходной дистиллированной воды (рис. 8), где преобладающим анионом является ${\text{HCO}}_{3}^{ - }$ (m/z 60.9573). Упомянутые азотсодержащие анионы, по-видимому, образуются в плазмохимических реакциях с участием растворенных компонентов воздуха. Этот процесс сопровождается ростом удельной электропроводности дисперсионной среды. Отметим, что возраст исследуемого коллоидного раствора составлял в этом случае 5 месяцев.
Рис. 7.
Обзорный масс-спектр коллоидного раствора серебра в отрицательных ионах, в правом углу – изотопная картина динитроаргентат-аниона.

Катионы, присутствующие в коллоидном растворе серебра, гораздо разнобразнее, чем анионы. В масс-спектрах регистрируются катионы серебра (изотопы с m/z 106.9057 и 108.906) и комплексные ионы состава Ag(NH3)+ (124.87) и Ag(NH3)(H2O)+ (141.9426) (рис. 9). Все серебросодержащие ионы дают двойные пики со схожей интенсивностью, так как серебро имеет два стабильных изотопа примерно равной распространенности. Кроме того, в масс-спектрах положительных ионов видны интенсивные линии с m/z 149.024, 279.160 и 301.143, а также сдвоенный пик около m/z 385, соответствующие протонированной молекуле дибутилфталата, ее фрагменту (протонированный фталевый ангидрид), кластеру дибутилфталата с катионом натрия и кластеру дибутилфталата с катионом серебра. Дибутилфталат является распространенным загрязнителем воды, поскольку служит пластификатором и вымывается из любых пластиковых сосудов (в том числе из ПЭТФ-бутыли, в которой хранилась суспензия) [46]. Азотсодержащие ионы, по всей видимости, являются продуктами плазмохимических реакций воды и растворенных в ней компонентов воздуха, инициированными электроискровым разрядом [47]. Реакции короткоживущих промежуточных продуктов в плазме определяют такой разнообразный ионный состав суспензии. Появление аммиаксодержащих ионных комплексов может быть обусловлено каталитическим синтезом аммиака на поверхности серебряных электродов при протекании электрического разряда [48]. Наблюдение аммиаксодержащих комплексов – частое явление в электроспрейной масс-спектрометрии [49].
3.4. Малоугловое рассеяние рентгеновских лучей
В дополнение к проведенным исследованиям нами для изучения синтезированных наносуспензий Ag был применен метод МУРР [50]. Его преимуществом является возможность исследования НЧ в растворе без предварительной подготовки образца и, как следствие, получение структурной информации in situ. Этот метод позволяет оценить форму и степень агрегации НЧ, определить такие их параметры, как длина, толщина, радиус и т.п. [51].
Методом МУРР был проанализирован коллоидный раствор серебра возрастом 5 месяцев. С помощью программы Primus пакета ATSAS [52] определили значения радиусов гирации частиц – инвариантов, получаемых из кривых малоуглового рассеяния. В рамках приближения вытянутых частиц получены размеры исследуемых НЧ серебра. Из графика ln(Iq) от q2 (рис. 10) был вычислен радиус гирации Rc = 8.7 ± 0.1 нм, что соответствует поперечному размеру частиц 17.4 нм. Используя приближение Гинье (зависимость ln I от q2), получили радиус гирации Rg = 19.6 ± 0.3 нм и, применяя формулу L = [12(Rg – Rc)]1/2 [51], нашли длину вытянутых частиц L = 60.9 ± 1.2 нм. Дальнейшая обработка кривых интенсивности рассеяния рентгеновского излучения на исследованных образцах путем аппроксимации экспериментальных кривых теоретическими функциями произведена с использованием программ Fitter [53] и SasView [54]. Результаты обработки показывают, что, судя по критерию χ2 Пирсона и величине невязок, наиболее правдоподобной является модель цепочек из четырех шариков с учетом полидисперсности их диаметров 42% по логнормальному распределению (полидисперсность – отношение среднеквадратичного отклонения к среднему значению диаметра, выраженное в процентах).
Рис. 10.
Зависимость натурального логарифма произведения интенсивности рассеянного рентгеновского излучения I и переданного импульса q от квадрата переданного импульса q2.

Модель отдельных шарообразных НЧ оказалась неприменимой для аппроксимации экспериментальных кривых, что свидетельствует об агрегации НЧ в растворе (см. рис. 11). Этот вывод справедлив, по крайней мере, для исследованных наносуспензий возрастом 5 месяцев. Среднее значение диаметра шарика в цепочке составило 14.8 нм, что, с учетом разброса, находится в разумном согласии с приведенными выше параметрами для вытянутых частиц, вычисленными на основании инвариантов. Экспериментальная кривая малоуглового рассеяния и аппроксимирующая кривая модели цепочки шариков представлены на рис. 11.
Рис. 11.
Зависимость интенсивности рассеянного рентгеновского излучения от переданного импульса для образца коллоидного раствора серебра. Свет-лыми кружками представлены данные эксперимента, сплошной линией – аппроксимация при помощи модели цепочки шариков, пунктирной линией – аппроксимация при помощи модели одиночных шариков.
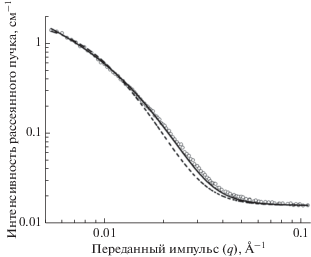
На основании полученных с помощью МУРР данных нельзя сделать однозначный вывод о структурно-морфологических характеристиках исследованного раствора. Однако можно предположить, что, по всей вероятности, в нем наряду с индивидуальными НЧ в небольшом количестве присутствуют агрегаты малой кратности. Это предположение согласуется с данными сканирующей электронной микроскопии, полученными для НЧ, иммобилизованных на поверхности полимерной трековой мембраны [9], а также с наблюдениями, сделанными в [20]. Существенная доля НЧ на поверхности трековой мембраны находилась в виде агрегатов, в том числе и цепочечных. Также это предположение не противоречит данным спектроскопии поглощения, т.к. согласно наблюдениям, сделанным в [41], агрегаты малой кратности, присутствующие в небольшом количестве, не вносят заметного вклада в спектр.
Полученные сведения о характере агрегации НЧ Ag в коллоидном растворе необходимы для понимания возможности формирования из него ГКР-структур на поверхности, например, трековых мембран [9]. Невысокий потенциальный барьер позволяет НЧ объединяться в небольшие агрегаты, на которых коэффициент усиления электромагнитного поля будет больше на несколько порядков по сравнению с индивидуальными НЧ. Таким образом, небольшой (по абсолютной величине) дзета-потенциал НЧ серебра, полученных электроискровым разрядом, приводящий к их умеренной агрегации в цепочки, позволяет применять данный коллоидный раствор в спектроскопии ГКР.
3.5. Состав наносуспензии
Методом АЭС ИСП установлено, что общее содержание серебра в наносуспензии – в ионной форме и в виде металлических НЧ – составляет 7.4 мг/л (данные получены для суспензии возрастом 8 месяцев).
Важным вопросом остается количественная оценка распределения серебра между твердой фазой (наночастицы) и дисперсионной средой. Электроспрейная масс-спектрометрия продемонстрировала, что доля серебросодержащих ионов среди всех однозарядных ионов (положительных и отрицательных) весьма значительна. ПЭМ показала, что при упаривании (высушивании) суспензии образуется заметное количество вещества, не являющегося коллоидным серебром. Исходя из этого можно предполагать, что увеличение удельной электропроводности среды в процессе синтеза на Δk = 5 мкСм/cм в значительной мере обусловлено серебросодержащими ионами.
Полагая, что половина прироста электропроводности приходится на серебросодержащие ионы, и беря для их средней эквивалентной электропроводности типичное значение λ = = 55 Ом–1 моль–1 см2, рассчитаем концентрацию cAg серебра в растворе:
На все изученные в работе свойства коллоидного раствора (размер, форма и характер агрегации НЧ, ионный состав дисперсионной среды) оказывает влияние исходная реакционная среда – дистиллированная вода. Несмотря на длительную стабильность наносуспензий, синтезированных в дистиллированной воде, их параметры могут немного различаться ввиду того, что состав дистиллированной воды в определенной мере случаен. Кроме того, значение ζ-потенциала НЧ, равное ‒25 мВ, характерно для умеренно стабильной суспензии [39], а концентрации серебра в суспензии составляет 7.4 мг/л. Для строгой воспроизводимости результатов и получения высокостабильного коллоидного раствора с бóльшими значениями концентрации серебра и ζ-потенциала НЧ необходимо вести синтез в деионизованной воде с контролируемым введением добавок, формирующих ионный состав ДЭС наночастиц. В частности, в качестве источника карбонат-ионов и дополнительных ионов Ag можно использовать карбонат серебра. При этом необходимо учитывать, что сильное повышение устойчивости коллоидного раствора может негативно сказаться на применении его в спектроскопии ГКР, а значительное увеличение концентрации ионов серебра, напротив, может привести к сжатию ДЭС, понижению дзета-потенциала НЧ и дестабилизации суспензии.
4. ЗАКЛЮЧЕНИЕ
Исследованы структурные характеристики и ионный состав коллоидного раствора (наносуспензии) серебра, полученного методом электроискрового разряда в дистиллированной воде. Раствор стабилен в течение длительного времени (до года) при хранении в темноте. Отметим, что нами не было обнаружено работ, в которых подобные долгоживущие коллоидные растворы получали бы электроискровым разрядом без введения стабилизирующих добавок. Впервые применен метод электроспрейной масс-спектрометрии для анализа таких растворов, позволивший обнаружить, что серебро находится в разнообразных катионных и анионных формах. Гидрокарбонатные анионы присутствуют в растворе в небольшом количестве по сравнению с исходной дистиллированной водой, на основании чего можно предположить, что значительная их часть входит в состав ДЭС. Определено общее содержание серебра в растворе, приведена оценка его распределения между твердой и ионной фазами. Благодаря варьированию методов подготовки образцов для ПЭМ получены электронные дифрактограммы порошка НЧ серебра с ГЦК-структурой, а также обнаружен эффект роста пластинок серебра с ГПУ-структурой на подложке в процессе пробоподготовки. Показаны различия в морфологии наносуспензий разного возраста, а также данных, получаемых методом ПЭМ, в зависимости от природы аморфной подложки.
Список литературы
Vo-Dinh T., Hiromoto M.Y.K., Begun G.M., Moody R.L. // Anal. Chem. 1984. V. 56. P. 1667.
Kneipp K., Wang Y., Kneipp H., Perelman L., Itzkan I., Dasari R., Feld M. // Phys. Rev. Lett. 1997. V. 78. P. 1667.
Nie S., Emory S.R. // Science. 1997. V. 275. P. 1102.
Gunnarsson L., Rindzevicius T., Prikulis J., Kasemo B., Kall M., Zou S., Schatz G. // J. Phys. Chem. B. 2005. V. 109. P. 1079.
García-Vidal F.J., Pendry J.B. // Phys. Rev. Lett. 1996. V. 77. P. 1163.
Lee P.C., Meisel D. // J. Phys. Chem. 1982. V. 86. P. 3391.
Schneider S., Halbig P., Grau H., Nickel U. // Photochem. Photobiol. 1994. V. 60. P. 605.
Munro C.H., Smith W.E., Garner M., Clarkson J., White P.C. // Langmuir. 1995. V. 11. P. 3712.
Криставчук О.В., Никифоров И.В., Кукушкин В.И., Нечаев А.Н., Апель П.Ю. // Коллоид. журн. 2017. Т. 79. С. 596.
Taurozzi J.S., Tarabara V.V. // Environ. Eng. Sci. 2007. V. 24. P. 122.
Grabar K.C., Hommer M.B., Natan M.J., Freeman R.G. // Anal. Chem. 1995. V. 67. P. 735.
Wang H., Levin C.S., Halas N.J. // J. Am. Chem. Soc. 2005. V. 127. P. 14992.
Копицын Д.С., Котелев М.С., Зиангирова М.Ю., Гущин П.А., Новиков А.А. // Башкирский хим. журн. 2014. Т. 21. № 4. С. 104.
Aggarwal R.L., Farrar L.W., Greeneltch N.G., Van Duyne R.P., Polla D.L. // Appl. Spectrosc. 2012. V. 66. P. 740.
Дементьева О.В., Мальковский А.В., Филиппенко М.А., Рудой В.М. // Коллоид. журн. 2008. Т. 70. С. 607.
Pastoriza-Santos I., Liz-Marzán M. // Langmuir. 1999. V. 15. P. 948.
Скатова А.В., Сарин С.А., Щипунов Ю.А. // Коллоид. журн. 2020. Т. 82. С. 377.
Treshchalov A., Tsarenko S., Avarmaa T., Saar R., Lohmus A., Vanetsev A., Sildos I. // Plasma Med. 2016. V. 6. P. 85.
Ashkarran A.A. // Curr. Appl. Phys. 2010. V. 10. P. 1442.
Абхалимов Е.В., Ершов В.А., Ершов Б.Г. // Коллоид. журн. 2017. Т. 79. С. 700.
Kerker M. // J. Colloid Interface Sci. 1985. V. 105. P. 297.
Evanoff D.D., Chumanov G. // ChemPhysChem. 2005. V. 6. P. 1221.
Moores A., Goettmann F. // New J. Chem. 2006. V. 30. P. 1121.
Paramelle D., Sadovoy A., Gorelik S., Free P., Hobley J., Fernig D.G. // Analyst. 2014. V. 139. P. 4855.
Xu M., Dignam M.J. // J. Chem. Phys. 1994. V. 100. P. 197.
Kreibig U., Genzel L. // Surf. Sci. 1985. V. 156. P. 678.
Tseng K.H., Lee H.L., Liao C.Y., Chen K.C., Lin H.S. // J. Nanomater. 2013. V. 2013. Article ID 174939.
Остроухов Н.Н., Тянгинский А.Ю., Слепцов В.В., Церулев М.В. // Физика и химия обработки материалов. 2013. № 1. С. 77.
Tseng K.H., Liao C.Y., Tien D.C. // J. Alloys Compd. 2010. V. 493. P. 438.
Tien D.C., Tseng K.H., Liao C.Y., Huang J.C., Tsung T.T. // J. Alloys Compd. 2008. V. 463. P. 408.
Lo C.H., Tsung T.T., Lin H.M. // J. Alloys Compd. 2007. V. 434–435. P. 659.
Rashed H.H. // J. Eng. Technol. 2016. V. 34. P. 295.
Rebollo-Plata B., Sampedro M.P., Gallardo-Gómez G., Ortega-Miranda N., Bravo-Barrera C.F., Daniel-Pérez G., Zenteno-Mateo B., Hernández-Cruz D., Jiménez-Sandoval S. // Rev. Mex. Fís. 2014. V. 60. P. 227.
Sulaimankulova S., Omurzak E., Jasnakunov J., Abdykerimova A., Gafforova H., Mametova A. // J. Clust. Sci. 2009. V. 20. P. 37.
Chen L.C., Tien D.C., Van Thai N., Ashraf S. // J. Nanomater. 2010. V. 2010. Article ID 634757.
El-Khatib A.M., Badawi M.S., Ghatass Z.F., Mohamed M.M., Elkhatib M. // J. Clust. Sci. 2018. V. 29. P. 1169.
Ashkarran A.A., Irajizad A., Ahadian M.M., Hormozi Nezhad M.R. // EPJ Appl. Phys. 2009. V. 48. 10601.
Tilaki R.M., Irajizad A., Mahdavi S.M. // Appl. Phys. A. 2006. V. 84. P. 215.
Bhattacharjee S. // J. Control. Release. 2016. V. 235. P. 337.
Tseng K.-H., Chen Y.-C., Shyue J.-J. // J. Nanoparticle Res. 2011. V. 13. P. 1865.
Meyer M., Le Ru E.C., Etchegoin P.G. // J. Phys. Chem. B. 2006. V. 110. P. 6040.
Martyanov T., Klimenko L.S., Kozlovskiy V.I., Ushakov E.N. // Tetrahedron. 2017. V. 73. P. 681.
Murugova T.N., Vlasov A., Ivankov O., Rogachev A., Ryzhykau Y., Soloviov D., Zhigunov A., Zinovev E., Kovalev Y., Round A., Gordeliy V., Kuklin A. // J. Optoelectron. Adv. Mater. 2015. V. 17. P. 1397.
Nyam-Osor M., Soloviov D., Kovalev Y., Zhigunov A., Rogachev A., Ivankov O., Erhan R., Kuklin A. // J. Phys.: Conf. Ser. 2012. V. 351. P. 1.
Nadagouda M.N., Varma R.S. // Aust. J. Chem. 2009. V. 62. P. 260.
Miles D.C., Briston J.H. Polymer Technology. 3rd Ed. N.Y.: Chem. Publ. Co., 1996.
Malik A.M., Ghaffar A., Malik S.A. // Plasma Sources Sci. Technol. 2001. V. 10. P. 82.
Yin K.S., Venugopalan M. // Plasma Chem. and Plasma Proc. 1983. V. 3. P. 343.
Cech N.B., Enke C.G. // Mass Spectrom. Rev. 2001. V. 20. P. 362.
Фейгин Л.А. Свергун Д.И. Рентгеновское и нейтронное малоугловое рассеяние. М.: Наука, 1986.
Zabelskii D., Vlasov A., Ryzhykau Y., Murugova T., Brennich M., Soloviov D., Ivankov O., Borshchevskiy V., Mishin A., Rogachev A., Round A., Dencher N., Büldt G., Gordeliy V., Kuklin A. // J. Phys.: Conf. Series. 2018. V. 994. 012017.
Franke D., Petoukhov M., Konarev P., Panjkovich A., Tuukkanen A., Mertens H., Kikhney A., Hajizadeh N., Franklin J., Jeffries C., Svergun D. // J. Appl. Cryst. 2017. V. 50. P. 1212.
Soloviev A.G., Murugova T.N., Islamov A.H., Kuklin A.I. // J. Phys.: Conf. Ser. 2012. V. 351. 012027.
Doucet M., Cho J., Gervaise A., Bakker J., Bouwman W., Butler P., Washington A. // SasView Version 4.1, Zenodo. 2017.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал





