Коллоидный журнал, 2021, T. 83, № 6, стр. 682-689
Влияние гидрофобности антибактериальных пептидов Galleria mellonella на параметры их хроматографического удерживания
К. Е. Полунин 1, О. С. Федоткина 2, И. А. Полунина 1, А. К. Буряк 1, *
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, Россия
2 ООО “СамараНИПИнефть”
443010 Самара, Вилоновская ул., 18, Россия
* E-mail: akburyak@mail.ru
Поступила в редакцию 11.06.2021
После доработки 25.08.2021
Принята к публикации 27.08.2021
Аннотация
Гидрофобность антибактериальных пептидов Galleria mellonella, рассчитанная с помощью алгоритмов HyperChem и SSRCalc аддитивной модели хроматографического разделения, сопоставлена с экспериментальными данными о разделении этих пептидов методом обращенно-фазовой высокоэффективной жидкостной хроматографии на SiO2-С18. Обнаружено, что существуют группы пептидов различного строения и функциональности, для которых удается добиться адекватного описания хроматографического поведения на основе предварительной оценки их гидрофобности. Внутри этих групп возможно предсказание величин удерживания пептидов для их идентификации.
ВВЕДЕНИЕ
Пептиды гемолимфы личинок гусеницы Galleria mellonella (GM), проявляющие антибактериальную активность – это биомолекулы массой до 5 кДа, в составе которых присутствуют аминокислоты с кислыми и основными свойствами, разной полярностью и гидрофобностью [1]. Гидрофобность белков и пептидов используется для оценки их биологических свойств, она влияет на их взаимодействие между собой и с клеточной мембраной, встраивание в неполярную липидную среду, образование комплексов рецептор–лиганд, распределение в тканях. Гидрофобный эффект играет существенную роль в формировании биоструктур, представляя собой один из основных факторов их стабилизации. Наиболее распространенным методом измерения гидрофобности аминокислот является анализ их распределения между двумя несмешивающимися жидкими фазами. Система октанол/вода широко используется для оценки биологической активности молекул, т.к. она моделирует систему липиды/вода. Для такой системы существует детально разработанная методика расчета коэффициентов распределения веществ разного состава и строения [2, 3]. Аддитивные модели хроматографического разделения пептидов могут более или менее точно предсказывать время их удерживания и порядок элюирования в предположении, что характер взаимодействия пептидов с поверхностью сорбента определяется суммарным эффектом различных взаимодействующих участков, рассредоточенных по всей аминокислотной цепочке [4]. Одним из наиболее успешных методов описания гидрофобного эффекта является эмпирическая концепция LSS (Linear Solvent Strength), полагающая, что линейная корреляция хроматографических данных является следствием теории линейной силы растворителя, предложенной Снайдером [5]. Обнаружение зависимости степени удерживания небольших пептидов и пептидных гормонов от суммарной степени гидрофобности для большинства гидрофобных аминокислотных остатков пептида [6] позволило использовать значения lg P ' (коэффициента распределения в системе октанол/вода) для прогнозирования времени удерживания tR пептидов в обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ ВЭЖХ). Однако для больших макромолекул это соотношение выполняется не всегда, так как в этом случае процесс разделения идет как по адсорбционному, так и по эксклюзионному механизму [4, 6].
В работе [7] было предложено использовать в качестве нормализованных времен удерживания значения относительной гидрофобности P пептидов, полученные с помощью алгоритма SSRCalc (Sequence Specific Retention Calculator) расчета времени удерживания по аминокислотной последовательности [8, 9]. В основе алгоритма SSRCalc лежит многопараметрическая оптимизация свободных параметров модели разделения пептидов для конкретных условий ВЭЖХ. Такой подход основан на линейной зависимости tR от P для набора пептидов, потенциально принадлежащих идентифицируемому белку.
Одним из перспективных направлений в области количественного анализа и идентификации белков методами хромато-масс-спектрометрии является подход, основанный на использовании баз данных точных масс и хроматографических времен удерживания пептидных маркеров белков. Он реализован в модели многоточечной нормализации [10], базирующейся на концепции линейности хроматографических данных, полученных в различных условиях разделения, типичных для протеомных исследований.
Расчетные методы прогнозирования, основанные на моделях, связывающих хроматографическое удерживание с параметрами гидрофобности сорбатов, хорошо работают в случаях, когда детальные исследования проводятся для какого-нибудь одного ограниченного класса соединений. В составе иммунизированной гемолимфы GM содержатся представители разных классов органических соединений [11, 12]. Поскольку невозможно полностью учесть все молекулярные взаимодействия в такой хроматографической системе, то желательно использовать простую и универсальную модель. Алгоритм SSRCalc в настоящее время считается наиболее точным алгоритмом вычисления времен удержания триптических пептидов и широко используется в протеомных исследованиях. Применение этого подхода ограничено условиями, типичными для протеомных исследований с использованием методов хроматографии и масс-спектрометрии [13]. Однако изменение размера пор сорбента или профиля градиента элюента потребует перенастройки всей программы SSRCalc.
Комбинация методов ОФ ВЭЖХ и масс-спектрометрии (МС) с матрично-активированной лазерной десорбцией/ионизацией (МАЛДИ) при исследовании пептидов существенно облегчает их поиск и разделение в сложных смесях [14, 15]. Точное время выхода пептида из колонки и установленная масса пептида создают в совокупности массово-временную метку пептида, которая почти однозначно его идентифицирует.
Биоактивные пептидные продукты, получаемые на основе иммунных реакций насекомых, являются основой для разработки новых фармакологических средств – альтернативы используемым в настоящее время антибиотикам. Механизм антимикробной активности пептидов в живых организмах во многих случаях сходен с их хроматографическим поведением (сорбция, изменение конформации, взаимодействие гидрофобных и гидрофильных участков). Все это указывает на перспективность применения хроматографических методов для изучения биологической активности пептидов.
Целью данной работы является сопоставление экспериментальных данных о параметрах хроматографического удерживания антибактериальных пептидов гемолимфы GM на сорбенте SiO2-С18 с теоретическими расчетами времен удерживания этих пептидов на основе их гидрофобности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Антибактериальные пептиды индуцировались в гемолимфе личинок GM в результате их иммунизации бактериями Escherichia coli (E. coli) или несимметричным диметилгидразином [11, 12]. Способы получения гемолимфы личинок, подготовки образцов к биохимическим и физико-химическим исследованиям подробно описаны в [16].
Анализ и разделение антибактериальных пептидов методом ОФ ВЭЖХ проводили на колонке, заполненной силикагелем С18 (Zorbax Eclipse XDB-С18, Agilent Technologies, США), размером 150 × 4.6 мм (размер зерна 5 мкм, диаметр пор 80 Å), упакованной в жидкостной хроматограф Agilent 1200 с диодно-матричным детектором и программным обеспечением ChemStation А.10.02. Режимы градиентного элюирования приведены в табл. 1. В качестве стандартов выбраны антибактериальные пептиды Nisin и Galleria defensin 1.
Таблица 1.
Условия хроматографического разделения антибактериальных пептидов Galleria mellonella на Zorbax Eclipse XDB-С18
| № | Элюенты | Режим градиентного элюирования |
Скорость элюента и T колонки, °C | Объем вводимой пробы, диапазон сбора фракций |
|---|---|---|---|---|
| 1 | 0.04% ТФУ* в воде (A)– AcCN** (B) | 5–80% B в диапазоне 0–30 мин, 80–100% B в диапазоне 30–32 мин |
0.5 мл/мин, 25°C |
20 мкл, 1–30 мин (через 1 мин) |
| 2 | 0.04% ТФУ в воде (A)– 0.04% ТФУ в AcCN (B) | 5–80% B в диапазоне 0–30 мин, 80–100% B в диапазоне 30–32 мин |
0.5 мл/мин, 25°C |
60 мкл, 3–9 мин (через 3 мин), 9–21.5 мин (через 0.5 мин), 21.5–30.5 мин (через 3 мин) |
| 3 | 0.04% ТФУ в воде (A)– 0.04% ТФУ в AcCN (B) | 10% B в диапазоне 0–5 мин, 10–80% B в диапазоне 5–45 мин |
0.5 мл/мин, 25°C |
25 мкл, 5–45 мин (через 1 мин) |
Масс-спектрометрическое исследование фракций гемолимфы GM методом МАЛДИ проводили с помощью масс-спектрометра UltraFlex II TOF (Bruker Daltonics, Германия), оснащенного азотным лазером (λ = 337, энергия лазерного излучения 110 кДж, частота импульса до 20 Гц), времяпролетным масс-анализатором с рефлектоном и программным обеспечением для сбора и обработки масс-спектров FlexControl 3.4 и FlexAnalysis 3.4. Ускоряющее напряжение составляло 25 кВ. Масс-спектры получали в режиме регистрации положительных ионов. Фрагментацию исходных метастабильных протонированных молекул пептидов в режиме распада за пределами ионного источника изучали с помощью масс-спектрометра UltraFlex II TOF-TOF (Bruker Daltonics), оснащенного неодимовым лазером (λ = 355 нм, энергия лазерного излучения 105 кДж, частота импульса до 20 Гц) и времяпролетным масс-анализатором с рефлектоном. Масс-спектры ионов-продуктов регистрировали методом LIFT (Bruker Daltonics). Начальное напряжение и ускоряющая разность потенциалов были равны 7 и 28 кВ соответственно. Точность измеренных моноизотопных масс [M + H]+ в режиме рефлектрона составляла 0.007%, точность измеренных усредненных масс в линейном режиме – 0.05–0.1%, точность измеренных масс фрагментов – 1–2 Да (0.02–0.1%).
Образцы для МАЛДИ готовили на мишенях AnchorChip с матрицей DHB (2,5-дигидроксибензойной кислотой) от Bruker Daltonics. Смешивали 10 мкл пептидного раствора и 0.3 мкл раствора матрицы (10 мг/мл) в 20%-ном растворе ацетонитрила (AcCN) в воде с добавкой 0.5%-ного раствора трифторуксусной кислоты (ТФУ). Полученную смесь высушивали на воздухе при атмосферном давлении.
Использовали систему Mascot [17] для определения первичной структуры пептидов на основании информации, получаемой при их диссоциации. Поиск проводился по массам метастабильных протонированных молекул пептидов [M + H]+, полученным в работе [11] и присутствующим в базе данных NCBI [18]. Определение первичной структуры неизвестных пептидов проводили на основании результатов процедуры секвенирования de novo [19].
Гидрофобность пептидов рассчитывалась с помощью программы HyperChem 6.0 [20] на основании коэффициентов распределения в системе октанол/вода.
Для расчетов теоретических времен удерживания пептидов использовалась программа SSRCalc [9], основанная на аддитивной модели разделения пептидов и эмпирически определяемых коэффициентах гидрофобности.
Использовали AcCN (for HPLC, Aldrich, США), ТФУ (99%, Alfa Aesar, Германия) и тридистиллированную воду, очищенную на фильтрах Millipore (Milli-P QG, Waters, США).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В табл. 2 приведены антибактериальные пептиды, идентифицированные в составе гемолимфы иммунизированных личинок GM [11, 21].
Таблица 2.
Антибактериальные пептиды, обнаруженные в гемолимфе Galleria mellonella
| № | Пептид | Аминокислотная последовательность пептида* | Масса, M, Да | N** | pI*** |
|---|---|---|---|---|---|
| 1 | Cecropin-B analog | WKVFKKIEKIGRNIRNGIVKAG- PLIAVLGEAKAL | 3728 | 34 | 11.02 |
| 2 | Cecropin-D-like peptide | ENFFKEIERAGQRIRDAIISAAPAVETL- AQAQKIIKGGD | 4253 | 39 | 6.45 |
| 3 | Proline-rich antimicrobial peptide 1 | DIQIPGIKKPTHRDIIIPNWNPNVRTQP- WQRFGGNKS | 4320 | 37 | 10.99 |
| 4 | Galleria defensin 1 | DTLIGSCVWGATNYTSDCNAECKRRG- YKGGHCGSFLNVNCWCE | 4715 | 43 | 7.25 |
| 5 | Galleria defensin 2 | DTLIGRCVWGATNYTSDCNAE- CKRRGYKGGHCGSFLNVNCWCE | 4786 | 43 | 7.25 |
| 6 | Lebocin-like anionic peptide 1 | EADEPLWLYKGDNIERAPTTADHPILP- SIIDDVKLDPNRRYA | 4816 | 42 | 4.51 |
| 7 | Proline-rich antimicrobial peptide 2 | EIRLPEPFRFPSPTVPKPIDIDPILPHPWS- PRQTYPIIARRS | 4929 | 42 | 9.97 |
| 8 | Defensin-like peptide | DKLIGSCVWGATNYTSDCNAE- CKRRGYKGGHCGSFWNVNCWCEE | 4949 | 44 | 7.46 |
| 9 | Anionic antimicrobial peptide 2 | ETESTPDYLKNIQQQLEEYTKNFNTQVQ-NAFDSDKIKSEVNNFIESLGKILNTEKKEAPK | 6980 | 60 | 4.80 |
* Последовательность аминокислот (однобуквенный код) [21], ** N – число аминокислотных остатков в пептиде, *** pI – изоэлектрическая точка.
Дополнительно в составе контрольной и иммунизированной гемолимфы GM были обнаружены фермент Lysozyme, белки Apolipophorin-3 и Hemolymph protein precursor с молекулярной массой M = 27 кДа, обладающие антибактериальным действием [11] (табл. 3).
Таблица 3.
Экспериментальные значения логарифма фактора удерживания k антибактериальных пептидов Galleria mellonella и рассчитанные значения логарифмов их относительной гидрофобности P (SSRCalc) и коэффициента распределения в системе октанол/вода P ' (HyperChem)
| № пептида | Пептид | M, Да | lg k | lg P | lg P ' |
|---|---|---|---|---|---|
| 3 | Proline-rich antimicrobial peptide 1 | 4320 | 0.987 | 1.523 | –15.42 |
| 6 | Lebocin-like anionic peptide 1 | 4816 | 1.029 | 1.581 | |
| 4 | Galleria defensin 1 | 4715 | 1.055 | – | –12.24 |
| 1 | Cecropin-B analog | 3728 | 1.063 | 1.606 | –4.89 |
| 7 | Proline-rich antimicrobial peptide 2 | 4929 | 1.097 | 1.707 | 3.81 |
| 2 | Cecropin-D-like peptide | 4253 | 1.117 | 1.678 | 3.41 |
| 9 | Anionic antimicrobial peptide 2 | 6980 | 1.143 | 1.672 | |
| Lysozyme | 14 027 | 1.101 | 1.641 | ||
| Hemolymph protein precursor | 23 764 | 1.167 | 1.754 | ||
| Apolipophorin-3 | 18 075 | 1.196 | 1.698 |
Хроматографическое разделение антибактериальных пептидов и белков гемолимфы GM в режиме № 3 позволило определить их факторы удерживания k на SiO2-С18 и сопоставить порядок элюирования с мерой их гидрофобности (табл. 3).
Данные, полученные для всех пептидов, кроме № 4 (см. табл. 2), свидетельствуют о линейной зависимости lg k от lg P (рис. 1а), которую можно описать уравнением lg k = a lg P + b, где константы a = 0.9624, b = 0.5925 (коэффициент корреляции r 2 = 0.8013). Используя это уравнение и рассчитанный логарифм относительной гидрофобности lg P, можно предсказывать времена удерживания пептидов в данных хроматографических условиях.
Рис. 1.
Зависимость логарифма фактора удерживания lg k антибактериальных пептидов Galleria mellonella от логарифма относительной гидрофобности lg P (а) и от логарифма коэффициента распределения в системе октанол/вода lg P ' (б).

Особое поведение пептида № 4, по-видимому, обусловлено его структурой. Для дефензинов (Galleria defensin) характерно наличие трех дисульфидных мостиков, стабилизирующих третичную структуру. Кроме того, дефензины, как правило, имеют короткую N-концевую α-спираль и тройную структуру β-складчатого листа, которые по длине и взаимному расположению аналогичны. Наличие дисульфидных связей в первичной структуре Galleria defensin 1 и Nisin, отличает характер их взаимодействия с неполярной поверхностью силикагеля С18 от других пептидов, не содержащих этих связей.
Цекропины (Cecropin-B analog, Cecropin-D-like peptide) на основании аминокислотных последовательностей и структурных особенностей отнесены к линейным α-спиральным пептидам, не содержащим остатков цистеина, а пролинсодержащие пептиды (Proline-rich antimicrobial peptide 1 и Proline-rich antimicrobial peptide 2) – к пептидам со сверхпредставлением пролина и глициновых остатков [21].
Использование программы HyperChem для расчетов факторов удерживания позволяет получить линейную зависимость lg k от lg P ' только для пяти антибактериальных пептидов (табл. 3, рис. 1б). Ее можно описать уравнением lg k = 161.13 lg P ' – ‒ 176.49 (коэффициент корреляции r 2 = 0.8013). Отсутствие линейной корреляции для анионных пептидов (Lebocin-like anionic peptide, Anionic antimicrobial peptide, Apolipophorin-3) связано с особенностями этих полярных соединений. Отклонения от линейной зависимости нередки, когда рассматриваются группы соединений, отличающихся не только гидрофобными фрагментами, но и характером функциональных групп. Возможно, отсутствие линейной корреляции связано также со спецификой расчета в программе HyperChem, поэтому продолжаются поиски моделей, связывающих параметры lg k и lg P ' более корректно.
В случае иммунизации GM высокими концентрациями несимметричного гидразина или E. coli детектирована (МАЛДИ-МС) индукция неизвестных пептидов массой до 4 кДа (табл. 4), образовавшихся, по-видимому, в результате окислительной деструкции пептидов. С помощью алгоритма SSRCalc для аминокислотных последовательностей ранее неизвестных пептидов GM (определенных методом МАЛДИ-МС), была рассчитана относительная гидрофобность lg P. На рис. 2 приведена зависимость порядка элюирования этих пептидов от их гидрофобности. Для разделения пептидов №№ 1–3, 6–10, 12–14, 16 (табл. 4) в режиме градиентного элюирования № 2 получена корреляционная зависимость lg k = = 1.7959 lg P – 0.2683.
Таблица 4.
Масса и аминокислотный состав протонированных молекул ранее неизвестных пептидов, обнаруженных в гемолимфе Galleria mellonella, иммунизированной 1%-ным раствором несимметричного диметилгидразина
| № пептида | [М + Н]+, Да | Аминокислотная последовательность пептидов |
|---|---|---|
| 1 | 1105 | PTDERLGYR |
| 2 | 1211 | CAELEKWWF |
| 3 | 1233 | RELESTLETR |
| 4 | 1241 | GLSVAQGRDALPG |
| 5 | 1359 | RRGNDNFRLDP |
| 6 | 1523 | WRSPSNPYPYKK |
| 7 | 1783 | KHESESEFLSESTQF |
| 8 | 1590 | HPTVVAYYCPMYF |
| 9 | 1927 | RMNYAASPFPSAHPHFV |
| 10 | 1948 | LYYKKKYKSNYHPNT |
| 11 | 2108 | DWPTTHTWLFHGKTWPP |
| 12 | 2185 | KAPETESGAAGGGSHSCVRSPLS |
| 13 | 2340 | GGASGHFNPYDYSYPNSPKWP |
| 14 | 2559 | CMSMWMCGKSSRIRYMMIHAH |
| 15 | 2563 | DHWWLSRVNEGCVRSKDLEHP |
| 16 | 3256 | PGAYYMMKAEMSVTYTACDEAKNYKRFS |
| 17 | 3731 | PVCGKCSHWAPNDFGNTTHLWVDPDWELKALHG |
| 18 | 4047 | RHALASLKDYTGTNKNHETHDKSKGCWWVSVVCYL |
Рис. 2.
Зависимость логарифма фактора удерживания от рассчитанного логарифма относительной гидрофобности для ранее неизвестных пептидов №№ 1–3, 6–10, 12–14, 16 (табл. 4), идентифицированных методом МАЛДИ-МС.

Обнаруженные корреляционные зависимости между логарифмами k и P, P ' могут служить основой для априорных расчетов как хроматографического удерживания, так и гидрофобности, они позволяют описать удерживание различных классов соединений единой моделью, могут стать основой для разработки способа идентификации новых антибактериальных пептидов.
Экспериментальные результаты определения времен удерживания пептидов tR в разных режимах разделения их смесей были сопоставлены с результатами расчетов tR, полученных методом SSRCalc для описания закономерностей хроматографического разделения пептидов в градиентной ОФ ВЭЖХ (табл. 5–7 ).
Таблица 5.
Физико-химические характеристики разделения смеси антибактериальных пептидов Galleria mellonella в условиях хроматографического режима № 1
| № пептида | Пептид | M, Да | k | tR, мин | |
|---|---|---|---|---|---|
| эксперимент | расчет (SSRCalc) | ||||
| 3 | Proline-rich antimicrobial peptide 1 | 4320 | 6.6 | 13.8 | 15.2 |
| 2f | Cecropin-D-like peptide | 2078 | 6.9 | 14.3 | 11.7 |
| 5 | Galleria defensin 2 | 4786 | 7.2 | 14.8 | 14.4 |
| 6 | Lebocin-like anionic peptide 1 | 4816 | 7.4 | 15.2 | 16.6 |
| 4 | Galleria defensin 1 | 4715 | 8.0 | 16.2 | 14.6 |
| 9f | Anionic antimicrobial peptide 2 | 3420 | 8.5 | 17.2 | 15 |
| 2f | Cecropin-D-like peptide | 3031 | 8.9 | 17.9 | 15.8 |
| 9 | Anionic antimicrobial peptide 2 | 6980 | 9.4 | 18.8 | 17.7 |
| 2 | Cecropin-D-like peptide | 4253 | 9.6 | 19.2 | 18.1 |
Таблица 6.
Физико-химические характеристики разделения смеси антибактериальных пептидов Galleria mellonella в условиях хроматографического режима № 3
| № пептида | Пептид | k | tR, мин | |
|---|---|---|---|---|
| эксперимент | расчет (SSRCalc) | |||
| 3 | Proline-rich antimicrobial peptide 1 | 9.6 | 26.8 | 26.5 |
| 6 | Lebocin-like anionic peptide 1 | 10.7 | 29.2 | 28.5 |
| 4 | Galleria defensin 1 | 11.4 | 30.9 | 25.5 |
| Nisin | 11.5 | 31.2 | 22.5 | |
| 1 | Cecropin-B analog | 11.6 | 31.4 | 30.5 |
| 7 | Proline-rich antimicrobial peptide 2 | 12.2 | 33.7 | 31.1 |
| 2 | Cecropin-D-like peptide | 13.1 | 35.2 | 30.6 |
| 9 | Anionic antimicrobial peptide 2 | 13.9 | 37.2 | 30.1 |
| Apolipophorin-3 | 15.7 | 41.7 | 33.4 | |
Для хроматографического режима № 1 (табл. 1) найдены удовлетворительные корреляции экспериментальных и расчетных времен удерживания антибактериальных пептидов GM (табл. 5). Программа SSRCalc адекватно описывает сорбционное поведение пептидов №№ 2, 3, 5, 6, 9 и несколько хуже – поведение фрагментов этих пептидов (2f, 9f) (табл. 5).
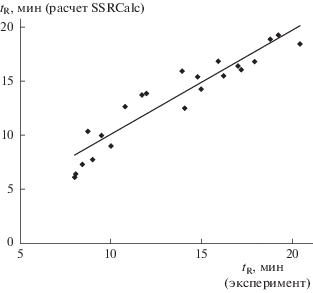
Для ранее неизвестных индуцированных пептидов GM (табл. 4) также получены удовлетворительные корреляции экспериментальных и рассчитанных времен удерживания в режиме разделения № 1 (рис. 3).
Рис. 3.
Сопоставление экспериментальных (режим разделения № 1) и рассчитанных (алгоритм SSRCalc) времен удерживания ранее неизвестных индуцированных антибактериальных пептидов Galleria mellonella (см. табл. 4).
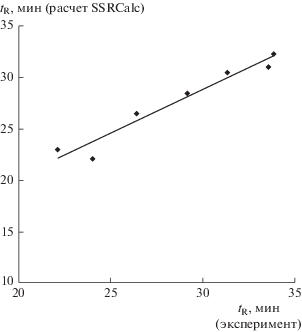
Антибактериальные пептиды в условиях хроматографического режима № 1 элюируются в диапазоне концентраций AcCN 35–55%, тогда как в условиях хроматографического режима № 3 – в диапазоне 45–75%. Столь большое различие обусловлено присутствием ТФУ в AcCN (табл. 1), которая является ион-парным агентом и поддерживает постоянное значение pH в течение всего процесса разделения. При разделении антибактериальных пептидов в режиме № 3 (табл. 1) хроматографическое поведение пептидов №№ 2 и 9 модель SSRCalc описывает недостаточно точно (табл. 6), в отличие от режима разделения № 1. Однако для других антибактериальных пептидов наблюдаются хорошие корреляции экспериментальных и расчетных времен удерживания. Линейные зависимости (рис. 4) получены для пептидов №№ 1, 3, 6, 7 и Lysozyme (табл. 2), а также неизвестных ранее пептидов №№ 14, 16 (табл. 4).
Рис. 4.
Сопоставление экспериментальных (режим разделения № 3) и рассчитанных (алгоритм SSRCalc) времен удерживания антибактериальных пептидов Galleria mellonella.
Таким образом, аддитивная схема расчета с помощью алгоритма SSRCalc позволяет добиться практически приемлемой надежности прогнозирования удерживания пептидов, а полученные корреляционные зависимости могут стать основой для разработки способа идентификации неизвестных антибактериальных пептидов.
Аддитивные модели расчетов хроматографических параметров разделения, основанные на суммировании инкрементов, особенно актуальны для пептидов, содержащих большое количество разных аминокислот, каждая из которых имеет различные взаимодействующие группы, распределенные по всей молекуле. Антимикробные цекропины (Cecropin-B analog и Cecropin-D-like peptide) – катионные α-спиральные пептиды, не содержащие остатков цистеина; к анионным пептидам относят Lebocin-like anionic peptide, Anionic antimicrobial peptide, Defensin-like peptide, Apolipophorin-3; структура пептидов Galleria defensin и Nisin стабилизирована дисульфидными мостиками, Proline-rich antimicrobial peptides 1 и 2 – пептиды со сверхпредставлением пролина и глициновых остатков [21]. Соотнесение экспериментальных и расчетных данных показывает, что не всегда экспериментально определенные и теоретически рассчитанные времена удерживания пептидов коррелируют друг с другом, что, по-видимому, обусловлено взаимодействием пептидов с сорбентом С18 не только за счет дисперсионных сил. В результате ни один из рассмотренных алгоритмов аддитивной модели (SSRCalc и HyperChem) полностью не описывает разделение всех антимикробных пептидов GM и продуктов их окислительной деструкции, но прогнозы, полученные с помощью алгоритма SSRCalc, экспериментально подтверждаются чаще. Наибольшие погрешности аппроксимации соответствуют пептидам с незащищенными концевыми группами, т.к. вклады этих полярных функциональных групп в баланс гидрофильных и гидрофобных свойств в системе, состоящей из водного раствора AcCN и алкильных групп С18, отличаются от аналогичного вклада в системе октанол/вода. Однако хроматографическое поведение некоторых пептидов при использовании разных режимов разделения описано с высокой точностью. При этом с изменением условий разделения (например, при переходе от режима № 1 к режиму № 3) изменяется точность описания моделью хроматографического поведения разных пептидов. Полученные данные о наиболее точном и корректном описании одних пептидов в режиме разделения № 1, а других пептидов – в режиме № 3 дополняют друг друга и могут рассматриваться в качестве одной из физико-химических характеристик разделения данных пептидов. Накопление экспериментальных данных по удерживанию пептидов в режиме ОФ ВЭЖХ позволит в дальнейшем корректировать имеющиеся модели физико-химического поведения этих соединений, создавать новые модели, обосновывать оптимальные условия разделения смесей, а при сочетании методов ОФ ВЭЖХ и МАЛДИ-МС проводить идентификацию компонентов сложных смесей пептидов.
ЗАКЛЮЧЕНИЕ
Экспериментально исследовано хроматографическое поведение в условиях ОФ ВЭЖХ на силикагеле С18 антибактериальных пептидов Galleria mellonella, их фрагментов и модификаций, индуцированных воздействием несимметричного диметилгидразина или бактериями E. coli на гемолимфу личинок GM. Установлено, что существуют группы пептидов разного строения и функциональности, для которых удается добиться адекватного описания хроматографического поведения на основе предварительной оценки их гидрофобности с помощью алгоритмов HyperChem и SSRCalc аддитивной модели хроматографического разделения. Внутри этих групп получены линейные зависимости факторов удерживания пептидов от их гидрофобности, позволяющие прогнозировать порядок элюирования.
Расчетные методы прогнозирования, связывающие хроматографическое удерживание с параметрами гидрофобности пептидов, хорошо работают в случае узких классов веществ, т. к. системы инкрементов в аддитивной модели расчетов разработаны для однотипных соединений. В составе иммунизированной гемолимфы GM присутствуют представители разных классов органических соединений, поэтому ни одна из рассмотренных аддитивных моделей полностью не описывает разделение всех антимикробных продуктов GM, но прогнозы, полученные с помощью алгоритма SSRCalc экспериментально подтверждались наиболее часто. Наблюдаемые отклонения от линейных зависимостей, вероятно, связаны с особенностями пептидов, различающихся не только гидрофобными фрагментами, но и природой функциональных групп. Однако все полученные закономерности в комплексе составляют основу, позволяющую описать хроматографическое поведение антибактериальных пептидов с разных сторон и тем самым выявить факторы, преимущественно определяющие их удерживание.
Список литературы
Cutuli M.A., Petronio J.P., Vergalito F., Magnifico I., Pietrangelo L., Venditti N., Di Marco R. // Virulence. 2019. V. 10. № 1. P. 527.
Leo A., Hansch C., Elkins D. // Chem. Rev. 1971. V. 71. № 6. P. 525.
Kundi V., Ho J. // J. Phys. Chem. B. 2019. V. 123. № 31. P. 6810.
Шатц В.Д., Сахартова О.В. Высокоэффективная жидкостная хроматография: Основы теории. Методология. Применение в лекарственной химии. Рига: Зинатне. 1988.
Snyder P.W., Mecinovic J., Moustakas D.T., Thomas S.W., Harder M. // PNAS. 2011. V. 108. P. 17889.
Высокоэффективная жидкостная хроматография в биохимии / Под ред. Хеншен А. и др. М.: Мир, 1988.
May D., Fitzgibbon M., Liu Y., Holzman T., Eng J., Kemp C.J., Whiteaker J., Paulovich A., McIntosh M. // J. Proteome Res. 2007. V. 6. P. 2685.
Krokhin O.V., Craig R., Spicer V., Ens W., Standing K.G., Beavis R.C., Wilkins J.A. // Mol. Cell. Proteomics. 2004. V. 3. P. 908.
http://hs2.proteome.ca/SSRCalc/SSRCalc32.html
Tarasova I.A., Guryča V., Pridatchenko M.L., Gorshkov A.V., Kieffer-Jaquinod S., Evreinov V.V., Masselon C.D., Gorshkov M.V. // J. Chromatogr. B. 2009. V. 877. P. 433.
Буряк А.К., Срибная О.С., Пурыгин П.П. // Биомедицинская химия. 2010. Т. 56. С. 387.
Полунин К.Е., Федоткина О.С., Полунина И.А., Буряк А.К. // Коллоид. журн. 2021. Т. 83. С. 611.
Николаев Е.Н., Попов И.А., Кононихин А.С., Индейкин М.И., Кукаев Е.Н. // Успехи химии. 2012. Т. 81. С. 1051.
Лебедев А.Т., Артеменко А.Т., Самгина Т.Ю. Основы масс-спектрометрии белков и пептидов. М.: Техносфера, 2012.
Тарасова А.И., Зубарев Р.А., Голобородько А.А., Горшков А.В., Горшков М.В. // Масс-спектрометрия. 2008. Т. 5. С. 7.
Пурыгин П.П., Срибная О.С., Кленова Н.А., Буряк А.К., Парамонов С.А., Литвинова Е.Г., Серебрякова М.В. // Сорбционные и хроматографические процессы. 2011. Т. 11. № 1. С. 42.
http://www.matrixscience.com/search_form_select.html
http://www.ncbi.nlm.nih.gov/guide/proteins/
Артеменко К.А., Самгина Т.Ю., Лебедев А.Т. // Масс-спектрометрия. 2006. Т. 3. С. 225.
http://www.hyper.com
Lange A., Beier S., Huson D.H., Parusel R., Iglauer F., Frick J.-S. // Genome Announc. 2018. V. 6. e01220-17.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


