Коллоидный журнал, 2021, T. 83, № 6, стр. 715-722
Влияние заместителя в β-циклодекстрине на характер взаимодействия комплексов левофлоксацин–β-циклодекстрин с липосомальной мембраной
А. С. Тычинина 1, *, А. А. Скуредина 1, И. М. Ле-Дейген 1, Е. В. Кудряшова 1
1 Московский государственный университет им. М.В. Ломоносова, химический факультет
119296 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: tychinina.a@yandex.ru
Поступила в редакцию 04.08.2021
После доработки 13.08.2021
Принята к публикации 17.08.2021
Аннотация
Исследовано влияние заместителя (полярного CH2CH(OH)CH3, гидрофобного CH3, заряженного ${{\left( {{\text{C}}{{{\text{H}}}_{{\text{2}}}}} \right)}_{{\text{4}}}}{\text{SO}}_{3}^{ - }$ (СБ)) в β-циклодекстрине (ЦД) на возникновение дефектов в липосомальном бислое, а также на взаимодействие с ним левофлоксацина (ЛВ) – антибактериального препарата класса фторхинолонов. Методом равновесного диализа показано, что 2-гидроксипропил-β-циклодекстрин вызывает возникновение наибольших дефектов в бислое. ЦД с гидроксипропильным (ГП-ЦД) и метильным (М-ЦД) заместителями усиливают взаимодействие ЛВ с липидным бислоем, о чем свидетельствуют данные спектроскопии кругового дихроизма. Все изученные в работе комплексы ЛВ с производными ЦД адсорбируются на бислое за счет электростатических взаимодействий между фосфатными группами липидов и несущим положительный заряд атомом азота в гетероцикле ЛВ. Усиление адсорбции ЛВ, связанного в комплексы с производными ЦД, на бислое проанализировано также путем измерений ζ-потенциала липосом. По мере увеличения содержания комплексов ЦД-ЛВ в дисперсии липосом, их ζ-потенциал изменяется по-разному вследствие различий в константах диссоциации. комплексов. Несмотря на то, что ГП-ЦД сильнее остальных производных ЦД влияет на состояние липосомальной мембраны за счет большего количества гидроксильных групп, отрицательные значения ζ-потенциала липосом в присутствии комплекса ГП-ЦД−ЛВ лишь ненамного меньше, чем в присутствии свободного ЛВ, что связано с наибольшей константой диссоциации этого комплекса. В то же время комплексы М-ЦД−ЛВ и СБ-ЦД−ЛВ нейтрализуют заряд липосом гораздо эффективнее.
ВВЕДЕНИЕ
В настоящее время большое количество инфекционных заболеваний представляет серьезную угрозу для человечества. Антибиотики и антибактериальные препараты, используемые в их терапии, обеспечивают не только подавление роста патогенных бактерий в организме, но и вызывают множество побочных эффектов [1]. Поэтому важной задачей биомедицины является разработка высокоэффективных готовых форм лекарственных препаратов (формуляций) с улучшенными физико-химическими свойствами. Особый интерес представляют системы доставки (носители) на основе природных и синтетических полимеров [2].
Одними из таких эффективных носителей являются циклодекстрины (ЦД) – олигосахариды, в которых остатки D-(+)-глюкопиранозы объединены в макроциклы α-D-1,4-гликозидными связями [3]. Молекулы ЦД имеют форму тора с гидрофильной поверхностью и гидрофобной полостью внутри. За счет такого пространственного строения ЦД могут включать в гидрофобную полость различные лекарственные молекулы, содержащие гидрофобные фрагменты, тем самым образуя комплексы “гость–хозяин”.
Существуют три основных типа ЦД (α-ЦД, β-ЦД и γ-ЦД), различающиеся количеством глюкопиранозных звеньев и, как следствие, размером внутренней полости [4]. Наиболее широко используемым является β-ЦД, так как объем его гидрофобной полости позволяет образовывать комплексы со многими малыми лекарственными молекулами: ибупрофеном, фторхинолонами, дексаметазоном и др. [5].
Помимо основных типов ЦД, созданы их производные путем модификации гидроксильных групп. Производные ЦД получают с помощью реакций аминирования, этерификации, электрофильной атаки ЦД алкилами, галогенангидридами, эпоксидами или нуклеофильной атаки гидроксильных групп ЦД неорганическими кислотами, ионами галогенов, тиолами и другими реагентами [6, 7]. В зависимости от природы заместителя изменяются растворимость, размер полости и способность к комплексообразованию ЦД [6]. Наиболее распространенными являются ЦД с гидрофильным гидроксипропильным (ГП-ЦД), гидрофобным метильным (М-ЦД) и заряженным сульфобутильным (СБ-ЦД) заместителем. Эти производные ЦД имеют растворимость в воде больше 500 мг/мл [8], а также демонстрируют высокую эффективность комплексообразования с малыми лекарственными молекулами [5].
ЦД и их производные не проникают сквозь биологические барьеры, в том числе и мембраны клеток, но могут адсорбироваться на поверхности липидного бислоя за счет неспецифических взаимодействий [16]. Более того, ЦД способны извлекать липиды из бислоя, в частности холестерин [10], а также другие компоненты клеточных мембран, образуя при этом комплексы “гость–хозяин”.
Ранее мы установили механизм взаимодействия ГП-ЦД с липосомальной мембраной на основе дипальмитоилфосфатидилхолина [9]: при добавлении ГП-ЦД к липосомам наблюдается его адсорбция на поверхности бислоя за счет образования водородных связей между гидроксильными группами ГП-ЦД и фосфатными группами липидов [9]. Известно, что ЦД могут также способствовать возникновению дефектов в бислое, например, в результате извлечения липидов или разрыхления мембраны [10, 11]. Такие трансформации целостности липидного бислоя могут приводить к значительным изменениям жизнедеятельности клетки, таким как активация или ингибирование ферментативных реакций, изменение тромбогенности мембраны, а также улучшение проникновения лекарственных препаратов через биологические барьеры, что увеличивает их биодоступность [12].
На сегодняшний день производные ЦД широко используются в фармацевтической промышленности как эффективные, безопасные и нетоксичные носители лекарств. Однако детально не изучен механизм взаимодействия производных ЦД с липидным бислоем, а также не ясна роль заместителя в ЦД в регулировании взаимодействия лекарственных препаратов с бислоем. Изучение влияния типа и природы заместителя в ЦД (его полярности, гидрофобности, заряда) на величину возникающих дефектов в бислое, а также на взаимодействие малых лекарственных молекул с бислоем необходимо для разработки высокоэффективных лекарственных формуляций с высокой биодоступностью.
В данной работе исследовано влияние полярности заместителя и наличия у него заряда на взаимодействие производных ЦД с модельной клеточной мембраной – липосомой.
Для изучения влияния образования комплексов лекарство–ЦД на взаимодействие лекарственного препарата с липидным бислоем использовали левофлоксацин (ЛВ) – антибактериальный препарат группы фторхинолонов, которые избирательно ингибируют бактериальные ферменты топоизомеразу IV и ДНК-гиразу [13].
МАТЕРИАЛЫ И МЕТОДЫ
Реагенты
В работе использовали 2-гидроксипропил-β-циклодекстрин, метил-β-циклодекстрин, Тритон Х-100, ЛВ (все от Sigma-Aldrich), таблетки для приготовления 0.02 М натрий-фосфатного буферного раствора с pH 7.4 (ЭкоСервис, Россия), сульфобутиловый эфир β-ЦД (Zibo Qianhui Biotechnology Co Ltd., КНР), дипальмитоилфосфатидилхолин (ДПФХ) и кардиолипин ((1,3-бис(sn-3'-фосфатидил)-sn-глицерин, КЛ) от Avanti Polar Lipids, HCl (Реахим, Россия).
Получение малых моноламеллярных липосом
Смешивали растворы липидов ДПФХ и КЛ в хлороформе для получения раствора с массовым соотношением ДПФХ : КЛ, равным 80 : 20, и тщательно удаляли хлороформ в вакуумном роторном испарителе при температуре 55°С. Образовавшуюся тонкую липидную пленку диспергировали в 0.02 М натрий-фосфатном буфере с pH 7.4. Далее этот раствор подвергали воздействию ультразвука с частотой 22 кГц (3 раза по 200 с), используя гомогенизатор (модель 4710, Cole-Parmer Instrument, США), при температуре 50–55°С. Концентрация липидов 4 × 10–3 М соответствует 1 × 1016 липосом в 1 л раствора [14].
Получение комплексов производных β-ЦД с левофлоксацином
Комплексы ГП-ЦД, М-ЦД и СБ-ЦД с ЛВ получали в соответствии с [13, 15]. К 0.02 М раствору ЛВ в солянокислом буферном растворе (pH 4.0) добавляли 0.02 М раствор соответствующего производного ЦД в том же буфере для достижения мольного соотношения ЦД : ЛВ, равного 1 : 1. Комплекс инкубировали при перемешивании в течение 1 ч при температуре 37°С. Для проведения экспериментов по исследованию взаимодействия комплекса с поверхностью липосом, раствор разбавляли в 10 раз 0.02 М натрий-фосфатным буфером (pH 7.4) непосредственно перед добавлением раствора к липосомам.
Спектры кругового дихроизма
Спектры кругового дихроизма (КД) регистрировали с помощью спектрометра J-815 (Jasco, Япония), оснащенного термостатируемой ячейкой. Измерения проводили в диапазоне длин волн 260–350 нм при температуре 25°C в кварцевой кювете с длиной оптического пути l = 1 мм. Спектры регистрировали трехкратно с шагом в 1 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
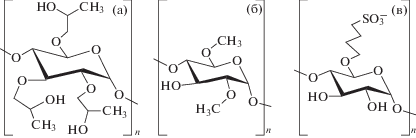
Для детального изучения влияния типа и природы заместителя (его полярности, гидрофобности, заряда) в производном ЦД на состояние липидного бислоя (в первую очередь, возникновение дефектов), а также образования комплекса ЛВ−ЦД на эффективность взаимодействия лекарства с бислоем были выбраны три наиболее часто используемые производные β-ЦД: ГП-ЦД (с полярным заместителем), М-ЦД (с гидрофобным заместителем) и СБ-ЦД (с заряженным заместителем) (рис. 1).
Рис. 1.
Структура молекул ЦД с гидроксипропильным (а), метильным (б) и сульфобутильным (в) заместителями.
В качестве модели плазматической мембраны использовались двухкомпонентные липосомы из смеси дипальмитоилфосфатидилхолина и кардиолипина (с массовым соотношением ДПФХ/КЛ, равным 80/20), так как эти липиды являются мажорными компонентами биомембран клеток. Характеристики липосом приведены в табл. 1.
Таблица 1.
Характеристики исследованных липосом
| Размер, нм | ζ-Потенциал, мВ | |||
|---|---|---|---|---|
| липосомы | липосомы + ГП-ЦД | липосомы + М-ЦД | липосомы + СБ-ЦД | |
| 100 ± 2 | –21.5 ± 4.4 | –20.2 ± 3.4 | –20.6 ± 3.4 | –24.8 ± 3.9 |
Влияние производных β-циклодекстрина на целостность липосомальной мембраны
Известно, что производные ЦД способны влиять на состояние биомембран. Их встраивание в липидный бислой или адсорбция на поверхности могут существенно изменять свойства биологической мембраны – ее проницаемость, микровязкость, скорости латеральной диффузии липидных молекул и “флип-флопа”. Это может приводить к значительным изменениям в состоянии и жизнедеятельности клетки, вызывая активацию или ингибирование ферментов, влияя на клеточный гомеостаз, а также на тромбогенность липидной мембраны [9, 17].
В данной работе было исследовано влияние заместителя в β-ЦД на величину возникающих в бислое дефектов. Для достижения этой цели был получен профиль высвобождения красителя из липосом в присутствии веществ, способных создавать дефекты в бислое. К суспензии липосом из смеси ДПФХ/КЛ (80/20 по массе), в которые был предварительно загружен фенолфталеин (ФФ) в фосфатном буфере (pH 7.4), добавляли тот или иной замещенный β-ЦД. Изучали кинетику высвобождения ФФ в условиях, приближенных к физиологическим, методом равновесного диализа. Внешний раствор содержал боратный буфер с pH 10.7, т.е. высвобождение ФФ должно было сопровождаться изменением окраски раствора и увеличением интенсивности сигнала свободного красителя. Наличие свободного ФФ во внешнем растворе детектировали, регистрируя его спектр поглощения в видимой области (рис. 2а). В независимом эксперименте контролировали целостность липосом в отсутствие замещенных ЦД.
Рис. 2.
(а) Спектр поглощения ФФ с максимумом при длине волны 550 нм; pH раствора 10.7, температура 25°C, CФФ = 10–7 M. (б) Кривые высвобождения ФФ из липосом (1), а также из липосом в присутствии М‑ЦД (2), ГП-ЦД (3), СБ-ЦД (4) и 10% Тритона X‑100 (5); pH 10.7, температура 25°C, CЦД = 0.14 М.

Липосомы, содержащие ФФ, высвобождают около 40% красителя в течение 120 мин (кривая 1 на рис. 2б). Для полного разрушения липосом и достижения 100%-ного высвобождения ФФ добавляли Тритон Х-100 (10%). При этом 100% ФФ высвобождаются за 20 мин (кривая 5 на рис. 2б).
Добавление производных β-ЦД к дисперсии липосом приводит к увеличению скорости высвобождения из них ФФ по сравнению с контролем. В присутствии всех трех производных β-ЦД 100%-ное высвобождение красителя наблюдается за 90 мин, т.е. медленнее, чем под действием ПАВ, но примерно в два раза быстрее, чем в контрольном эксперименте. Этот результат согласуется с литературными данными: для полного нарушения целостности липидного бислоя необходимы относительно жесткие условия, например время инкубации 24 ч и концентрация ЦД, равная примерно 0.15 M [17].
По профилю высвобождения ФФ в присутствии производных ЦД можно судить о том, какой заместитель в ЦД вносит больше дефектов в липидный бислой. Согласно полученным данным, в случае ГП-ЦД (кривая 3 на рис. 2б) скорость высвобождения ФФ выше, чем под действием М-ЦД и СБ-ЦД (кривые 2 и 4 соответственно). Это может быть обусловлено повышенной адсорбцией ГП-ЦД на поверхности бислоя за счет большего количества OH-групп в его молекуле.
Влияние производных β-циклодекстрина на взаимодействие левофлоксацина с бислоем
Для изучения влияния ЦД на взаимодействие молекул антибактериального препарата ЛВ с липосомами, т.е. исследования сложной трехкомпонентной системы (комплекс ЛВ−ЦД и липосомы) использовался метод спектроскопии кругового дихроизма. КД-спектроскопия является информативным и удобным методом анализа состояния фторхинолонов, поскольку в исследуемой системе только молекулы ЛВ проявляют оптическую активность.
Обнаружено, что в спектре КД свободного ЛВ при pH 7.4 имеется отрицательный максимум на длине волны 301 нм (кривая 1 на рис. 3а) При добавлении ЛВ к суспензии липосом данный пик смещается в сторону меньших длин волн (кривая 2). Этот эффект может быть обусловлен либо сменой микроокружения ЛВ на более гидрофильное, либо изменением ионного состояния его молекулы.
Рис. 3.
(а) Спектры КД свободного ЛВ (1) и адсорбированного на поверхности липосом (2); pH 7.4, CЛВ = 2 × 10–3 М. (б) Положение минимума в КД-спектрах свободного ЛВ (1) и связанного в комплексы с М-ЦД (2), ГП-ЦД (3) и C-Б-ЦД (4) как функция мольного избытка ЛВ относительно липосом; pH 7.4, температура 37°C.
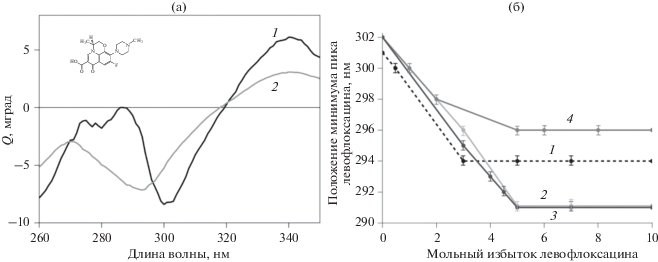
Важно отметить, что ЛВ имеет две ионогенные группы: карбоксильную (pKa = 6.24) и азот гетероцикла (pKa = 8.74) [18]. В условиях эксперимента при pH 7.4 в молекуле свободного ЛВ карбоксильная группа депротонирована, а гетероцикл положительно заряжен (см. вставку на рис. 3а). При переходе ЛВ из двухзарядного состояния (фосфатный буфер с рН 7.4) в однозарядное (боратный буфер с рН 9.2, где на азоте гетероцикла заряда нет) минимум на КД-спектре ЛВ смещается в синюю область и регистрируется на длине волны 287 нм.
Поскольку аналогичные изменения были обнаружены при добавлении ЛВ к липосомам, полученные результаты указывают на адсорбцию молекул этого лекарства на поверхности бислоя за счет электростатического взаимодействия между положительно заряженным атомом азота в гетероцикле ЛВ и отрицательно заряженными фосфатными группами липидов (при этом компенсируется положительный заряд гетероцикла и образуется однозарядная форма ЛВ). Максимальная адсорбция лекарственного препарата наблюдается при его трехкратном мольном избытке (≈7 × 105 молекул ЛВ в расчете на 1 липосому) [14]. При дальнейшем увеличении мольного избытка ЛВ изменения положения полосы в его спектре КД не наблюдаются, что указывает на насыщение центров связывания лекарственных молекул в бислое (кривая 1 на рис. 3б).
При образовании комплексов ЛВ со всеми изученными замещенными β-ЦД наблюдается смещение его КД-спектра в сторону бóльших длин волн на 1 нм, что, по-видимому, обусловлено погружением ароматического остова ЛВ в полость ЦД (т.е. сменой микроокружения на более гидрофобное). Отметим, что сдвиг на 1 нм является типичным для экспериментов при pH 7.4. Аналогичный эффект имел место при образовании комплексов другого фторхинолона (моксифлоксацина) с производными ЦД [20], а также для модельных систем – растворов ряда ароматических соединений, таких как триптофаны и тирозины, в органических растворителях [19].
При добавлении комплексов ЛВ−ЦД к суспензии липосом изменения в КД-спектре ЛВ были аналогичны тем, что наблюдались для двухкомпонентной системы ЛВ/липосомы: полоса смещалась в синюю область. Полученные данные указывают на однотипный характер взаимодействия лекарство–мембрана в системах ЛВ/липосомы и ЛВ−ЦД/липосомы. Однако важно отметить, что по сравнению со свободным ЛВ в случае его комплексов с производными β-ЦД сдвиг полосы КД более выражен. Так, для комплексов ЛВ с М-ЦД и ГП-ЦД максимальный сдвиг составляет 11 нм (кривые 2 и 3 на рис. 3б). Это свидетельствует об усилении взаимодействия ЛВ в составе его комплексов с производными β-ЦД с липидным бислоем. Кроме того, максимум адсорбции ЛВ наблюдается при 5-кратном мольном избытке этого лекарственного препарата по отношению к концентрации липосом (≈12 × 105 молекул ЛВ в расчете на 1 липосому) [14]. Таким образом, комплексообразование ЛВ с ГП-ЦД и М-ЦД, действительно, усиливает его взаимодействие с бислоем.
Важно отметить, что в присутствии липосом пик в КД-спектре ЛВ, связанного с СБ-ЦД, смещается в значительно меньшей степени, от 302 нм до 296 нм (кривая 4 на рис. 3б), чем связанного с ГП-ЦД и М-ЦД, а также свободного ЛВ. Это объясняется отталкиванием отрицательно заряженного сульфобутильного заместителя в молекуле СБ-ЦД от отрицательно заряженных фосфатных групп липосом. Также отметим, что, несмотря на отталкивание заряженного заместителя, смещение пика происходит иным образом, чем в случае свободного ЛВ, т.е. можно сделать вывод о том, что СБ-ЦД влияет на микроокружение ЛВ, адсорбированного на липисомах.
Таким образом, для ЛВ, включенного в полости ГП-ЦД и М-ЦД, имеет место выраженное усиление взаимодействия с липидным бислоем по сравнению со свободным ЛВ.
Полученные результаты подтверждаются данными флуоресцентной спектроскопии. Так, спектр эмиссии флуоресценции ЛВ имеет максимум при длине волны 456 нм (λвозб = 289 нм) (кривая 1 на рис. 4). При взаимодействии ЛВ, как свободного, так и связанного в комплекс с производными ЦД, с липосомами наблюдается тушение его флуоресценции, что может быть обусловлено связыванием с поверхностью липосом. Похожие изменения в спектре эмиссии другого фторхинолона (моксифлоксацина) при его включении в липидные везикулы были обнаружены нами ранее [20]. В этом случае ароматический остов моксифлоксацина располагается в бислое, а заряженный гетероцикл нейтрализуется фосфатными группами липидов.
Рис. 4.
Спектры эмиссии флуоресценции ЛВ (1) и систем ЛВ–липосомы (5 : 1) (2) и комплекс ЛВ−М-ЦД–липосомы (5 : 1) (3); pH 7.4, температура 37°C.
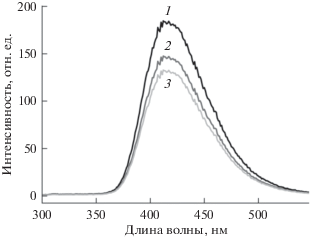
Важно отметить, что для комплексов ЛВ−ЦД тушение более выражено (кривая 3 на рис. 4), чем для свободного ЛВ, приблизительно на 10–12% (кривая 2). При этом пик эмиссии флуоресценции ЛВ практически не смещается, что указывает на отсутствие значимых изменений в ароматической системе лекарственной молекулы. Таким образом, взаимодейстие ЛВ с мембраной не приводит к выраженному заглублению гидрофобного остова молекулы ЛВ в лиридный бислой в условиях эксперимента.
Изменение ζ-потенциала липосом в присутствии лекарственной формуляции
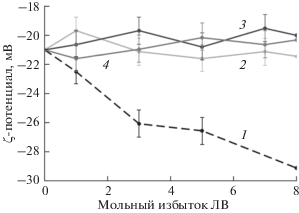
Для выявления вклада электростатических взаимодействий был исследован ζ-потенциал липосом при их связывании с комплексами ЛВ−ЦД. Липосомы из смеси ДПФХ/КЛ (80/20 по массе) имеют заряд –21 мВ (pH 7.4), который обусловлен депротонированными фосфатными группами липидов.
В условиях формирования комплексов при pH 4 карбоксильная группа ЛВ протонирована и находится в полости ЦД, а атом азота гетероцикла направлен наружу и несет положительный заряд. Добавление свободного ЛВ к суспензии липосом приводит к росту отрицательного значения их ζ-потенциала до –34 мВ при трехкратном мольном избытке лекарственного препарата. Такой эффект можно объяснить адсорбцией ЛВ на поверхности липосом за счет взаимодействия положительно заряженного атома азота ЛВ с отрицательно заряженными фосфатными группами липидов. При этом отрицательно заряженные карбоксильные группы молекул ЛВ “покрывают” поверхность липосом, что и обусловливает увеличение ζ-потенциала по абсолютной величине (кривая 1 на рис. 5).
Рис. 5.
Зависимости ζ-потенциала липосом от мольного избытка ЛВ: свободный ЛВ (1) и связанный в комплексы с М-ЦД (2), ГП-ЦД (3) и СБ-ЦД (4); pH 7.4, температура 37°C.

ζ-Потенциал липосом практически не изменяется в присутствии ГП-ЦД и М-ЦД, однако несколько возрастает по абсолютной величине, до ‒24.8 мВ, при добавлении СБ-ЦД (табл. 1). По мере введения в дисперсию липосом комплексов ЛВ−ЦД отрицательный заряд липосом возрастает в случае ГП-ЦД (кривая 3 на рис. 5) и уменьшается – в случае М-ЦД и СБ-ЦД (кривые 2 и 4), т.е. имеет место экранирование отрицательно заряженных групп липидов. Это – следствие адсорбции комплексов ЛВ−ЦД на липосомах, однако ζ-потенциал не принимает значений ниже регистрируемых в контрольном опыте для дисперсии липосом в присутствии свободного ЛВ; значит, карбоксильная группа ЛВ протонирована, находясь в полости ЦД.
Максимальная адсорбция ЛВ для всех рассмотренных комплексов ЛВ−ЦД имеет место при 5-кратном мольном избытке лекарственного препарата относительно липосом, что коррелирует с приведенными выше данными спектроскопии КД и флуоресцентной спектроскопии.
Однако наиболее интересны различия в изменении ζ-потенциала липосом в присутствии комплексов ЛВ с разными производными ЦД. Так, в случае комплекса ЛВ с ГП-ЦД, продемонстрировавшим наибольшую способность к созданию дефектов в бислое по сравнению с другими замещенными ЦД (эксперимент с ФФ) и выраженное усиление взаимодействия ЛВ с бислоем, ζ-потенциал липосом лишь ненамного меньше, чем в присутствии свободного ЛВ, при всех значениях мольного избытка ЛВ. Напротив, комплекс ЛВ с СБ-ЦД, для которого не наблюдалось усиление адсорбции ЛВ на бислое, эффективно нейтрализует заряд липосом. Данные тенденции могут быть обусловлены разной прочностью комплексов ЛВ−ЦД. Так, комплекс ЛВ с ГП-ЦД характеризуется наибольшей константой диссоциации (Kdiss ~ 10–3 M), а значения Kdiss для комплексов ЛВ с М-ЦД и СБ-ЦД составляют 10–4 и 10–5 M соответственно [13]. В связи с тем, что комплекс ЛВ c ГП-ЦД стабилизирован только нековалентными взаимодействиями и, таким образом, концентрация свободного ЛВ больше, чем связанного в комплекс, при адсорбции комплекса на липосомах, по-видимому, происходит смещение равновесия в сторону свободного ЛВ. Таким образом, вероятно, имеет место конкуренция за связывание с липосомами между свободным ЦД, комплексом и свободным ЛВ.
Комплексы ЛВ с М-ЦД и СБ-ЦД значительно прочнее, что и обуславливает существенное уменьшение отрицательных значений ζ-потенциала липосом в их присутствии (кривые 2 и 4 на рис. 5). Взаимодействие происходит по механизму, описанному выше: за счет экранирования зарядов фосфатных групп липидов в результате связывания с комплексами ЛВ−ЦД, при котором заряженный атом азота гетероцикла направлен в сторону бислоя.
Таким образом, комплексы ЛВ−ЦД адсорбируются на поверхности липосом за счет электростатических сил.
Для изучения вклада электростатических взаимодействий были проведены аналогичные эксперименты в присутствии 0.2 М хлорида натрия (рис. 6). Их результаты подтвердили предположение об электростатическом взаимодействии между фосфатными группами липидов и положительно заряженным атомом азота ЛВ в комплексах с замещенными ЦД: в присутствии соли ζ-потенциал липосом под действием всех комплексов ЦД−ЛВ изменяется в пределах погрешности измерений (кривые 2–4 на рис. 6). В то же время в случае свободного ЛВ картина иная (кривая 1) и близкая к той, что наблюдалась в отсутствие соли. По-видимому, взаимодействие свободного ЛВ с липосомальной мембраной происходит по другому механизму, и вклад электростатических сил незначителен.
ЗАКЛЮЧЕНИЕ
Исследовано влияние типа и природы заместителя (метильного, гидроксипропильного, сульфобутильного) в молекуле β-ЦД на ее способность создавать дефекты в липосомальной мембране. Показано, что все производные ЦД вызывают образование дефектов в бислое при физиологических условиях (pH 7.4, 37°C). Однако эффект в целом довольно мягкий, наиболее сильное изменение целостности мембраны имеет место в присутствии ГП-ЦД, что, по-видимому, обусловлено наибольшей его адсорбцией на поверхности липосом за счет образования водородных связей многочисленными гидроксильными группами молекулы ГП-ЦД с фосфатными группами липидов.
Изучено также влияние комплексообразования замещенных ЦД с ЛВ на взаимодействие этого лекарственного препарата с липидным бислоем. Установлено, что образование комплексов ЛВ-ЦД приводит к усилению взаимодействия лекарства с модельной липосомальной мембраной. При этом для М-ЦД (с гидрофобным заместителем) и ГП-ЦД (с гидрофильным заместителем) наблюдается больший эффект, чем для СБ-ЦД, что, скорее всего, обусловлено отталкиванием отрицательно заряженного сульфобутильного заместителя от отрицательно заряженных фосфатных групп липидов.
Адсорбцию комплексов на поверхности липосом подтверждают также данные об изменении их ζ-потенциала: взаимодействие молекул ЛВ с липидным бислоем происходит по механизму электростатического притяжения между положительно заряженным атомом азота в гетероцикле ЛВ и отрицательно заряженными фосфатными группами липидов. Образование ЛВ комплексов с ЦД способствует уменьшению отрицательных значений ζ-потенциала липосом вследствие экранирования карбоксильной группы ЛВ, которая находится в полости ЦД. При этом различие в значениях Kdiss комплексов ЛВ с производными ЦД приводит к тому, что ζ-потенциал липосом в присутствии комплексов ЛВ−М-ЦД и ЛВ−СБ-ЦД уменьшается существенно сильнее, чем в присутствии комплекса ЛВ−ГП-ЦД.
Список литературы
Dube D., Agrawal G.P., Vyas S.P. // Drug Discov. Today. 2012. V. 17. P. 760.
Chadha R., Kashid N., Saini A. // J. Sci. Ind. Res. (India). 2004. V. 63. P. 211–229.
Duran Meras I., Espinosa-Mansilla A., Airado Rodriguez D. // J. Pharm. Biomed. Anal. 2007. V. 43. P. 1025.
Biwer A., Antranikian G., Heinzle E. // Appl. Microbiol. Biotechnol. 2002. V. 59. P. 609.
Junthip J., Tabary N., Leclercq L., Martel B. // Carbohydr. Polym. 2015. V. 126. P. 156.
Szejtli J. // Chem. Rev. 1998. V. 98. P. 1743.
Yoshida A., Arima H., Uekama K., Pitha J. // Int. J. Pharm. 1988. V. 46. P. 217.
Loftsson T., Jarho P., Masson M.T.J. // Adv. Drug Deliv. Rev. 2005. V. 2. P. 335.
Скуредина А.А., Тычинина А.С., Ле-Дейген И.М., Белогурова Н.Г., Кудряшова Е.В. // Биоорг. химия. 2020. Т. 46. С. 505.
Lopez C.A., de Vries A.H., Marrink S.J. // PLoS Comput. Biol. 2011. V. 7. № 3. e1002020.
Saltzman W.M., Kyriakides T.R. // Principles of Tissue Engineering. 4th Ed. / Ed. by Lanza R., Langer R., Vacanti J.P. Elsevier, 2013. P. 385.
Vercelli C., Lebkowska-Wieruszewska B., Barbero R., Lisowski A., Re G., Giorgi M. // Res. Vet. Sci. 2020. V. 133. P. 283.
Le-Deygen I.M., Skuredina A.A., Uporov I.V., Kudryashova E.V. // Anal. Bioanal. Chem. 2017. V. 409. P. 6451.
Deygen I.M., Kudryashova E.V. // Colloids Surf. B. 2016. V. 141. P. 36.
Скуредина А.А., Ле-Дейген И.М., Кудряшова Е.В. // Коллоид. журн. 2018. Т. 80. С. 330.
Hammoud Z., Khreich N., Auezova L., Fourmentin S., Elaissari A., Greige-Gerges H. // Int. J. Pharm. 2019. V. 564. P. 59.
Hatzi P., Mourtas S., Klepetsanis G.P., Antimisiaris G.S. // Int. J. Pharm. 2007. V. 333. P. 167.
Van Doorslaer X., Dewulf J., Van Langenhove H., Demeestere K. // Sci. Total Environ. 2014. V. 500–501. P. 250.
Skuredina A.A., Le-Deygen I.M., Belogurova N.G., Kudryashova E.V. // Carbohydr. Res. 2020. V. 498. 108183.
Le-Deygen I.M., Skuredina A.A., Safronova A.S., Yakimov I.D., Kolmogorov I.M., Deygen D.M., Burova T.V., Grinberg N.V., Grinberg V.Y., Kudryashova E.V. // Chem. Phys. Lipids. 2020. V. 228. 104891.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал