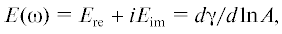Коллоидный журнал, 2022, T. 84, № 1, стр. 58-66
Влияние малых концентраций тромбина на динамические поверхностные свойства растворов фибриногена
О. Ю. Миляева 1, *, А. Р. Рафикова 1
1 Санкт-Петербургский государственный университет, кафедра коллоидной химии
198504 Санкт-Петербург,
Университетский проспект, 26, Россия
* E-mail: o.milyaeva@spbu.ru
Поступила в редакцию 19.12.2021
После доработки 23.12.2021
Принята к публикации 24.12.2021
- EDN: SQECNN
- DOI: 10.31857/S0023291222010074
Аннотация
Взаимодействие фибриногена и тромбина с образованием фибрина представляет ключевую стадию формирования кровяного сгустка при свертывании крови, морфология которого определяется концентрациями компонентов. Ранее показано, что при низких концентрациях тромбина образуются длинные фибриллярные агрегаты фибрина. В данной работе рассматриваются особенности образования агрегатов фибрина в поверхностном слое водных растворов при относительно низких концентрациях как фибриногена (5 × 10–9–2 × 10–7 М), так и тромбина (от 5 до 25 Ед./л). При низкой концентрации тромбина (5 Ед./л) наблюдались немонотонные зависимости упругости, что может быть связано с разворачиванием макромолекул белка в поверхностном слое. В области более высоких концентраций фермента (10 и 25 Ед./л) эти зависимости становились монотонными и динамическая поверхностная упругость достигала более высоких значений, превосходящих таковые для растворов чистого белка. Применение атомно-силовой микроскопии позволило показать, что этот эффект вызван образованием фибриллярных агрегатов в поверхностном слое.
ВВЕДЕНИЕ
Получение тонких микро- и наноструктурированных пленок на основе природных материалов открывает новые возможности для создания биосовместимых мембран, применяемых в качестве носителей для биосенсоров и биокатализаторов [1–4]. Пленка фибрина, образующаяся на месте порезов и препятствующая кровопотере, представляет хорошо известный пример такой биополимерной микрогетерогенной пленки.
Фибрин – высокомолекулярный неглобулярный белок, составляющий основу кровяного сгустка, образуется при полимеризации одного из основных белков крови – фибриногена под действием фермента тромбина [1, 3–7]. Этот процесс можно разделить на следующие этапы: 1) ферментативное выделение фибринопептидов из фибриногена, 2) самосборка мономерного фибрина, 3) агрегация протофибрилл (олигомеров фибрина, состоящих из 20–25 мономеров), 4) упаковка протофибрилл в волокно с периодической структурой и 5) формирование фибриновой сети из разветвленных волокон [5, 7–9]. Состав плазмы крови, pH и ионная сила влияют на образование кровяного сгустка. Изменение концентрации активного тромбина меняет структуру образующегося фибрина [6, 10–18]. Так, высокое содержание тромбина приводит к образованию сильноразветвленного фибрина, состоящего из большого числа коротких тонких фибрилл [5, 10, 11, 18]. В то же время фибрин, полученный под действием малых концентраций тромбина, имеет крупные поры и состоит из меньшего числа толстых малоразветвленных фибрилл. Большинство этих эффектов связано с кинетикой отдельных стадий полимеризации фибрина [5, 11, 17].
Морфология и механические свойства фибриновых пленок могут влиять на кровопотерю при ранении и инфицировании раны [4, 19, 20]. Однако информация о формировании фибриновых пленок и их свойствах крайне ограничена [4]. В литературе обсуждается, прежде всего, образование фибриновых сгустков в связи с задачей получения фибриновых герметиков, широко используемых в медицине [21, 22]. В то же время данные о структуре и механических свойствах пленок фибрина практически отсутствуют.
Недавно было показано, что применение методов дилатационной поверхностной реологии позволяет определить основные стадии полимеризации гидрохлорида дофамина на границе жидкость–газ [23, 24]. Эти методы оказались эффективными и при исследовании поверхностных свойств растворов белков, в частности фибриногена [25], наночастиц и их смесей с полиэлектролитами и ПАВ [25–28]. Динамические поверхностные свойства растворов фибриногена заметно отличались от свойств растворов глобулярных белков, что связано с особенностями структуры фибриногена. Молекула этого белка состоит из трех последовательно расположенных доменов и имеет вытянутую форму. При относительно низких концентрациях фибриногена в растворе его вытянутые молекулы располагаются в адсорбционном слое параллельно межфазной поверхности. При увеличении концентрации происходит переориентация молекул белка, что приводит к уменьшению динамической поверхностной упругости [25, 29–32].
Несмотря на то, что сканирующая электронная микроскопия указывает на различную морфологию поверхностных пленок фибриногена и фибрина, поверхностное натяжение их растворов оказывается одинаковым [4]. В данной работе для характеристики перехода фибриногена в фибрин в поверхностном слое использована дилатационная поверхностная реология, более чувствительная к изменениям структуры поверхностного слоя, чем тензиометрия. Морфология адсорбционных слоев исследована с помощью микроскопии при угле Брюстера и атомно-силовой микроскопии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Динамическая поверхностная упругость измерялась методом осциллирующего кольца [33, 34]. Метод основан на регистрации отклика системы на растяжение–сжатие поверхности за счет периодических колебаний площади мениска, образующегося у внутренней поверхности стеклянного кольца, частично погруженного в жидкость. Кольцо колеблется вдоль своей оси, перпендикулярной поверхности жидкости. Амплитуда и частота осцилляций площади поверхности составляли 7% и 0.1 Гц соответственно. Поверхностное натяжение измерялось методом пластинки Вильгельми.
В случае малой амплитуды колебаний комплексная динамическая дилатационная поверхностная упругость E определяется следующим соотношением:
где γ – поверхностное натяжение, А – площадь поверхности жидкости и ω – круговая частота. Если фазовый сдвиг между колебаниями поверхностного натяжения и площади поверхности отсутствует, то мнимая часть поверхностной упругости равна нулю.Для исследуемых в данной работе систем мнимая часть динамической поверхностной упругости была меньше действительной части. Поэтому в дальнейшем представлены результаты только для модуля динамической поверхностной упругости.
Для определения изотерм сжатия пленок фибрина был использован прибор ISR (KSV NIMA, Финляндия). Для изменения площади поверхности исследуемой жидкости в ванне Ленгмюра использовались два барьера. Поверхностное натяжение измерялось методом пластинки Вильгельми. Пластинку из фильтровальной бумаги шириной 1 см располагали в центре ванны параллельно барьерам. Все измерения проводили при постоянной скорости сжатия 5 мм/мин.
Статическую поверхностную упругость εst оценивали численным дифференцированием полученных изотерм сжатия.
Эллипсометрические измерения проводились с помощью нуль-эллипсометра Multiskop (Optrel GBR, Германия), оснащенного лазером с длиной волны генерации 632.8 нм, при постоянном значении угла падения 49° вблизи угла Брюстера. Разность между эллипсометрическими углами Δ для исследуемого раствора и чистой воды Δsurf пропорциональна величине адсорбции [34].
Морфология адсорбционных пленок определялась с помощью атомно-силового микроскопа (АСМ, NT-MDT, Россия). Для этого адсорбционные пленки переносили на поверхность слюды методом Ленгмюра–Шеффера. После переноса пленка высушивалась в эксикаторе при комнатной температуре в течение двух дней. Все измерения проводились в полуконтактном режиме.
Для определения мезоскопической морфологии пленок была применена микроскопия при угле Брюстера (прибор BAM 1, Nanofilm Technology, Германия).
Фибриноген и тромбин (оба от Sigma-Aldrich, Германия) использовались без дальнейшей очистки. Тромбин (100 Ед.) был растворен в 10 мл буферного раствора и разделен на порции объемом 1 мл, которые хранились в холодильнике при –18°C. Для приготовления исследуемых растворов размораживалась порция тромбина, которая хранилась при 4°C не дольше пяти дней. Также для приготовления исследуемых растворов исходный раствор фибриногена с концентрацией C = 1 г/л разбавлялся до заданной концентрации. Исходный раствор фибриногена хранился при 4°C не дольше пяти дней. Добавление тромбина к раствору фибриногена осуществлялось двумя способами: путем смешения исходных растворов и путем добавления тромбина к раствору фибриногена, когда адсорбционная пленка белка уже сформирована.
Исследуемые растворы готовились в фосфатном буфере (растворы Na2HPO4 и NaH2PO4 (Sigma-Aldrich, Германия)) с ионной силой 0.02 и pH 7.
При приготовлении растворов использовалась трижды перегнанная вода. Две последние перегонки осуществлялись на установке, целиком сделанной из стекла. Поверхностное натяжение буферного раствора без белка составляло 72.8 мН/м.
Все измерения проводились при температуре 20 ± 1°C.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для оценки влияния тромбина на динамические поверхностные свойства адсорбционных слоев фибриногена были измерены динамическая поверхностная упругость и поверхностное натяжение растворов смеси фибриногена и тромбина как функции концентрации компонентов, времени жизни поверхности и ионной силы раствора. В исследованной области концентраций (5–25 Ед./л) тромбин не проявляет заметной поверхностной активности. Фибриноген проявляет заметную поверхностную активность уже при концентрациях 5 × 10–9 М (рис. 1). Через два часа от момента образования поверхности динамическое поверхностное натяжение достигает 65 мН/м (рис. 1б).
Рис. 1.
Кинетические зависимости динамической поверхностной упругости (а), динамического поверхностного натяжения (б) и зависимости динамической поверхностной упругости от поверхностного давления (в) растворов фибриногена. Концентрация фибриногена: 5 × 10–9 (1), 1 × 10–8 (2), 2 × 10–8 (3), 5 × 10–8 (4) и 1 × 10–7 М (5).
При концентрации фибриногена 5 × 10–9 и 1 × × 10–8 М на кинетических зависимостях динамических поверхностных свойств виден индукционный период, в течение которого динамическая поверхностная упругость и динамическое поверхностное натяжение остаются близкими к соответствующим значениям для воды (рис. 1а, 1б). С ростом концентрации белка индукционный период пропадает, поверхностное натяжение достигает равновесных значений (55–58 мН/м) в течение часа. Значения поверхностной упругости вблизи равновесия не превышают 45 мН/м, что заметно ниже, чем для растворов глобулярных белков – лизоцима и бычьего сывороточного альбумина (80 мН/м) [35]. В ряде работ было выдвинуто предположение, что это связано с более рыхлой упаковкой молекул фибриногена в поверхностном слое [25, 29–32].
Добавление даже небольших количеств тромбина (5 Ед./л) (рис. 2а–2в) приводит к замедлению изменений поверхностных свойств и увеличению продолжительности индукционного периода при малых концентрациях белка (5 × 10–9 М): динамическая поверхностная упругость и динамическое поверхностное давление начинают возрастать только спустя два часа от момента образования поверхности. Это может быть связано с уменьшением концентрации свободного фибриногена в результате его связывания с тромбином.
Рис. 2.
Кинетические зависимости динамической поверхностной упругости (а, г, ж), динамического поверхностного натяжения (б, д, з) и зависимости динамической поверхностной упругости от поверхностного давления (в, е, и) растворов смесей фибриногена и тромбина. Концентрация фибриногена: 5 × 10–9 (1), 1 × 10–8 (2), 2 × 10–8 (3), 5 × 10–8 (4) и 1 × 10–7 М (5). Концентрация тромбина: 5 (а–в), 10 (г–е) и 25 Ед./л (ж–и).

При более высоких концентрациях фибриногена добавление фермента приводит к немонотонным кинетическим зависимостям динамической поверхностной упругости (рис. 2а и 2в). Значение этой величины в области локального максимума составляет около 45 мН/м, т.е. почти совпадает со значением для растворов фибриногена вблизи равновесия. Затем динамическая поверхностная упругость снижается до примерно 38 мН/м. С ростом концентрации фибриногена скорость изменения динамической поверхностной упругости возрастает и максимум смещается в сторону меньших времен жизни поверхности (рис. 2в). Максимум поверхностной упругости соответствует поверхностному давлению 10–12 мН/м, до достижения которого все зависимости близки к соответствующим зависимостям для чистого белка. Возникновение локального максимума на кинетических зависимостях динамической поверхностной упругости может свидетельствовать о процессах разворачивания белка в поверхностном слое [28]. В этом случае возникает новый механизм релаксации поверхностных напряжений за счет вытеснения отдельных сегментов макромолекулы в дальнюю область поверхностного слоя – область петель и хвостов. После снижения поверхностная упругость остается выше значений, характерных для неглобулярных белков и неионных полимеров; это может указывать на то, что только часть молекул белка начинает разворачиваться в поверхностном слое.
При концентрациях тромбина 10 и 25 Ед./л и при низких концентрациях фибриногена (5 × 10–9–1 × 10–8 М) помимо замедления адсорбции наблюдается низкая поверхностная упругость вблизи равновесия. При этом поверхностная упругость не превышает 30 мН/м, что заметно меньше, чем для растворов фибриногена (50 мН/м). Это снижение может быть следствием изменения концентрации белка в объеме субфазы из-за увеличения степени связывания его с тромбином. Кроме того, при этих концентрациях тромбина все кинетические зависимости поверхностной упругости становятся монотонными. С ростом концентрации белка поверхностная упругость вблизи равновесия увеличивается и достигает 80 мН/м.
Если представить полученные результаты в виде зависимостей динамической поверхностной упругости от давления (рис. 2е, 2и), то основное отличие от результатов для чистого белка заключается в росте динамической поверхностной упругости в области высоких поверхностных давлений. При этом близость полученных зависимостей указывает на то, что поверхностные свойства смешанных растворов определяются свободным фибриногеном. Рост упругости в области высоких поверхностных давлений может быть связан с влиянием нитевидных агрегатов фибрина [13]. Подобное поведение – рост динамической поверхностной упругости примерно в полтора раза по сравнению с раствором чистого белка – ранее наблюдалось для адсорбционных пленок неочищенных фибрилл β-лактоглобулина, лизоцима и овальбумина [36–38]. Рост поверхностной упругости, обусловленный наличием фибрилл, составлял от 15 до 30 мН/м.
Описанные выше тенденции хорошо заметны на кинетических зависимостях динамической поверхностной упругости и поверхностного натяжения при постоянной концентрации белка, равной 1 × 10–7 М (рис. 3). При небольшой концентрации тромбина (5 Ед./л) динамическая поверхностная упругость снижается и проходит через максимум. При добавлении 10 Ед./л фермента эта величина немного превышает значения для чистого фибриногена и, наконец, при концентрации 25 Ед./л более чем в полтора раза превосходит значения для растворов фибриногена, не содержащих тромбина (рис. 3а). При этом зависимости динамического поверхностного натяжения остаются близкими друг к другу (рис. 3б). Таким образом, изменения динамической поверхностной упругости, свидетельствующие об изменениях структуры поверхностного слоя, протекают при практически постоянном поверхностном давлении. Если представить динамическую поверхностную упругость как функцию поверхностного давления (рис. 3в), то за исключением системы с концентрацией тромбина 25 Ед./л полученные зависимости близки к результатам для чистого белка до достижения поверхностного давления, равного 8 мН/м. Выше этого значения появляются различия, связанные, по-видимому, с различными стадиями взаимодействия фибриногена и фермента.
Рис. 3.
Кинетические зависимости динамической поверхностной упругости (а) и динамического поверхностного натяжения (б) и зависимости динамической поверхностной упругости от поверхностного давления (в) растворов фибриногена (концентрация 1 × 10–7 М) и его смесей с тромбином. Концентрация тромбина: 0 (1), 5 (2), 10 (3) и 25 Ед./л (4).

Изотермы сжатия адсорбционных слоев, формирующихся в смешанных растворах (рис. 4) оказываются близкими друг к другу, что также указывает на то, что динамические поверхностные свойства определяются в первую очередь фибриногеном. Поверхностное давление медленно увеличивается по мере сжатия. Когда пленка сжата примерно в два раза, а поверхностное давление достигает 25–30 мН/м, начинается более быстрое увеличение поверхностного давления, достигающего 50 мН/м при максимальном сжатии, которое может свидетельствовать о переходе от плотноупакованного монослоя к полимолекулярной структуре. Отметим почти линейное увеличение поверхностного давления при сжатии для 1 × 10–7 М раствора фибриногена, содержащего 25 Ед./л тромбина. В этом случае поверхностное давление линейно растет от 20 до 50 мН/м, и полученные значения оказываются выше, чем для других исследованных систем при тех же степенях сжатия, что может свидетельствовать о дополнительной жесткости поверхностного слоя, обусловленной присутствием агрегатов фибрина.
Рис. 4.
Изотермы сжатия адсорбционных пленок фибриногена и его смесей с тромбином, полученные при различной концентрации компонентов. Концентрация фибриногена: 1 × 10–7 (1, 3, 4 и 5), 5 × 10–8 М (2); концентрация тромбина: 0 (1), 5 (3), 10 (2, 4) и 25 Ед./л (5).

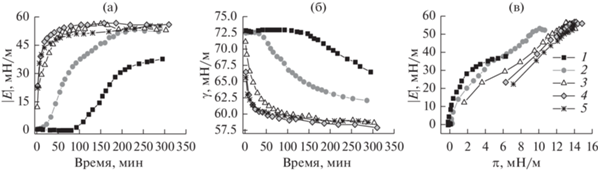
Кинетические зависимости эллипсометрического угла Δsurf были получены при варьировании концентрации фибриногена в диапазоне 5 × 10–9–2 × × 10–7 М (рис. 5а) и при добавлении 10 и 25 Ед./л тромбина (рис. 5б, 5в). Эллипсометрический угол Δsurf возрастает с увеличением концентрации белка. К такому же эффекту приводит и увеличение концентрации тромбина, если концентрация фибриногена больше или равна 5 × 10–8 М. Основные черты, свойственные кинетике изменения динамической поверхностной упругости и поверхностного натяжения, наблюдаются также и для кинетических зависимостей эллипсометрического угла Δsurf. При концентрации фибриногена 5 × 10–9 М добавление тромбина приводит к уменьшению значений Δsurf при больших временах жизни поверхности (5 ч). В течение первого часа измерений наблюдаются флуктуации значений Δsurf, что связано с неоднородностью поверхностного слоя. При концентрации фибриногена 1 × 10–7 М, а тромбина 25 Ед./л разница между результатами для растворов чистого белка и смеси составляет около 2°, что указывает на увеличение поверхностной концентрации агрегатов.
Рис. 5.
Кинетические зависимости эллипсометрического угла Δ растворов фибриногена и его смесей с тромбином. Концентрация фибриногена: 5 × 10–9 (1), 1 × 10–8 (2), 5 × 10–8 (3), 1 × 10–7 (4) и 2 × 10–7 М (5). Концентрация тромбина: 0 (а), 10 (б) и 25 Ед./л (в).
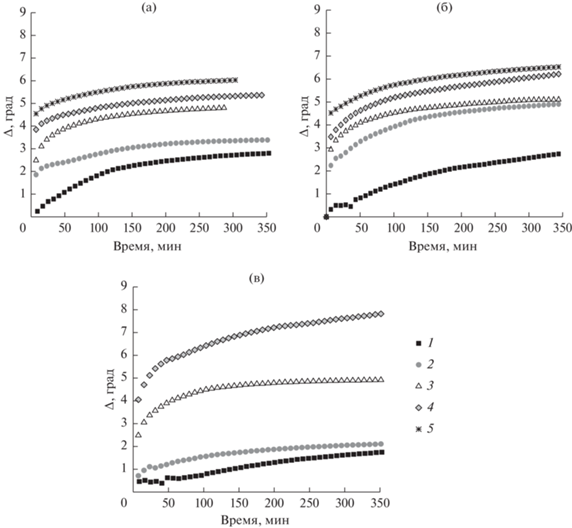
С помощью микроскопии при угле Брюстера (рис. 6) была получена серия изображений для растворов фибриногена с концентрацией 1 × 10–7 М, содержащих 0, 10 и 25 Ед./л тромбина. Для растворов чистого белка изображение представляет собой однородный серый фон без каких-либо особенностей (рис. 6а). При добавлении тромбина на полученных изображениях появляются отдельные островки (рис. 6б, 6в). При сжатии адсорбционного слоя на 30 и 50% он становится более неоднородным (рис. 6г, 6д), и небольшое механическое возмущение оставляет след на поверхности (рис. 6е). В этом случае адсорбционная пленка оказывается более жесткой, в отличие от адсорбционной пленки чистого фибриногена, для которой этот эффект не наблюдается.
Рис. 6.
Полученные с помощью микроскопии при угле Брюстера изображения адсорбционных пленок фибриногена при его концентрации в растворе 1 × 10–7 М в отсутствие (а) и в присутствии 25 Ед./л тромбина (б–е). Пленки формировались в течение 5 мин (б) и 4 ч (а, в–е). Площадь поверхности составляла 100 (а–в), 70 (г) и 50% от начальной (д, е). Изображение (е) было получено после небольшого механического возмущения поверхности.
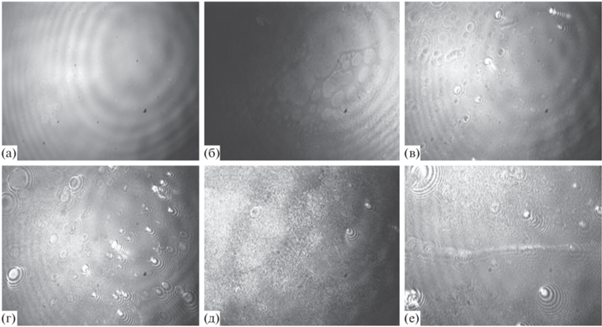
Агрегаты белка в поверхностном слое хорошо видны на АСМ-изображениях. Для раствора чистого фибриногена (1 × 10–7 М) видна пленка, состоящая из отдельных частиц (рис. 7). Отметим, что молекула фибриногена состоит из трех крупных доменов, которые могут быть обнаружены с помощью АСМ [13, 31].
Рис. 7.
АСМ-изображение адсорбционной пленки фибриногена, сформировавшейся на поверхности его раствора с концентрацией 1 × 10–7 М за 12 ч и перенесенной на поверхность слюды.
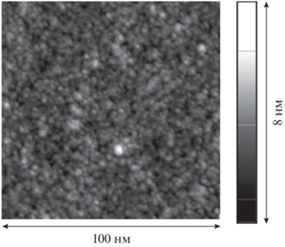
Добавление фермента приводит к появлению длинных нитевидных и небольших сферических агрегатов (рис. 8). Протяженность нитей может достигать сотен нанометров, при этом высота и сечение нити составляют 10–20 нм. Высота сферических агрегатов также не превышает 20 нм, хотя их диаметр может достигать сотен нанометров. Агрегаты не образуют сплошной сетки, их количество невелико, и основным компонентом остается свободный фибриноген. Однако даже небольшого числа агрегатов оказывается достаточно для роста поверхностной упругости в полтора раза по сравнению с раствором чистого фибриногена.
ВЫВОДЫ
В исследованной области концентраций фибриногена и тромбина поверхностные свойства растворов определяются первым компонентом. Добавление небольшого количества тромбина приводит к немонотонным кинетическим зависимостям динамической поверхностной упругости, что может указывать на присутствие в поверхностном слое отдельных развернутых молекул белка. Вероятно, использованные концентрации фермента оказываются достаточными для начала формирования протофибрилл, однако недостаточными для формирования длинных волокон фибрина. Появление длинных нитевидных агрегатов было обнаружено с помощью АСМ при более высоких концентрациях тромбина. Увеличение концентрации тромбина приводит к тому, что кинетические зависимости снова становятся монотонными и наблюдается рост динамической поверхностной упругости с увеличением поверхностной концентрации. Подобное поведение ранее наблюдалось для водных дисперсий амилоидных фибрилл.
Список литературы
Janmey P.A., Winer J.P., Weisel J.W. // J. R. Soc. Interface. 2009. V. 6. № 30. P. 1.
Payamyar P., King B.T., Öttinger H.C., Schlüter A.D. // Chem. Commun. 2016. V. 52. P. 18.
O’Brien E.T., Falvo M.R., Millard D., Eastwood B., Taylor R.M., Superfine R. // Proc. Natl. Acad. Sci. U.S.A. 2008. V. 105. P. 19438.
Macrae F.L., Duval C., Papareddy P., Baker S.R., Yuldasheva N., Kearney K.J., McPherson H.R., Asquith N., Konings J., Casini A., Degen J.L., Connell S.D., Philippou H., Wolberg A.S., Herwald H., Ariëns R.A.S. // J. Clin. Invest. 2018. V. 128. P. 3356.
Weisel J.W., Litvinov R.I. // Blood. 2013. V. 121. P. 1712.
Zuev Y.F., Litvinov R.I., Sitnitsky A.E., Idiyatullin B.Z., Bakirova D.R., Galanakis D.K., Zhmurov A., Barsegov V., Weisel J.W. // J. Phys. Chem. B. 2017. V. 121. P. 7833.
Scheraga H.A. // Biophys. Chem. 2004. V. 112. P. 117.
Zhmurov A., Kononova O., Litvinov R.I., Dima R.I., Barsegov V., Weisel J.W. // J. Am. Chem. Soc. 2012. V. 134. P. 20396.
Privalov P., Medved L. // J. Mol. Biol. 1982. V. 159. P. 665.
Ryan E.A., Mockros L.F., Weisel J.W., Lorand L. // Biophys. J. 1999. V. 77. P. 2813.
Weisel J.W., Nagaswami C. // Biophys. J. 1992. V. 63. P. 111.
Hämisch B., Büngeler A., Kielar C., Keller A., Strube O., Huber K. // Langmuir. 2019. V. 35. P. 12113.
Yermolenko I.S., Lishko V.K., Ugarova T.P., Magonov S.N. // Biomacromolecules. 2011. V. 12. P. 370.
Sit P.S., Marchant R.E. // Surf. Sci. 2001. V. 491. P. 421.
Gorbet M.B., Sefton M.V. // Biomater. Silver Jubil. Compend. 2006. V. 25. P. 219.
Wolberg A.S. // Haemophilia. 2010. V. 16. № s3. P. 7.
Konings J., Govers-Riemslag J.W.P., Philippou H., Mutch N.J., Borissoff J.I., Allan P., Mohan S., Tans G., Ten Cate H., Ariëns R.A.S. // Blood. 2011. V. 118. P. 3942.
Fogelson A.L., Keener J.P. // Phys. Rev. E. 2010. V. 81. 051922.
Gu S.X., Lentz S.R. // J. Clin. Invest. 2018. V. 128. P. 3243.
Leslie D.C., Waterhouse A., Berthet J.B., Valentin T.M., Watters A.L., Jain A., Kim P., Hatton B.D., Nedder A., Donovan K., Super E.H., Howell C., Johnson C.P., Vu T.L., Bolgen D.E., Rifai S., Hansen A.R., Aizenberg M., Super M., Aizenberg J., Ingber D.E. // Nat. Biotechnol. 2014. V. 32. P. 1134.
Karp J.M., Sarraf F., Shoichet M.S., Davies J.E. // J. Biomed. Mater. Res. Part A. 2004. V. 71. P. 162.
Ho W., Tawil B., Dunn J.C.Y., Wu B.M. // Tissue Eng. 2006. V. 12. P. 1587.
Milyaeva O.Y., Bykov A.G., Campbell R.A., Loglio G., Miller R., Noskov B.A. // Colloids Surf. A. 2019. V. 579. P. 123637.
Milyaeva O.Y., Bykov A.G., Campbell R.A., Loglio G., Miller R., Noskov B.A. // Colloids Surf. A. 2020. V. 599. P. 124930.
Milyaeva O.Y., Gochev G., Loglio G., Miller R., Noskov B.A. // Colloids Surf. A. 2017. V. 532. P. 108.
Noskov B.A. // Curr. Opin. Colloid Interface Sci. 2010. V. 15. P. 229.
Noskov B.A., Bykov A.G., Gochev G., Lin S.Y., Loglio G., Miller R., Milyaeva O.Y. // Adv. Colloid Interface Sci. 2020. V. 276. P. 102086.
Noskov B.A. // Adv. Colloid Interface Sci. 2014. V. 206. P. 222.
Ariola F.S., Krishnan A., Vogler E.A. // Biomaterials. 2006. V. 27. P. 3404.
Hernandez E.M., Franses E.I. // Colloids Surf. A. 2003. V. 214. P. 249.
Hassan N., Maldonado-Valderrama J., Gunning A.P., Morris V.J., Ruso J.M. // J. Phys. Chem. B. 2011. V. 115. P. 6304.
Damodaran S. // Anal. Bioanal. Chem. 2003. V. 376. P. 182.
Bykov A.G., Lin S.-Y., Loglio G., Miller R., Noskov B.A. // J. Phys. Chem. C. 2009. V. 113. P. 5664.
Motschmann H., Teppner R. // Novel Methods to Study Interfacial Layers. Ed. by Mobius D., Miller R. Amsterdam: Elsevier. 2001. P. 1.
Noskov B.A. // Adv. Colloid Interface Sci. 2014. V. BMP. P. 222.
Peng D., Yang J., Li J., Tang C., Li B. // J. Agric. Food Chem. 2017. V. 65. P. 10658.
Jordens S., Rühs P.A., Sieber C., Isa L., Fischer P., Mezzenga R. // Langmuir. 2014. V. 30. P. 10090.
Humblet-Hua N.-P.K., van der Linden E., Sagis L.M.C. // Soft Matter. 2013. V. 9. P. 2154.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал