Коллоидный журнал, 2022, T. 84, № 1, стр. 67-73
Наноэмульсии и нанокапсулы с олеиновой кислотой
Е. В. Мищенко 1, Е. Е. Тимофеева 1, А. С. Артамонов 1, И. Б. Портная 2, М. Ю. Королева 1, *
1 Российский химико-технологический университет им. Д.И. Менделеева,
кафедра наноматериалов и нанотехнологии
125047 Москва, Миусская пл., д. 9, Россия
2 Technion – Israel Institute of Technology, Faculty of Biotechnology
and Food Engineering
32000 Technion City, Haifa, Israel
* E-mail: m.yu.kor@gmail.com
Поступила в редакцию 28.12.2021
После доработки 03.01.2022
Принята к публикации 06.01.2022
- EDN: LHEIQU
- DOI: 10.31857/S0023291222010086
Аннотация
Наноэмульсии являются перспективными дисперсными системами, которые могут быть использованы в качестве носителей гидрофобных лекарственных и биологически-активных соединений. В данной работе исследованы наноэмульсии с олеиновой кислотой в качестве дисперсной фазы, стабилизированные смесями неионогенных ПАВ Tween 80/Span 80 и Tween 60/Span 60. Наноэмульсии с Tween 80 и Span 80 были неустойчивыми. В таких системах интенсивно протекала флокуляция и коалесценция капель дисперсной фазы. Наноэмульсии с Tween 60 и Span 60 были значительно более устойчивыми. Средний диаметр частиц дисперсной фазы практически не изменялся в течение длительного времени при 25°C, а также в двух циклах нагревания до 60°C и последующего охлаждения до 5°C. С использованием микрокалориметрии были определены температуры фазовых переходов в таких наноэмульсиях. На термограммах имелись два пика, обусловленные плавлением олеиновой кислоты и смешанного адсорбционного слоя из молекул Tween 60 и Span 60. Так как на поверхности капель олеиновой кислоты формировалась твердая оболочка, то такие системы можно считать нанокапсулами.
1. ВВЕДЕНИЕ
В последнее время возрос интерес к липидным дисперсным системам, в том числе и к наноэмульсиям (НЭ) [1, 2], которые перспективны для использования в качестве переносчиков активных соединений в организм человека. В качестве компонента дисперсной фазы НЭ может быть использована олеиновая кислота, которая является биосовместимым соединением [3] и, кроме того, проявляет антиметастатические и противовоспалительные свойства [4]. В этом случае капли дисперсной фазы будут не только обеспечивать биологически активное действие самой олеиновой кислоты, но и являться контейнерами для инкапсулирования гидрофобных лекарственных соединений.
Исследовались НЭ олеиновой кислоты, стабилизированные разными поверхностно-активными веществами (ПАВ). Например, НЭ со средним диаметром капель 72 нм были получены ультразвуковым (УЗ) диспергированием. При массовом соотношении Tween 80 и олеиновой кислоты 2 : 1 и доле дисперсной фазы 7 мас. % такие НЭ были стабильны более года [5]. В то же время в эмульсиях, также полученных УЗ-диспергированием и стабилизированных Tween 80, средний диаметр капель дисперсной фазы возрастал от 147 до 175 нм за 28 сут при выдерживании при 25°C [6].
Эмульсии, стабилизированные смесью неионогенных ПАВ – Tween 80 и липофильного моноолеата маннида в объемном соотношении 5.25, были получены гомогенизацией под высоким давлением. При хранении НЭ при 4°C средний диаметр капель дисперсной фазы, равный 154 нм, не изменялся в течение 6 недель. При 25 и 37°C диаметр возрастал до 161–162 нм за этот же период времени [7]. НЭ олеиновой кислоты, стабилизированные Tween 80 с небольшими добавками цетилтриметиламмония бромида или карбаматного ПАВ, были более устойчивы, чем стабилизированные только Tween 80 [8].
В большинстве публикаций по эмульсиям и НЭ с олеиновой кислотой в качестве дисперсной фазы основное внимание уделено не коллоидно-химическим аспектам таких дисперсных систем, а перспективам их медико-биологического применения. Исследовались НЭ, в дисперсную фазу которых включались активные компоненты широкого спектра действия. Например, эмульсии со смесью олеиновой и линолевой кислот в качестве дисперсной фазы и с инкапсулированным лютеином были получены УЗ-диспергированием и выпариванием растворителя. Для стабилизации НЭ был использован Tween 20. НЭ со средним диаметром капель 110 нм были стабильны при 4°C, однако при 25°C размер капель увеличивался до 350 нм за 30 сут [9].
Исследовались НЭ с диаметром капель олеиновой кислоты 96 нм, загруженные антибактериальными компонентами: молочной кислотой, низином и лаурил альгинатом. Данные НЭ были получены УЗ-диспергированием и стабилизированы Tween 80 [10].
Эмульсии, стабилизированные Tween 80 и ПЭГ 400, получали интенсивным диспергированием. В эмульсиях, загруженных диацереином, средний диаметр капель был равен 174 нм [11]. При загрузке инсулина диаметр капель составлял 460 нм [12]. При инкапсулировании аторвастатина и стабилизации смесями ПАВ Tween 80/ПЭГ 400 и Tween 20/ПЭГ 400 диаметр капель дисперсной фазы варьировался от 142 до 472 нм [13].
При стабилизации Tween 80 в НЭ, полученных УЗ-диспергированием и загруженных паклитакселом, средний размер капель дисперсной фазы составлял 108 нм [14]. Комбинирование методов температурной инверсии фаз и УЗ-диспергирования приводило к образованию НЭ с размером капель 32–43 нм при загрузке их лоратадином [15].
Изучались эмульсии, содержащие в дисперсной фазе смесь масла мирры и олеиновой кислоты, загруженные аторвастатином. При стабилизации Tween 40, Tween 60 или Tween 80 диаметр капель дисперсной фазы варьировался от 130 до 274 нм [16]. В эмульсиях, стабилизированных Capmul MCM EP, Span 85, бромидом цетилтриметиламмония и фосфатидной кислотой, капли олеиновой кислоты имели размер 123–167 нм. При выдерживании таких эмульсий при 4, 25 и 37°C в течение 21 сут размер капель практически не изменялся [17].
В НЭ, стабилизированных смесями Cremophor RH 40/Transcutol HP и загруженных эмодином, размер капель был равен 10–30 нм [18], при стабилизации смесью Transcutol P/Labrasol и загрузке доксепином или имипрамином были получены капли олеиновой кислоты размером 17–20 нм [19].
Из эмульсий и НЭ на основе олеиновой кислоты получали нано- и микрокапсулы с оболочкой из полиэлектролитов размером 81–117 нм [20, 21], с оболочкой из додецилового эфира гиалуроновой кислоты диаметром 365 нм [22]. Микрокапсулы размером 265–710 нм были получены из эмульсий, капли дисперсной фазы которых состояли из смеси трикаприлина и олеиновой кислоты и были стабилизированы Tween 80 и соевым лецитином. Микрокапсулы, загруженные гиперлонгумином, были получены при нанесении оболочки из хитозана или альгината натрия [23]. Микрокапсулы с токоферолом размером 233 нм формировались при создании оболочки из олеата хитозана [24].
В качестве переносчиков лекарственных соединений активно исследуются и другие липидные системы с олеиновой кислотой. Например, были получены липосомы, в фосфолипидный бислой которых был включен комплекс олеиновой кислоты и человеческого α-лактоальбумина [25]. Были получены наноструктурированные носители из глицерилбегената и олеиновой кислоты, загруженные астаксантином [26], микрокапсулы с телмисартаном, состоящие из эмульгеля олеиновой кислоты, в оболочке из хитозана [27], лиотропные жидкие кристаллы, образованные CETETH-10 с солюбилизированной олеиновой кислотой и загруженные донепезилом [28].
Таким образом, в литературе имеются ограниченные сведения о коллоидно-химических свойствах НЭ, содержащих в качестве дисперсной фазы олеиновую кислоту. В данной работе исследовано влияние смесей неионогенных ПАВ Tween 80/Span 80 и Tween 60/Span 60 на дисперсность и устойчивость таких НЭ. Показано, что при стабилизации НЭ смесью Tween 60 и Span 60 на поверхности капель дисперсной фазы образуется твердая оболочка, т.е. происходит образование нанокапсул олеиновой кислоты.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Реактивы и материалы
Для получения НЭ были использованы олеиновая кислота (Stanchem Sp. z o.o. Przedsiębiorstwo Chemiczne), а также моноолеат полиоксиэтиленсорбитана (Tween 80, ≥95%), моностеарат полиоксиэтиленсорбитана (Tween 60), сорбитанмоноолеат (Span 80, ≥95%), сорбитанмоностеарат (Span 60, ≥95%) и NaCl (≥99.5%) от Sigma-Aldrich. Реактивы дополнительной очистке не подвергались. Для получения НЭ и нанокапсул использовалась бидистиллированная вода.
2.2. Получение наноэмульсий и нанокапсул
НЭ и нанокапсулы были получены методом температурной инверсии фаз. Сосуд, содержащий 2.5 мл олеиновой кислоты, 1.25 мл смеси Tween 80/Span 80 или Tween 60/Span 60 и 6.25 мл водного раствора NaCl с концентрацией 0.15 М, нагревали до температуры инверсии фаз. Затем смесь охлаждали на ледяной бане при интенсивном перемешивании. Мольное соотношение ПАВ в смеси составляло 0.76 [29].
2.3. Исследование наноэмульсий и нанокапсул
Размер частиц определяли с помощью лазерного анализатора Zetasizer Nano ZS (Malvern Instruments) с углом детектирования 173°. Анализатор оснащен He–Ne-лазером с длиной волны излучения 633 нм. Распределения частиц по размерам были получены с использованием алгоритма Multiple Narrow Modes.
Устойчивость НЭ и дисперсий нанокапсул к флокуляции и седиментации определяли с помощью прибора MultiScan MS 20 (DataPhysics Instruments GmbH). Измерения интенсивности проходящего света и обратного светорассеяния проводили при сканировании образца по высоте с шагом 20 мкм, скорость сканирования составляла 12.5 мм/c. Длина волны монохроматического излучения была равна 880 нм. На основе полученных данных были построены зависимости обратного светорассеяния от высоты, т.е. от расстояния от дна сосуда с НЭ или дисперсией нанокапсул, выраженного в относительных величинах – от 0 до 1.
Термограммы плавления и кристаллизации получали с помощью микрокалориметра VP-DSC (MicroCal Inc., США) с использованием ячеек из сплава тантала. Образец, содержащий нанокапсулы, разбавляли в 10 раз и помещали в измерительную ячейку (0.5 мл), в ячейку сравнения наливали 0.5 мл 0.15 M раствора NaCl. Термограммы снимали в двух циклах нагревания и охлаждения (5–60–5–60–5°C) со скоростью сканирования 60 град/ч. Интервалы между каждым нагреванием и охлаждением составляли 15 мин.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
3.1. Температурные характеристики наноэмульсий, стабилизированных смесями Tween 80/Span 80 и Tween 60/Span 60
НЭ были получены с помощью температурной инверсии фаз [30]. В данном методе смесь компонентов нагревается до температуры выше температуры инверсии фаз. При перемешивании в таких условиях образуется обратная макроэмульсия. Затем система резко охлаждается на ледяной бане при интенсивном перемешивании. В результате инверсии фаз обратная макроэмульсия трансформируется в прямую НЭ.
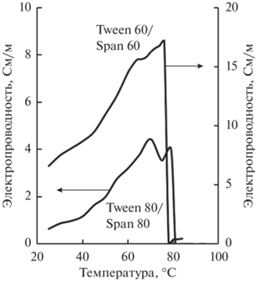
Температура инверсии фаз в эмульсиях, стабилизированных смесями ПАВ Tween 80/Span 80 или Tween 60/Span 60, была определена кондуктометрическим методом. На рис. 1 приведены зависимости электропроводности эмульсий от температуры. Резкое изменение электропроводности свидетельствует о трансформации обратной эмульсии, существующей при высокой температуре, в прямую эмульсию при более низкой температуре. Инверсия фаз протекала в узких температурных диапазонах: 79–81°C в эмульсиях, стабилизированных Tween 80 и Span 80, и 76–78°C в эмульсиях с Tween 60 и Span 60.
Рис. 1.
Зависимости электропроводности эмульсий, стабилизированных смесями Tween 60/Span 60 и Tween 80/Span 80, от температуры.
По данным производителя температура плавления олеиновой кислоты находится в диапазоне от 13 до 14°С. Неионогенные ПАВ Tween 80 и Span 80 плавятся при –(21–25)°C и 1°C соответственно. Температуры плавления Tween 60 и Span 60, равные 24.5 и 52°C, были определены нами в предыдущей работе [31]. Таким образом, в НЭ, стабилизированных Tween 80 и Span 80, при температуре 25°C все компоненты находятся в жидком состоянии. Для определения температур фазовых переходов в НЭ со смесью Tween 60 и Span 60 был использован метод микрокалориметрии. На рис. 2 приведены термограммы, полученные в двух циклах нагревания и охлаждения образца в температурном диапазоне 5–60°C.
Рис. 2.
Термограммы НЭ, стабилизированных Tween 60/Span 60, в двух циклах нагревания от 5 до 60°C и охлаждения от 60 до 5°C.
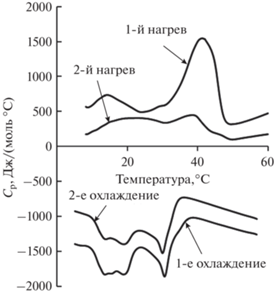
На кривой первого нагрева имеются два эндотермических пика при значениях температуры 14.3 и 41.3°C (табл. 1). Пик при 14.3°C очевидно соответствует плавлению олеиновой кислоты. Второй максимум при 41.3°C обусловлен плавлением смешанного адсорбционного слоя из молекул Tween 60 и Span 60 [31]. В ходе второго нагрева эти пики на кривых сохраняются, однако их форма выражена менее четко. При этом первый пик становится более протяженным и растягивается от 17.5 до 27.0°C, а второй пик сдвигается в сторону меньших температур, до 38.4°C.
Таблица 1.
Температуры фазовых переходов в НЭ, стабилизированной Tween 60 и Span 60
| Фаза сканирования | Температура, °C | |
|---|---|---|
| пик 1 | пик 2 | |
| Первое нагревание | 14.3 ± 0.2 | 41.3 ± 0.4 |
| Второе нагревание | (17.5–27.0) ± 0.3 | 38.4 ± 0.4 |
| Первое охлаждение | (13.6–18.9) ± 0.2 | 30.6 ± 0.3 |
| Второе охлаждение | (13.8–19.0) ± 0.2 | 29.9 ± 0.3 |
На кривой, соответствующей первому охлаждению, имеются экзотермические пики. Первый из них (раздваивающийся) начинается при 13.6°C и заканчивается более четким минимумом при 18.9°C. Второй экзотермический пик четко выражен и соответствует температуре 30.6°C. При втором охлаждении форма кривой остается практически неизменной, смещения положений максимумов находятся практически в пределах погрешности измерений.
При получении НЭ, стабилизированных смесью Tween 60 и Span 60, системы нагревали до температуры, превышающей температуру плавления всех компонентов, а затем резко охлаждали. Происходила инверсия фаз, и адсорбционный слой из Tween 60 и Span 60 затвердевал. Олеиновая кислота, обладающая поверхностно-активными свойствами, не успевала встроиться в адсорбционный слой и переходила в твердообразное состояние, находясь в ядре капель. Кривая первого нагрева, по сути, отражает состояние эмульсии после получения. При 25°C дисперсная система представляла собой жидкие капли олеиновой кислоты, окруженные твердообразной оболочкой из молекул ПАВ. Так как на поверхности капель в таких НЭ формировалась твердая оболочка, то далее эти системы будем называть нанокапсулами.
При микрокалориметрическом анализе нагревание и охлаждение системы происходило относительно медленно – со скоростью 1°C/мин. Поэтому при первом охлаждении некоторое количество олеиновой кислоты успевало встроиться в адсорбционный слой, а небольшая часть молекул неионогенных ПАВ могла перейти в ядро нанокапсул. Как следствие, при повторном нагревании первый пик стал более размытым и сместился в сторону более высоких температур. Второй максимум сдвинулся в сторону более низких температур. Такое перераспределение компонентов в нанокапсулах слабо отразилось на кривых кристаллизации. Однако можно сказать, что практическое совпадение их формы при первом и втором охлаждениях свидетельствует об устойчивости нанокапсул с олеиновой кислотой и оболочкой из смеси Tween 60 и Span 60 в исследованном температурном диапазоне, верхняя граница которого превышала температуру плавления оболочки на поверхности нанокапсул.
3.2. Устойчивость наноэмульсий и нанокапсул при 25°C и повышенных температурах
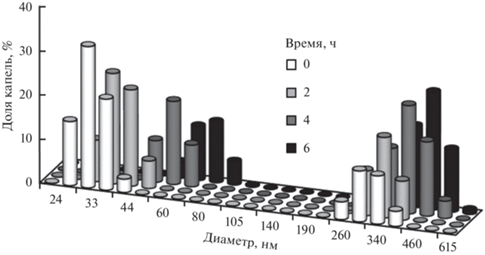
Так как НЭ являются кинетически стабильными системами, в них могут протекать процессы флокуляции, обратной седиментации, коалесценции и оствальдова созревания. НЭ с Tween 80 и Span 80 были неустойчивыми. Гистограммы для этих НЭ сразу же после их получения были бимодальными (рис. 3). Первый максимум соответствовал единичным каплям олеиновой кислоты диаметром 33–35 нм. Второй максимум, скорее всего, был обусловлен образованием каплями дисперсной фазы флокул [32] размером 300–330 нм.
Рис. 3.
Распределения капель по размерам в НЭ, стабилизированной Tween 80 и Span 80, спустя разное время после ее получения. Температура – 25°С.
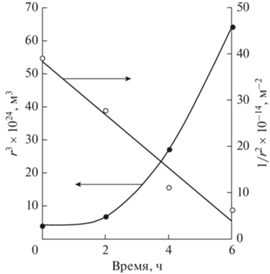
Размер единичных капель быстро возрастал с течением времени. Для определения того, какой процесс – коалесценция или оствальдово созревание – является доминирующим, были построены зависимости, изображенные на рис. 4 (r – радиус капель). Зависимость r3 от времени не была линейной, поэтому увеличение размеров единичных капель с течением времени не было обусловлено преимущественным влиянием оствальдова созревания [33]. Зависимость 1/r2 от времени можно было аппроксимировать линейной функцией с достаточно высоким коэффициентом достоверности (R2 = 0.9637). Поэтому можно заключить, что увеличение размеров единичных капель происходило в результате их коалесценции [32].
Профиль обратного светорассеяния для исходной НЭ, стабилизированной смесью Tween 80/Span 80, представлял собой практически ровную горизонтальную линию, что свидетельствует об однородности структуры наноэмульсии. Достаточно быстро в нижней части образца появилась зона с более низким обратным светорассеянием, которая расширялась в течение первых часов после получения наноэмульсии (рис. 5). Одновременно в верхней части образца образовалась зона более высокого светорассеяния. Это свидетельствует о процессах флокуляции капель олеиновой кислоты и обратной седиментации флокул, которые постепенно замедлялись и практически остановились через 24 ч. Пропускание образцов было очень низким и не изменялось по высоте столба НЭ в течение 24 ч (данные не приведены), т.е. водная фаза из НЭ с Tween 80 и Span 80 за это время не отслаивалась.
Рис. 5.
Профили обратного светорассеяния по высоте столба НЭ, стабилизированной Tween 80 и Span 80, спустя разное время после ее получения. Температура – 25°С.

В отличие от НЭ, стабилизированных Tween 80 и Span 80, дисперсии нанокапсул с оболочкой из Tween 60 и Span 60 были устойчивыми. В течение 28 сут при 25°C распределение нанокапсул по размерам оставалось монодисперсным, их средний диаметр практически не изменялся (рис. 6а). Профили обратного светорассеяния представляли собой почти горизонтальные линии, величина светорассеяния незначительно снижалась с течением времени (рис. 6б). Это показывает, что в дисперсии очень медленно протекала флокуляция нанокапсул, но при этом образцы сохраняли однородность структуры по высоте образца.
Рис. 6.
Зависимости среднего диаметра нанокапсул с оболочкой из Tween 60 и Span 60 от времени (а) и профили обратного светорассеяния по высоте столба дисперсии нанокапсул спустя разное время после ее получения (б). Температура – 25°С.
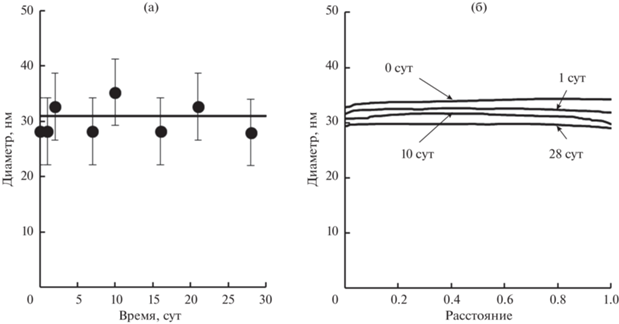
При использовании липидных носителей с инкапсулированными лекарственными соединениями необходимо, чтобы они сохраняли устойчивость в относительно широком температурном диапазоне. Поэтому была изучена устойчивость нанокапсул с олеиновой кислотой, стабилизированных Tween 60 и Span 60, в диапазоне температуры от 25 до 55°C. Средний диаметр нанокапсул при нагреваниях и охлаждениях изменялся в пределах погрешности измерений (рис. 7). Это свидетельствует о высокой устойчивости нанокапсул с оболочкой из Tween 60 и Span 60. Нанокапсулы оставались стабильными, в том числе и при температурах, превышающих температуру плавления оболочки.
4. ЗАКЛЮЧЕНИЕ
Наноэмульсии с олеиновой кислотой в качестве дисперсной фазы исследуются в качестве носителей лекарственных и биологически-активных соединений. Для успешного использования такие дисперсные системы должны быть устойчивыми в течение длительного времени, в том числе и при повышенных температурах. В данной работе исследованы НЭ с олеиновой кислотой в качестве дисперсной фазы, стабилизированные смесями неионогенных ПАВ Tween 80/Span 80 и Tween 60/Span 60.
Температуры фазовых переходов в НЭ с Tween 60 и Span 60 были определены методом микрокалориметрии. При первом нагреве от 5 до 60°C на термограмме наблюдались два эндотермических пика при значениях температуры 14.3 и 41.3°C, обусловленные плавлением олеиновой кислоты и смешанного адсорбционного слоя из молекул Tween 60 и Span 60 соответственно. При повторном нагревании первый пик становился более протяженным, а второй сдвигался в низкотемпературную область, так как некоторое количество олеиновой кислоты встраивалось в адсорбционный слой, а небольшая доля молекул неионогенных ПАВ могла перейти в ядро нанокапсул.
НЭ, стабилизированные Tween 80 и Span 80, были неустойчивыми. В таких системах интенсивно протекала флокуляция и коалесценция капель дисперсной фазы. В отличие от НЭ, стабилизированных Tween 80 и Span 80, нанокапсулы с оболочкой из Tween 60 и Span 60 характеризовались высокой устойчивостью. В течение 28 сут при 25°C распределение нанокапсул по размерам оставалось мономодальным, их средний диаметр практически не изменялся. В двух циклах нагревания до 60°C и последующего охлаждения до 5°C средний диаметр нанокапсул изменялся в пределах погрешности измерений. Таким образом, нанокапсулы с оболочкой из Tween 60 и Span 60 оставались стабильными и при значениях температуры, превышающих температуру плавления оболочки.
Список литературы
Zhang R., Zhang Z., McClements D.J. // Colloids Surf., B. 2020. V. 194. 111202.
Koroleva M.Yu., Yurtov E.V. // Russ. Chem. Rev. 2012. V. 81. P. 21.
Cury-Boaventura M.F., C. Pompéia, Curi R. // Clin. Nutr. 2004. V. 23. P. 721.
Rinaldi F., Forte J., Pontecorvi G., Hanieh P.N., Carè A., Bellenghi M., Tirelli V., Ammendolia M.G., Mattia G., Marianecci C., Puglisi R., Carafa M. // Int. J. Pharm. 2022. V. 613. 121391.
Pérez-González M.L.L., Rosa C.H.G., Pérez-Hernández G., Beltrán H.I. // Colloids Surf. B. V. 187. 110758.
Branco I.G., Sen K., Rinaldi C. // Chem. Eng. Process. 2020. V. 153. 107942.
Sravanthi V., Pallavi M.C.P., Bonam S.R., Sathyabama S., Kumar H.M.S. // J. Drug Deliv. Sci. Technol. 2015. V. 28. P. 56.
Mirgorodskaya A.B., Koroleva M.Yu., Kushnazarova R.A., Mishchenko E.V., Petrov K.A., Lenina O.A., Vyshtakalyuk A.B., Voloshina A.D., Zakharova L.Ya. // Nanotechnology. 2021. https://doi.org/10.1088/1361-6528/ac467d
Toragall V., Srirangam P., Jayapala N., Vallikanana B. // Mater. Today Commun. 2021. V. 28. 102522.
Sánchez-Ortega I., García-Almendárez B.E., Santos-López E.M., Reyes-González L.R., Regalado C. // Food Hydrocoll. 2016. V. 52. P. 906.
Chattopadhyay H., Datta S. // Mater. Today: Proc. 2018. V. 5. P. 9690.
Chakraborty T., Gupta S., Nair A., Chauhan S., Saini V. // J. Drug Deliv. Sci. Technol. 2021. V. 64. 102601.
Shaker D.S., Ishak R.A.H., Elhuoni M.A., Ghoneim A.M. // Int. J. Pharm. 2020. V. 578. 119073.
Cao S.-Q., Zhang K.-Y., Yan X., Ma Y. // Chin. Herbal Med. 2018. V. 10. P. 310.
Sarheed O., Shouqair D., Ramesh K.V.R.N.S., Khaleel T., Amin M., Boateng J., Drechsler M. // Int. J. Pharm. 2020. V. 576. 118952.
Shehata T.M., Khalil H.E., Elsewedy H.S., Soliman W.E. // J. Drug Deliv. Sci. Technol. 2021. V. 61. 102277.
Zaichik S., Steinbring C., Jelkmann M., Bernkop-Schnürch A. // Int. J. Pharm. 2020. V. 581. 119299.
Shi Y., Li H., Li J., Zhi D., Zhang X., Liu H., Wang H., Li H. // J. Drug Deliv. Sci. Technol. 2015. V. 27. P. 46.
Sandig A.G., Campmany A.C.C., Campos F.F., Villena M.J.M., Naveros B.C. // Colloids Surf. B. 2013. V. 103. P. 558.
Bazylińska U., Skrzela R., Szczepanowicz K., Warszyński P., Wilk K.A. // Soft Matter. 2011. V. 7. P. 6113.
Bazylińska U., Warszyński P., Wilk K.A. // Colloids Surf. A. 2012. V. 413. P. 266.
Janik-Hazuka M., Szafraniec-Szczęsny J., Kamiński K, Odrobińska J., Zapotoczny S. // Int. J. Biol. Macromol. 2020. V. 164. P. 2000.
Giacone D.V., Dartora V.F.M.C., Matos J.K.R., Passos J.S., Miranda D.A.G., Oliveira E.A., Silveira E.R., Costa-Lotufo L.V., Maria-Engler S.S., Lopes L.B. // Int. J. Biol. Macromol. 2020. V. 165. P. 1055.
Bonferoni M.C., Riva F., Invernizzi A., Dellera E., Sandri G., Rossi S., Marrubini G., Bruni G., Vigani B., Caramella C., Ferrari F. // Eur. J. Pharm. Biopharm. 2018. V. 123. P. 31.
Jung S., Lee S., Lee H., Yoon J., Lee E.K. // Colloids Surf. B. 2020. V. 146. P. 585.
Tamjidi F., Shahedi M., Varshosaz J., Nasirpour A. // Innovative Food Sci. Emerging Technol. 2014. V. 26. P. 366.
Chin L.Y., Tan J.Y.P., Choudhury H., Pandey M., Sisinthy S.P., Gorain B. // J. Drug Deliv. Sci. Technol. 2021. V. 62. 102341.
Souza I.F.F., Santos T.Q., Placido R.V., Mangerona B.A., Carvalho F.C., Boralli V.B., Ruela A.M., Pereira G.R. // Colloids Surf. B. 2021. V. 203. 111721.
Koroleva M.Yu., Nagovitsina T.Yu., Yurtov E.V. // Mendeleev Commun. 2015. V. 25. P. 389.
Izquierdo P., Esquena J., Tadros T.F., Dederen C., Garcia M.J., Azemar N., Solans C. // Langmuir. 2002. V. 18. P. 26.
Koroleva M., Portnaya I., Mischenko E., Abutbul-Ionita I., Kolik-Shmuel L., Danino D. // J. Colloid Interface Sci. 2022. V. 610. P. 61.
Koroleva M., Nagovitsina T., Yurtov E. // Phys. Chem. Chem. Phys. 2018. V. 20. P. 10369.
Koroleva M.Yu., Yurtov E.V. // Russ. Chem. Rev. 2021. V. 90. P. 293.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал