Коллоидный журнал, 2022, T. 84, № 1, стр. 74-83
Процессы растворения краун-замещенного фталоцианината магния в воде в присутствии бромидов алкилтриметиламмония
Т. Г. Мовчан 1, *, А. Ю. Чернядьев 1, Е. В. Плотникова 1, А. Ю. Цивадзе 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва,
Ленинский просп., 31, Россия
* E-mail: movchan_tamara@mail.ru
Поступила в редакцию 07.11.2021
После доработки 22.11.2021
Принята к публикации 27.11.2021
- EDN: POWVBW
- DOI: 10.31857/S0023291222010098
Аннотация
Методами электронной спектроскопии поглощения и люминесцентной спектроскопии проведен анализ процессов растворения окта-краун-замещенного фталоцианината магния (Mgcr8Pc) в воде при добавлении бромидов додецил-, тетрадецил- и гексадецилтриметиламмония. В предмицеллярной области концентрации ПАВ доминирует агрегирование Mgcr8Pc, индуцируемое ПАВ. Выше критической концентрации мицеллообразования ПАВ Mgcr8Pc полностью дезагрегирует до мономеров, при этом тенденция к его мономеризации возрастает с увеличением длины алкильной цепи в молекуле ПАВ, о чем свидетельствуют результаты измерений электронных спектров поглощения, флуоресценции и кинетики затухания флуоресценции. Увеличение времени жизни флуоресценции Mgcr8Pc по мере компактизации мицелл указывает на снижение степени их гидратации, приводящее к уменьшению полярности среды в микроокружении Mgcr8Pc. В растворах бромида гексадецилтриметиламмония Mgcr8Pc обладает интенсивной флуоресценцией как при комнатной температуре, так и после быстрой заморозке до 77 К, что подтверждает сохранение молекул Mgcr8Pc в мицеллах в дезагрегированном состоянии даже при такой низкой температуре. Полученные результаты свидетельствуют о потенциальной возможности использования Mgcr8Pc в растворах бромидов алкилтриметиламмония при фотодинамической терапии опухолей совместно с процедурами криолиза.
ВВЕДЕНИЕ
Как известно, фталоцианины и их производные помимо использования в качестве красителей нашли применение в качестве компонентов солнечных батарей, носителей информации в перезаписываемых CD- и DVD-дисках [1, 2], катализаторов окисления спиртов, тиолов, сульфидов и других химических реакций [2, 3], а также фотосенсибилизаторов (ФС) в фотодинамической терапии (ФДТ) онкологических заболеваний [4, 5]. Метод ФДТ основан на способности ФС селективно накапливаться в ткани опухолей и при локальном воздействии облучения определенной длины волны генерировать синглетный кислород или другие агрессивные формы кислорода, что приводит к гибели опухолевых клеток [3–5].
Повышенный интерес к фталоцианинам как претендентам на роль ФС обусловлен их высокой стабильностью, доступностью, способностью к интенсивному (с коэффициентом экстинкции ε ≥ 105 М–1 см–1) поглощению света в красной области (670–770 нм) спектра, что позволяет активировать эти соединения излучением, глубоко проникающим в ткани человека [3–5]. Однако склонность фталоцианинов к самоагрегации в воде и других полярных средах является основной проблемой при использовании как в ФДТ, так и в процессах окисления, поскольку их агрегаты фактически не обладают способностью генерировать синглетный кислород, а активный центр фталоцианинатов металлов оказывается недоступным для молекул субстрата каталитического процесса, что приводит к уменьшению каталитической активности материалов на их основе [3–7].
Проблема агрегации фталоцианинов решалась синтетическим путем за счет введения на периферии макроцикла заместителей с различными функциональными группами, препятствующими ассоциации этих молекул в полярных растворителях [6–9], а также путем использования органических растворителей в смеси с водой [3, 10]. Так, наличие в молекулах фталоцианинатов металла сульфо-, карбоксильных, краун-эфирных и других групп позволило достичь более высокой их растворимости, но не привело к полной дезагрегации как в воде, так и в физиологических растворах (содержащих ионы калия и натрия) – молекулы этих соединений находились в растворе в виде ассоциатов (преимущественно H-димеров) [6–9, 11–13]. Согласно работам [9, 12, 13], присутствие ионов калия в водной среде повышает растворимость фталоцианинов с краун-эфирными заместителями, но из-за большего (по сравнению с размером полости краун-эфирного фрагмента) размера этих ионов приводит к катион-индуцированной агрегации с образованием кофациальных димеров (H-димеров).
Эффективным методом повышения степени дезагрегации металлокомплексов фталоцианинов оказалась адсорбция и солюбилизация (в мицеллах) поверхностно-активных веществ (ПАВ) или дифильных блок-сополимеров. Эти системы способны обеспечить надежную изоляцию соседних хромофоров и доставить молекулу-фотосенсибилизатор к клетке – объекту атаки синглетным кислородом [11–14]. Мицеллярные растворы ПАВ благоприятствуют протеканию химических реакций в локальном микрообъеме.
Эффективное управление агрегационным состоянием и, как следствие, фотокаталитической активностью металлокомплексов фталоцианинов, осуществляется и с помощью их иммобилизации в полимерные матрицы или адсорбции на поверхности твердых минеральных носителей, препятствующих агрегации макроциклов. В роли таких носителей могут использоваться нанодисперсные порошки металлов и их оксидов, а также различные дисперсные природные минералы, в том числе алюмосиликаты [3]. С помощью ПАВ можно регулировать состояние поверхности твердых минеральных носителей для обеспечения адсорбции на ней металлокомплексов фталоцианинов различной природы.
Среди функционально замещенных фталоцианинов одним из перспективных ФС является окта[(4'-бензо-15-краун-5)окси]фталоцианинат магния (Mgcr8Pc), поскольку он обладает интенсивным поглощением [11–15] в фототерапевтическом окне и способностью локализоваться как в ядрах, так и в цитоплазме опухолевых клеток согласно данным флуоресцентной микроскопии и результатам изучения цитотоксичности по отношению к опухолевым клеткам HeLa [14].
Ранее эффект дезагрегации Mgcr8Pc в водном растворе был достигнут в присутствии мицелл додецилсульфата (ДСН), додецилбензолсульфоната и дезоксихолата натрия [11–13]. Результаты исследований электронных спектров поглощения (ЭСП) и спектров ЯМР привели авторов работ [11, 12] к выводу о предпочтительном использовании анионных ПАВ (АПАВ) для достижения дезагрегации Mgcr8Pc в воде с помощью ПАВ. Выбор иона натрия в качестве противоиона был связан с близостью его геометрических параметров и размеров полости бензо-15-краун-5-эфира, позволяющей иону находиться внутри нее. В качестве объяснения механизма дезагрегации молекул Mgcr8Pc в присутствии АПАВ предложена [11] гипотеза о синергизме взаимодействий, таких как комплексообразование ионов натрия с краун-эфирными фрагментами в его молекуле (по типу гость–хозяин), электростатическое взаимодействие полярной головной группы ДСН c комплексно-связанным ионом натрия и гидрофобные взаимодействия ароматических протонов с протонами метиленовых групп углеводородной цепи ДСН.
Однако позднее разрушение агрегатов Mgcr8Pc в воде было достигнуто с помощью катионных ПАВ (КПАВ): бромидов алкилтрифенилфосфония (СnТФФБ с n = 8, 12, 14, 16) [15–17], которые широко применяются в качестве антимикробных препаратов, переносчиков лекарственных средств и генного материала [18]. Проведены исследования по солюбилизации и мономеризации бромидов тетрадецил- и гексадецилтриметиламмония в насыщенных водных растворах Mgcr8Pc [19].
Данная работа продолжает начатые нами исследования по дезагрегации Mgcr8Pc в воде с помощью КПАВ, различающихся структурой молекул, и посвящена анализу методами электронной спектроскопии поглощения и флуоресцентной спектроскопии влияния длины алкильной цепи в гомологическом ряду бромидов алкилтриметиламмония (СnТАБ с n = 10, 12, 14 и 16) на растворимость Mgcr8Pc в воде до мономеров, а также устойчивости мицелл С16ТАБ при низкой температуре (77 К).
Следует отметить, что эти исследования представляют интерес не только с точки зрения применения Mgcr8Pc в ФДТ, но и для развития представлений о механизме модифицирования органических и неорганических (в частности, металлооксидных) наноструктур макроциклическими соединениями, обладающими выраженными функциональными свойствами (химическими, электрофизическими, оптическими и др.).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы
Синтез и очистка окта[(4'-бензо-15-краун-5)окси]фталоцианината магния, (рис. 1), проведенные в Институте физиологически активных веществ РАН совместно с Институтом физической химии и электрохимии им. А.Н. Фрумкина РАН, описаны в работе [11]. Препараты ПАВ гомологического ряда СnТАБ: С10ТАБ (I), С12ТАБ (II), С14ТАБ (III) и С16ТАБ (IV) – бромиды децил-, додецил-, тетрадецил- и гексадецилтриметиламмония соответственно (Acros Organics, содержание основного вещества 99.8%) дополнительной очистке не подвергали.
Растворы ПАВ с концентрацией в интервале c1 = 0.0004–0.7 М готовили на тридистилляте воды со значением электропроводности не больше 4 × 10–6 Ом–1 см–1, а также в фосфатном буфере с pH 7.4, используемом в биологических исследованиях. Содержание Mgcr8Pc в растворах ПАВ находилось в интервале значений 0.1–15 мкМ. Все измерения проводили при комнатной температуре (27°C).
Спектрофотометрические измерения проводили с помощью сканирующего спектрофотометра UV-2800 (UNICO, США) методом, аналогичным использованному нами ранее [14, 16, 17]. Растворы Mgcr8Pc помещали в кварцевые кюветы с длиной оптического пути l = 1 см. При анализе спектров поглощения Mgcr8Pc в различных средах основное внимание уделено длинноволновой области (500–900 нм), поскольку именно в ней наиболее заметны изменения при варьировании состава среды.
Спектры флуоресценции водных растворов Mgcr8Pc–ПАВ записаны на модульном спектрофлуориметре Fluorolog 3 (Horiba Jobin Yvon S.A.S., Франция) при длинах волн возбуждения 356 и 650 нм и оптической ширине щели 5 нм. В диапазоне 800–1600 нм спектры флуоресценции регистрировали с использованием детектора на основе InGaAs с одной решеткой типа Черни–Тернера. На рисунках представлены исправленные на спектральную чувствительность ФЭУ/решетки (истинные) спектры флуоресценции.
Измерения кривых затухания флуоресценции Mgcr8Pc выполнены методом счета единичных фотонов с помощью модуля FluoroHub, управляемого программой DataStation 2.6, при использовании импульсного светодиода (NanoLED) с λмакс = 370 нм в качестве источника возбуждения. Времена жизни флуоресценции Mgcr8Pc определяли путем моделирования экспериментальных кривых одноэкспоненциальной функцией в программе DAS 6.6.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние концентрации СnТАБ на растворимость Mgcr8Pс в воде. Электронные спектры поглощения
Как известно [11–13], октакраунзамещенный фталоцианинат магния в воде растворяется незначительно и медленно. Ранее [16] нами было показано, что в диапазоне 500–900 нм спектр поглощения Mgcr8Pс в воде содержит широкую бесструктурную полосу с максимумом при 634 нм, которая отражает тенденцию Mgcr8Pc к образованию димеров и более крупных агрегатов [12, 13]. В воде Mgcr8Pс обнаруживает только слабую флуоресценцию с максимумом в области 800 нм [16], соответствующую его агрегатам, которые образуются в результате π–π-cтэкинга молекул фталоцианината магния. Растворение Mgcr8Pc в воде может быть обусловлено образованием водородных связей между атомами кислорода краун-эфирных фрагментов и молекулами воды, а также водородными связями молекул воды с атомами азота в мезо-положениях фталоцианинового кольца.
Присутствие ПАВ гомологического ряда СnТАБ (n = 10, 12, 14, 16) и изменение их концентрации оказывает значительное влияние на агрегационное поведение Mgcr8Pс в воде, о чем можно судить по изменениям в спектрах поглощения. В качестве ПАВ использовали соединения I, II, III и IV со значениями ККМ 65, 15, 3.8 и 1 мМ соответственно [20], измеренными в отсутствие солюбилизата. При дальнейшем изложении условимся обозначать концентрацию ПАВ как c1 и выражать (для удобства сравнения) в единицах их ККМ, а концентрацию Mgcr8Pс – как c2.
На рис. 2 для системы Mgcr8Pc–I–вода приведены ЭСП при постоянной концентрации Mgcr8Pc c2 = 0.6 мкМ и переменной концентрации ПАВ c1. При c1 = 0.6 ККМ спектр поглощения Mgcr8Pc (кривая 2) еще аналогичен его спектру в воде (кривая 1). Более высокое, чем в воде, значение оптической плотности при 634 нм указывает на увеличение количества димеров, образующихся, по-видимому, за счет разрушения более крупных агрегатов Mgcr8Pc. Усиливающееся влияние I с дальнейшим ростом его содержания отражается в изменении формы спектра поглощения. Так, при c1 ≈ ККМ в спектре поглощения просматриваются два максимума (вблизи 682 и 647 нм) примерно одинаковой интенсивности (кривая 3). Максимум при 682 нм характерен для мономерного Mgcr8Pc. В интервале c1 = 1–6 ККМ высота пика при 682 нм немного растет, а при 647 нм снижается (кривые 4, 5), что указывает на увеличение количества мономеров Mgcr8Pc в растворе за счет разрушения его димеров.
Рис. 2.
ЭСП системы Mgcr8Pc–I–вода при концентрации Mgcr8Pc 0.6 мкМ и содержании I c1, ед. ККМ: 0 (1), 0.6 (2), 1.0 (3), 1.9 (4) и 6.2 (5). Вставка – зависимости оптической плотности (А) в максимумах поглощения мономеров (6) и димеров (7) от концентрации I (c1, в ед. ККМ), построенные на основании кривых 2–5, т.е. при концентрации Mgcr8Pc 0.6 мкМ.
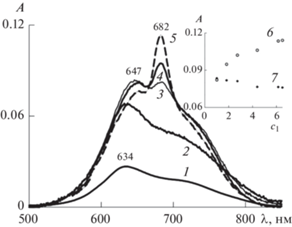
Рис. 3.
ЭСП системы Mgcr8Pc–II–вода при концентрации Mgcr8Pc 1.33 мкМ и содержании II c1, ед. ККМ: 0.4 (1), 0.7 (2), 1.1 (3), 1.6 (4) и 4 (5). Вставка – зависимости оптической плотности (А) в максимумах поглощения мономеров (6) и димеров (7) от концентрации II (c1, в ед. ККМ), построенные на основании кривых 1–5, т.е. при концентрации Mgcr8Pc 1.33 мкМ.
Нагляднее эту тенденцию иллюстрируют зависимости оптической плотности (А) в максимумах поглощения мономеров (7) и димеров (8) Mgcr8Pc от концентрации I (c1, в ед. ККМ). Они построены на основании спектров, приведенных рис. 2, и размещены на его вставке. Ввиду небольшого повышения оптической плотности при 682 нм и незначительного ее снижения в области 647 нм можно говорить лишь о частичной дезагрегации Mgcr8Pc в мицеллярных растворах I под влиянием этого ПАВ.
В системе Mgcr8Pc–II–вода (рис. 3) при концентрации Mgcr8Pc c2 = 1.33 мкМ, как и в присутствии I, при низких концентрациях ПАВ (c1 = = 0.4–0.7 ККМ) в спектре поглощения Mgcr8Pc наблюдается повышение оптической плотности при сохранении формы полосы (кривые 1, 2), а при c1 ≈ ККМ – изменение формы спектра (кривая 3). В отличие от I, в присутствии II второй максимум (при 683 нм) интенсивнее, чем первый, а его высота резко возрастает при меньшей (1.6 ККМ) концентрации ПАВ (кривая 4). Зависимость оптической плотности при 683 нм от концентрации II (кривая 6, на вставке) демонстрирует резкий рост в интервале c1 = 1–2 ККМ с последующим его замедлением при увеличении содержания ПАВ.
В системах Mgcr8Pc–ПАВ–вода влияние III (рис. 4) и IV (рис. 5) на процесс дезагрегации Mgcr8Pc в воде (c2 = 1.1 мкМ) оказывается более эффективным по сравнению с влиянием II. В частности, в присутствии III в спектре поглощения Mgcr8Pc появление пика мономера (кривая 2 на рис. 4) и заметный рост его высоты наблюдаются при меньшей концентрации ПАВ, чем в присутствии II (кривые 3–5 на рис. 4, кривые 2 и 3 на рис. 5). В случае IV в спектре поглощения Mgcr8Pc высокоинтенсивная полоса мономера присутствует уже при c1 = 1.3 ККМ.
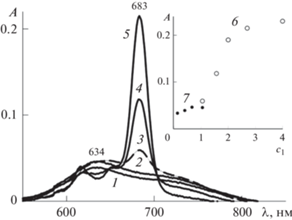
Рис. 4.
ЭСП системы Mgcr8Pc–III–вода при концентрации Mgcr8Pc 1.1 мкМ и концентрации III (ед. ККМ) 0.36 (1), 0.8 (2), 1.05 (3), 1.9 (4), 3.2 (5).

Рис. 5.
ЭСП системы Mgcr8Pc–IV–вода при концентрации Mgcr8Pc 1.1 мкМ и содержании IV c1, ед. ККМ: 0.1 (1), 1.3 (2) и 1.7 (3). Вставка – зависимости оптической плотности при 683 нм от концентрации (в ед. ККМ) II (4), III (5) и IV (6).
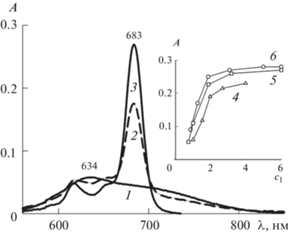
Рис. 6.
ЭСП системы Mgcr8Pc–II–вода при концентрации II c1 = 4 ККМ и разной концентрации Mgcr8Pc (снизу вверх): 0.2, 0.3, 0.7, 1.3, 2.6, 6.2 и 8 мкМ.

На вставке рис. 5 показаны зависимости оптической плотности мономеров Mgcr8Pc от концентрации II (4), III (5) и IV (6). Видно, что значения A резко возрастают с увеличением концентрации ПАВ примерно до 2 ККМ, а затем их рост замедляется. При этом эффект увеличения A тем больше, чем длиннее алкильная цепь в молекуле ПАВ.
Усиление влияния ПАВ при увеличении его содержания в растворе на процессы дезагрегации Mgcr8Pc, наблюдаемое по изменениям в ЭСП систем Mgcr8Pc–ПАВ–вода связано с проявлением различного рода межмолекулярных взаимодействий. Как уже было отмечено выше, в воде присутствуют в основном агрегаты Mgcr8Pc, устойчивость которых определяется стэкинг-взаимодействием ароматических электронов фталоцианината магния, а также наличием водородных связей между атомами кислорода краун-эфирных фрагментов и атомами азота с молекулами воды. В присутствии ПАВ указанные взаимодействия ослабевают. Так, поверхностно-активные ионы, адсорбируясь на поверхности макроциклов, предотвращают cтэкинг-взаимодействия ароматических систем. Разрушая водородные связи между атомами кислорода краун-эфирных фрагментов и атомами азота с молекулами воды, они формируют новые – между кислородными атомами краун-эфира и полярными группами поверхностно-активных катионов. Однако из-за больших размеров полярной группы (по сравнению с размером полости краун-эфирного фрагмента) это взаимодействие приводит к катион-индуцированной агрегации молекул Mgcr8Pc подобно тому, как это происходит в присутствии катионов калия в воде [9, 12, 13]. Отсюда следует, что при низких концентрациях I–IV еще превалируют гидрофобные силы притяжения между молекулами фталоцианината магния, что объясняет его преимущественно агрегированное состояние.
С ростом содержания ПАВ при некоторой его концентрации, уменьшающейся с увеличением поверхностной активности молекулы, гидрофобные взаимодействия между молекулами Mgcr8Pc перестают доминировать, что приводит к разрушению димеров и появлению мономеров.
Увеличение оптической плотности Mgcr8Pc в растворах II, III и IV при повышении их содержания (наиболее резком в интервале c1 = 1–2 ККМ с последующим замедлением) свидетельствует о том, что мономеризация Mgcr8Pc реализуется в основном за счет солюбилизации в мицеллах этих ПАВ, количество которых достаточно для включения 1 мкМ фталоцианината магния.
Обнаруженная тенденция к повышению эффективности дезагрегации Mgcr8Pc в мицеллярных растворах I, II, III и IV с ростом числа атомов C (nC) в алкильной цепи молекулы ПАВ, по-видимому, обусловлена снижением полярности микроокружения молекул Mgcr8Pc, предотвращающей их агрегации систем Mgcr8Pc–ПАВ–вода, приведенные ниже.
Влияние концентрации Mgcr8Pc на его растворимость в водной и фосфатно-буферной средах в присутствии мицелл СnТАБ
На рис. 6 приведены ЭСП системы Mgcr8Pc–II–вода в интервале c2 = 0.2–8 мкМ и концентрации II c1 = 4 ККМ. С ростом концентрации Mgcr8Pc увеличивается интенсивность полосы поглощения мономеров. Однако при c2 > 6 мкМ наблюдаются изменения формы спектра: уширение полосы мономеров, сопровождающееся ростом максимума поглощения в области 647 нм и появлением плеча в длинноволновой части спектра. Эти изменения указывают на уменьшение доли мономеров в смеси с агрегатами в растворе, что, вероятно, связано с межмолекулярным взаимодействием Mgcr8Pc.
На основе спектроскопических данных, приведенных на рис. 6, получена зависимость оптической плотности мономеров Mgcr8Pc от его концентрации c2 в системе Mgcr8Pc–II–вода (рис. 7, кривая 1, пустые треугольники) при концентрации II c1 = 4 ККМ. На этом же рисунке показаны аналогичные зависимости A(c2) (кривые 2, 3) в интервале c2 = 0.5–15 мкМ, полученные ранее [19] для систем Mgcr8Pc–III–вода (при концентрации III c1 ≈ 3 ККМ) и Mgcr8Pc–IV–вода (при концентрации IV c1 = 6 ККМ). Экспериментальные данные, относящиеся к III и IV, представлены пустыми квадратами и кружками соответственно.
Рис. 7.
Зависимости оптической плотности (A) в максимумах поглощения мономеров Mgcr8Pc от его концентрации (c2) в системах Mgcr8Pc–ПАВ–вода (1–3, пустые символы) и Mgcr8Pc–ПАВ–PBS (заполненные символы). ПАВ – II (1, треугольники), III (2, квадраты) и IV (3, кружки). Пояснения в тексте.
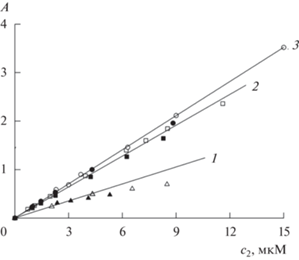
Из рис. 7 следует, что графическая зависимость A(c2) для мономеров Mgcr8Pc в присутствии II только в небольшом диапазоне c2 = 0.1–5 мкМ отвечает уравнению Бугера–Ламберта–Бера, а рассчитанный коэффициент молярной экстинкции ε = = 1.2 × 105 М–1 см–1. Отклонение экспериментальных данных от линейной зависимости при c2 ≥ 6 мкМ (пустые треугольники для прямой 1 на рис. 7) сопровождается изменениями формы спектра поглощения Mgcr8Pc (рис. 6).
В присутствии III и IV зависимости A(c2) линейны в большем диапазоне c2 = 0.5–15 мкМ, а их наклон определяет значения ε = 2.13 × 105 и 2.64 × × 105 М–1 см–1 соответственно [19]. Полученные значения ε (в единицах 105 М–1 см–1), близкие к величинам ε для Mgcr8Pc в дихлорметане (1.64 [11] и 2.09 [19]) и в растворах ДСН (1.7 [11] и 2.7 в интервале c2 = 1–10 мкМ [15]), отражают высокую эффективность II, III и IV в мономеризации Mgcr8Pc в воде.
Замена водной среды на фосфатный буфер (PBS) с pH 7.4 приводит к снижению интенсивности поглощения Mgcr8Pc в присутствии этих ПАВ, но незначительному. На рис. 7 экспериментальные зависимости A(c2) для систем Mgcr8Pc–ПАВ–PBS (pH 7.4) показаны заполненными символами – треугольниками, квадратами и кружками для II, III и IV соответственно. Можно заметить, что заполненные символы расположены немного ниже прямых, аппроксимирующих экспериментальные данные A(c2) для растворов в воде. Рассчитанные коэффициенты молярной экстинкции Mgcr8Pc в растворах II, III и IV в PBS с pH 7.4 (ε683, 105 М–1 см–1) равны 1.1, 1.9 и 2.25 соответственно. Полученные значения отражают тенденцию к увеличению интенсивности поглощения мономеров с ростом длины алкильной цепи ПАВ, но обнаруживают небольшое снижение по сравнению со значениями поглощения в водной среде. Это снижение (при замене воды на PBS с pH 7.4) может быть связано с присутствием димеров Mgcr8Pc, сформировавшихся под влиянием катиона калия [9, 12, 13] в буферной среде и сохранившихся в небольшом количестве в присутствии мицелл ПАВ.
Спектры и кинетика затухания флуоресценции Mgcr8Pc в этаноле и водных растворах СnТАБ
В спектрах флуоресценции Mgcr8Pс, находящегося в водных мицеллярных растворах I с с1 = = 10 ККМ и в растворах II, III и IV с с1 = 6 ККМ, наблюдается полоса с максимумом в диапазоне 692–695 нм, интенсивность которой увеличивается с ростом длины алкильной цепи ПАВ (кривые 1–4 на рис. 8). Спектры флуоресценции Mgcr8Pс в мицеллярных растворах I, II, III и IV в фосфатном буфере с pH 7.4 содержат полосы (кривые 5–8 на вставке рис. 8), близкие по интенсивности к измеренным в водных мицеллярных растворах тех же ПАВ. Таким образом, в буферных растворах также преобладают процессы мономеризации Mgcr8Pс. Незначительное снижение интенсивности флуоресцентного излучения Mgcr8Pс в мицеллярных растворах ПАВ при переходе от водной среды к буферной подтверждает гипотезу о присутствии небольшого количества димеров, которые не излучают.
Рис. 8.
Спектры флуоресценции системы Mgcr8Pc–ПАВ–вода при концентрации Mgcr8Pc 1.1 мкМ в присутствии мицелл I (1), II (2), III (3) и IV (4). На вставке – спектры флуоресценции систем Mgcr8Pc–ПАВ–PBS с pH 7.4 при концентрации Mgcr8Pc 0.9 мкМ в присутствии мицелл I (5), II (6), III (7) и IV (8); длина волны возбуждения 356 нм.

Измерения при длинах волн возбуждения 356 и 650 нм показали, что положение максимумов флуоресценции Mgcr8Pс в водных растворах II, III и IV не зависит от длины возбуждения. Близкое соответствие нормированных спектров поглощения (кривые 1–3) и флуоресценции (кривые 4–6) для растворов II (3, 6), III (2, 5) и IV (1, 4) при c1 = 6 ККМ, построенных с использованием шкалы волновых чисел (рис. 9), позволяет сделать вывод о практически полной мономеризации Mgcr8Pс при c2 = 1.1 мкМ. Нестрогое соответствие спектров правилу зеркальной симметрии может объясняться методическими особенностями: регистрацией спектров поглощения при ширине щели 1 нм, а спектров флуоресценции – при 5 нм. В случае I (c1 = = 10 ККМ, c2 = 0.6 мкМ) существенное нарушение правила зеркальной симметрии (сравните кривые 7, 8 во вставке на рис. 9) подтверждает предположение лишь о частичной дезагрегации Mg-cr8Pс в этой среде.
Рис. 9.
Нормированные спектры поглощения (1–4) и флуоресценции (5–8) систем Mgcr8Pc–ПАВ–вода при концентрации Mgcr8Pс 1.1 мкМ и c1 = 6 ККМ. ПАВ – II (3, 6), III (2, 5), IV (1, 4). На вставке – нормированные спектры поглощения (7) и флуоресценции (8) системы Mgcr8Pc–I–вода при c1 = 10 ККМ и содержании Mgcr8Pс 0.6 мкМ.
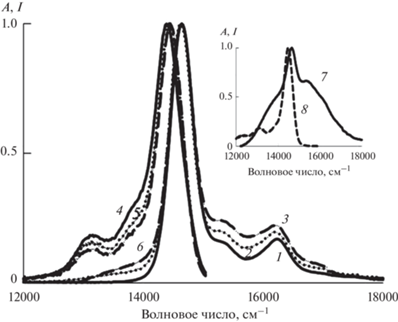
Кривые затухания флуоресценции Mgcr8Pc в мицеллярных растворах II, III и IV при его содержании c2 = 0.56 мкМ характеризуются одноэкспоненциальным спадом интенсивности, о чем свидетельствует линейность кривых, построенных в полулогарифмических координатах, используемых в программах DataStation 2.4 и DAS 6.6. Найденные времена жизни флуоресценции Mgcr8Pc (τ) составили 5.59, 5.67 и 6.38 нс для II, III и IV соответственно. Относительно большое значение τ в случае IV, свидетельствует о слабополярном микроокружении мономеров Mgcr8Pc в мицеллах этого ПАВ. Для сравнения укажем, что в полярном 96%-ном растворе этанола [21] мономеры этого производного фталоцианина характеризуются меньшим временем τ, равным 5.42 нс [16]. Таким образом, эксперимент по затуханию флуоресценции Mgcr8Pс в мицеллярных растворах II, III и IV выявил тенденцию к снижению полярности среды в микроокружении его мономеров с ростом длины алкильной цепи (nC) в молекулах CnТАБ.
Из физико-химии ПАВ известно, что при удлинении алкильного радикала (т.е. с ростом nC) в гомологическом ряду CnТАБ увеличиваются размер мицелл и плотность упаковки в них мономеров ПАВ. При более плотной упаковке мономеров затрудняется проникновение молекул воды в мицеллу, что снижает степень ее гидратации. Поэтому в зависимости от места локализации молекулы-зонда в мицелле, а при одинаковой локализации – в зависимости от степени гидратации будет изменяться полярность микроокружения зонда. В качестве возможных вариантов локализации молекул солюбилизата в мицеллах ПАВ рассматривают: 1) адсорбцию на поверхности мицеллы, 2) встраивание между полярными головными группами молекул ПАВ и несколькими ближайшими к ним CH2-группами гидрофобных “хвостов” и 3) более глубокое проникновение в углеводородное ядро мицеллы. Такому более глубокому проникновению молекулы Mgcr8Pс с краун-эфирными фрагментами внутрь мицелл II, III и IV мешают ее размеры, а адсорбции на поверхности – небольшая степень гидрофилизации краун-эфирных фрагментов. К тому же измеренные значения времени жизни флуоресценции Mgcr8Pс в присутствии мицелл II, III и IV указывают на его слабополярное микроокружение, едва ли реализуемое при адсорбции на поверхности мицеллы. Второй вариант локализации мономеров Mgcr8Pс в мицеллах этих ПАВ представляется более предпочтительным. Отсюда следует, что полярность микроокружения молекул Mgcr8Pс, солюбилизированных в мицеллах II, III и IV, снижается с увеличением длины алкильной цепи (ростом nC).
Заметим, что в аналогичных системах на основе CnТАБ (при n = 12, 14, 16) для тетрасульфофталоцианината цинка (ZnPcS4) в работе [7] получена иная тенденция – снижение полярности микроокружения молекул ZnPcS4 с уменьшением nC. Снижение полярности авторы [7] объяснили более глубоким проникновением компактной молекулы ZnPcS4 в ядро мицеллы с менее плотной упаковкой мономеров ПАВ, что достигается при меньшем значении nC. Различие в структуре молекул Mgcr8Pc и ZnPcS4 приводит к разным тенденциям в изменении времени жизни флуоресценции этих металлофталоцианинов в мицеллах CnТАБ при удлинении алкильной цепи ПАВ, т.е. при переходе от II к IV.
Таким образом, результаты исследований затухания флуоресценции Mgcr8Pc в мицеллярных растворах II, III и IV подтвердили предположение о влиянии полярности микроокружения солюбилизированного “зонда” на усиление интенсивности поглощения и флуоресценции при увеличении nC.
Спектры флуоресценции Mgcr8Pc в водном растворе С16ТАБ при температуре 77 К
На рис. 10 показаны спектры флуоресценции (λвозб = 615 нм) системы Mgcr8Pc–IV–вода с концентрацией Mgcr8Pc с2 = 1.1 мкМ и концентрацией IV с1 = 10 ККМ при температуре 300 (1) и 77 К (2). Там же приведен спектр возбуждения флуоресценции для переходов с λмакс 720 и 770 нм при температуре 77 К (3). При замораживании мицеллярного раствора Mgcr8Pc до температуры жидкого азота (77 К) интенсивность спектра флуоресценции (кривая 2) мало изменяется по сравнению с интенсивностью спектра при комнатной температуре (кривая 1), что свидетельствует о сохранении всего набора молекул красителя в дезагрегированном состоянии в условиях глубокой заморозки. Данный факт свидетельствует о возможности применения Mgcr8Pс в качестве фотосенсибилизатора ФДТ опухолей совместно с процедурами криолиза, также убивающего “плохие” клетки.
Рис. 10.
Спектры флуоресценции системы Mgcr8Pc–IV–вода при концентрации Mgcr8Pc 1.1 мкМ и концентрации IV с1 = 10 ККМ при температуре 300 (1) и 77 К (2); длина волны возбуждения 615 нм. Спектр возбуждения флуоресценции для переходов с λмакс 720 и 770 нм при температуре 77 К (3).
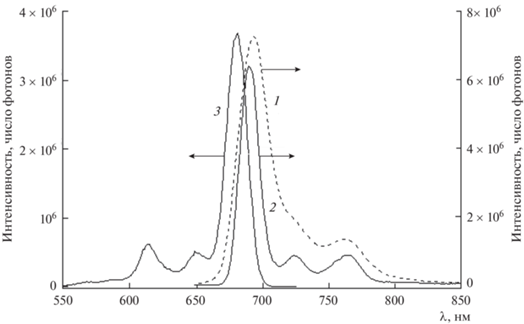
Сравнение кривых 1 и 2 показывает, что после замораживания наблюдается гипсохромный сдвиг спектра флуоресценции и уменьшение полуширины полос эмиссии. Спектр флуоресценции при 77 К становится более разрешенным в силу уменьшения заселенности колебательных спутников электронных переходов при охлаждении. Обнаруженные различия во флуоресценции Mgcr8Pc при 77 и 298 К типичны для растворов органических красителей, охлажденных до температуры жидкого азота [22].
Спектр возбуждения флуоресценции Mgcr8Pс при 77 К (кривая 3) хорошо соответствует правилу зеркальной симметрии по отношению к спектру флуоресценции (сравните кривые 2 и 3), что подтверждает связь флуоресценции с электронными переходами в области Q-полос поглощения фталоцианината магния, то есть переходы поглощения и эмиссии относятся к одним и тем же электронным уровням молекулы Mgcr8Pс [22].
ЗАКЛЮЧЕНИЕ
Мицеллярные растворы бромидов децил-, додецил-, тетрадецил- и гексадецилтриметиламмония в воде и фосфатном буфере с pH 7.4 обладают способностью эффективно разрушать агрегаты Mgcr8Pc, усиливающейся с увеличением длины алкильной цепи в молекуле ПАВ, о чем свидетельствуют данные ЭСП, флуоресцентной спектроскопии и кинетики затухания флуоресценции. Относительно большие значения времени жизни флуоресценции τ Mgcr8Pc в мицеллярных растворах бромидов додецил-, тетрадецил- и гексадецилтриметиламмония (5.59, 5.67 и 6.38 нс соответственно) указывают на слабополярное микроокружение мономеров Mgcr8Pc. Увеличение τ с ростом компактности мицелл, обусловленным удлинением алкильной цепи в молекуле ПАВ, подтверждает влияние степени гидратации мицелл на полярность микроокружении молекулы-зонда. С ее уменьшением усиливается эффективность мономеризации Mgcr8Pc.
При быстром замораживании мицеллярного раствора бромида гексадецилтриметиламмония до температуры 77 К находящиеся в нем молекулы фталоцианината магния остаются полностью дезагрегированными, что указывает на потенциальную возможность применения Mgcr8Pc в мицеллярных растворах катионного ПАВ для ФДТ опухолей совместно с криотерапией, например, для фотодинамической обработки контура убитых при криотерапии папиллом или злокачественных опухолей.
Список литературы
Цивадзе А.Ю. // Успехи химии. 2004. Т. 73. С. 6.
Vashurin A., Kuzmin I., Titov V., Pukhovskaya S., Razumov M., Golubchikov O., Koifman O. // Maкpoгeтepoциклы/Macroheterocycles. 2015. T. 8. C. 351.
Градова М.А., Осташевская И.И., Градов О.В., Лобанов А.В., Иванов В.Б. // Макрогетероциклы/ Macroheterocycles. 2018. Т. 11. С. 404.
Лукьянец Е.А. // Фотодинамическая терапия и фотодиагностика. 2013. Т. 2. № 3. С. 3.
Якубовская Р.И., Плютинская А.Д., Лукьянец Е.А. // Рос. биотерапевт. журн. 2014. Т. 13. № 4. С. 65.
Zhou L., Chen E., Jin W., Wang Y., Zhou J., Wei S. // RSC Adv. 2016. V. 45. P. 15170.
Jadhao M., Mukherjee S., Joshi R., Kumar H., Ghosh S.K. // RSC Adv. 2016. V. 6. P. 77161.
Li X.-y., He X., Ng A.C.H., Wu C., Ng D.K.P. // Macromolecules. 2000. V. 33. P. 2119.
Овсянникова Е.В., Ширяев А.А., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю., Андреев В.Н., Алпатова Н.М. // Макрогетероциклы/Macroheterocycles. 2013. Т. 6. С. 274.
Zekeriya B., Volkan C., Dilek C., Halit K. // J. Organomet. Chem. 2014. V. 749. P. 18.
Гольдшлегер Н.Ф., Черняк А.В., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю. // Журн. общей химии. 2012. Т. 82. С. 856.
Гольдшлегер Н.Ф., Баулин В.Е., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2014. Т. 50. С. 117.
Гольдшлегер Н.Ф., Лобач А.С., Гак В.Ю., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2014. Т. 50. С. 496.
Лапшина М.А., Норко С.И., Гольдшлегер Н.Ф., Баулин В.Е., Терентьев А.А. // Рос. биотерапевт. журн. 2018. Т. 17. № S. С. 40.
Мовчан Т.Г., Аверин А.А., Баулин Д.В., Плотникова Е.В., Баулин В.Е., Цивадзе А.Ю. // Коллоид. журн. 2018. Т. 80. С. 528.
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Аверин А.А., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2018. Т. 80. С. 694.
Мовчан Т.Г., Русанов А.И., Плотникова Е.В. // Коллоид. журн. 2021. Т. 83. С. 443.
Beyer K., Leine D., Blume A. // Colloids Surf. B. 2006. V. 49. P. 31.
Мовчан Т.Г., Русанов А.И., Плотникова Е.В. // Коллоид. журн. 2021. Т. 83. С. 187.
Мовчан Т.Г., Щекин А.К., Соболева И.В., Хлебунова Н.Р., Плотникова Е.В., Русанов А.И. // Коллоид. журн. 2015. Т. 77. С. 189.
Prasath R., Bhavana P. // J. Heterocycl. Chem. 2012. V. 49. P. 1044.
Лакович Дж. Основы флуоресцентной спектроскопии. М.: Мир, 1986.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал



