Коллоидный журнал, 2022, T. 84, № 1, стр. 97-104
Золотые наностержни с функционализированной органокремнеземной оболочкой: синтез и перспективы применения в тераностике опухолей
Н. А. Салаватов 1, А. В. Большакова 1, 2, В. Н. Морозов 3, М. А. Колыванова 3, А. К. Исагулиева 3, О. В. Дементьева 1, *
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва,
Ленинский проспект, 31, Россия
2 Московский государственный университет им. М.В. Ломоносова,
химический факультет
119992 Москва, Ленинские горы, 1, стр. 3, Россия
3 Федеральный медицинский биофизический центр им. А.И. Бурназяна ФМБА России
123098 Москва,
ул. Живописная, 46, Россия
* E-mail: dema_ol@mail.ru
Поступила в редакцию 11.10.2021
После доработки 27.10.2021
Принята к публикации 01.11.2021
- EDN: DTUWHI
- DOI: 10.31857/S0023291222010104
Аннотация
Обсуждаются особенности формирования на поверхности золотых наностержней органокремнеземной оболочки из γ-меркаптопропилтриметоксисилана и возможность использования полученных композитных частиц в сочетанной терапии опухолей. Показано, что наличие в составе оболочки функциональных SH-групп, способных координировать ионы платины, позволяет загрузить в нее достаточно большое количество противоракового препарата цисплатина. Получены количественные данные о закономерностях сорбции этого препарата и о влиянии pH и ионной силы раствора на кинетику его десорбции.
ВВЕДЕНИЕ
Диагностика и терапия злокачественных новообразований входят в число самых актуальных проблем современной медицины. При этом основными задачами являются разработка способов ранней диагностики, малоинвазивных методов лечения и создание принципиально новых препаратов локального действия, позволяющих сочетать различные методы воздействия (например, лучевое, химическое и фототермическое) [1, 2].
В этой связи значительный интерес представляют композитные наночастицы (КНЧ) с ядром из благородного металла (Au, Ag) и диэлектрической оболочкой, способной служить контейнером для того или иного целевого соединения. Присущий наночастицам металлов эффект локализованного плазмонного резонанса (ЛПР) обуславливает их способность к эффективному рассеянию излучения строго определенной длины волны, а также к его поглощению с последующей трансформацией в тепло [3]. Все это позволяет использовать металлические наночастицы при диагностике и фототермической терапии опасных заболеваний [2–4]. В свою очередь, высокая атомная масса благородных металлов (и в первую очередь золота) делает их наночастицы весьма перспективными объектами и с точки зрения повышения эффективности лучевой терапии [2, 5, 6]. В случае КНЧ открываются дополнительные возможности за счет загрузки в оболочку лекарственного препарата, локальный выход которого может быть обеспечен действием лазерного излучения.
Как свидетельствует анализ литературных данных (см., например, обзоры [2, 7] и приведенные в них ссылки), основное внимание исследователей привлекают анизотропные КНЧ на основе золотых наностержней, ЛПР которых можно настраивать на заданную длину волны (в том числе в окне прозрачности биологических тканей) за счет изменения осевого отношения частиц. В качестве материала оболочки, как правило, выступает кремнезем, получаемый путем гидролитической конденсации тетрaэтоксисилана (ТЭОС) [7]. Формирование такой оболочки является многостадийным процессом, подразумевающим предварительную модификацию Au-ядер функционализованными алкоксисиланами, а также введение в реакционную систему поверхностно-активных веществ для обеспечения развитой удельной поверхности, что является необходимым условием для загрузки достаточного количества лекарственного препарата.
На наш взгляд, замена ТЭОС на несимметричный триалкоксисилан, несущий ту или иную функциональную группу (например, NH2− или SH−), устраняет необходимость модификации Au-ядер и позволяет обеспечить формирование пористой оболочки без использования поверхностно-активного вещества. Кроме того, как свидетельствуют результаты наших предварительных экспериментов [8], выполненных с использованием в качестве прекурсора γ-меркаптопропилтриметоксисилана (МПТМС), введение в состав оболочки реакционноспособной SH-группы может способствовать загрузке в нее того или иного целевого соединения.
Данная работа является продолжением описанных в [8] экспериментов. Ее основная цель заключается в получении систематической информации об особенностях формирования на поверхности ЗНСт органокремнеземной оболочки заданной толщины, а также о закономерностях сорбции такой оболочкой противоракового препарата цисплатина и его последующей десорбции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и методы исследования
В работе использовали следующие реактивы: тригидрат золотохлористоводородной кислоты с содержанием основного вещества ≥99% (Acros Organics), соляную кислоту и дигидрат хлорида олова(II) марки “х. ч.” (Компонент-Реактив), раствор плазмидной ДНК (Сибэнзайм), а также бромид цетилтриметиламмония (ЦТАБ) (≥96%), гидрохинон (≥99.5%), нитрат серебра (99.9999%), борогидрид натрия (99%), МПТМС (95%), цисплатин (99%), 5,5'-дитиобис-2-нитробензойную кислоту (99%), этилендиаминтетрауксусную кислоту (99%), абсолютированный этанол, раствор NaOH с концентрацией 1 М и 28–30%-ный раствор аммиака (99.99%) производства Sigma-Aldrich.
Растворителями служили свежеперегнанный этанол, фосфатный буферный раствор (ФБР) и дистиллированная вода, дополнительно деионизированная на установке Arium 611 (Sartorius, Германия).
Для осаждения частиц на разных стадиях эксперимента использовали центрифугу 320R (Hettich, Германия); их редиспергирование проводили в ультразвуковой ванне.
Размеры и структуру частиц анализировали с помощью просвечивающего электронного микроскопа высокого разрешения (ПЭМВР) Leo-912 AB Omega (K. Zeiss, Германия) при ускоряющем напряжении 100 кВ. Для этого каплю водной дисперсии частиц помещали на медную сеточку, покрытую формваром, выдерживали ее в течение 1 мин, а затем удаляли фильтровальной бумагой. Полученные ПЭМВР-изображения обрабатывали с помощью программы JMicroVision.
В ряде случаев толщину органокремнеземной оболочки КНЧ определяли с помощью атомно-силового микроскопа Multimode V (Veeco, США). Измерения проводили в режиме прерывистого контакта. Образцы готовили, помещая каплю дисперсии КНЧ на стеклянную подложку и высушивая ее на воздухе при комнатной температуре.
Спектры экстинкции исследуемых растворов регистрировали с помощью двухлучевого спектрофотометра Evolution 300 (Thermo Electron Corp., США) в диапазоне длин волн от 190 до 1100 нм в полистирольных или кварцевых кюветах с длиной оптического пути 10 мм; в луч сравнения помещали кювету с дистиллированной водой.
ИК-фурье-спектры КНЧ (как исходных, так и с загруженным в оболочку функциональным соединением) записывали на спектрометре Nicolet 380 (Thermo Electron Corp., США). Измерения проводили в режиме диффузного отражения в диапазоне волновых чисел 400–4000 см–1; число сканирований составляло от 64 до 512.
Для изучения фототермических свойств ЗНСт и полученных на их основе КНЧ был использован непрерывный диодный лазер мощностью 500 мВт с длиной волны генерации 808 нм. Температуру дисперсий измеряли с помощью термопары.
Синтез золотых наностержней
ЗНСт получали беззатравочным способом по разработанному ранее протоколу [9]. В колбу объемом 300 мл вносили 10 г ЦТАБ, добавляли 250 мл воды и смесь интенсивно перемешивали на водяной бане при 30°C. После полного растворения ЦТАБ в раствор с интервалами в 5 мин последовательно вводили растворы HAuCl4, AgNO3, гидрохинона и NaBH4 в количестве, необходимом для получения наностержней, максимум продольного ЛПР которых находится вблизи 800 нм. Спустя 30 с после введения NaBH4 перемешивание прекращали и реакционную смесь оставляли на сутки на водяной бане при температуре 30°C.
Формирование на поверхности ЗНСт органокремнеземной оболочки
Для получения на поверхности ЗНСт органокремнеземной оболочки заданной толщины были сопоставлены два различных подхода. Помимо этого было определено влияние температуры и состава реакционной системы на характер роста оболочки.
Однократное введение прекурсора. В пластиковую пробирку объемом 50 мл вносили 10–20 мл золя ЗНСт, предварительно отмытого от избытка ЦТАБ по описанной в [9] схеме (числовая концентрация частиц примерно 4 × 1011 мл–1), затем в нее добавляли МПТМС из расчета 0.5−2 мкл меркаптосилана на 1 мл золя. Полученную смесь обрабатывали ультразвуком в течение 1 мин и оставляли перемешиваться на шейкере в течение суток для вытеснения катионов ЦТАБ с поверхности ЗНСт и хемосорбции МПТМС. Затем в реакционную систему вводили 28–30%-ный раствор аммиака в расчете 0.5–2 мкл на 1 мл золя, перемешивали ее на шейкере еще в течение суток, а затем оставляли в покое на 1–12 дней. Спустя заданные промежутки времени из системы отбирали пробы, регистрировали спектры их поглощения и анализировали размеры частиц.
Дробное введение прекурсора. В пластиковую пробирку объемом 50 мл вносили 10 мл дисперсии отмытых от избытка ЦТАБ наностержней с концентрацией ≈4 × 1011 или 1.6 × 1012 мл–1 и добавляли 40 мкл спиртового раствора МПТМС с концентрацией 5 об. %. Полученную смесь выдерживали в ультразвуковой ванне в течение 1 мин и оставляли перемешиваться в течение суток при температуре 20–60°C. После этого в систему вводили 20 мкл 28–30%-ного раствора аммиака, а затем, спустя заданные промежутки времени, требуемое количество порций 5%-ного спиртового раствора МПТМС объемом 40 мкл каждая. В ряде случаев перед внесением в систему аммиачной воды в нее добавляли 2.5 мл этанола. Реакционную смесь выдерживали при заданной температуре и непрерывном перемешивании в течение суток, а затем в покое до 6 сут, периодически отбирая из нее пробы для спектрального и микроскопического анализа. По окончании процесса полученные КНЧ осаждали центрифугированием (15 мин, 7000 об./мин). Надосадочную жидкость отбирали, а осадок редиспергировали в этаноле. Процедуру осаждения частиц повторяли еще раз и редиспергировали их в воде.
Определение количества свободных тиольных групп в составе оболочки с помощью реактива Эллмана
Количество тиольных групп в оболочке синтезированных КНЧ оценивали по их реакции с реактивом Эллмана (5,5'-дитиобис-2-нитробензойной кислотой) [10]. В результате этой реакции образуется 2-нитро-5-тиобензойная кислота, характеризующаяся интенсивной полосой поглощения с максимумом на 412 нм.
Определение количества SH-групп проводили по следующей схеме. К нейтральному ФБР добавляли 1 М раствор NaOH до достижения значения pH, равного 8, а затем вносили в него 30 мг этилендиаминтетрауксусной кислоты. В 980 мкл этого раствора редиспергировали КНЧ, осажденные центрифугированием из их водной дисперсии, и добавляли 20 мкл раствора 5,5'-дитиобис-2-нитробензойной кислоты. Полученную смесь выдерживали в течение 15 мин при комнатной температуре и регистрировали спектр ее поглощения.
Концентрацию тиольных групп CSH рассчитывали, используя следующую формулу:
где A − оптическая плотность раствора 2-нитро-5-тиобензойной кислоты на длине волны 412 нм, ε − ее коэффициент экстинкции (согласно [11] он составляет 14150 М–1 см–1), l − длина оптического пути, равная в условиях нашего эксперимента 1 см.Исследование закономерностей сорбции цисплатина органокремнеземными оболочками КНЧ и его последующей десорбции
Для изучения кинетики сорбции цисплатина дисперсию КНЧ с числовой концентрацией частиц 4 × 1011 мл–1 смешивали с раствором цисплатина (1 мг/мл) и выдерживали в темноте при постоянном перемешивании и комнатной температуре. Периодически из системы отбирали пробы, осаждали КНЧ центрифугированием и анализировали надосадочную жидкость на содержание в ней платины.
Ионы платины в растворе определяли методом комплексообразования с хлоридом олова(II) [12]. Эксперименты проводили следующим образом. 100 мкл водного раствора, содержащего 0.16 М SnCl2 и 4 М соляной кислоты, добавляли к 400 мкл надосадочной жидкости, выдерживали смесь 60 мин и регистрировали ее спектр поглощения. (В случае необходимости надосадочную жидкость разбавляли в 16 или 20 раз.)
Для построения изотермы сорбции КНЧ осаждали из 2 мл дисперсии с числовой концентрацией частиц 4 × 1011 мл–1 и редиспергировали их в таком же объеме раствора цисплатина, концентрацию которого варьировали в диапазоне 0.004–1 мг/мл. Полученную дисперсию выдерживали в течение суток в описанных выше условиях, а затем осаждали КНЧ центрифугированием и определяли содержание платины в надосадочной жидкости.
Кинетику десорбции цисплатина исследовали в статическом режиме. Для этого КНЧ с загруженным в оболочку препаратом диспергировали в деионизованной воде, а также в нейтральном или кислом (pH ≈ 5) ФБР. Периодически из системы отбирали пробы и анализировали их на содержание платины по описанной выше схеме.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
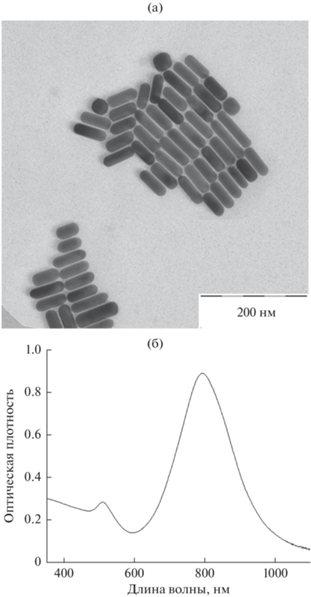
Результаты ПЭМВР (рис. 1а) свидетельствуют о том, что использованный нами протокол позволяет получать монодисперсные ЗНСт со средним диаметром 21.4 ± 1.8 нм и длиной 61.4 ± 7.6 нм. Высокое отношение интенсивностей продольного и поперечного ЛПР в спектре соответствующего гидрозоля (рис. 1б) указывает на то, что основным продуктом реакции являются именно ЗНСт. Максимум продольного ЛПР таких частиц находится вблизи 800 нм, т.е. в первом окне прозрачности биологических тканей.
Рис. 1.
Типичное ПЭМВР-изображение ЗНСт, полученных по описанному протоколу (а), и соответствующий спектр экстинкции (б).
Известно (см., например, [8]), что одним из преимуществ МПТМС с точки зрения синтеза оболочки на металлических частицах-ядрах является его способность хемосорбироваться на их поверхности с образованием связи S–металл. Как следствие, при введении МПТМС в водную дисперсию ЗНСт он достаточно быстро вытесняет катионы ЦТАБ с поверхности частиц, формируя плотный адсорбционный слой, о чем свидетельствует незначительный батохромный сдвиг продольного ЛПР.
Характер роста органокремнеземной оболочки критическим образом зависит от количества МПТМС в системе (точнее, скорости его введения), концентрации ЗНСт, соотношения вода/этанол и температуры. Дело в том, что в ходе гидролитической поликонденсации МПТМС в системе протекают два параллельных процесса: формирование оболочки на поверхности ЗНСт, а также нуклеация и рост новых “безъядерных” частиц органокремнезема.
В водной среде при комнатной температуре преобладает именно второй из указанных процессов, что отрицательным образом сказывается на качестве получаемых КНЧ. Анализ соответствующих ПЭМВР-изображений позволяет предположить, что при однократном введении заданного количества МПТМС в систему основная его часть расходуется именно на образование побочных продуктов (рис. 2а), что указывает на крайне низкий порог пересыщения. Уменьшение количества прекурсора в системе за счет его дробного введения или/и увеличение концентрации ЗНСт способствуют смещению равновесия в сторону роста оболочки (рис. 2б). Однако основными факторами, позволяющими практически полностью подавить образование безъядерных частиц (рис. 2в), являются повышение температуры системы до 40–60°C и введение в нее этанола (оптимальное его количество составляет 20 об. %).
Рис. 2.
ПЭМВР-изображения КНЧ, полученных при комнатной температуре (а, б) и 40°C (в); (а) однократное и (б) дробное добавление прекурсора в систему, практически не содержащую этанола, (в) дробное добавление прекурсора в систему с 20 об. % этанола. На вставке дано ПЭМВР-изображение с бóльшим увеличением.

Образование оболочки на поверхности ЗНСт сопровождается закономерным сдвигом максимума их продольного ЛПР в длинноволновую область вследствие изменения диэлектрической проницаемости среды вблизи поверхности частиц. При этом в диапазоне значений толщины оболочки (h) от 2−5 до 15−20 нм существует линейная корреляция между h и положением плазмонного пика, что позволяет достаточно точно контролировать рост оболочки с помощью спектроскопии поглощения.
Отметим, что рост оболочки на поверхности ЗНСт происходит скачкообразно. Так, максимальный прирост h, равный примерно 2 нм, регистрируется уже спустя 1 мин после добавления порции прекурсора. В дальнейшем (в течение 60 мин и более) значение h остается почти неизменным. На наш взгляд, постоянство значений h связано с тем, что наряду с присоединением к поверхности частиц новых молекул прекурсора имеет место уплотнение сетки силоксановых связей в оболочке, способствующее уменьшению ее толщины.
Титрование синтезированных КНЧ с помощью реактива Эллмана показало, что объем, приходящийся на одну SH-группу в составе оболочки, равен примерно 2.9 нм3. Эта величина представляется достаточно разумной с учетом размера “мономерного звена” органокремнезема, которое имеет брутто-формулу Si–O1.5–(CH2)3–SH, и рыхлой структуры оболочки, визуализируемой в ПЭМВР. Следует, однако, подчеркнуть, что количество SH-групп, определенных таким методом, не превышает 8% от их расчетного количества. На наш взгляд, такое различие связано, в первую очередь, с тем, что сравнительно большая молекула реактива Эллмана проникает только в верхние слои оболочки. Кроме того, нельзя исключить, что некоторое количество тиольных групп окисляется в процессе роста оболочки с образованием дисульфидов, не участвующих в этой реакции.
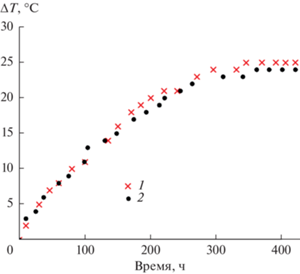
Дальнейшие эксперименты показали, что как ЗНСт, так и синтезированные на их основе КНЧ характеризуются достаточно высокой фототермической эффективностью. Так, воздействие на дисперсии ЗНСт и композитных частиц с максимумом ЛПР вблизи 800 нм излучения непрерывного диодного лазера мощностью 500 мВт с длиной волны генерации 808 нм приводит к достаточно быстрому их разогреву (рис. 3). При этом наличие на поверхности ЗНСт органокремнеземной оболочки практически не влияет на характер процесса и максимальную достигаемую температуру дисперсий, которая закономерно зависит от числовой концентрации частиц. Все это свидетельствует о возможности использования ЗНСт с органокремнеземной оболочкой при фототермической терапии опухолей.
Рис. 3.
Кривые нагрева дисперсии ЗНСт с числовой концентрацией частиц 4 × 1011 мл–1 (1) и дисперсии КНЧ с концентрацией 2.7 × 1011 мл–1 (2) под действием лазерного излучения.
Как было сказано выше, одной из целей данной работы являлось изучение особенностей загрузки в органокремнеземную оболочку КНЧ противоракового препарата цисплатина. Процесс проводили путем сорбции препарата из его раствора в деионизованной воде. Величину сорбции определяли спектрофотометрически; этот же метод был использован и при изучении кинетики десорбции препарата.
Как уже отмечалось ранее [8], смешение дисперсии композитных частиц с раствором цисплатина приводит к незначительному батохромному сдвигу продольного ЛПР, что косвенным образом свидетельствует о проникновении лекарственного препарата внутрь оболочки. Этот вывод подтверждают и данные ИК-фурье-спектроскопии, показавшие, что сорбция цисплатина приводит к появлению в спектре частиц полосы с максимумом вблизи 524 см–1, характерной для связи Pt−N [13]. В то же время полоса вблизи 2560 см–1, отвечающая валентным колебаниям группы –SH [14], полностью исчезает. Последний факт в целом согласуется с высказанным в [15] предположением о том, что сорбция цисплатина тиолированными частицами происходит за счет специфического взаимодействия между SH-группой и ионом Pt.
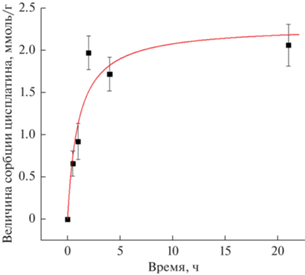
Следует подчеркнуть, что сорбция цисплатина органокремнеземной оболочкой композитных частиц происходит достаточно быстро, достигая своего максимального значения спустя 2–4 ч после начала процесса (рис. 4). Изотерма сорбции достаточно хорошо описывается уравнением Ленгмюра (рис. 5).
По данным спектроскопии поглощения максимальная величина сорбции цисплатина составляет 0.6 г цисплатина в расчете на 1 г органокремнеземной оболочки, это соответствует примерно 1 молекуле препарата на четыре тиольные группы.
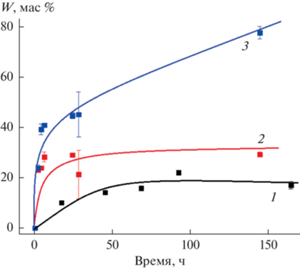
Как следует из представленных на рис. 6 кинетических кривых, характер десорбции цисплатина сильно зависит от pH и ионной силы раствора. Так, доля препарата (W), перешедшего в деионизованную воду за десять суток, не превышает 10 мас. % от его исходного количества. При диспергировании частиц в нейтральном и кислом (pH ≈ 5) фосфатном буфере скорость процесса резко возрастает и количество цисплатина, перешедшего в дисперсионную среду за 100 ч, составляет около 80 и 95 мас. % соответственно. Одной из причин такого эффекта может быть быстрая гидролитическая деструкция оболочки в среде с высокой ионной силой.
Увеличение скорости выхода препарата в кислой среде позволяет говорить о возможности его преимущественного высвобождения в опухоли, для тканей которой характерно более низкое значение pH по сравнению со здоровыми тканями.
Отметим также, что КНЧ с загруженным в оболочку цисплатином могут быть использованы для сочетанной терапии опухолей, выступая и в роли радиосенсибилизатора. Об этом свидетельствуют результаты предварительных экспериментов, выполненных на модели плазмидной ДНК.
ЗАКЛЮЧЕНИЕ
Определены основные факторы, обеспечивающие формирование на поверхности золотых наностержней однородных органокремнеземных оболочек заданной толщины с использованием в качестве прекурсора МПТМС, и показано, что полученные в результате КНЧ могут служить высокоемкими контейнерами для противоракового препарата цисплатина.
Список литературы
Lim E.-K., Kim T., Paik S., Haam S., Huh Y.-M., Lee K. // Chem. Rev. 2015. V. 115. P. 327.
Fan W., Yung B., Huang P., Chen X. // Chem. Rev. 2017. V. 117. P. 13566.
Jain P.K., Huang X., El-Sayed I.H., El-Sayed M.A. // Acc. Chem. Res. 2008. V. 41. P. 1578.
Kharlamov A.N., Tyurnina A.E., Veselova V.S., Kovtun O.P., Shur V.Y., Gabinsky J.L. // Nanoscale. 2015. V. 7. P. 8003.
Morozov K.V., Kolyvanova M.A., Kartseva M.E., Shishmakova E.M., Dement’eva O.V., Isagulieva A.K., Salpagarov M.H., Belousov A.V., Rudoy V.M., Shtil A.A., Sa-moylov A.S., Morozov V.N. // Nanomaterials. 2020. V. 10. P. 952.
Penninckx S., Heuskin A.-C., Michiels C., Lucas S. // Cancers. 2020. V. 12. P. 2021.
Abadeer N.S., Murphy C.J. // J. Phys. Chem. C. 2016. V. 120. P. 4691.
Салаватов Н.А., Дементьева О.В., Рудой В.М. // Коллоид. журн. 2020. Т. 82. С. 733.
Салаватов Н.А., Дементьева О.В., Михайличенко А.И., Рудой В.М. // Коллоид. журн. 2018. Т. 80. С. 571.
Lin P.-Y., Chen N.-F., Beck D.E., Plucktaveesa N., Hsieh S. // Mater. Res. Express. 2019. V. 6. 045035.
Riddles P.W., Blakeley R.L., Zerner B. // Meth. Enzymol. 1983. V. 91. P. 49.
Гинзбург И.И., Езерская Н.А., Прокофьева И.В., Федоренко Н.В., Шленская В.И., Бельский Н.К. // Аналитическая химия платиновых металлов / Под ред. Виноградова А.П. М.: Наука, 1972.
Torres M., Khan S., Duplanty M., Lozano H.C., Morris T.J., Nguyen T., Rostovtsev Y.V., De Yonker N.J., Mirsaleh-Kohan N. // J. Phys. Chem. A. 2018. V. 122. P. 6934.
Беллами Л. Инфракрасные спектры сложных молекул. М.: Издательство иностранной литературы, 1963.
Varache M., Bezverkhyy I., Weber G., Saviot L., Chassagnon R., Baras F., Bouyer F. // Langmuir. 2019. V. 35. P. 8984.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал