Коллоидный журнал, 2022, T. 84, № 2, стр. 200-212
Адсорбционные характеристики азокрасителя амаранта на рисовой лузге, модифицированной бромидом цетилтриметиламмония, в водном растворе
S. Chowdhury 1, P. Ghosh 1, Md. T. R. Joy 2, S. Karmaker 1, T. K. Saha 1, *
1 Department of Chemistry, Jahangirnagar University
1342 Savar, Dhaka, Bangladesh
2 Department of Chemistry, Jashore University of Science and Technology
7408 Jashore, Bangladesh
* E-mail: tksaha_ju@yahoo.com
Поступила в редакцию 09.05.2021
После доработки 07.10.2021
Принята к публикации 16.10.2021
- EDN: SJRKDW
- DOI: 10.31857/S0023291222020021
Аннотация
Для удаления анионоактивного азокрасителя амаранта из водного раствора был предложен экологически безопасный эффективный адсорбент – рисовая лузга, модифицированная бромидом гексадецилтриметиламмония (ЦТАБ-РЛ). Синтезированный адсорбент ЦТАБ-РЛ был охарактеризован с помощью Фурье инфракрасной спектроскопии (FTIR). Для ЦТАБ-РЛ определена точка нулевого заряда, соответствующая значению pH 5.85. Адсорбция амаранта на ЦТАБ-РЛ была подтверждена данными сканирующей электронной микроскопии с полевой эмиссией (FE-SEM) и энергодисперсионного анализа с применением рентгеновского излучения (EDX). Эксперименты по кинетике адсорбции красителя проводились при различных временах контакта с раствором, рН раствора, концентрации красителя в растворе, ионной силе и температуре. Максимальная адсорбция красителя наблюдалась при рН 2. Кинетические данные адсорбции амаранта соответствовали кинетической модели псевдовторого порядка. Данные равновесной адсорбции описывались изотермой Ленгмюра с максимальной адсорбционной способностью красителя 125 мкмоль/г ЦТАБ-РЛ при 45°C. Было определено, что энергия активации (Еа) процесса адсорбции красителя равна 18.71 кДж/моль. Термодинамический анализ показал, что адсорбция красителя амаранта на ЦТАБ-РЛ представляет собой спонтанный эндотермический процесс. Десорбцию амаранта адсорбентом ЦТАБ-РЛ из раствора красителя проводили в растворах NaOH при pH 13. Наконец, показано, что после рециклирования ЦТАБ-РЛ можно использовать без существенной потери его адсорбционной способности.
1. ВВЕДЕНИЕ
Стремление человечества к повышению индустриализации всех областей жизнедеятельности приводит к увеличению количества загрязнения и в настоящее время загрязнение воды является острой проблемой для многих стран. Большое количество органических загрязнителей поступает из текстильной, красильной и пищевой промышленности. Неочищенные стоки этих производств, как правило, смешиваются с открытой водой и загрязняют водную среду. Исследователи постоянно пытаются решить эту жизненно важную проблему. Удалить вредные красители из водного раствора можно с помощью наиболее признанного и экономичного метода адсорбции [1–3]. Различные природные и модифицированные адсорбенты, такие как хитозан [4], опилки и модифицированные опилки [5–9], обработанное джутовое волокно [10], отходы хлопка, активированного угля [11], пыль кокосовой койры [12], биокомпозит косточки манго [13], порошок, полученный из банановой кожуры [14], обработанная кислотой кожура банана [15], скорлупа древесного яблока [16], активированные стебли хлопка [17], катионно-модифицированный порошок апельсиновой корки [18], натуральный и модифицированный жмых сахарного тростника [19, 20] использовались для удаления красителей из водного раствора. Однако адсорбционная способность этих адсорбентов по красителям незначительна. Поэтому исследователи пытаются разработать новые адсорбенты с лучшей адсорбционной способностью по отношению к красителям.
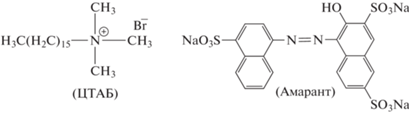
Рисовая лузга является дешевым побочным продуктом, производимым в больших количествах в сельском хозяйстве рисоперерабатывающей промышленностью в нашей стране, Бангладеш. Обзор литературы показывает, что натуральная рисовая лузга, зола рисовой шелухи и модифицированная рисовая лузга использовались для удаления различных загрязняющих веществ, таких как фенол [21], прямые красители [21], метилвиолет 10B [23], индигокармин [24], метиленовый синий [21, 25, 26], родамин Б [27, 28], малахитовый зеленый [29, 30], эриохром черный-Т [31], эозин Y и красный X-GRL [32], амарант [33] и Конго красный [34] из водного раствора. Однако удаление амарантового красителя (рис. 1 справа) из водного раствора с помощью рисовой лузги, модифицированной катионным поверхностно-активным веществом бромидом гексадецилтриметиламмония (ЦТАБ-РЛ, рис. 1 слева), ранее не исследовалось. Амарант является важной моделью синтетического азокрасителя и широко используется для придания привлекательного красного цвета сиропам, напиткам и сладостям [35]. Сообщается, что амарант может вызывать многочисленные неблагоприятные последствия для здоровья, такие как высокая генотоксичность, цитостатичность и цитотоксичность [36].
Рис. 1.
Структура бромида гексадецилтриметиламмония (ЦТАБ; слева) и амарантового красителя (справа).
Недавно мы обнаружили, что опилки, обработанные бромидом гексадецилпиридиния, являются эффективным адсорбентом для удаления красного пищевого красителя (Allura Red AC) из водной среды [5]. Этот значительный результат вдохновил нас на разработку ЦТАБ-РЛ для удаления красителя амаранта из водной среды. Здесь мы детально описываем синтез ЦТАБ-РЛ с целью улучшения адсорбционной способности адсорбента по отношению к анионным красителям. Полученный ЦТАБ-РЛ был охарактеризован с помощью Фурье-ИК спектроскопии пропускания. Адсорбция красителя амаранта на ЦТАБ-РЛ исследовалась с помощью полевой эмиссионной электронной микроскопии (FE-SEM) в сочетании с энергодисперсионным анализом (EDX). Влияние времени контакта, рН раствора, концентрации амарантового красителя, ионной силы и температуры раствора на кинетику адсорбции красителя изучали в порционных экспериментах. Кроме того, равновесная адсорбция амарантового красителя на ЦТАБ-РЛ в водной среде исследовалась при различных температурах. Данные по кинетике адсорбции анализировали с использованием кинетических моделей псевдопервого и псевдовторого порядка, моделей Эловича, пленочной диффузии и внутричастичной диффузии. Данные равновесной адсорбции красителя исследовали с помощью моделей изотерм Ленгмюра, Фрейндлиха и Темкина. Также было исследовано повторное использование ЦТАБ-РЛ для извлечения красителя из водного раствора. Наконец, были определены термодинамические параметры процесса адсорбции.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Материалы
Катионоактивное ПАВ бромид гексадецилтриметиламмония (ЦТАБ) и азокраситель амарант (Sigma-Aldrich, Германия) использовали без дополнительной очистки. Химическая структура амаранта и ЦТАБ представлена на рис. 1. Остальные реагенты, использованные в этом эксперименте, были марки “ХЧ”. Во всех экспериментах использовалась дистиллированная и деионизированная вода.
2.2. Приготовление и характеризация адсорбента
Рисовая лузга (РЛ) была приобретена на региональном рынке Савара, Дакка, Бангладеш. Неочищенную РЛ многократно очищали дистиллированной водой от грязи и сушили на воздухе. Обезвоженную РЛ измельчали в порошок и промывали петролейным эфиром для удаления красящих компонентов и других загрязнений. Обесцвеченную РЛ обрабатывали горячей дистиллированной водой (60°C), затем сушили при 80°C в течение 24 часов в печи. Обезвоженный порошок РЛ отделяли с помощью различных калиброванных сеток, а затем РЛ с размером частиц менее 75 мкм сохраняли в эксикаторе для использования.
Для приготовления ЦТАБ-РЛ рисовую лузгу (15 г; размер частиц: 0–75 мкм) переносили в химический стакан на 500 мл, содержащий 200 мл 1% (вес/объем) раствора ЦТАВ. Смесь перемешивали магнитной мешалкой при 120 об./мин и комнатной температуре (30°С) в течение 24 часов. Отделяя ЦТАБ-РЛ от смеси, ее повторно промывали деионизированной водой для удаления удерживаемого на поверхности ЦТАБ до тех пор, пока не переставали определяться бромид-ионы при добавлении к фильтрату 0.1 моль/л раствора AgNO3. После этого ЦТАБ-РЛ высушивали при 110°C в течение 12 часов и хранили в запечатанной стеклянной бутылке для дальнейшего использования.
Для измерения Фурье спектров пропускания для РЛ и РЛ, модифицированной ЦТАБ, порошок запрессовывали в таблетки с KBr. Спектры в частотном интервале 4000–400 см‒1 измеряли на Фурье-ИК спектрометре (IRPrestige-21, Shimadzu, Japan). Потенциал нулевого заряда (pHpzc) ЦТАБ-РЛ рассчитывался методом дрейфа pH [37].
Поверхностную морфологию и элементы рисовой лузги, модифицированной ЦТАБ, изучали до и после адсорбции амарантового красителя, используя полевую эмиссионную растровую электронную микроскопию (РЭМ) совместно с энергодисперсионным анализом рентгеновских лучей (EDX) на сканирующем растровом электронном микроскопе с катодом Шоттки (JSM-7610F, JEOL Ltd., Япония).
2.3. Порционные эксперименты по адсорбции
Чтобы охарактеризовать адсорбцию амарантового красителя на ЦТАБ-РЛ в водном растворе, были проведены порционные эксперименты по адсорбции в течение длительного времени. Этот эксперимент выполнялся в 125 мл закупоренных флаконах с адсорбентом (0.1 г) и 100 мкмоль/л раствора амаранта (25 мл) [38]. Для поддержания фиксированного значения рН, который измеряли с помощью рН-метра (Adwa AD8000), в раствор красителя добавляли либо 1 моль/л раствор HCl, либо 1 моль/л раствор NaOH. Для обеспечения равновесной адсорбции флаконы с образцами встряхивали в термостатируемом шейкере при комнатной температуре (30 ± 0.2°C) со скоростью 120 об./мин. Крышки на каждой бутылке позволяли значительно снижать испарение при высоких температурах. Для анализа концентрации красителя в растворе, через определенные промежутки времени отбирали пробы раствора и центрифугировали при 4000 об./мин в течение 5 мин. Концентрацию амарантового красителя в супернатанте определяли спектрофотометрическим методом на спектрофотометре UV-1800 (Shimadzu, Япония) при λmax = 521 нм (для рН 1–10) и 502 нм (для рН 11–13). Расчетная молярная абсорбционная способность амарантового красителя составила 20.9 × 103 л/моль см при 521 нм и 13.0 × 103 л/моль см при 502 нм соответственно. Количество красителя, адсорбированного на ЦТАБ-РЛ в произвольный момент времени t, qt (мкмоль/г) и в момент равновесия, qe (мкмоль/г), рассчитывали по следующим уравнениям:
и где C0, Ct и Ce, измеряемые в мкмоль/л, – концентрации красителя в растворе в начальный момент времени, в момент времени t и при равновесии, соответственно; V (л) – объем раствора красителя, а m (г) – вес сухого адсорбента.Также исследовали кинетику адсорбции при различных концентрациях растворов красителей (от 200 до 1200 мкмоль/л), ионной силе (от 0.01 до 0.20 моль/л) и температурах (30, 35, 40 и 45°С). Для контроля ионной силы раствора красителя использовали раствор KCl (1 моль/л). Исследование адсорбционного равновесия проводили при различных температурах (30, 35, 40 и 45°C) и pH 2. Для эксперимента по десорбции в качестве растворителя использовали раствор NaOH с концентрацией 0.1 моль/л (pH 13). После первой адсорбции насыщенный амарантовым красителем адсорбент ЦТАБ-РЛ собирали и сушили при комнатной температуре (30°C) в течение 12 часов. Высушенный адсорбент переносили в 25 мл 0.1 моль/л раствора NaOH, встряхивали в течение 420 мин и оценивали степень десорбции. Все данные, представленные в этой статье, являются средними значениями по двум измерениям.
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3.1. Характеризация адсорбента
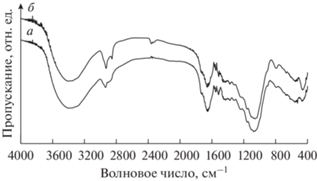
FTIR cпектры пропускания для РЛ и ЦТАБ-РЛ показаны на рис. 2. Спектр РЛ (рис. 2а) демонстрирует типичные полосы колебаний при 3390 см–1 (широкая полоса) для валентных колебаний O–H групп, 1687 см–1 для карбонильной группы (C=O) карбоксилата, 2935 см–1 для валентных C–H колебаний, 1461 см–1 для деформационных колебаний CH2 групп, 1380 см–1 для деформационных колебаний CH3 групп, 1238 см–1 для валентных C–O колебаний, 1076 и 1060 см–1 для валентных колебаний связей Si–O–Si. Эти полосы в основном являются следствием наличия целлюлозы, лигнина и кремнезема в РЛ. Пики групп ОН и С=О указывают на присутствие –СООН в РЛ [39]. Полосы 785 и 463 см–1 относятся к валентным колебаниям связей Si–H свежей РЛ.
На Фурье спектре пропускания ЦТАБ-РЛ (рис. 2б) наблюдается несколько пиков, характерных для немодифицированной РЛ, такие, как широкий пик при 3400 см–1 , относящийся к валентным колебаниям O–H групп, полосы 1659 см–1 карбонильной группы (C=O) карбоксилата, 1074 и 1053 см–1 для валентных колебаний связей Si–O–Si, 788 и 459 см–1 для валентных колебаний Si–H. Дополнительные пики при 2928 и 2855 см–1 связаны с валентыми С–Н колебаниями соответственно концевых групп –СН3 и –СН2 алифатического хвоста ПАВ [40]. Таким образом, подтверждается наличие ЦТАБ на поверхности модифицированного РЛ. Добавление ЦТАБ к РЛ приводит к образованию адмицелл на поверхности частиц РЛ, как это было замечено ранее для нанокристаллов целлюлозы, модифицированной ЦТАБ [41]. Формирование адмицелл в [41] объясняется гидрофобным притяжением между гидрофобными хвостами адсорбированных и свободных молекул ПАВ.
Значение pHpzc для ЦТАБ-РЛ было оценено в 5.85. Это означает, что поверхность ЦТАБ-РЛ будет положительно заряженной при pH < 5.85, что благоприятно для адсорбции отрицательно заряженных молекул адамантанового красителя. Напротив, поверхность ЦТАБ-РЛ становится отрицательно заряженной при увеличении рН раствора выше 5.85, противодействуя адсорбции молекул красителя.
3.2. Подтверждение адсорбции амарантового красителя на ЦТАБ-РЛ методами РЭМ и EDX
Сканирующая электронная микроскопия является очень функциональным инструментом для исследования морфологии поверхности адсорбентов. Морфологию поверхности образцов наблюдали с помощью автоэмиссионного растрового электронного микроскопа, оснащенного энергодисперсионной рентгеновской спектроскопией при ускоряющем напряжении 5 кВ. На рис. 3 показаны FE-SEM изображения поверхности ЦТАБ-РЛ до и после адсорбции красителя. Видно, что поверхность ЦТАБ-РЛ является шероховатой и нерегулярной (рис. 3а), что, возможно, обеспечивает больше пространства для адсорбции молекул красителя. После адсорбции амарантового красителя поверхность CTAB-RH стала более шероховатой (рис. 3б). Видно, что некоторые частицы прилипли к поверхности ЦТАБ-РЛ, что свидетельствует о присутствии молекул амаранта на поверхности ЦТАБ-РЛ [5].
Рис. 3.
Электронно-микроскопические (FE-SEM) изображения и результаты энергодисперсионной рентгеновской спектроскопии (EDX) до (а, в) и после (б, г) адсорбции амарантового красителя на ЦТАБ-РЛ.
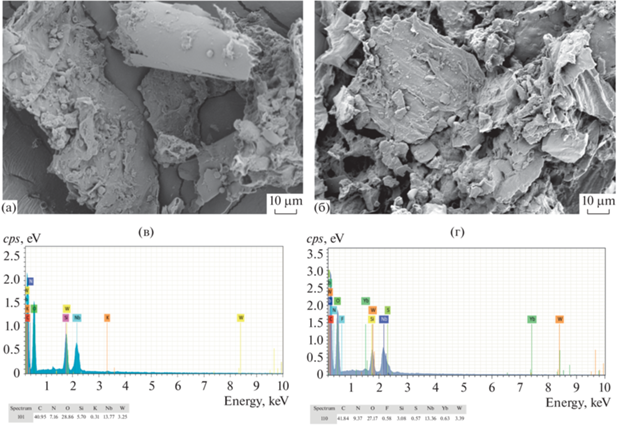
Энергодисперсионный анализ поверхности ЦТАБ-РЛ показывает, что основными химическими компонентами до адсорбции красителя являются C, O и N (рис. 3в). Пик S появился на EDX спектре поверхности ЦТАБ-РЛ после адсорбции амарантового красителя (рис. 3г). Кроме того, массовый процент N увеличился с 7.2 до 9.4%. Поскольку молекула амаранта имеет в своей структуре атомы N и S (рис. 1), можно сказать, что данные EDX еще раз подтверждают, что молекулы амаранта адсорбировались на поверхности ЦТАБ-РЛ [5].
3.3. Влияние времени контакта
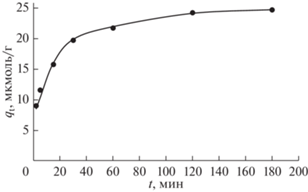
Влияние времени взаимодействия на адсорбцию амаранта на ЦТАБ-РЛ проверяли в водной среде (pH 2) при 30°C. Результаты показали, что поглощение ультрафиолетового излучения с длиной волны 521 нм раствором амарантового красителя постепенно снижалось с увеличением времени контакта. Это означает, что адсорбция красителя из раствора на поверхность ЦТАБ-РЛ со временем постепенно увеличивалась. Влияние времени взаимодействия на величину адсорбции амарантового красителя (qt) на ЦТАБ-РЛ показано на рис. 4. Наблюдается, что краситель интенсивно адсорбируется на ЦТАБ-РЛ в течение первых 15 мин, а затем скорость адсорбции красителя постепенно снижается со временем и по истечении 120 мин практически наступает адсорбционное равновесии. Однако степень адсорбции красителя мониторировали до 180 мин, чтобы подтвердить равновесную адсорбцию. Высокая скорость адсорбции красителя на начальном этапе является следствием адсорбции молекул красителя на развитой периферийной поверхности ЦТАБ-РЛ. При полном насыщении периферийной поверхности молекулами красителя скорость адсорбции снижается. На последующем этапе молекулы красителя начинают диффундировать в полости частиц адсорбента с меньшей скоростью адсорбции [42]. Поэтому в последующих исследованиях использовали время контакта 180 мин.
3.4. Влияние pH раствора
На адсорбцию амаранта на CTAB-RH сильно влияет рН раствора, поскольку заряд поверхности адсорбента контролируется рН раствора [43]. В данной работе мы изучили кинетику адсорбции амарантового красителя на ЦТАБ-РЛ в водном растворе при рН 2–10 с фиксированной концентрацией красителя (100 мкмоль/л) в растворе и дозировкой адсорбента (0.1 г) в течение 180 мин. Величина адсорбции амаранта на ЦТАБ-РЛ в зависимости от времени контакта при различных pH раствора показана на рис. S1 . Начальная скорость адсорбции красителя, h (мкмоль/(г мин)), значительно уменьшалась с ростом рН раствора (табл. 1). Из рис. 5 видно, что зависимость равновесного количества адсорбированного красителя qe от pH раствора имеет характер, аналогичный наблюдаемому для начальной скорости адсорбции красителя (табл. 1). Расчетное максимальное количество адсорбции амарантового красителя на ЦТАБ-РЛ составило 24.84 мкмоль/г при рН раствора 2.
Таблица 1.
Кинетические параметры, полученные при применении различных кинетических моделей для описания адсорбции амарантового красителя на ЦТАБ-РЛ в водных средах
| Варьируемый параметр | qe(exp), мкмоль/г | Кинетическая модель псевдопервого порядка | Кинетическая модель псевдовторого порядка | Кинетическая модель Еловича | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| qe(cal), мкмоль/г | k1, 1/мин | R2 | ∆qt, % | qe(cal), мкмоль/г | k2, г/мкмоль мин | h, мкмоль/г мин | R2 | ∆qt, % | qe(cal), мкмоль/г | α, мкмоль/г мин | β, г/мкмоль | R 2 | ∆qt, % | ||
| Варьируемый параметр: pH раствора (1-я колонка); размер частиц: ≤75 мкм; начальная концентрация красителя 100 мкмоль/л; температура 30°C | |||||||||||||||
| 2 | 24.84 | 14.76 | 0.029 | 0.979 | 4.26 | 25.71 | 0.005 | 3.47 | 0.999 | 1.25 | 27.86 | 3.80 × 1001 | 0.27 | 0.990 | 2.33 |
| 3 | 23.99 | 19.62 | 0.046 | 0.979 | 2.90 | 25.06 | 0.005 | 3.23 | 0.999 | 1.44 | 24.58 | 1.57 × 1001 | 0.27 | 0.985 | 1.07 |
| 4 | 23.66 | 19.37 | 0.037 | 0.997 | 2.92 | 25.00 | 0.004 | 2.59 | 0.999 | 1.63 | 24.89 | 6.03 × 1000 | 0.22 | 0.981 | 1.56 |
| 5 | 21.62 | 16.54 | 0.041 | 0.978 | 3.48 | 23.09 | 0.004 | 2.21 | 0.999 | 1.87 | 23.69 | 5.62 × 1000 | 0.23 | 0.964 | 2.22 |
| 6 | 20.89 | 14.47 | 0.033 | 0.946 | 4.04 | 22.27 | 0.004 | 2.05 | 0.999 | 1.87 | 22.58 | 5.23 × 1000 | 0.24 | 0.971 | 2.08 |
| 7 | 20.56 | 13.86 | 0.029 | 0.941 | 4.20 | 21.88 | 0.004 | 1.97 | 0.999 | 1.86 | 21.91 | 4.45 × 1000 | 0.24 | 0.990 | 1.88 |
| 8 | 19.91 | 17.87 | 0.041 | 0.997 | 2.39 | 21.55 | 0.004 | 1.65 | 0.999 | 2.14 | 20.92 | 4.15 × 1000 | 0.25 | 0.978 | 1.68 |
| 9 | 19.42 | 19.13 | 0.048 | 0.996 | 0.92 | 21.14 | 0.004 | 1.57 | 0.999 | 2.25 | 21.04 | 4.28 × 1000 | 0.25 | 0.975 | 2.19 |
| 10 | 18.31 | 17.15 | 0.042 | 0.991 | 1.96 | 20.16 | 0.003 | 1.31 | 0.999 | 2.48 | 21.53 | 4.84 × 1000 | 0.25 | 0.978 | 3.27 |
| Варьируемый параметр: начальная концентрация красителя (1-я колонка, мкмоль/л); pH раствора 2; размер частиц: ≤75 мкм; температура 30°C | |||||||||||||||
| 200 | 49.37 | 22.02 | 0.029 | 0.979 | 3.53 | 50.51 | 0.004 | 10.91 | 0.999 | 0.72 | 51.42 | 1.30 × 1002 | 0.16 | 0.982 | 0.97 |
| 500 | 80.99 | 52.70 | 0.038 | 0.990 | 2.19 | 84.75 | 0.002 | 12.12 | 0.999 | 0.80 | 84.12 | 5.81 × 1001 | 0.08 | 0.966 | 0.73 |
| 700 | 99.88 | 66.76 | 0.034 | 0.992 | 1.92 | 104.17 | 0.001 | 12.64 | 0.999 | 0.69 | 104.89 | 5.01 × 1001 | 0.06 | 0.965 | 0.75 |
| 800 | 103.76 | 70.86 | 0.039 | 0.991 | 1.84 | 107.53 | 0.001 | 15.04 | 0.999 | 0.62 | 103.86 | 1.14 × 1002 | 0.07 | 0.977 | 0.10 |
| 1000 | 106.22 | 33.80 | 0.013 | 0.845 | 2.67 | 107.53 | 0.002 | 23.15 | 0.999 | 0.36 | 101.61 | 3.61 × 1003 | 0.11 | 0.989 | 0.67 |
| 1200 | 106.34 | 31.98 | 0.028 | 0.845 | 2.70 | 107.53 | 0.003 | 38.46 | 0.999 | 0.34 | 113.12 | 1.28 × 1004 | 0.11 | 0.989 | 0.82 |
| Варьируемый параметр: ионная сила раствора (1-я колонка, моль/л); pH раствора 2; размер частиц: ≤75 мкм; начальная концентрация красителя 300 мкмоль/л; температура 30°C | |||||||||||||||
| 0.01 | 74.69 | 29.38 | 0.050 | 0.969 | 2.15 | 75.19 | 0.013 | 71.43 | 0.999 | 0.32 | 74.04 | 1.26 × 1003 | 0.14 | 0.966 | 0.36 |
| 0.05 | 74.67 | 29.90 | 0.043 | 0.984 | 1.37 | 76.34 | 0.004 | 24.27 | 1.000 | 0.58 | 75.61 | 1.57 × 1003 | 0.14 | 0.973 | 0.43 |
| 0.10 | 74.41 | 27.93 | 0.031 | 0.963 | 2.47 | 75.76 | 0.004 | 20.58 | 0.999 | 0.52 | 78.05 | 1.09 × 1003 | 0.13 | 0.980 | 0.85 |
| 0.15 | 74.35 | 28.31 | 0.026 | 0.963 | 2.44 | 75.76 | 0.004 | 18.25 | 0.999 | 0.53 | 74.80 | 7.14 × 1002 | 0.13 | 0.984 | 0.30 |
| 0.20 | 74.33 | 25.41 | 0.024 | 0.950 | 2.34 | 75.76 | 0.003 | 16.86 | 0.999 | 0.54 | 78.38 | 5.63 × 1002 | 0.12 | 0.986 | 0.90 |
| Варьируемый параметр: температура (1-я колонка, °C); pH раствора 2; размер частиц: ≤75 мкм; начальная концентрация красителя 500 мкмоль/л | |||||||||||||||
| 30 | 80.99 | 43.81 | 0.023 | 0.852 | 2.51 | 80.73 | 0.001 | 9.47 | 0.999 | 0.21 | 92.70 | 2.41 × 1001 | 0.06 | 0.969 | 1.41 |
| 35 | 83.92 | 44.90 | 0.025 | 0.903 | 2.48 | 83.35 | 0.001 | 11.17 | 1.000 | 0.30 | 96.78 | 3.08 × 1001 | 0.06 | 0.968 | 1.42 |
| 40 | 87.44 | 44.94 | 0.027 | 0.922 | 2.49 | 86.87 | 0.002 | 13.50 | 1.000 | 0.29 | 91.82 | 4.91 × 1001 | 0.07 | 0.957 | 0.80 |
| 45 | 89.79 | 43.91 | 0.026 | 0.968 | 2.51 | 89.87 | 0.002 | 15.75 | 0.999 | 0.11 | 47.80 | 3.18 × 1000 | 0.08 | 0.987 | 2.41 |
Рис. 5.
Влияние pH на величину равновесной адсорбции (qe) амарантового красителя на ЦТАБ-РЛ из водного раствора.
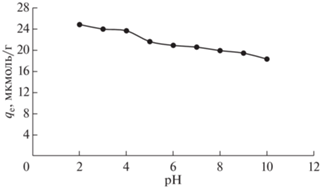
Было обнаружено, что pHpzc ЦТАБ-РЛ составляет 5.85. При pH 2 поверхности ЦТАБ-РЛ становились положительно заряженными, что притягивало молекулы анионного красителя, повышая скорость адсорбции. Наоборот, при повышении рН раствора выше pHpzc поверхности частиц ЦТАБ-РЛ превращались в отрицательно заряженные, что приводило к электростатическому отталкиванию между ЦТАБ-РЛ и молекулами амарантового красителя [44], что в конечном итоге приводило к меньшей адсорбции красителя на ЦТАБ-РЛ. Аналогичный результат был отмечен и при адсорбции красителя Allura Red AC на опилках, обработанных бромидом гексадецилпиридиния [5]. Поэтому, все остальные кинетические эксперименты проводились в водном растворе при рН 2.
3.5. Влияние начальной концентрации красителя
Величина адсорбции амарантового красителя на ЦТАБ-РЛ в зависимости от времени контакта при различной концентрации красителя в растворах (pH 2) и при температуре 30°C показана на рис. S2 . Начальная скорость адсорбции красителя h (мкмоль/г мин) увеличивалась с увеличением концентрации красителя в растворе (табл. 1), что свидетельствует о том, что адсорбция амаранта на ЦТАБ-РЛ зависит от концентрации красителя в растворе. С увеличением концентрации красителя от 200 до 1200 мкмоль/л величина равновесной адсорбции красителя также увеличивалась с 49.37 до 106.34 мкмоль/г (табл. 1). Высокая концентрация красителя в растворе обеспечивает подавление сопротивления массопереносу молекул между жидкой и твердой фазами [38]. Аналогичные явления отмечались и при адсорбции красителей реактивный синий 4 и реактивный черный 5 на хитозан в водном растворе [4, 45].
3.6. Влияние ионной силы
Изменение количества адсорбированного красителя амаранта на ЦТАБ-РЛ в зависимости от времени контакта исследовали в водном растворе (pH 2) при различной ионной силе раствора и начальной концентрации амарантового красителя 300 мкмоль/л при 30°C. Результаты представлены на рис. S3 . Установлено, что равновесная адсорбция красителя на ЦТАБ-РЛ постепенно снижается с ростом ионной силы раствора красителя (табл. 1). Эти результаты могут быть объяснены конкурентным эффектом между анионами красителя и ионами хлора (из KCl) за активные сорбционные центры ЦТАБ-РЛ, что было замечено ранее при адсорбции реактивного оранжевого 13 (RO13) на хлопьях семян джекфрута [46] и реактивного желтого 145. (RY145) при адсорбции на хитозан [47] в водной среде. Это также свидетельствует о наличии электростатических взаимодействий между молекулами красителя и частицами адсорбента.
3.7. Влияние температуры
Кинетику адсорбции амарантового красителя на ЦТАБ-РЛ исследовали в водном растворе (pH 2) при различных температурах с фиксированной начальной концентрацией красителя 500 мкмоль/л в течение 180 мин. Результаты представлены на рис. S4 . Видно, что скорость адсорбции красителя и степень равновесной адсорбции красителя увеличивались с повышением температуры раствора от 30 до 45°С (табл. 1). Следовательно, молекулы красителя амаранта более эффективно взаимодействовали с функциональными группами ЦТАБ-РЛ при более высокой температуре из-за повышенной гибкости молекул красителя при более высокой температуре. Предполагается, что более высокая температура раствора может вызывать эффект растяжения во внутренней конфигурации ЦТАБ-РЛ [48], как это наблюдается при адсорбции амаранта на кожуре граната [49], реактивного черного 5 и RY145 на хитозане [45, 47] из водного раствора.
3.8. Кинетическое моделирование
Для описания механизма адсорбции красителя данные, полученные в ходе порционных исследований адсорбции, обрабатывались в рамках кинетических моделей псевдопервого [50] и псевдовторого [51] порядка, моделей Эловича [52], пленочной диффузии [53] и внутричастичной диффузии [54]. Кинетическая модель псевдопервого порядка выражается уравнением (3) [50]:
(3)
$\lg ~({{q}_{{\text{e}}}} - {{q}_{{\text{t}}}}) = \lg {{q}_{{\text{e}}}} - \frac{{{{k}_{1}}}}{{2.0303}}t,$Нелинейная форма кинетической модели псевдовторого порядка описывается уравнением (4) [51]:
(4)
${{q}_{{\text{t}}}} = \frac{{{{k}_{2}}q_{{\text{e}}}^{2}t}}{{\left( {1 + {{k}_{2}}{{q}_{{\text{e}}}}t} \right)}},$Кинетическая модель Еловича описывается уравнением (6) [52]:
(6)
${{q}_{{\text{t}}}} = \frac{1}{\beta }\ln \left( {\alpha \beta } \right) + \frac{1}{\beta }\ln t,$Значимость и достоверность каждой модели можно проверить с помощью нормализованного стандартного отклонения (∆qe %) [55], которое можно определить следующим соотношением:
(7)
$\Delta {{q}_{{\text{e}}}}~~\left( \% \right) = 100\sqrt {\frac{{\sum {{{\left[ {{{\left( {{{q}_{{{\text{e}}\left( {{\text{exp}}} \right)}}} - {{q}_{{{\text{e}}\left( {{\text{cal}}} \right)}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{q}_{{{\text{e}}\left( {{\text{exp}}} \right)}}} - {{q}_{{{\text{e}}\left( {{\text{cal}}} \right)}}}} \right)} {{{q}_{{{\text{e}}\left( {{\text{exp}}} \right)}}}}}} \right. \kern-0em} {{{q}_{{{\text{e}}\left( {{\text{exp}}} \right)}}}}}} \right]}}^{2}}}}{{N - 1}}} ,$Кинетические параметры вместе с коэффициентами корреляции (R2) и нормализованным стандартным отклонением (∆qe), рассчитанные по различным кинетическим моделям, показаны в табл. 1. Стоит отметить, что значения R2, полученные для кинетической модели псевдовторого порядка (≥0.999), были значительно лучше, чем полученные для моделей псевдопервого порядка (≤0.997) и Еловича (≤0.990). Значения ∆qe, полученные для кинетической модели псевдовторого порядка, были меньше по сравнению со значениями, полученными для кинетических моделей псевдопервого порядка и Еловича (табл. 1). Более того, значения qe(cal), рассчитанные по кинетической модели псевдовторого порядка, очень близки к экспериментальным значениям qe(exp) (табл. 1), что свидетельствует о хорошем совпадении c кинетикой адсорбции псевдовторого порядка. Похожее согласие было обнаружено ранее для адсорбции RB5 и RY145 на хитозане в водной среде [45, 47].
Модель пленочной диффузии описывается уравнением (8) [53]:
где kfd (1/мин) – константа скорости пленочной диффузии, F – достигнутая доля равновесной адсорбции. Константа скорости пленочной диффузии рассчитывалась из графика зависимости ln(1 – F) от t. Вычисленные значения kfd и соответствующие величины коэффициента детерминации R2 приведены в табл. 2.Таблица 2.
Значения констант скорости диффузии в диффузионных моделях адсорбции амарантового красителя на ЦТАБ-РЛ
| Варьируемый параметр | Модель пленочной диффузии | Модель внутричастичной диффузии | ||||
|---|---|---|---|---|---|---|
| kfd, 1/мин | R 2 | kid1, мкмоль/г мин0.5 | R2 | kid2, мкмоль/г мин0.5 | R2 | |
| Варьируемый параметр: pH раствора (1-я колонка); размер частиц ≤75 мкм; начальная концентрация красителя 100 мкмоль/л; температура 30°C | ||||||
| 2 | 0.030 | 0.973 | 2.634 | 0.998 | 0.542 | 0.911 |
| 3 | 0.046 | 0.979 | 2.438 | 0.998 | 0.394 | 0.830 |
| 4 | 0.037 | 0.999 | 2.840 | 0.997 | 0.381 | 0.885 |
| 5 | 0.041 | 0.978 | 3.049 | 0.999 | 0.146 | 0.929 |
| 6 | 0.033 | 0.946 | 2.933 | 0.996 | 0.187 | 0.996 |
| 7 | 0.030 | 0.941 | 2.909 | 0.987 | 0.230 | 0.999 |
| 8 | 0.041 | 1.000 | 2.766 | 0.996 | 0.290 | 0.866 |
| 9 | 0.048 | 0.998 | 2.810 | 0.996 | 0.225 | 0.844 |
| 10 | 0.042 | 0.999 | 2.796 | 0.989 | 0.256 | 0.862 |
| Варьируемый параметр: начальная концентрация красителя (1-я колонка, мкмоль/л); pH раствора 2; размер частиц ≤75 мкм; температура 30°C | ||||||
| 200 | 0.029 | 0.979 | 4.782 | 0.965 | 0.603 | 0.950 |
| 500 | 0.038 | 0.990 | 9.053 | 0.987 | 1.074 | 0.813 |
| 700 | 0.034 | 0.992 | 11.072 | 0.983 | 1.808 | 0.889 |
| 800 | 0.039 | 0.991 | 9.731 | 0.991 | 1.710 | 0.854 |
| 1000 | 0.013 | 0.854 | 7.068 | 0.989 | 0.989 | 0.890 |
| 1200 | 0.013 | 0.854 | 6.432 | 0.960 | 1.056 | 0.935 |
| Варьируемый параметр: ионная сила раствора (1-я колонка, моль/л); pH раствора 2; размер частиц ≤75 мкм; начальная концентрация красителя 300 мкмоль/л; температура 30°C | ||||||
| 0.01 | 0.050 | 0.969 | 5.010 | 0.982 | 0.125 | 0.909 |
| 0.05 | 0.043 | 0.983 | 4.886 | 0.980 | 0.257 | 0.912 |
| 0.10 | 0.031 | 0.963 | 4.834 | 0.975 | 0.468 | 0.988 |
| 0.15 | 0.026 | 0.950 | 4.990 | 0.971 | 0.629 | 1.000 |
| 0.20 | 0.024 | 0.946 | 5.048 | 0.981 | 0.746 | 0.997 |
| Варьируемый параметр: температура (1-я колонка, °C); pH раствора 2; размер частиц ≤75 мкм; начальная концентрация красителя 500 мкмоль/л | ||||||
| 30 | 0.023 | 0.852 | 12.369 | 0.957 | 1.013 | 0.924 |
| 35 | 0.026 | 0.903 | 12.064 | 0.932 | 1.029 | 0.994 |
| 40 | 0.027 | 0.922 | 12.316 | 0.963 | 1.253 | 0.987 |
| 45 | 0.026 | 0.968 | 9.168 | 0.937 | 1.253 | 0.987 |
Модель внутричастичной диффузии характеризуется уравнением (10) [54]:
где kid (мкмоль/г мин0.5) представляет собой константу скорости внутричастичной диффузии, а I (мкмоль/г) обозначает отсекаемый отрезок.Типичные графики зависимости qt от t 0.5 для адсорбции амарантового красителя на ЦТАБ-РЛ при различных исходных концентрациях красителя показаны на рис. S5 . На каждом графике наблюдается по два линейных участка, что свидетельствует о двух явлениях в процессе адсорбции. Первое из них связано с быстрой внешней диффузией адсорбата к поверхности адсорбента с константой скорости kid1, а второе – с медленной внутренней диффузией адсорбента с константой скорости kid2 [47]. Значения kid1 и kid2, представленные в табл. 2, были определены по наклону соответствующих линий на рис. S5 . Стоит отметить, что ни одна из прямых не проходит через начало координат (рис. S5 ), что свидетельствует о многогранности механизмов адсорбции данного красителя. Механизмы поверхностной адсорбции и внутричастичной диффузии могут быть ответственны за суммарный процесс сорбции, как это отмечалось для адсорбции красителя RY145 на хитозане в водной среде [47].
3.10. Параметры энергии активации
Значения k2, представленные в табл. 1 для различных температур, были использованы для расчета энергии активации адсорбции амарантового красителя на ЦТАБ-РЛ в водной среде. Энергия активации (Ea), константа скорости (k2) и температура (T) связаны соотношением (11) [56]:
где R = 8.314 Дж/моль К – газовая постоянная. По представленным здесь данным, величина Ea была оценена в 18.71 кДж/моль по наклону графика ln k2 в зависимости от 1/T (R2 = 0.999). Близкие по величине значения энергии активации в 25.52 кДж/моль наблюдались для адсорбции ремазола бриллиантового фиолетового на хитозане 10B [38], 25.40 кДж/моль для адсорбции красителя реактивного оранжевого 13 на хлопьях семян джекфрута [46] и 19.72 кДж/моль для адсорбции RY145 на хитозане [47]. Величина Ea отражает характер процесса адсорбции. Обычно она составляет 5–40 кДж/моль для процесса физической сорбции и 40–800 кДж/моль для процесса хемосорбции [57]. Таким образом, полученное здесь значение (18.71 кДж/моль) указывает на то, что адсорбция амарантового красителя на ЦТАБ-РЛ определяется явлением физической сорбции.Для рассматриваемой адсорбционной системы изменение энтальпии активации (ΔH ‡), энтропии активации (ΔS ‡) и свободной энергии Гиббса активации (ΔG ‡) определяли по уравнениям (12) и (13) [58, 59]:
(12)
$\ln \left( {\frac{{{{k}_{2}}}}{T}} \right) = - \frac{{\Delta {{H}^{\ddag }}}}{{RT}} + ~\ln \frac{{{{k}_{{\text{B}}}}}}{{{{h}_{P}}}} + \frac{{\Delta {{S}^{\ddag }}}}{R},$3.11. Изотермы адсорбции
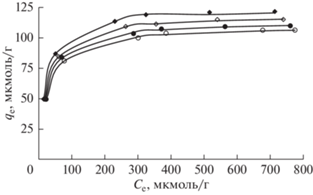
Различные модели изотерм использовались для оценки данных по изотермам равновесной адсорбции, чтобы понять взаимодействие, происходящее между адсорбатом и адсорбентом. Графики зависимости величины равновесной адсорбции амаранта qe от соответствующей равновесной концентрации раствора красителя Ce при различных температурах раствора показаны на рис. 6. Было обнаружено, что адсорбция исследованного красителя является эндотермическим процессом, поскольку величина qe увеличивается с повышением температуры раствора от 30 до 45°С. Для интерпретации данных равновесной адсорбции, полученных при различных температурах, использовались модели изотерм Фрейндлиха [62], Темкина [63] и Ленгмюра [64]. Уравнения использованных моделей приведены ниже.
Рис. 6.
Изотермы адсорбции амарантового красителя на ЦТАБ-РЛ при различных температурах: ⚪ 30°C; ⚫ 35°C; ◇ 40°C; ◆ 45°C. pH раствора 2; размер частиц ≤75 мкм; начальная концентрация красителя 200–1200 мкмоль/л; объем раствора 25 мл; загрузка адсорбента 0.1 г. Линиями показаны расчетные изотермы Ленгмюра (16), а определенные значения параметров aL и KL для разных температур приведены в табл. 3.
Модель Фрейндлиха
Модель Темкина
Модель Ленгмюра
(16)
${{q}_{{\text{e}}}} = \frac{{{{K}_{{\text{L}}}}{{C}_{{\text{e}}}}}}{{\left( {1 + {{a}_{{\text{L}}}}{{C}_{{\text{e}}}}} \right)}},$Таблица 3.
Значения параметров для различных изотерм и термодинамические характеристики адсорбции амарантового красителя на ЦТАБ-РЛ в водном растворе при pH 2
| Модель изотермы | Параметр | Температура, °C | |||
|---|---|---|---|---|---|
| 30 | 35 | 40 | 45 | ||
| Фрейндлиха | KF, (мкмоль/г)(ммоль/л)–1/n | 42.89 | 43.84 | 44.34 | 44.72 |
| n | 7.13 | 7.00 | 6.66 | 6.25 | |
| R2 | 0.971 | 0.975 | 0.977 | 0.963 | |
| Темкина | KT, ммоль/л | 40.07 | 39.62 | 31.22 | 23.22 |
| b, Дж/моль | 0.004 | 0.004 | 0.004 | 0.005 | |
| R2 | 0.943 | 0.950 | 0.954 | 0.933 | |
| Ленгмюра | KL (л/г) | 3.96 | 4.44 | 4.94 | 5.71 |
| aL , л/мкмоль | 0.036 | 0.039 | 0.042 | 0.046 | |
| qm, мкмоль/г | 109.89 | 113.64 | 119.05 | 125.00 | |
| R2 | 0.996 | 0.996 | 0.996 | 0.995 | |
| ∆G, кДж/моль | ‒26.46 | ‒27.12 | ‒27.73 | ‒28.37 | |
| ∆H, кДж/моль | 12.44 | ||||
| ∆S, Дж/моль K | 128.20 | ||||
| R2 | 0.992 | ||||
Значения максимальной адсорбции амарантового красителя qm на ЦТАБ-РЛ коррелируют с данными для других адсорбентов, о которых сообщалось в литературе (табл. 4). При этом оказалось, что ЦТАБ-РЛ адсорбирует большее количество амарантового красителя по сравнению с другими адсорбентами, такими как рисовая шелуха [33], кожура граната [49], скорлупа стручков тамаринда [65], смектитовая глина [66], шелуха арахиса [67], зольный остаток и обезжиренная соя [68], полистирол, армированный оксидом алюминия [69]. Следовательно, CTAB-RH можно использовать в качестве экологически чистого и высокоэффективного адсорбента для удаления амарантового красителя из водных растворов.
Таблица 4.
Сравнение адсорбционной емкости различных адсорбентов по отношению к амарантовому красителю в водных растворах
| Адсорбент | Размер частиц, мкм | pH | Температура, °C | qm, мкмоль/г | Источник |
|---|---|---|---|---|---|
| ЦТАБ-РЛ | ≤75 | 2 | 30 | 109.89 | Эта работа |
| Рисовая лузга | – | 2 | 30 | 39.84 | [33] |
| Кожура граната | – | 3 | 25 | 5.70 | [49] |
| Скорлупа стручков тамаринда | – | 2 | – | 107.59 | [65] |
| Смектитовая глина | 8 | 2 | – | 3.05 | [66] |
| Шелуха арахиса | 150–180 | 2 | 20 | 24.65 | [67] |
| Зольный остаток | ≤300 | 2 | 30 | 11.58 | [68] |
| Обезжиренная соя | ≤300 | 2 | 30 | 46.32 | [68] |
| Полистирол, армированный оксидом алюминия | 150–300 | 2 | 30 | 13.69 | [69] |
3.12. Термодинамические характеристики адсорбции
Определение термодинамических характеристик процесса адсорбции необходимо для выявления направления спонтанных процессов в системе. Термодинамические параметры, такие как изменение свободной энергии Гиббса (∆G, кДж/моль), энтальпии (∆H, кДж/моль) и энтропии (∆S, Дж/моль К), оценивали по следующим уравнениям [70]:
Наклон и отсекаемый на оси ординат отрезок зависимости ln aL от 1/T (R 2 = 0.992) использовались для расчета значений ∆H и ∆S, приведенных в табл. 3. Положительное значение ∆H свидетельствует об эндотермическом характере адсорбции. Положительный знак ∆S подтверждает повышенную разупорядоченность красителя на границе твердое тело–жидкость [61]. Термодинамические данные показывают, что ∆H < T∆S при всех температурах (табл. 3), что свидетельствует о том, что процесс адсорбции контролируется больше энтропийным, чем энтальпийным фактром. Рассчитанное изменение свободной энергии Гиббса составило от −26.5 до −28.4 кДж/моль при температуре от 30 до 45°С (табл. 3). Отрицательный знак и увеличение абсолютного значения ∆G с повышением температуры означает, что процесс адсорбции является самопроизвольным и ему благоприятствуют более высокие температуры.
3.13. Регенерация ЦТАБ-РЛ
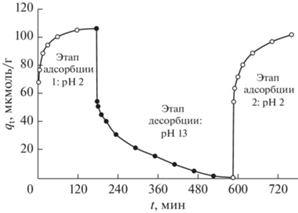
Регенерируемость адсорбентов очень важна в промышленности для создания экономичных установок по очистке сточных вод. На рис. 7 показана типичная картина цикла адсорбции-десорбции-адсорбции амарантового красителя на ЦТАБ-РЛ. На этапе адсорбции 1 раствор красителя с концентрацией 1200 мкмоль/л (при pH 2) взаимодействовал с 0.1 г ЦТАБ-РЛ в течение 180 мин при 30°C. Измеренное значение qe составило 106.34 мкмоль/г. Высвобождение красителя из ЦТАБ-РЛ, наполненного амарантовым красителем, измеряли в 0.1 моль/л растворе NaOH (pH 13) в течение 420 мин при 30°C. На этапе десорбции скорость высвобождения амарантового красителя была наиболее высокой в течение первых 15 минут; в целом, 99.34% амарантового красителя было выделено из наполненного красителем ЦТАБ-РЛ в течение 420 мин. Отметим, что молекулы анионного амарантового красителя легко высвобождаются из насыщенного красителем ЦТАБ-РЛ в сильнощелочном растворе (pH 13). На этапе адсорбции 2 регенерированный ЦТАБ-РЛ снова использовали для адсорбции раствора красителя с концентрацией 1200 мкмоль/л при pH 2 в течение 180 мин. Была отмечена картина адсорбции красителя, аналогичная обнаруженной на этапе 1. Расчетное значение qe составило 102.87 мкмоль/г для регенерированного ЦТАБ-РЛ. Эти результаты показывают, что ЦТАБ-РЛ можно использовать в качестве эффективного регенерируемого адсорбента для удаления амарантового красителя из водного раствора.
4. ЗАКЛЮЧЕНИЕ
В этом исследовании рисовая лузга, модифицированная бромидом гексадецилтриметиламмония (ЦТАБ-РЛ), использовалась для удаления амарантового красителя из водного раствора. Адсорбент ЦТАБ-РЛ был охарактеризован с помощью ИК-спектроскопии с преобразованием Фурье. Было определено, что значение pH в точке нулевого заряда для ЦТАБ-РЛ равно 5.85. Адсорбция амаранта на ЦТАБ-РЛ была подтверждена наблюдениями методом сканирующей электронной микроскопии с полевой эмиссией (FE-SEM) в сочетании с энергодисперсионной рентгеновской спектроскопией (EDX). Кинетику адсорбции красителя изучали в водных растворах в зависимости от времени контакта, рН раствора, концентрации красителя в растворе, ионной силы раствора и температуры. Адсорбционная способность ЦТАБ-РЛ повышалась с увеличением времени контакта, исходной концентрации красителя в растворе и температуры и уменьшалась с увеличением ионной силы в растворе красителя. Максимальная адсорбция амарантового красителя на ЦТАБ-РЛ наблюдалась в водном растворе при pH 2. Кинетика адсорбции успешно описывалась в рамках кинетической модели псевдовторого порядка, в то время как внутричастичная диффузия играла значительную роль на стадии снижения скорости адсорбции. Изотермы равновесной адсорбции лучше описываются моделью Ленгмюра, чем моделями Фрейндлиха и Темкина. Максимальная адсорбционная способность ЦТАБ-РЛ по отношению к амарантовому красителю составила 110 мкмоль/г при 30°C. Значения энергии активации (Ea = 18.71 кДж/моль) и термодинамических параметров (∆H = 12.44 кДж/моль; ∆S = 128.2 Дж/моль K и ∆G от −26.46 до −28.37 кДж/моль) показывают, амарантовый краситель самопроизвольно физически адсорбируется в эндотермическом процессе. Насыщенный красителем адсорбент ЦТАБ-РЛ высвобождает амарантовый краситель в 0.1 М растворе NaOH (pH 13), а регенерированный ЦТАБ-РЛ может быть повторно использован для адсорбции красителя. В целом представленная работа подтверждает, что ЦТАБ-РЛ можно использовать в качестве эффективного регенерируемого адсорбента для удаления амарантового красителя из водного раствора.
Список литературы
Karthik V., Saravanan K., Bharath P., Dharanya V., Meiaraj C. // J. Chem. Pharm. Sci. 2014. V. 7. P. 301.
Katheresan V., Kansedo J., Lau S.Y. // J. Environ. Chem. Eng. 2018. V. 6. P. 4676.
Sharma S., Kaur A. // Indian J. Sci. Technol. 2018. V. 11. P. 1.
Karmake, S., Nag A.J., Saha T.K. // Russ. J. Phys. Chem. A. 2020. V. 94. P. 2349.
Saha T.K., Bishwa, R.K., Karmaker S., Islam Z. // ACS Omega. 2020. V. 5. P. 13358.
Banerjee S., Chattopadhyaya M.C. // Arab. J. Chem. 2017. V. 10. P. S1629.
Pinto T.F., Bezerra C.W.B., Silva D.S.A., Silva Filho E.C.D., Vieira A.P., Airoldi C., Melo J.C. P.D., Silva H.A.S., Santana S.A.A. // An. Acad. Bras. Ciênc. 2016. V. 88. P. 1212.
Agarwal S., Tyagi I., Gupta V.K., Ghasemi N., Shahivand M., Ghasemi M. // J. Mol. Liq. 2016. V. 218. P. 208.
Sun L., Chen D., Wan S., Yu Z. // Bioresour. Technol. 2015. V. 198. P. 300.
Attya R., Zohdy M., Rabie A.G. // Arab J. Nucl. Sci. A-ppl. 2019. V. 52. P. 237.
Ekrami E., Dadashian F., Arami M. // Desalination Water Treat. 2016. V. 57. P. 7098.
Etim U.J., Umore, S.A., Eduok U.M. // J. Saudi Chem. Soc. 2016. V. 20. P. S67.
Shoukat S., Bhatti H.N., Iqbal M., Noreen S. // Microporous Mesoporous Mater. 2017. V. 239. P. 180.
Munagapati V.S., Yarramuthi V., Kim Y., Lee K.M., Kim D.S. // Ecotoxicol. Environ. Saf. 2018. V. 148. P. 601.
Oyekanmi A.A., Ahmad A., Hossain K., Rafatullah M. // PLoS One. 2019. V. 14. P. e0216878.
Sartape A.S., Mandhare A.M., Jadhav V.V., Raut P.D., Anuse M.A., Kolekar S.S. // Arab. J. Chem. 2017. V. 10. P. S3229.
Özdemir M., Durmuş Ö., Şahin Ö., Saka C. // Desalination Water Treat. 2016. V. 57. P. 18038.
Munagapati V.S., Kim D.S. // J. Mol. Liq. 2016. V. 220. P. 540.
Tahir H., Sultan M., Akhtar N., Hameed U., Abid T. // J. Saudi Chem. Soc. 2016. V. 20. P. S115.
Fideles R.A., Ferreira G.M.D., Teodoro F.S., Adarme O.F.H., da Silva, L.H.M., Gil L.F., Gurgel L.V.A. // J. Colloid Interface Sci. 2018. V. 515. P. 172.
Daffalla S.B., Mukhtar H., Shaharun M.S. // J. Applied. Sci. 2010. V. 10. P. 1060.
Abdelwahab O., Nemr A.E., Sikaily A.E., Khaled A. // Egypt. J. Aqut. Res. 2005. V. 31. P. 1.
Barbosa T.R., Foletto E.L., Dotto G.L., Jahn S.L. // Ceram. Int. 2018. V. 44. P. 416.
Arenas C.N., Vasco A., Betancur M., Martínez J.D. // Process Saf. Environ. Prot. 2017. V. 106. P. 224.
Chandrasekhar S., Pramada P.N. // Adsorption. 2006. V. 12. P. 27.
Franco D.S., Tanabe E.H., Dotto G.L. // Chem. Eng. Commun. 2017. V. 204. P. 625.
Suc N.V., Chi D.K. // J. Dispersion Sci. Technol. 2017. V. 38. P. 216.
Ding L., Zou B., Gao W., Liu Q., Wang Z., Guo Y., Wang X., Liu Y. // Colloids Surf. A. 2014. V. 446. P. 1.
Bhatti H.N., Jabeen A., Iqbal M., Noreen S., Naseem Z. // J. Mol. Liq. 2017. V. 237. P. 322.
Mobarak M., Mohamed E.A., Selim A.Q., Eissa M.F., Seliem M.K. // J. Mol. Liq. 2019. V. 273. P. 68.
Sohrabnezhad S., Daraie Mooshangaie S. // Mater. Sci. Eng. B. 2019. V. 240. P. 16.
Shafeii Darabi S.F., Bahramifar N., Khalilzadeh M. A. // J. Appl. Res. Wat. Wast. 2018. V. 9. P. 392.
Chowdhury S. // American Int. J. Research in Formal, Applied & Nat. Sci. 2015. V. 13. P. 55.
Bamroongwongdee C., Suwannee S., Kongsomsaksiri M. // J. Sci. Technol. 2019. V. 41. P. 1076.
Wang P., Hu X., Cheng Q., Zhao X., Fu X., Wu K. // J. Agric. Food Chem. 2010. V. 58. P. 12112.
Mpountoukas P., Pantazaki A., Kostareli E., Christodoulou P., Kareli D., Poliliou S., Mourelatos C., Lambropoulou V., Lialiaris T. // Food Chem. Toxicol. 2010. V. 48. P. 2934.
Kosmulski M. // J. Colloid Interface Sci. 2009. V. 337. P.439.
Karmaker S., Nag A.J., Saha T.K. // Cellulose Chem. Technol. 2019. V. 53. P. 373.
Pathiraja G.C., De Silva D.K., Dhanapala L., Nanayakkara N. // Desalination Water Treat. 2015. V. 54. P.547.
Mathurasa L., Damrongsiri S. // Int. J. Recycl. Org. Waste Agric. 2018. V. 7. P. 143.
Ranjbar D., Raeiszadeh M., Lewis L., MacLachlan M.J., Hatzikiriakos S.G. // Cellulose. 2020. V. 27. P. 3211.
Rahman M.M., Akter N., Karim M.R., Ahmad N., Rahman M.M., Siddiquey I.A., Bahadur N.M., Hasnat M.A. // J. Environ. Chem. Eng. 2014. V. 2. P. 76.
Ai L., Zhang C., Liao F., Wang Y., Li K., Meng L., Jiang J. // J. Hazard. Mater. 2011. V. 198. P. 282.
Saha T.K., Karmaker S., Ichikawa H., Fukumori Y. // J. Colloid Interface Sci. 2005. V. 286. P. 433.
Saha T.K., Bhoumik N.C., Karmaker S., Ahmed M.G., Ichikawa H., Fukumori Y. // Clean‒Soil, Air, Water. 2011. V. 39. P. 984.
Karmaker S., Uddin M.N., Ichikawa H., Fukumori Y., Saha T.K. // J. Environ. Chem. Eng. 2015. V. 3. P. 583.
Karmaker S., Sen T., Saha T.K. // Polym Bull. 2015. V. 72. P. 1879.
Bhattacharyya K.G., Sharma A. // Dyes Pigm. 2003. V. 57. P. 211.
Ali A.H., Egzar H.K., Kamal N.M., Abdulsaheb N., Mashkour M.S. // Int. J. Basic. Appl. Sci. 2013. V. 13. P. 34.
Lagergren S., Sven K. // Vetenskapsakad. Handl. 1898. V. 24. P. 1.
Ho Y.S., McKay G. // Process Biochem. 1999. V. 34. P. 451.
Elovich S.Y., Larinov O.G. // Izv. Akad. Nauk SSSR, Otd. Khim. Nauk. 1962. V. 2. P. 209.
Boyd G.E., Adamson A.W., Myers Jr.L.S. // J. Am. Chem. Soc. 1947. V. 69. P. 2836.
Weber W.J., Morris J.C. // J. Sanit. Eng. Div. Proc. Am. Soc. Civ. Eng. 1963. V. 89. P. 31.
Abdelhay A., Bsoul A.A., Al-Othman A., Al-Ananzeh N.M., Jum’h I., Al-Taani A.A. // Adsorp. Sci. Technol. 2018. V. 36. P. 46.
Ho Y.S., McKay G. // Chem. Eng. J. 1998. V. 70. P. 115.
Wu C.H. // J. Hazard. Mater. 2007. V. 144. P. 93.
Petrolekas P.D., Maggenakis // Ind. Eng. Chem. Res. 2007. 46. P. 1326.
Miyahara M., Okazaki M. // J. Chem. Eng. Jpn. 1993. V. 26. P. 510.
Eren E. // Clean‒Soil, Air, Water. 2010. V. 38. P. 758.
Karmaker S., Sintaha F., Saha T.K. // Adv. Biol. Chem. 2019. V. 9. P. 1.
Freundlich H. // Z. Phys. Chem. 1906. V. 57. P. 384.
Temkin M.I., Pyzhev V. // Acta Physicochim. URSS. 1940. V. 12. P. 327.
Langmuir I. // J. Am. Chem. Soc. 1918. V. 40. P. 1361.
Ahalya N., Chandraprabha M.N., Kanamadi R.D., Ramachandra T.V. // J. Biochem. Technol. 2012. V. 3. P. 189.
Nanganoa L.T., Ketcha J.M., Ndi J.N. // Res. J. Chem. Sci. 2014. V. 4. P. 7.
Gong R., Ding Y., Li M., Yang C., Liu H., Sun Y. // Dyes Pigm. 2005. V. 64. P. 187.
Mittal A., Kurup (Krishnan) L., Gupta V.K. // J. Hazard. Mater. 2005. V. 117. P. 171.
Ahmad R., Kumar R. // Clean–Soil, Air, Water. 2011. V. 39. P. 74.
Liu Y. // Colloid Surf. A. 2006. V. 274. P. 34.
Дополнительные материалы
- скачать ESM.docx
- Рис. S1. - Рис. S5.
Инструменты
Коллоидный журнал