Коллоидный журнал, 2022, T. 84, № 2, стр. 164-170
Агрегативная устойчивость наноэмульсий в еЛипосомах: анализ результатов математического моделирования
М. Ю. Королева 1, *, А. Плотниеце 2
1 Российский химико-технологический университет им. Д.И. Менделеева,
кафедра наноматериалов и нанотехнологии
125047 Москва, Миусская пл. 9, Россия
2 Латвийский институт органического синтеза,
Лаборатория мембранно-активных соединений
LV-1006 Рига, ул. Айзкрауклес 21, Латвия
* E-mail: m.yu.kor@gmail.com
Поступила в редакцию 18.02.2022
После доработки 04.03.2022
Принята к публикации 04.03.2022
- EDN: OBCCNW
- DOI: 10.31857/S0023291222020069
Аннотация
В последнее время активно разрабатываются гибридные многокомпонентные носители для доставки лекарственных веществ, одним из которых являются еЛипосомы. Благодаря комплексной структуре еЛипосом, которые представляют собой капли наноэмульсии, окруженные фосфолипидным бислоем, такие системы могут быть использованы для доставки гидрофильных, гидрофобных и амфифильных соединений одновременно. Для эффективного использования таких структур необходимо, чтобы наноэмульсия была устойчивой в ограниченном пространстве внутри липосом. В данной работе с помощью математического моделирования с использованием динамики Ланжевена была изучена стабильность наноэмульсий с различным ζ-потенциалом капель масла и с разной долей дисперсной фазы. Результаты расчетов показали, что при низких величинах ζ-потенциала устойчивыми являются наноэмульсии с долей дисперсной фазы ≤10 об. %. Для получения стабильных наноэмульсий с более высокой долей дисперсной фазы необходимо, чтобы ζ-потенциал капель дисперсной фазы превышал 40 мВ по абсолютной величине. При этом устойчивость наноэмульсий как с низким ζ-потенциалом капель, так и с высоким, обеспечивается в большой степени интенсивным броуновским движением капель во внутреннем пространстве еЛипосом.
ВВЕДЕНИЕ
Липидные нано- и микрокапсулы – перспективные средства для доставки лекарственных соединений в организм человека. Наиболее исследованными и разрешенными для практического использования являются липосомы [1–4]. В липосомах можно инкапсулировать различные по полярности лекарственные соединения: гидрофильные – во внутреннем водном ядре, амфифильные – в фосфолипидном бислое, гидрофобные – между углеводородными цепями фосфолипидов [5]. Степень загрузки гидрофильных и амфифильных соединений в липосомы может быть достаточно большой. Емкость по гидрофобным соединениям существенно меньше из-за ограниченности пространства внутри фосфолипидного бислоя. С другой стороны, наиболее эффективное инкапсулирование гидрофобных соединений происходит в липидных нанокапсулах, к которым относятся наноэмульсии и твердые липидные наночастицы [6, 7].
Если соединить эти две структуры в единый гибридный носитель, то можно объединить достоинства этих систем и проводить доставку лекарственных соединений различной природы одновременно. При этом оболочка из фосфолипидного бислоя, окружающая более мелкие носители, будет выполнять защитную функцию, препятствуя разрушению инкапсулированных веществ [8]. Кроме того, и липиды, и липосомы можно рассматривать в качестве потенциальных лекарственных средств [9]. Например, синтетические алкилфосфолипиды относятся к многообещающему классу противоопухолевых агентов, которые действуют на клеточные мембраны, а не на ДНК [10]. Представители катионных производных 1,4-дигидропиридина, как синтетические липиды, обладают токсичностью в отношении грамположительных и грамотрицательных видов бактерий [11], антиоксидантной активностью, способностью блокировать устойчивость ко многим лекарственным соединениям [12]. Такие липиды также продемонстрировали высокую цитотоксичность по отношению к раковым клеткам HT-1080 и MH-22A, но низкую цитотоксичность к нераковым клеткам NIH3T3 [13].
В литературе описаны различные типы подобных гибридных систем – везосомы, содержащие внутри фосфолипидной мембраны другие более мелкие липосомы (везикулы) [8, 14–16], полимеросомы-в-полимеросоме – более мелкие везикулярные полимеросомы внутри полимерной бислойной мембраны [17], дендросомы, состоящие из молекул дендримеров, окруженных фосфолипидным бислоем [14, 18, 19]. Однако все такие многокомпонентные системы недостаточно эффективны для транспортирования гидрофобных лекарственных соединений.
Гибридный носитель, в котором капли наноэмульсии масло-в-воде инкапсулированы во внутреннем водном ядре, окруженном фосфолипидной мембраной, получили название eЛипосомы (eLiposomes) (рис. 1). Термин eЛипосомы был впервые предложен Питтом (Pitt) в 2012 г. [20].
Разработанные на сегодняшний день eЛипосомы содержали нанокапли перфторуглеводородов, которые нагревались и испарялись под воздействием ультразвука [20]. В результате увеличения внутреннего объема липосом фосфолипидный бислой разрывался, что приводило к высвобождению инкапсулированных соединений [20–25]. Следует отметить, что исследованные eЛипосомы содержали во внутреннем водном ядре либо водорастворимые соединения – флуорексон в качестве модельного лекарственного вещества [21, 23–25], доксорубицин [22], плазмиды, модифицированные зеленым флуоресцентным белком [23].
Информации о eЛипосомах, содержащих во внутреннем водном ядре нанокапли масла или твердые липидные наночастицы с инкорпорированными гидрофобными лекарственными соединениями, не обнаружено. При этом наноэмульсии являются эффективными носителями для доставки неполярных лекарственных и биологически-активных соединений: талинолола [26], холестерин-гексагидрофталоил-5-фторурацила [27], темопорфина [28], гвоздичного [29] и облепихового масла [30] и др.
При включении капель наноэмульсии масло-в-воде во внутреннюю полость липосом необходимо, чтобы капли масла были устойчивыми, чтобы не происходило расслаивание наноэмульсии с течением времени. Несмотря на то, что оствальдово созревание часто бывает основным механизмом, приводящим к деградации наноэмульсий, скорость данного процесса может быть существенно снижена при включении в состав капель масла соединений, в том числе и лекарственных, с чрезвычайно низкой растворимостью в водной фазе [31]. Обычно наноэмульсии для медицинского применения стабилизируют неионогенными ПАВ из-за их меньшей токсичности. Поверхностный заряд капель дисперсной фазы в таких наноэмульсиях отрицательный, но низкий по абсолютной величине [30, 32]. С одной стороны, этот факт является положительным, так как из-за невысокого поверхностного заряда снижается скорость опсонизации, поскольку в таких системах более низкие силы электростатического притяжения между белками и каплями дисперсной фазы наноэмульсий [33]. С другой стороны, при низком поверхностном заряде капли масла становятся неустойчивыми к флокуляции, которая может приводить к коалесценции и последующему расслаиванию наноэмульсий [32].
Поскольку для возможного применения eЛипосом необходимо, чтобы наноэмульсии были устойчивыми в ограниченном пространстве внутри липосом, в нашей работе было проведено исследование влияния ζ-потенциала и концентрации капель неполярного масла на стабильность данных систем. Для определения условий существования агрегативно устойчивых наноэмульсий было проведено математическое моделирование методом динамики Ланжевена. В данном случае эксперименты in silico позволяют прогнозировать устойчивость нанокапель, что поможет в дальнейшем эффективно конструировать eЛипосомы разного состава.
ОПИСАНИЕ МАТЕМАТИЧЕСКОЙ МОДЕЛИ
В данной работе траектории движения отдельных нанокапель и их агрегатов описывались уравнениями Ланжевена с использованием алгоритма интегрирования Langevin impulse integrator [34]. Уравнения для расчета сил притяжения ван-дер-Ваальса и электростатического отталкивания; случайной составляющей силы, обусловленной броуновским движением; а также подробное описание расчетов скоростей и координат капель приведено в наших предыдущих работах [35, 36].
Генерация капель диаметром 30 нм проводилась случайным образом в модельной ячейке кубической формы с размерами сторон 300 нм. Объемная доля капель составляла от 0.05 до 0.20. Расстояние между генерируемыми каплями было не менее 5 нм в наноэмульсиях с объемной долей дисперсной фазы 0.2 и не менее 10 нм в наноэмульсиях с меньшим содержанием дисперсной фазы.
Образование агрегатов происходило при сближении капель на расстояние, меньшее, чем расстояние коагуляции, условно принятое равным 0.1 нм. При этом слипание капель считалось обратимым. Для каждой пары капель в агрегате сумма сил притяжения и отталкивания принималась равной сумме данных сил на расстоянии коагуляции. Сумма сил считалась неизменной при любом дальнейшем сближении капель. При увеличении расстояния между парой слипшихся капель в агрегате более расстояния коагуляции происходил распад пары.
Предполагалось, что дисперсионная среда наноэмульсий представляла собой 0.15 М водный раствор NaCl, а дисперсная фаза состояла из углеводородного масла. Константа Гамакера для капель масла в воде принималась равной 3.9 × 10–21 Дж [37]. Диэлектрическая проницаемость водной фазы при данной концентрации электролита составляла 76.816. Плотность капель масла и водной фазы была равной 870 и 1000 кг/м3 соответственно. Динамическая вязкость водной фазы – 0.001 Па с. Температура принималась равной 298 К.
Все расчеты были проведены для нанокапель с положительным поверхностным зарядом. Полученные результаты справедливы и для капель с отрицательным поверхностным зарядом, равным по абсолютной величине.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние доли дисперсной фазы на устойчивость наноэмульсий в ограниченном объеме еЛипосом
В качестве аналога были взяты наноэмульсии, содержащие в качестве дисперсной фазы неполярное углеводородное масло и стабилизированные смесью неионогенных ПАВ Tween 80 и Span 80, устойчивость которых была исследована экспериментально в нашей предыдущей работе [32]. Так как ζ-потенциал капель дисперсной фазы в таких наноэмульсиях очень низкий, несколько единиц милливольт, то в расчетах он принимался равным 0 мВ. Доля дисперсной фазы в наноэмульсиях, находящихся в модельной ячейке, была равной 5, 10 или 20 об. %. Агрегативную устойчивость наноэмульсий анализировали по динамике изменения таких параметров, как доля нанокапель, входящих в состав максимально кластера (агрегата); суммарное количество кластеров и одинарных капель в системе; распределение кластеров по количеству нанокапель.
В наноэмульсиях с долей дисперсной фазы 20 об. % очень быстро происходила агрегация капель масла (рис. 2). Однако доля капель в максимальном кластере варьировалась в достаточно широком диапазоне от 0.15 до 0.80, так как агрегация была обратимой, и максимальный кластер то увеличивался в размерах, то распадался на более мелкие агрегаты.
Рис. 2.
Доля капель масла, входящих в состав максимального кластера, в наноэмульсиях с разной долей дисперсной фазы в зависимости от времени. ζ-Потенциал капель масла – 0 мВ.
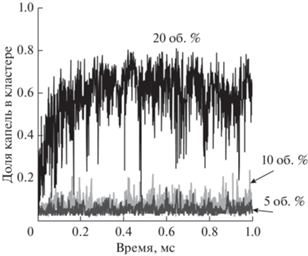
В наноэмульсиях с долей дисперсной фазы 10 об. % агрегация протекала менее активно. Среднее количество капель, входящих в максимальный кластер, составляло 15 штук, т.е. средняя доля капель в максимальном кластере от общего количества в модельной ячейке была равной 0.075. При снижении доли дисперсной фазы до 5 об. % среднее количество капель в максимальном кластере не превышало 5 штук (средняя доля от общего количества – 0.05).
Суммарное количество кластеров и одинарных капель в системе резко уменьшалось в начальные моменты времени, особенно заметное в наноэмульсиях с долей дисперсной фазы 20 об. % (рис. 3). По истечении ~0.005 мс суммарное количество кластеров и одинарных частиц колебалось относительно средней величины. При этом количество частиц в максимальном кластере (рис. 2) возрастало в течение ~0.5 мс. То есть в таких наноэмульсиях с течением времени происходило увеличение максимального кластера, при этом число капель в остальных агрегатах снижалось.
Рис. 3.
Общее число кластеров, существующих в наноэмульсиях с разной долей дисперсной фазы, в зависимости от времени. ζ-потенциал капель масла – 0 мВ.
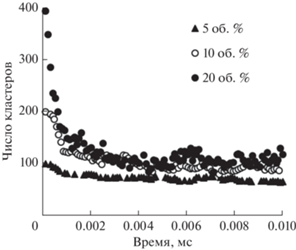
Эта тенденция в меньшей степени видна в наноэмульсиях с долей дисперсной фазы 10 об. %. В наноэмульсиях с долей дисперсной фазы 5 об. % суммарное количество кластеров и одинарных капель в системе лишь незначительно снизилось в начальные моменты времени.
Анализ распределения кластеров по размерам в момент времени 0.5 мс показал, что в наноэмульсиях с долей дисперсной фазы 5 об. % помимо одинарных капель (N1) также существовали димеры (N2). Количество кластеров, состоящих из большего количества нанокапель (N3–N5), было единичным (рис. 4а). В наноэмульсиях с долей дисперсной фазы 10 об. % распределение кластеров по количеству входящих в них нанокапель было сходным (рис. 4б), только присутствовали агрегаты с большим количеством нанокапель.
Рис. 4.
Диаграммы, иллюстрирующие количество кластеров, состоящих из i-капель, в наноэмульсиях с долей дисперсной фазы 5 (а), 10 (б) и 20 об. % (в) в момент времени 0.5 мс. Ni – кластеры, содержащие i-количество капель, NΣ – суммарное количество кластеров в наноэмульсии в данный момент времени.
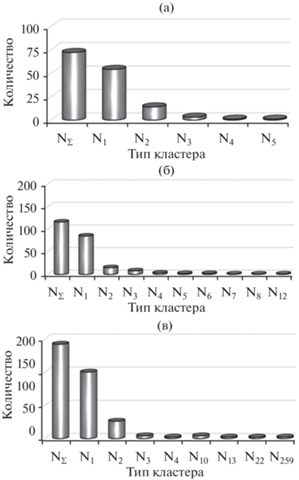
В наноэмульсиях с долей дисперсной фазы 20 об. % распределение кластеров было иным. В системе также присутствовали одинарные капли и агрегаты, состоящие из небольшого числа капель. При этом существовал один очень крупный агрегат (рис. 4в). В момент времени 0.5 мс в него входило 259 нанокапель из 400, присутствовавших в модельной ячейке. Наличие такого крупного, единичного агрегата свидетельствует о неустойчивости данных наноэмульсий.
В наноэмульсиях с долей дисперсной фазы 5 и 10 об. % агрегаты не существовали длительное время и распадались на отдельные капли, поэтому такие наноэмульсии можно считать устойчивыми.
Влияние ζ-потенциала капель дисперсной фазы на устойчивость наноэмульсий в ограниченном объеме еЛипосом
Так как наноэмульсии с долей дисперсной фазы 20 об. % и ζ-потенциалом капель масла, равным 0 мВ, были неустойчивыми к агрегации в ограниченном пространстве, было проведено изучение влияния величины ζ-потенциала на агрегирование капель.
Как видно из представленных на рис. 5 зависимостей, в наноэмульсиях, в которых у капель масла ζ-потенциал был равен 30 мВ, также происходило образование достаточно крупного кластера, как и в наноэмульсиях с ζ-потенциалом капель 0 мВ.
Рис. 5.
Доля капель масла, входящих в состав максимального кластера, в наноэмульсиях с разным ζ-потенциалом капель масла в зависимости от времени. Доля дисперсной фазы – 20 об. %.
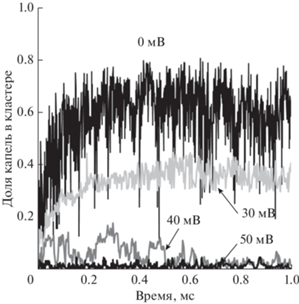
Если ζ-потенциал был более высоким и равным 40 мВ, в начальном интервале времени от 0 до ~0.5–0.7 мс происходило скачкообразное образование и распад относительно крупных агрегатов. В дальнейшем размер максимального кластера колебался в существенно меньшем диапазоне. В случае ζ-потенциала, равного 50 мВ, образование крупного кластера не происходило, и колебания относительно среднего размера были небольшими. Поэтому наноэмульсии, содержащие капли с ζ-потенциалом 40 и 50 мВ, можно считать устойчивыми.
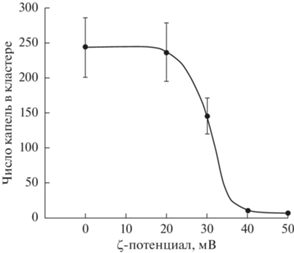
Средний размер максимального кластера, состоящего из капель с ζ-потенциалом от 0 до 20 мВ, практически не изменялся, в него входило 240–250 капель. С увеличением величины ζ-потенциала средний размер максимального кластера снижался, и при 40 и 50 мВ максимальный кластер состоял из 11 и 7 капель соответственно (рис. 6).
Рис. 6.
Среднее число капель масла, входящих в состав максимального кластера, в интервале времени 0.5–1.0 мс в зависимости от ζ-потенциала капель.
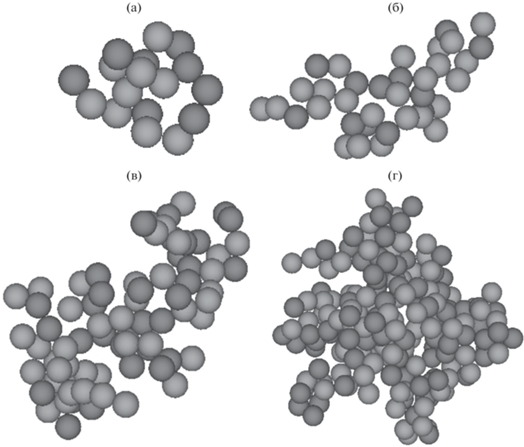
На рис. 7 приведены изображения максимального кластера в наноэмульсиях, в которых ζ-потенциал капель масла был равен 0 мВ. В начальные моменты времени кластер имел рыхлую разветвленную структуру (рис. 7б и 7в). С течением времени по мере увеличения количества капель структура агрегата становилась более плотной из-за ограниченности пространства внутри модельной ячейки (рис. 7г).
Рис. 7.
Скриншоты максимального кластера в наноэмульсии: t = 5 × 10–4 мс, Nmax = 17 (а), t = 0.001 мс, Nmax = 37 (б), t = 0.01 мс, Nmax = 78 (в), t = 0.1 мс, Nmax = 205 (г). Доля дисперсной фазы – 20 об. %, ζ-потенциал – 0 мВ.
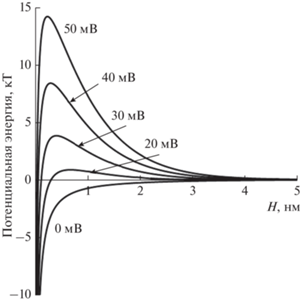
Потенциальные кривые, приведенные на рис. 8, показывают, что величина потенциального барьера была достаточно низкой. В том числе и в наноэмульсиях с ζ-потенциалом капель масла 40 и 50 мВ высота потенциального барьера не превышала 15 кT, что недостаточно для существования стабильной наноэмульсии. Именно поэтому капли при движении в модельной ячейке сталкивались и происходило образование агрегатов. Однако агрегация была обратимой, и с течением времени агрегаты распадались на отдельные нанокапли. В исследованных системах наиболее важным фактором, обусловливающим существование устойчивых к агрегации наноэмульсий в ограниченном пространстве, является малый размер капель, и соответственно, их интенсивное броуновское движение. Именно поэтому при уменьшении доли дисперсной фазы в наноэмульсиях до ≤10 об. % активная агрегация капель не протекала. При этом агрегация оставалась обратимой, и образование крупных кластеров в системе не происходило.
ВЫВОДЫ
еЛипосы, обладающие комплексной многокомпонентной структурой, могут быть перспективными носителями для доставки лекарственных соединений разной природы: гидрофильные растворяются в водном пространстве внутри липосом, гидрофобные – в каплях дисперсной фазы наноэмульсии, амфифильные встраиваются в фосфолипидный бислой и поверхностный слой капель в наноэмульсии. Однако для эффективного использования таких структур необходимо, чтобы наноэмульсия была устойчивой в ограниченном пространстве внутри липосом.
В данной работе было проведено математическое моделирование с использованием динамики Ланжевена поведения нанокапель масла в модельной ячейке, имитирующей внутреннее пространство внутри липосом. Результаты расчетов показали, что при низких величинах ζ-потенциала устойчивыми являются наноэмульсии с долей дисперсной фазы ≤10 об. %. При более высокой доле дисперсной фазы 20 об. % происходило образование одно крупного кластера, размеры которого увеличивались с течением времени. Структура такого кластера постоянно изменялась, он кратковременно распадался на отдельные агрегаты, а затем вновь объединялся с присоединением мелких агрегатов и одинарных капель.
Для получения стабильных наноэмульсий с долей дисперсной фазы 20 об. % необходимо, чтобы ζ-потенциал капель дисперсной фазы превышал 40 мВ по абсолютной величине. Такое существенное увеличение поверхностного заряда капель масла возможно только при их стабилизации ионогенными ПАВ. Однако если рассматривать еЛипосомы, как носители лекарственных соединений, то необходимо учитывать возможно более высокую токсичность таких соединений.
При этом расчеты показали, что устойчивость наноэмульсий как с низким ζ-потенциалом капель, так и с высоким обеспечивается в большой степени интенсивным броуновским движением нанокапель во внутреннем пространстве еЛипосом. Поэтому для получения еЛипосом более рационально использовать наноэмульсии с меньшей долей дисперсной фазы и низким ζ-потенциалом капель дисперсной фазы. Полученные результаты позволяют прогнозировать устойчивость наноэмульсий в ограниченном пространстве, что в дальнейшем позволит эффективно конструировать eЛипосомы разного состава.
Список литературы
Vemuri S., Rhodes C.T. // Pharmaceutics Acta Helvetiae. 1995. V. 70. P. 95.
Liposomes. A Practical Approach / Ed. Torchilin V., Weissig V.: Oxford University Press, 2003.
Kauscher U., Holme M.N., Björnmalm M., Stevens M.M. // Adv. Drug Deliv. Rev. 2019. V. 138. P. 259.
Antoniou A.I., Giofrè S., Seneci P., Passarella D., Pellegrino S. // Drug Discovery Today. 2021. V. 26 (8). P. 1794.
Liposomes. Methods and Protocols, Vol. 1: Pharmaceutical Nanocarriers / Ed. Weissig V.: Humana Press, 2010.
Koroleva M.Yu., Yurtov E.V. // Russ. Chem. Rev. 2012. V. 81. P. 21.
Wilson R.J., Li Y., Yang G., Zhao C.-X. // Particuology. 2022. V. 64. P. 85.
Al-Jamal W.T., Kostarelos K. // Int. J. Pharm. 2007. V. 331. P. 182.
Carmona-Ribeiro A.M. // Current Med. Chem. 2003. V. 10. P. 2425.
Luna A.C.L., Saraiva G.K.V., Filho O.M.R., Chierice G.O., Neto S.C., Cuccovia I.M., Maria D. // Int. J. Nanomedicine. 2016. V. 11. P. 1577.
Rucins M., Dimitrijevs P., Pajuste K., Petrichenko O., Jackevica L., Gulbe A., Kibilda S., Smits K., Plotniece M., Tirzite D., Pajuste K., Sobolev A., Liepins J., Domracheva I., Plotniece A. // Pharmaceutics. 2019. V. 11. P. 115.
Cindric M., Cipak A., Serly J., Plotniece A., Jaganjac M., Mrakovcic L., Lovakovic T., Dedic A., Soldo I., Duburs G., Zarkovic N., Molnar J. // Anticancer Research. 2010. V. 30. P. 4063.
Rucins M., Smits R., Sipola A., Vigante B., Domracheva I., Turovska B., Muhamadejev R., Pajuste K., Plotniece M., Sobolev A., Duburs G., Plotniece A. // Oxidative Med. Cell. Longevity. 2020. 8413713.
Paleos C.M., Tsiourvas D., Sideratou Z., Pantos A. // J. Controlled Release. 2013. V. 170. P. 141.
Gautam L., Shrivastava P., Yadav B., Jain A., Sharma R., Vyas S., Vyas S.P. // Drug Discovery Today. 2021. In Press, Corrected Proof. https://doi.org/10.1016/j.drudis.2021.12.007
Kisak E.T., Coldren B., Evans C.A., Boyer C., Zasadzinski J.A. // Curr. Med. Chem. 2004. V. 11. P. 199.
Gaur D., Dubey N.C., Tripathi B.P. // Adv. Colloid Interface Sci. 2022. V. 299. 102566.
Movassaghian S., Moghimi H.R., Shirazi F.H., Koshkaryev A., Trivedi M.S., Torchilin V.P. // Int. J. Pharmaceutics. 2013. V. 441. P. 82.
Wang M., Li J., Li X., Mu H., Zhang X., Shi Y., Chu Y., Wang A., Wu Z., Sun K. // J. Controled Release. 2016. V. 232. P. 161.
Lattin J.R., Belnap D.M., Pitt W.G. // Colloids Surf. B. 2012. V. 89. P. 93.
Javadi M., Pitt W.G., Belnap D.M., Tsosie N.H., Hartley J.M. // Langmuir. 2012. V. 28. P. 14720.
Lin C.-Y., Javadi M., Belnap D.M., Barrow J.R., Pitt W.G. // Nanomedicine: Nanotechnology, Biology, and Medicine. 2014. V. 10. P. 67.
Javadi M., Pitt W.G., Tracy C.M., Barrow J.R., Willardson B.M., Hartley J.M., Tsosie N.H. // J. Controlled Release. 2013. V. 167. P. 92.
Lattin J.R., Pitt W.G., Belnap D.M., Husseini G.A. // Ultrasound in Med. & Biol. 2012. V. 38 (12). P. 2163.
Lattin J.R., Pitt W.G. // J. Pharm. Sci. 2015. V. 104(4). P. 1.
Ghai D., Sinha V.R. // Nanomedicine: Nanotechnology, Biology and Medicine. 2012. V. 8 (5). P. 618.
Alanazi F.K., Haq N., Radwan A.A., Alsarra I.A., Shakeel F. // J. Drug Delivery Sci. Technol. 2014. V. 24. P. 459.
Primo F.L., Michieleto L., Rodrigues M.A.M., Macaroff P.P., Morais P.C., Lacav Z.G.M., Bentley M.V.L.B., Tedesco A.C. // J. Magn. Magn. Mater. 2007. V. 311. P. 354.
Kheawfu K., Pikulkaew S., Rades T., Müllertz A., Okonogi S. // J. Drug Delivery Sci. Technol. 2018. V. 46. P. 330.
Ivanova Ya.O., Kostromicheva M.M., Ofitserov E.N., Koroleva M.Yu. // Colloid. J. 2022. V. 84 (1). P. 34.
Koroleva M.Yu., Yurtov E.V. // Russ. Chem. Rev. 2021. V. 90 (3). P. 293.
Koroleva M., Nagovitsina T., Yurtov E. // Phys. Chem. Chem. Phys. 2018. V. 20. P. 10369.
Longmire M., Choyke P.L., Kobayashi H. // Nanomedicine. 2008. V. 3. P. 703.
Skeel R.D., Izaguirre J.A. // Mol. Phys. 2002. V. 100. P. 3885.
Koroleva M., Yurtov E. // Colloids Surf. A. 2020. V. 601. 125001.
Koroleva M.Yu., Tokarev A.M., Yurtov E.V. // Mendeleev Commun. 2017. V. 27. P. 518.
Israelachvili J. Intermolecular and Surface Forces. 3rd ed. Elsevier, Academic press, 2011.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал