Коллоидный журнал, 2023, T. 85, № 3, стр. 355-365
Динамические поверхностные свойства фибрина
О. Ю. Миляева 1, *, А. Р. Рафикова 1
1 Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург,
Университетский просп., 26, Россия
* E-mail: o.milyaeva@spbu.ru
Поступила в редакцию 13.12.2022
После доработки 23.03.2023
Принята к публикации 24.03.2023
- EDN: ZOFJIQ
- DOI: 10.31857/S0023291222600675
Аннотация
Фибрин образуется при полимеризации одного из основных белков крови – фибриногена под действием фермента тромбина. Динамическая поверхностная упругость и динамическое поверхностное натяжение смешанных растворов фибриногена и тромбина измерялись как функции времени жизни поверхности и концентрации фермента (от 50 до 800 Ед./л). Немонотонный характер зависимостей динамической поверхностной упругости указывает на многостадийный характер формирования пленки фибрина и позволяет проследить переход от разворачивания белка к отдельным нитевидным агрегатам, сетке разветвленных фибрилл, а затем к сплошной пленке. Динамическая поверхностная упругость пленок фибрина превышает соответствующие значения для фибриногена в 2 раза (115 и 55 мН/м соответственно). Применение различных видов микроскопии позволило оценить морфологию полученных пленок.
ВВЕДЕНИЕ
Применение фибрина и материалов на его основе имеет долгую историю. Одним из первых применений было создание фибриновых герметиков. В начале XX века было создано первое кровоостанавливающее средство на основе фибрина [1]. С конца XX века нарастала популярность материалов на основе фибрина, применявшихся в качестве гемостатиков в хирургии и клеев для прикрепления кожного трансплантата пациентам с ожогами [2]. В тканевой инженерии фибриновые гели используются в качестве двумерных и трехмерных каркасов [1, 3]. С помощью фибриновых гелей успешно осуществляется доставка таких лекарств, как липофильные противоопухолевые препараты [4] и малорастворимые антибиотики [5].
Изучению фибриновых сгустков и объемных материалов на их основе [6, 7] уделяется большое внимание: исследуются механические свойства фибрина, морфология фибриновых сгустков, их пористость, толщина волокон, степень разветвления, рассматривается влияние различных условий (pH, концентрация фибриногена, концентрация тромбина, ионная сила, содержание ионов Ca2+, температура) на образование фибрина [8–10]. Активно изучается механизм полимеризации фибриногена [8, 11–15].
2D материалы и фибриновые пленки на границе жидкость–газ исследуются реже [16–20]. Исследование пленок на границе раздела фаз представляет собой сложную задачу, поскольку протяженность такого объекта по нормали к поверхности сопоставима с молекулярными размерами [21]. Лишь ограниченное число экспериментальных методов позволяет получить новую информацию о подобных системах. В то же время морфология и структурно-механические свойства фибриновых пленок представляют интерес как с фундаментальной, так и с практической точки зрения, поскольку именно образование фибриновых пленок препятствует кровопотере и инфицированию раны [16–19].
Динамические поверхностные свойства фибриногена – одного из основных белков крови, из которого под действием факторов свертывания, в первую очередь тромбина, может быть получен фибрин, определялись в нескольких работах [19, 22–26], в том числе с применением методов дилатационной поверхностной реологии [19, 22]. Полученные результаты показывают, что динамические поверхностные свойства фибриногена имеют ряд особенностей по сравнению с динамическими поверхностными свойствами других белков. В частности, значения динамической поверхностной упругости растворов фибриногена оказываются ниже соответствующих значений для глобулярных белков (55 и 80 мН/м соответственно). Вероятной причиной этого является различие в структуре молекулы фибриногена и типичных глобулярных белков. Молекула фибриногена имеет большой размер (молекулярная масса около 340 кДа, размеры молекулы 47.5 нм × 5 нм) и состоит из трех основных последовательно расположенных доменов [25, 27]. Характер кинетических зависимостей динамической поверхностной упругости для растворов фибриногена различной концентрации и результаты других методов позволили предположить изменение ориентации молекул по мере увеличения поверхностной концентрации и формирование более протяженного поверхностного слоя с большим содержанием воды [22–26].
Несмотря на то, что сканирующая электронная микроскопия указывает на различную морфологию поверхностных пленок фибриногена и фибрина, поверхностное натяжение их растворов оказывается одинаковым [18, 19]. Динамическая поверхностная упругость оказывается более чувствительной к образованию фибрина из фибриногена, чем поверхностное натяжение. Недавно было показано, что на основе результатов измерения динамической поверхностной упругости можно обнаружить начало формирования фибриновых волокон на межфазной границе [19]. Они представляют собой длинные нитевидные агрегаты, протяженностью более 5 микрон, толщиной около 20 нм [14, 19]. Однако число волокон невелико и в рассмотренном концентрационном диапазоне динамические поверхностные свойства, как правило, определяются свободным фибриногеном. При этом исследования динамических поверхностных свойств дисперсий амилоидных фибрилл, также представляющих собой нитевидные белковые агрегаты, показывают, что существенное влияние фибрилл на поверхностные свойства возможно, только если их поверхностная концентрация оказывается достаточно высокой [28–30].
Цель данной работы – определение механизма формирования фибрина на границе жидкость–газ под действием относительно высоких концентраций тромбина (свыше 50 Ед./л). Можно ожидать, что добавление фермента к растворам фибриногена приведет к образованию фибрина не только в объеме раствора, но и в поверхностном слое. В этом случае можно ожидать изменения динамических поверхностных свойств от типичных для растворов чистого фибриногена к динамическим поверхностным свойствам фибрина, зависящим от структуры образующейся пленки.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для измерений динамической поверхностной упругости был использован метод осциллирующего кольца [31, 32]. Этот метод основан на регистрации отклика поверхностного натяжения на небольшие гармонические колебания площади поверхности жидкости. Стеклянное кольцо с шероховатой внутренней поверхностью частично погружается в жидкость. Движение кольца вверх и вниз вдоль своей оси приводит к периодическим изменениям формы мениска у внутренней части кольца. Это в свою очередь приводит к колебаниям поверхностного натяжения внутри кольца, которые измеряются с помощью пластинки Вильгельми. Если деформации площади поверхности достаточно малы и описываются гармоническим законом, то колебания поверхностного натяжения также оказываются синусоидальными. В этом случае мы можем определить поверхностную упругость с помощью следующей формулы:
(1)
$E(\omega ) = {{E}_{{re}}} + i{{E}_{{im}}} = \frac{{\delta \gamma }}{{\delta {\kern 1pt} \ln {\kern 1pt} A}},$Для исследуемых в данной работе систем мнимая часть динамической поверхностной упругости была меньше действительной части. Поэтому в дальнейшем представлены результаты только для модуля динамической поверхностной упругости.
С помощью прибора ISR (KSV NIMA, Финляндия) были определены изотермы сжатия полученных пленок фибрина. Смешанный раствор фибриногена и тромбина заливался в ванну Ленгмюра и по прошествии 15 ч осуществлялось сжатие адсорбционного слоя при постоянной скорости 5 мм/мин. Поверхностное натяжение измерялось методом пластинки Вильгельми, расположенной посередине между двумя барьерами.
Эллипсометрические измерения проводились с помощью нуль эллипсометра Multiskop (Optrel GBR, Германия) с длиной волны света 632.8 нм при постоянном значении угла падения 49° вблизи угла Брюстера. Разность Δsurf между элилипсометрическими углами Δ для исследуемого раствора и чистой воды пропорциональна величине адсорбции [32].
Для определения морфологии пленок фибрина был использован метод атомно-силовой микроскопии (АСМ) – прибор Nte-MDT (Россия). Пленки фибрина переносились на поверхность слюды с помощью метода Ленгмюра–Шеффера. После переноса пленка высушивалась в эксикаторе при комнатной температуре в течение двух дней. Все измерения проводились в полуконтактном режиме.
Для определения мезоскопической морфологии пленок была применена микроскопия при угле Брюстера (прибор BAM 1, Nanofilm Technology, Германия).
Фибриноген (Sigma-Aldrich, Германия) и тромбин (Sigma-Aldrich, Германия) использовались без дополнительной очистки. Концентрация тромбина выражена в единицах ферментативной активности. 1 Ед. определяется как количество фермента, которое катализирует превращение одного микромоля субстрата в минуту при стандартных условиях. Тромбин (1000 Ед.) был растворен в 10 мл буферного раствора и разделен на порции объемом 1 мл, которые хранились в холодильнике при –18°С. Для приготовления исследуемых растворов размораживалась порция тромбина, которая хранилась при 4°С не дольше пяти дней. Также для приготовления исследуемых растворов исходный раствор фибриногена с концентрацией С = 1 г/л разбавлялся до заданной концентрации. Исходный раствор фибриногена хранился при 4°С не дольше пяти дней. Добавление тромбина к раствору фибриногена осуществлялось путем смешения исходных растворов.
Исследуемые растворы готовились в фосфатном буфере (растворы Na2HPO4 и NaH2PO4 (Sigma-Aldrich, Германия) с рН 7. Ионная сила раствора задавалась путем добавления 0.9 мас. % NaCl.
При приготовлении растворов использовалась трижды перегнанная вода. Две последние перегонки осуществлялись на установке, целиком сделанной из стекла. Поверхностное натяжение буферного раствора без белка составляло 72.8 мН/м.
Все измерения проводились при температуре 20 ± 1°С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В области малых концентраций тромбина (5–25 Ед./л) поверхностные свойства смешанных растворов фибриногена и тромбина определяются первым компонентом [19]. С увеличением концентраций компонентов влияние тромбина оказывается сильнее и изменение динамических поверхностных свойств позволяет проследить за процессом формирования фибрина в поверхностном слое.
В области концентраций тромбина от 50 до 300 Ед./л (рис. 1) кинетические зависимости поверхностной упругости оказываются немонотонными. На кинетических зависимостях динамической поверхностной упругости появляется локальный максимум при небольших временах жизни поверхности (до 30 мин) (рис. 1). С повышением содержания фермента локальный максимум сдвигается в область меньших времен жизни поверхности и становится менее выраженным. На кинетических зависимостях динамической поверхностной упругости также наблюдается выраженный локальный минимум (рис. 1), глубина которого достигает 22–33 мН/м (рис. 1а). Снижение динамической поверхностной упругости в этом случае оказывается больше (более 20 мН/м), чем наблюдавшееся ранее для малых концентраций тромбина [19]. Скорость образования пленки возрастает с увеличением концентрации фермента, и при концентрации ≥300 Ед./л локальный максимум пропадает, зависимости становятся монотонными (рис. 1).
Рис. 1.
Кинетические зависимости динамической поверхностной упругости растворов фибриногена концентрацией 1 × 10–2 (а) и 3 × 10–7М (б) и различных концентраций тромбина. Концентрация тромбина: 50 (1), 100 (2), 200 (3), 300 (4), 500 (5) и 800 Ед./л (6).
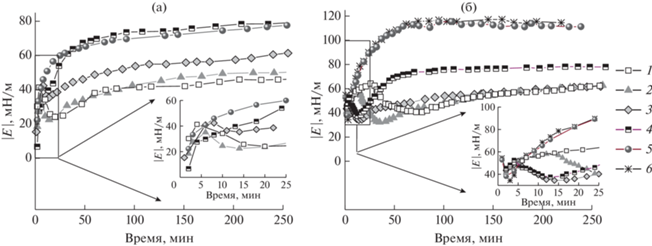
Для концентраций 50 и 100 Ед./л значения поверхностной упругости не достигают значений динамической поверхностной упругости для чистого белка за время эксперимента. Однако увеличение концентрации тромбина позволяет достичь более высоких поверхностных упругостей, чем для раствора чистого фибриногена. Так при добавлении 300–1000 Ед./л фермента к 1 × 10–7 М раствору фибриногена значения динамической поверхностной упругости при больших временах жизни поверхности превышают результаты для чистого белка (55 мН/м) [19, 22] и составляют 75–80 мН/м (рис. 1а). Для более высокой концентрации фибриногена 3 × 10–7 М этот эффект выражен сильнее (рис. 1б), и динамическая поверхностная упругость в два раза превышает значения для чистого белка (115 и 55 мН/м соответственно).
По-видимому, немонотонный характер изменения динамической поверхностной упругости связан с последовательным изменением структуры пленки. На начальном этапе при малых временах жизни поверхности фибриноген быстро адсорбируется на границе раздела жидкость–газ. Динамическая поверхностная упругость достигает значений, близких к результатам для чистого белка. Появление максимума на зависимостях динамической поверхностной упругости ранее наблюдалось для растворов белков с добавлением денатурантов и было связано с разворачиванием макромолекул в поверхностном слое и вытеснением отдельных участков молекул белка в дальнюю область поверхностного слоя – область петель и хвостов [21]. Действие тромбина может оказаться более сложным по сравнению с действием денатурантов. Однако и в этом случае оказывается возможна релаксация поверхностных напряжений за счет вытеснения отдельных участков молекулы фибриногена в дальнюю область поверхностного слоя. Можно предположить, что разрезание фибринопептидов А и В под действием тромбина на начальном этапе формирования фибрина [27], а также возможное денатурирующее влияние границы раздела фаз [21], приводит к тому, что молекула фибриногена становится более гибкой, частично разворачивается и способна формировать дальнюю область поверхностного слоя.
Дальнейшее образование агрегатов фибрина приводит к увеличению поверхностной упругости. Различия в полученных величинах динамической поверхностной упругости при больших временах жизни поверхности для разных концентраций тромбина, вероятно, связано с различием в числе и/или морфологии образованных агрегатов фибрина.
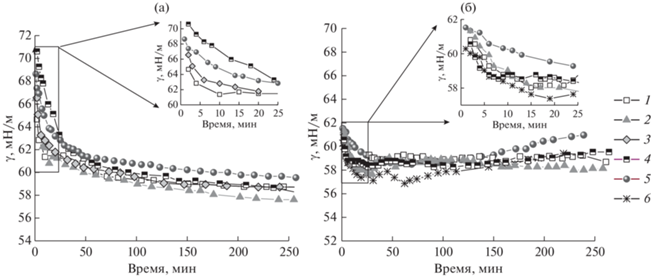
Динамическое поверхностное натяжение в отличие от динамической поверхностной упругости оказывается менее чувствительным к изменениям структуры поверхностного слоя, связанным с превращением фибриногена в фибрин. Для концентраций фибриногена 1 × 10–7 и 3 × 10–7 М скорость адсорбции велика и динамическое поверхностное натяжение оказывается близко к постоянным значениям уже в первые минуты жизни поверхности (рис. 2) для всех исследованных концентраций тромбина. Увеличение концентрации тромбина слабо влияет на кинетические зависимости поверхностного натяжения. На протяжении всего эксперимента его значения для всех исследованных смешанных растворов составляют около 58–60 мН/м, что превышает значения для чистого фибриногена при соответствующей концентрации примерно на 4 мН/м. Также стоит отметить небольшой рост поверхностного натяжения при временах жизни поверхности около двух часов в пределах 2 мН/м для систем, в которых предположительно образуется сплошная пленка фибрина. Похожее поведение ранее наблюдалось для полимеризации гидрохлорида дофамина за счет действия фермента лакказы [33] и также было связано с процессами образования сплошной пленки на границе жидкость–газ.
Рис. 2.
Кинетические зависимости динамического поверхностного натяжения растворов фибриногена концентрацией 1 × 10–7 (а) и 3 × 10–7 М (б) и различных концентраций тромбина. Концентрация тромбина: 50 (1), 100 (2), 200 (3), 300 (4), 500 (5) и 800 Ед./л (6).
Изотермы сжатия были получены для поверхностных слоев смешанных растворов фибриногена и тромбина при приближении к равновесию и больших временах жизни поверхности (15 ч). Зависимости поверхностного давления от относительной площади (A/A0) (рис. 3) оказываются близки друг к другу. Для чистого фибриногена сначала происходит довольно медленное возрастание поверхностного давления, но после сжатия примерно в два раза, когда поверхностное давление достигает 25–30 мН/м, дальнейшее уменьшение площади вызывает его быстрое увеличение до 50 мН/м. Добавление тромбина приводит к тому, что поверхностное давление для равновесной пленки до сжатия оказывается немного выше (на 3–4 мН/м) и изотерма имеет больший угол наклона. Разница в начальных значениях поверхностного давления для растворов тромбина и для смешанных растворов, вероятно, связана с формированием агрегатов в поверхностном слое. При этом так же, как и для чистого фибриногена, в конце сжатия достигается поверхностное давление 50 мН/м. Несмотря на то, что кинетические зависимости динамической поверхностной упругости указывают на значительные изменения структуры поверхностного слоя, изотермы сжатия меняются слабо при повышении содержания фермента.
Рис. 3.
Изотермы сжатия адсорбционных пленок фибриногена и его смесей с тромбином (а) и рассчитанные на их основе зависимости статической упругости от относительной площади (б). Концентрация тромбина: 0 (1), 50 (2), 100 (3), 200 (4) и 500 Ед./л (5).
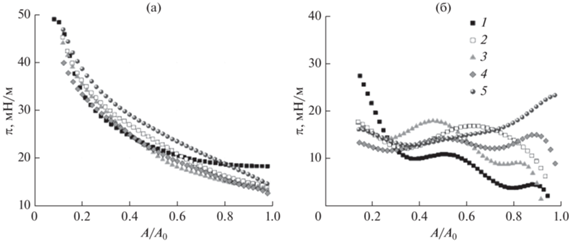
Если представить полученные результаты в виде зависимости статической упругости εst от относительной площади (рис. 3б), видно, что сжатие поверхности приводит к уменьшению различий в ходе зависимостей для растворов смесей фибриногена и тромбина. Можно предположить, что в начале равновесная пленка состоит из различного числа и типа агрегатов фиброина (волокон более широких лент), однако по мере сжатия образуется более однородная пленка. Максимальная упругость для смешанных растворов (около 24 мН/м) наблюдалась при концентрации тромбина 500 Ед./л. В этом случае сплошная пленка, вероятно, образовывалась сразу, без дополнительного сжатия, поэтому ход зависимости отличается от зависимостей для растворов с меньшей концентрацией.
Разность ∆surf между эллипсометрическими углами ∆ для исследуемого раствора и чистой воды пропорциональна величине адсорбции (числу молей вещества в поверхностном слое на единицу площади поверхности) [32, 34]. Для растворов, содержащих 1 × 10–7 М фибриногена, добавление тромбина от 50 до 500 Ед./л приводит к увеличению как скорости адсорбции, так и предельных значений эллипсометрического угла ∆surf по сравнению с чистым фибриногеном такой же концентрации (рис. 4). Для чистого фибриногена значение ∆surf при приближении к равновесию составляет 3.9°, для смешанных растворов фибриногена с тромбином возрастает с увеличением концентрации последнего вплоть до 5°. Этот эффект схож с результатами, полученными ранее для концентрации фермента 25 Ед./л [19], и, вероятно, связан с появлением фибриновых агрегатов в поверхностном слое. Для концентраций тромбина выше 100 Ед./л кинетические зависимости угла ∆surf оказываются близки, что может быть связано с большим числом формирующихся волокон фибрина и образованием практически сплошной пленки. Предельные значения ∆surf для растворов, содержащих 50 Ед./л фермента, оказываются ниже (около 4.1°). Можно предположить, что в этом случае сплошная пленка не образуется, и в поверхностном слое присутствуют отдельные агрегаты фибрина.
Рис. 4.
Кинетические зависимости эллипсометрического угла Δsurf растворов фибриногена концентрацией 1 × 10–7 М и различных концентраций тромбина. Концентрация тромбина: 0 (1), 50 (2), 100 (3), 200 (4) и 500 Ед./л (5).
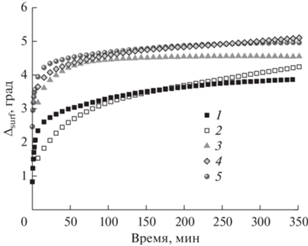
Хотя полученные значения эллипсометрического угла ∆surf оказываются больше полученных для растворов фибриногена при заданной концентрации белка, эти различия оказываются невелики и говорят лишь о слабом увеличении поверхностной концентрации в результате формирования фибриновой пленки из смешанных растворов. Можно предположить, что в первую очередь в процессе образования фибрина принимают участие молекулы фибриногена, адсорбированные при относительно небольших временах жизни поверхности. Однако для дальнейшего формирования пленки фибрина требуется постоянный подвод вещества из объемной фазы.
Наглядное представление о морфологии полученных пленок можно получить с помощью АСМ и микроскопии при угле Брюстера. На АСМ изображениях, полученных для 1 × 10–7 М раствора чистого фибриногена, видна пленка, обладающая небольшой шероховатостью (рис. 5а) [19]. В ряде случаев применение метода АСМ позволяет различить отдельные домены фибриногена [3]. Полученное изображение (рис. 5а) типично для пленок из растворов с высокой концентрацией белка.
Рис. 5.
Изображения адсорбционных пленок растворов смеси фибриногена концентрацией 1 × 10–7 М и тромбина концентрацией 0 (а), 25 (б), 50 (в), 100 (г), 200 (д), 300 (е), 500 Ед./л (ж), полученные с помощью атомно-силовой микроскопии после их переноса на поверхность слюды. Пленки формировались в течение 15 ч.

При добавлении 25 Ед./л фермента образуются длинные нитевидные и небольшие сферические агрегаты (рис. 5б). Протяженность нитей достигает несколько сотен нм, а высота и сечение – 10–20 нм. На фоне более протяженных нитей можно различить более короткие и тонкие протофибриллы. Эти агрегаты не образуют сплошной пленки и, вероятно, основным компонентом пленки остается фибриноген, что подтверждает предположение о разворачивании только части молекул белка в поверхностном слое для этой концентрации тромбина.
Добавление 50 Ед./л тромбина к 1 × 10–7 М раствору фибриногена существенно меняет морфологию полученных пленок и позволяет получить широкие и переплетающиеся фибриновые волокна (рис. 5в). Длина волокон заметно превышает 500 нм, а их ширина составляет около 100 нм. Сжатие поверхности в 10 раз приводит к образованию сплошной пленки, в которой тем не менее еще можно различить некоторое количество широких волокон (рис. 6а).
Рис. 6.
Изображения адсорбционных пленок растворов смеси фибриногена концентрацией 1 × 10–7 М и тромбина концентрацией 50 (а) и 100 Ед./л (б), полученные с помощью атомно-силовой микроскопии после их переноса на поверхность слюды. Пленки формировались в течение 15 ч, затем осуществлялось сжатие поверхности в 10 раз.

Для того, чтобы установить, как связано наличие локального максимума на зависимостях динамической поверхностной упругости с процессом образования агрегатов, были получены АСМ-изображения для смеси 1 × 10–7 М и тромбина концентрацией 50 Ед./л при переносе в точке локального максимума динамической поверхностной упругости (рис. 7). На этих изображениях хорошо видно отсутствие каких-либо крупных нитевидных агрегатов или волокон. Таким образом, можно предположить, что фибрин формируется в поверхностном слое уже после локального максимума. Максимуму же соответствует процесс разворачивания белка и начало образования протофибрилл. Структура поверхностного слоя оказывается похожей на пленку чистого фибриногена, однако более неоднородную, что также подтверждает предположение о начале денатурации белка и вытеснении отдельных частей молекулы из ближней области поверхностного слоя в области локального максимума упругости.
Рис. 7.
Изображения адсорбционных пленок растворов смеси фибриногена концентрацией 1 × 10–7 М и тромбина концентрацией 50 Ед./л, полученные с помощью атомно-силовой микроскопии после их переноса на поверхность слюды. Время жизни поверхности соответствует максимуму динамической поверхностной упругости (7 мин).

При добавлении 100 Ед./л фермента (рис. 5г) даже в несжатом виде можно увидеть в поверхностном слое сплошные участки пленки среди переплетающихся волокон, ширина которых заметно увеличилась до 250 нм. Сжатие в 10 раз приводит к образованию сплошной однородной пленки (рис. 6б).
Для пленок, полученных из растворов с концентрацией тромбина 200 (рис. 5д) и 300 Ед./л (рис. 5е), видно дальнейшее срастание волокон в широкие ленты, переходящие в сплошную пленку. При высоких концентрациях тромбина (500 Ед./л и выше) плeнка становится однородной (рис. 5ж).
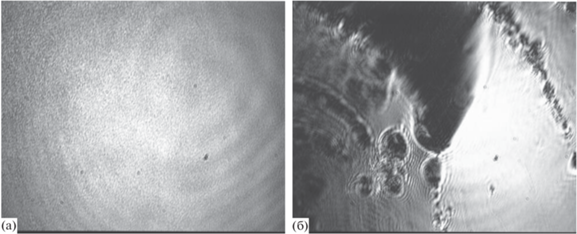
С помощью микроскопии при угле Брюстера были получены изображения пленок для 1 × 10–7 М раствора фибриногена при добавлении 200 Ед./л тромбина (рис. 8). При малых временах жизни поверхности (5 мин) изображения представляют собой серый фон, что говорит об образовании пленки, однородной в мезоскопическом масштабе. С увеличением времени жизни поверхности (>30 мин) на изображении можно различить небольшую шероховатость (рис. 8а). Для малых концентраций тромбина подобную шероховатость можно было наблюдать только при сжатии. Сжатие же пленки, полученной при высоких концентрациях тромбина (200 Ед./л), не позволяет обнаружить каких-то серьезных изменений. Однако небольшое механическое возмущение показывает, что на поверхности имеется сплошная пленка (рис. 8б). На изображении видны светлые области, отвечающие пленке фибрина, и темные области, отвечающие воде.
Рис. 8.
Изображения, полученные с помощью микроскопии при угле Брюстера для адсорбционных пленок фибриногена концентрацией 1 × 10–7 М с добавлением тромбина 200 Ед./л (а). Пленки формировались течение 5 ч. Изображение (б) было получено после сжатия поверхности на 50% и небольшого механического возмущения поверхности.
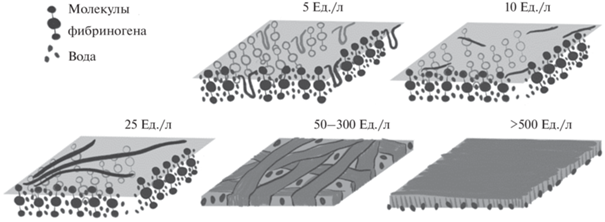
Таким образом, применение АСМ и микроскопии при угле Брюстера позволило обнаружить изменение морфологии поверхностного слоя при формировании пленки фибрина под действием различных концентраций тромбина и подтвердило предположения, выдвинутые при анализе зависимостей динамической поверхностной упругости. Полученные результаты, совместно с выводами, представленными в [19], позволяют предложить следующую схему структуры пленки фибрина для различных концентраций тромбина. В отсутствиe фермента при концентрациях белка выше 2 × 10–8 М молекулы фибриногена, окруженные молекулами воды, располагаются почти перпендикулярно поверхности (рис. 9). При добавлении 5 Ед./л тромбина кинетические зависимости динамической поверхностной упругости имеют немонотонный вид. Это позволяет выдвинуть предположение о разворачивании небольшого количества молекул белка и вытеснению отдельных их частей в виде хвостов и петель в дальнюю область поверхностного слоя. Повышение концентрации тромбина до 10 Ед./л, вероятно способствует образованию некоторого количества протофибрилл, при этом зависимость поверхностной упругости от времени становится монотонной, а значения этой величины оказываются близки к результатам для чистого белка. Добавление 25 Ед./л тромбина приводит к росту динамической поверхностной упругости на 30% по сравнению со значениями для чистого белка. Такое поведение было ранее обнаружено для дисперсий амилоидных фибрилл [35] и позволило предположить, что в этом случае в поверхностном слое также сформировалось некоторое количество длинных нитевидных агрегатов, придающих дополнительную жесткость полученной пленке. В области высоких концентраций тромбина (50–1000 Ед./л) происходит разворачивание практически всех молекул белка, сопровождающееся максимумом на зависимостях поверхностной упругости и дальнейшим увеличением ее значений. Ранее было показано, что формирование полимерной пленки на поверхности жидкость–газ ведет к росту динамической поверхностной упругости [33]. Для концентраций тромбина свыше 50 Ед./л все больше молекул фибриногена принимают участие в полимеризации. Отдельные нитевидные агрегаты, образованные на предыдущем этапе, становятся более широкими и разветвленными и при высоких концентрациях тромбина (свыше 500 Ед./л) образуют сплошную пленку фибрина, обладающую упругостью, двукратно превышающей значения для чистого белка. Такое действие тромбина оказывается противоположным тому, что наблюдалось для объемной фазы. При формировании фибриновых сгустков в объеме раствора увеличение концентрации фибрина ведет к получению более длинных и менее разветвленных агрегатов [4].
ЗАКЛЮЧЕНИЕ
Комплексный подход на основе методов дилатационной поверхностной реологии, эллипсометрии и различных видов микроскопии позволил предложить механизм формирования пленок фибрина на границе жидкость–газ и определить морфологию таких пленок. Обнаружен немонотонный характер зависимостей динамической поверхностной упругости, отвечающий различным этапам формирования пленки фибрина. Интерпретация кинетических зависимостей поверхностных свойств, результаты АСМ и микроскопии при угле Брюстера позволили показать, что с увеличением концентрации тромбина происходит переход от отдельных нитевидных агрегатов к структуре, состоящей из разветвленных волокон, а затем к сплошной пленке фибрина. Таким изменениям морфологии отвечают различные значения динамической поверхностной упругости. При этом зависимости динамического поверхностного натяжения для всех исследованных смешанных растворов оставались близки, что указывает на большую чувствительность динамической поверхностной упругости к изменению структуры поверхностного слоя по сравнению с поверхностным натяжением.
Список литературы
Li Y., Meng H., Liu Y., Lee B.P. Fibrin gel as an injectable biodegradable scaffold and cell carrier for tissue engineering // Scientific World Journal. 2015. V. 2015. Article ID 685690. https://doi.org/10.1155/2015/685690
Spotnitz W.D. Fibrin sealant: Past, present, and future: A brief review // World J. Surg. 2010. V. 34. № 4. P. 632–634. https://doi.org/10.1007/s00268-009-0252-7
Al Kayal T., Losi P., Pierozzi S., Soldani G.A. New method for fibrin-based electrospun/sprayed scaffold fabrication // Sci. Rep. 2020. V. 10. № 1. P. 1–4. https://doi.org/10.1038/s41598-020-61933-z
Janmey P.A., Winer J.P., Weisel J.W. Fibrin gels and their clinical and bioengineering applications // J. R. Soc. Interface. 2009. V. 6. № 30. P. 1–10. https://doi.org/10.1098/rsif.2008.0327
Woolverton C.J., Fulton J.A., Salstrom S.J., Hayslip J., Haller N.A., Wildroudt M.L., MacPhee M. Tetracycline delivery from fibrin controls peritoneal infection without measurable systemic antibiotic // J. Antimicrob. Chemother. 2001. V. 48. № 6. P. 861–867. https://doi.org/10.1093/jac/48.6.861
Karp J.M., Sarraf F., Shoichet M.S., Davies J.E. Fibrin-filled scaffolds for bone-tissue engineering: An in vivo study // J. Biomed. Mater. Res. Part A. 2004. V. 71. № 1. P. 162–171. https://doi.org/10.1002/jbm.a.30147
Ho W., Tawil B., Dunn J.C.Y., Wu B.M. The behavior of human mesenchymal stem cells in 3D fibrin clots: Dependence on fibrinogen concentration and clot structure // Tissue Eng. 2006. V. 12. № 6. P. 1587–1595. https://doi.org/10.1089/ten.2006.12.ft-134
Stamboroski S., Joshi A., Noeske P.-L.M., Koppen S., Bruggemann D. Principles of fibrinogen fiber assembly in vitro // Macromol. Biosci. 2021. V. 21. P. 2000412. https://doi.org/10.1002/mabi.202000412
Hämisch B., Büngeler A., Kielar C., Keller A., Strube O., Huber K. Self-assembly of fibrinogen in aqueous, thrombin-free solutions of variable ionic strengths // Langmuir. 2019. V. 35. № 37. P. 12113–12122. https://doi.org/10.1021/acs.langmuir.9b01515
Konings J., Govers-Riemslag J.W.P., Philippou H., Mutch N.J., Borissoff J.I., Allan P., Mohan S., Tans G., Ten Cate H., Ariëns R.A.S. Factor XIIa regulates the structure of the fibrin clot independently of thrombin generation through direct interaction with fibrin // Blood. 2011. V. 118. № 14. P. 3942–3951. https://doi.org/10.1182/blood-2011-03-339572
Litvinov R.I., Gorkun O.V., Owen S.F., Shuman H., Weisel J.W. Polymerization of fibrin: Specificity, strength, and stability of knob−hole interactions studied at the single-molecule level // Blood. 2005. V. 106. № 9. P. 2944–2951. https://doi.org/10.1182/blood-2005-05-2039
Litvinov R.I., Gorkun O.V., Galanakis D.K., Yakovlev S., Medved L., Shuman H., Weisel J.W. Polymerization of fibrin: Direct observation and quantification of individual B:b knob-hole interactions // Blood. 2007. V. 109. № 1. P. 130–138. https://doi.org/10.1182/blood-2006-07-033910
Weisel J.W., Medved L. The structure and function of the αC domains of fibrinogen // Ann. N. Y. Acad. Sci. 2001. V. 936. P. 312–327. https://doi.org/10.1111/j.1749-6632.2001.tb03517.x
Zavyalova E.G., Protopopova A.D., Kopylov A.M., Yaminsky I.V. Investigation of early stages of fibrin association // Langmuir. 2011. V. 27. P. 4922–4927. https://doi.org/10.1021/la200148n
Yesudasan S., Averett R.D. Multiscale network modeling of fibrin fibers and fibrin clots with protofibril binding mechanics // Polymers. 2020. V. 12. № 6. https://doi.org/10.3390/polym12061223
Gu S.X., Lentz S.R. Fibrin films: Overlooked hemostatic barriers against microbial infiltration // J. Clin. Invest. 2018. V. 128. № 8. P. 3243–3245. https://doi.org/10.1172/JCI121858
Leslie D.C., Waterhouse A., Berthet J.B., Thomas M.V., Watters A.L., Abhishek J., Kim P., Hatton B.D., Nedder A., Donovan K., Super E.H., Howell C., Johnson C.P., Vu T.L., Bolgen D.E., Rifai S., Hansen A.R., Aizenberg M., Super M., Aizenberg J., Ingber D.E. A bioinspired omniphobic surface coating on medical devices prevents thrombosis and biofouling // Nat. Biotechnol. 2014. V. 32. № 11. P. 1134–1140. https://doi.org/10.1038/nbt.3020
Macrae F.L., Duval C., Papareddy P., Baker S.R., Yuldasheva N., Kearney K.J., McPherson H.R., Asquith N., Konings J., Casini A., Degen J.L., Connell S.D., Philippou H., Wolberg A.S., Herwald H., Ariëns R.A.S. A fibrin biofilm covers blood clots and protects from microbial invasion // J. Clin. Invest. 2018. V. 128. № 8. P. 3356–3368. https://doi.org/10.1172/JCI98734
Миляева О.Ю., Рафикова А.Р. Влияние малых концентраций тромбина на динамические поверхностные свойства растворов фибриногена // Коллоид. журн. 2022. Т. 84. № 1. С. 58–66. https://doi.org/10.31857/S0235009222010024
O’Brien E.T., Falvo M.R., Millard D., Eastwood B., Taylor R.M., Superfine R. Ultrathin self-assembled fibrin sheets // Proc. Natl. Acad. Sci. U.S.A. 2008. V. 105. № 49. P. 19438–19443. https://doi.org/10.1073/pnas.0804865105
Noskov B.A. Protein conformational transitions at the liquid-gas interface as studied by dilational surface rheology // Adv. Colloid Interface Sci. V. 2014. V. 206. P. 222–238. https://doi.org/10.1016/j.cis.2013.10.024
Milyaeva O.Y., Gochev G., Loglio G., Miller R., Noskov B.A. Influence of polyelectrolytes on dynamic surface properties of fibrinogen solutions // Colloids Surfaces A Physicochem. Eng. Asp. 2017. V. 532. P. 108–115. https://doi.org/10.1016/j.colsurfa.2017.06.002
Ariola F.S., Krishnan A., Vogler E.A. Interfacial rheology of blood proteins adsorbed to the aqueous-buffer/air interface // Biomaterials. 2006. V. 27. № 18. P. 3404–3412. https://doi.org/10.1016/j.biomaterials.2006.02.005
Hernandez E.M., Franses E.I. Adsorption and surface tension of fibrinogen at the air / water interface // Colloids Surf. A. 2003. V. 214. № 1. P. 249–262. https://doi.org/10.1016/S0927-7757(02)00403-X
Hassan N., Maldonado-Valderrama J., Gunning A.P., Morris V.J., Ruso J.M. Surface characterization and AFM imaging of mixed fibrinogen-surfactant films // J. Phys. Chem. B. 2011. V. 115. № 19. P. 6304–6311. https://doi.org/10.1021/jp200835j
Damodaran S. In situ measurement of conformational changes in proteins at liquid interfaces by circular dichroism spectroscopy // Anal. Bioanal. Chem. 2003. V. 376. № 2. P. 182–188. https://doi.org/10.1007/s00216-003-1873-6
Weisel J.W., Litvinov R.I. Fibrin Formation, Structure and Properties / ed. Parry D.A.D., Squire J.M. Cham: Springer International Publishing. 2017. P. 405–456. https://doi.org/10.1007/978-3-319-49674-0_13
Peng D., Yang J., Li J., Tang C., Li B. Foams stabilized by β-Lactoglobulin amyloid fibrils: effect of pH // J. Agric. Food Chem. 2017. V. 65. № 48. P. 10658–10665. https://doi.org/10.1021/acs.jafc.7b03669
Thi-Yen Le T., Hussain S., Tsay R.Y., Noskov B.A., Akentiev A., Lin S.Y. On the equilibrium surface tension of aqueous protein solutions – Bovine serum albumin // J. Mol. Liq. 2022. V. 347. P. 118305. https://doi.org/10.1016/j.molliq.2021.118305
Jordens S., Rühs P.A., Sieber C., Isa L., Fischer P., Mezzenga R. Bridging the gap between the nanostructural organization and macroscopic interfacial rheology of amyloid fibrils at liquid interfaces // Langmuir. 2014. V. 30. № 33. P. 10090–10097. https://doi.org/10.1021/la5020658
Bykov A.G., Lin S.-Y., Loglio G., Miller R., Noskov B.A. Kinetics of adsorption layer formation in solutions of polyacid/surfactant complexes // J. Phys. Chem. C. 2009. V. 113. № 14. P. 5664–5671. http://pubs.acs.org/doi/abs/10.1021/jp810471y
Motschmann H., Teppner R. Ellipsometry in interface science / In: Moebius D., Miller R., Eds. Novel Methods to Study Interfacial Layers. Studies in Interface Science. Vol. 11. Elsevier, 2001. P. 1–42. https://doi.org/10.1016/S1383-7303(01)80014-4
Milyaeva O.Y., Bykov A.G., Campbell R.A., Loglio G., Miller R., Noskov B.A. The dynamic properties of PDA-laccase films at the air−water interface // Colloids Surfaces A Physicochem. Eng. Asp. 2020. V. 599. P. 124930. https://doi.org/10.1016/j.colsurfa.2020.124930
Campbell R.A., Tummino A., Varga I., Milyaeva O.Y., Krycki M.M., Lin S.Y., Laux V., Haertlein M., Forsyth V.T., Noskov B.A. Adsorption of denaturated lysozyme at the air−water interface: structure and morphology // Langmuir. 2018. V. 34. № 17. P. 5020–5029. https://doi.org/10.1021/acs.langmuir.8b00545
Noskov B.A., Akentiev A. V., Bykov A.G., Loglio G., Miller R., Milyaeva O.Yu. Spread and adsorbed layers of protein fibrils at water–air interface // Colloids and Surfaces B: Biointerfaces, 2022. V. 220. P. 112942. https://doi.org/10.1016/j.colsurfb.2022.112942
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал