Коллоидный журнал, 2023, T. 85, № 3, стр. 366-375
Водорастворимый интерполиэлектролитный комплекс на основе полидиаллилдиметиламмоний хлорида и полиакрилата натрия как компонент для создания устойчивых биоцидных покрытий
В. А. Пигарева 1, *, А. В. Большакова 1, 2, В. И. Марина 1, А. В. Сыбачин 1
1 Московский государственный университет имени М.В. Ломоносова
119991 Москва, Химический факультет, Ленинские горы д. 1, Россия
2 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва,
Ленинский просп. 31, корп. 4, Россия
* E-mail: vla_dislava@mail.ru
Поступила в редакцию 01.02.2023
После доработки 31.03.2023
Принята к публикации 01.04.2023
- EDN: ZPYSCB
- DOI: 10.31857/S0023291223600190
Аннотация
Покрытия на основе поликатионов представляют собой перспективный класс защитных антимикробных покрытий. Водорастворимые комплексы полидиаллилдиметиламмоний хлорида (ПДАДМАХ) с полиакрилатом натрия (ПАNa) исследовали методом турбидиметрии. Показано, что добавление 12 мол. % полианиона к поликатиону приводит к образованию интерполиэлектролитного комплекса (ИПЭК), устойчивого к фазовому расслоению в водно-солевых средах с концентрацией соли до 0.1–0.2 М. В отличие от традиционного способа получения покрытий из ИПЭК методом послойного нанесения, в работе исследовано получение покрытий непосредственно из раствора водорастворимых ИПЭК на гидрофильной стеклянной поверхности и поверхности из более гидрофобного поликарбоната. Установлено, что формирование ИПЭК позволяет повысить устойчивость покрытия к смыванию водой по сравнению с индивидуальным покрытием ПДАДМАХ на обоих типах подложек.
ВВЕДЕНИЕ
Размножение микроорганизмов на стенах в пищевых цехах, а также на поверхностях оборудования для хранения, транспортировки и производства пищи могут привести к ее заражению и последующим серьезным отравлениям. Другой важной проблемой пищевой безопасности является формирование биопленок – сложных микробных экосистем, которые образуются одним или несколькими видами бактериальных культур, погруженных во внеклеточный матрикс (различного состава в зависимости от типа среды производства пищевых продуктов и колонизирующих видов) [1]. Такие системы трудно удалить физически, а также биопленки плохо реагируют на обычные антибиотики и могут развить устойчивость к дезинфицирующим средствам [2, 3]. Поэтому, несмотря на наличие многочисленных сильнодействующих антибиотических препаратов и других современных антибактериальных средств, бактериальные инфекции по-прежнему представляют собой серьезную угрозу. Классические низкомолекулярные биоциды являются эффективным средством для уничтожения бактерий, но демонстрируют слабую адгезию к обрабатываемым поверхностям. Таким образом, существует необходимость в эффективных антибактериальных системах пролонгированного действия, а также материалах, препятствующих образованию биопленок.
Среди полимеров в качестве биоцидов хорошо себя зарекомендовали поликатионы, в частности, макромолекулы с четвертичными аминогруппами [4]. Одним из ярких представителей биоцидных поликатионов является полидиаллилдиметиламмоний хлорид (ПДАДМАХ) [5], нашедший применение в качестве биоцидной добавки в стоматологических материалах, в компонентах раневых повязок [6, 7]. Модификация ПДАДМАХ при помощи малой доли полианиона приводит к образованию водорастворимого интерполиэлектролитного комплекса (ИПЭК) [8], содержащего области со свободными заряженными группами, способными обеспечить биоцидное действие и адгезию к гидрофильным поверхностям. Помимо того, в модифицированном полианионом ПДАДМАХ содержатся и гидрофобные области, повышающие адгезию к гидрофобным поверхностям и дающие возможность модифицировать такие системы низкомолекулярными антибактериальными агентами.
В литературе можно встретить работы, посвященные исследованию функциональных покрытий, в том числе и антибактериальных, из ИПЭК на основе ПДАДМАХ и различных полианионов, в частности, полиакриловой кислоты (ПАК) и ее солей, а также сополимеров ПАК-ПДАДМАХ [9, 10]. Однако, предлагаемые методы обладают рядом недостатков, связанных, к примеру, со сложным синтезом сополимеров, вследствие чего будет возрастать их цена. Также в литературных данных основным методом нанесения покрытий преимущественно является метод послойного нанесения (layer-by-layer method) [11], существенным недостатком которого является то, что не все поверхности представляется возможным обработать таким способом, особенно в условиях промышленных цехов на пищевых производствах.
В данной работе проводится исследование возможности получения покрытий из готового раствора водорастворимого ИПЭК. Такой способ получения антибактериальных покрытий более удобен для практического применения. В качестве полианиона была выбрана натриевая соль поликариловой кислоты (ПАNa) различных молекулярных масс. Было изучено влияние молекулярной массы ПАNa на формирование водорастворимых комплексов ПДАДМАХ с полианионами, проведена оценка устойчивости покрытий, сформированных непосредственно из водного раствора ИПЭК, к смыванию водой, а также проведена оценка возможности иммобилизировать отрицательно заряженные патогенные микроорганизмы с использованием модельных систем.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
В работе использованы ПДАДМАХ со средней молекулярной массой 400–500 кДа и ПАNa молекулярных масс: 100, 15, 8 и 2.1 кДа (ПАNa100, ПАNa15, ПАNa8 и ПАNa2 соответственно) (Sigma-Aldrich, США), электронейтральный диолеоилфосфатидилхолин (ДОФХ), отрицательно заряженный диолеоилфосфатидилглицерол (ДОФГ) – все фирмы Avanti Polar Lipids (США), трисгидроксиметиламинометан (Трис), ацетат натрия, хлорид натрия – все Реахим (Россия) марки “ч.д.а.”.
Для исследования полимерных покрытий в качестве подложек были выбраны пластины из стекла и поликарбоната площадью 1.8 × 1.8 см. Перед экспериментом подложки тщательно очищались и обезжиривались метанолом. Активация стеклянной поверхности проводилась путем выдерживания обезжиренных стекол в 1 М растворе KOH с последующим промыванием бидистиллированной водой.
В качестве подложек для экспериментов по атомно-силовой микроскопии использовались оптические боросиликатные стекла диаметром 1.5 см от Edmund Optics (США).
Для моделирования взаимодействия микроорганизмов с покрытиями из ПДАДМАХ и его комплекса с ПАNa были использованы отрицательно заряженные латексные микросферы размером 2 мкм (Диа-М, Россия), модифицированные липидным бислоем. Для этого предварительно были синтезированы липосомы из смеси ДОФХ и ДОФГ с мольной долей анионного липида 0.3 по методике, описанной ранее [12].
Биомиметические липидные мембраны (модельные бактериальные мембраны) готовили по методике, описанной ранее [13] – 2 мг 2-микронных латексных частиц диспергировали в 1 мл этанола и затем отделяли от этанола центрифугированием. Промытые этанолом частицы диспергировали в 1 мл 1 М раствора КОН, затем разделяли центрифугированием и промывали деионизированной водой и Трис-буфером с рН 7 для очистки поверхности. Затем 2 мг частиц в 1 мл Трис-буфера с рН 7 диспергировали с суспензией липосом ДОФХ/ДОФГ концентрации липосом 0.064 мг/мл на вортексе Biosan (Латвия) при 600 об./мин в течение 30 мин. Далее непрореагировавшие липосомы отделяли центрифугированием и получали латексные частицы, модифицированные липидной мембраной (ЛМЛ).
Во всех экспериментах использовалась бидистиллированная вода с проводимостью 0.05 мкСм/см.
Методы
Формирование ИПЭК, а также устойчивость комплексов к фазовому разделению изучали методом турбидиметрии с использованием спектрофотометра Shimadzu UV-3600 (Япония).
Оценку устойчивости покрытий из ПДАДМАХ и ИПЭК к смыванию проводили при помощи гравиметрического анализа на весах ВЛА-120 М производства Госметр (Россия) по описанной ранее методике [14]. Свежеочищенную подложку взвешивали, на нее наносили 200 мкл раствора поликатиона или ИПЭК с концентрацией 20 мг/мл, а затем сушили на воздухе. При этом вся поверхность подложки была покрыта раствором. Далее образец еще раз взвешивали и рассчитывали массу пленки как разность масс подложки с покрытием и чистой подложки. Циклы смывания проводили следующим образом: на подложку наносили объем воды в количестве 200 мкл так, чтобы она полностью покрывала поверхность полимерной пленки. После двух минут инкубации жидкость удаляли, а образец оставляли сушиться на воздухе. Затем образец взвешивали и рассчитывали потерю массы.
Первоначальную толщину получаемых покрытий фиксировали с помощью оптического микроскопа Люм-1 (Альтами, Россия). Морфологию и толщину покрытий из поликатиона и ИПЭК после нескольких циклов смывания определяли с помощью атомно-силового микроскопа Multimode Nanoscope V компании Veeco (США) в полуконтактном и контактном режиме с использованием кантилеверов из поликремния с зондами с высоким аспектным соотношением HA-FM фирмы TipsNano (Россия) с резонансной частотой 76 кГц и добротностью около 300. Толщина полимерного покрытия определялась с помощью скретч-теста (scratch-test) следующим образом. Сначала исходную морфологию покрытия исследовали в полуконтактном режиме (кадр 3 × 3 мкм2), затем режим сканирования переключали в контактный и сканировали меньшую область (кадр 1 × 1 мкм2) в течение 10 мин со скоростью сканирования 10 Гц. При таких условиях покрытие “сметается” зондом с поверхности подложки, обнажая ее поверхность. После этого режим переключали в стандартный режим сканирования полимерных пленок (полуконтактный режим, скорость сканирования 1–1.5 Гц) и снимали общий вид покрытия на большем масштабе (кадр 3 × 3 мкм2). В середине кадра наблюдали квадрат площадью 1 × 1 мкм2, с которого в ходе скретч-теста было удалено полимерное покрытие. Глубина квадрата постулировалась равной толщине покрытия. Данная методика позволяет с высокой степенью точности определить толщину нанесенного покрытия [15].
Электрофоретическую подвижность (ЭФП) растворов ПДАДМАХ и ИПЭК на его основе измеряли методом лазерного микроэлектрофореза на приборе ZetaPlus компании Brookhaven (США) с использованием термостатируемой ячейки.
Исследование возможности покрытий из ПДАДМАХ и ИПЭК иммобилизировать модельные патогенные микроорганизмы проводили следующим образом. На заранее очищенном и обезжиренном предметном стекле с помощью двух полосок скотча сформировали дорожку размером 5 мм × 26 мм. На дорожку по всей площади наносили 80 мкл ИПЭК с концентрацией 20 мг/мл и оставляли высушиваться в термошкафу при 30°С. После полного высыхания пленки стекло располагали под углом 45° и на верхний край сформированной дорожки наносили 80 мкл суспензии ЛМЛ с концентрацией 1 мг/мл. Жидкость с неадсорбированным ЛМЛ собирали внизу дорожки и удаляли. Далее предметное стекло оставляли высушиваться в термошкафу при 30°С для удаления остаточных следов воды. Связывание частиц латекса, выступавших моделью отрицательно заряженных бактерий, с поверхностью пленки из полиэлектролитного комплекса фиксировали с помощью оптического микроскопа Люм-1 (Альтами, Россия).
Также была проведена оценка минимальных ингибирующих концентраций (МИК) ПДАДМАХ и его комплексов. Оценку значений МИК проводили для грамположительных бактерий Bacillus subtilis и грамотрицательных бактерий Escherichia coli KanR в среде лизогенного бульона (LB). МИК определяли с помощью анализа серийного микроразведения в бульоне с шагом в 2 раза. Концентрацию клеток доводили до 106 клеток/мл. В качестве тестируемого соединения использовали растворы ПДАДМАХ и его ИПЭК с исходной концентрацией 20 мг/мл. Растворы серийно разбавляли в два раза в 96-луночном микропланшете (по 100 мкл на лунку) с 1 по 10 лунку включительно, в 11 лунке находился положительный контроль – среда с клетками без добавления тестируемого соединения, а в 12 – отрицательный контроль – чистая среда LB. Микропланшеты инкубировали при 37°С при равномерном помешивании в течении 16 ч. Затем измеряли оптическую плотность и определяли МИК – минимальную ингибирующую концентрацию тестируемого соединения, при которой наблюдалось отсутствие роста бактериальной культуры по сравнению с контрольной точкой, где была добавлена только среда LB (12 лунка). Рост бактериальных клеток измеряли при 590 нм с помощью микропланшетного ридера (VICTOR X5 Light Plate Reader, PerkinElmer, Уолтем, Массачусетс, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На растворимость ИПЭК в воде влияет множество факторов, основными из них являются природа и количественное соотношение функциональных групп макромолекул, соотношение их степеней полимеризации, рН среды и ионная сила раствора [16–18]. В ходе данной работы гидрофобизация поликатионов осуществлялась путем формирования комплексов с рН-зависимым полианионом, характеристическая константа диссоциации рК0 которого, согласно литературным данным, составляет 4.6 [19, 20]. Для полиакрилата натрия различных степеней полимеризации методом турбидиметрического титрования были определены области существования водорастворимых ИПЭК с ПДАДМАХ при различных рН. Результаты турбидиметрического титрования раствора ПДАДМАХ растворами ПАNa различных молекулярных масс в буфере с рН 5 представлены на рис. 1 в виде зависимости относительной мутности (τ/τмакс) от соотношения анионных и катионных групп полимеров χ = [ПАNa]/[ПДАДМАХ].
Рис. 1.
Кривая турбидиметрического титрования раствора ПДАДМАХ раствором ПАNa2 (1), ПАNa8 (2), ПАNa15 (3), ПАNa100 (4). CNaCl = 0.005 М, CПДАДМАХ = = 6 × 10–4 осново-моль/л, ацетатный буфер с pH 5.0 концентрации 0.01 М.
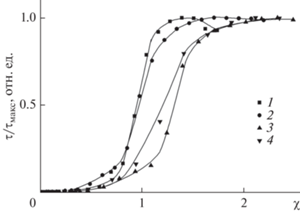
Добавление раствора ПАNa2 к раствору ПДАДМАХ при рН 5 вплоть до значения χ = 0.45 не приводит к изменению мутности раствора, свидетельствуя об образовании водорастворимых ИПЭК. Дальнейшее добавление ПАNa2 приводит к резкому увеличению мутности, что свидетельствует об образовании гетерогенной системы, т.е. фазовом разделении. При этом следует отметить интервал 0.45 < χ < 0.8 – в данном диапазоне наблюдалось увеличение мутности с увеличением доли ПАNa в смеси, но не такое выраженное, как при больших составах. Ранее подобный эффект был продемонстрирован на системе ПДАДМАХ – полистиролсульфонат натрия [14]. По-видимому, вследствие полидисперсности образцов происходит формирование агрегатов, не являющихся термодинамически соответствующими системе с заданными средними молекулярными массами. Доля этих агрегатов незначительна, но она вносит вклад в формирование гетерогенной системы. Максимум на турбидиметрической кривой соответствует полной нейтрализации заряда ПДАДМАХ полианионом. Увеличение молекулярной массы ПАNa до 8000, не приводило к изменению области существования водорастворимых комплексов с ПДАДМАХ в подкисленной среде (см. кривые 1 и 2 на рис. 1). Дальнейшее увеличение молекулярной массы ПАNa до 15 000 и 100 000 приводило к смещению турбидиметрической кривой в область больших составов, однако, полностью водорастворимые комплексы удавалось получить также только в интервале χ ≤ 0.45. При рН 5 для всех турбидиметрических кривых наблюдался максимум при значениях χ, превышающих единицу. Это связано с тем, что при рН 5 большая часть карбоксильных групп находится в протонированном состоянии [21, 22], а, следовательно, для нейтрализации всех кватернизованных аминогрупп требуется большее количество ПАNa, чем в случае, когда все звенья полианиона несут отрицательный заряд.
На рис. 2. представлены кривые турбидиметрического титрования раствора ПДАДМАХ растворами ПАNa в нейтральной среде.
Рис. 2.
Кривая турбидиметрического титрования раствора ПДАДМАХ раствором ПАNa2 (1), ПАNa8 (2), ПАNa15 (3), ПАNa100 (4). CNaCl = 0.005 М, CПДАДМАХ = = 6 × 10–4 осново-моль/л, Трис-буфер с pH 7.0 концентрации 0.01 М.
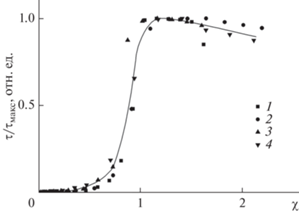
Из приведенных зависимостей видно, что степень полимеризации ПАNa практически не оказывает существенного влияния на область существования водорастворимых ИПЭК. Для всех исследованных фракций ПАNa фазового разделения не наблюдалось вплоть до составов комплексов χ = 0.65–0.75. При этом максимумы мутности на турбидиметрических кривых наблюдаются при значении χ ~ 1. Несмотря на то, что при рН 7 доля депротонированных карбоксильных групп меньше 1.0, формирование ИПЭК приводит к их дополнительной ионизации [21–23].
При рН 9 все группы ПАNa находятся в заряженном состоянии [21, 22]. Результаты турбидиметрического титрования раствора ПДАДМАХ растворами ПАNa различных молекулярных масс в буфере с рН 9 представлены на рис. 3.
Рис. 3.
Кривая турбидиметрического титрования раствора ПДАДМАХ раствором ПАNa2 (1), ПАNa8 (2), ПАNa15 (3), ПАNa100 (4). CNaCl = 0.005 М, CПДАДМАХ = = 6 × 10–4 осново-моль/л, Трис-буфер с pH 9.0 концентрации 0.01 М.
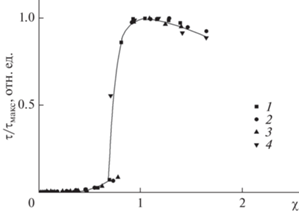
Все пары ПАNa/ПДАДМАХ формировали водорастворимые комплексы в одном и том же диапазоне значений χ ≤ 0.75 для всех исследованных значений степеней полимеризации ПАNa. Таким образом, формирование водорастворимых комплексов ПАNa/ПДАДМАХ при составах χ ≤ 0.45 возможно для широкого диапазона молекулярных масс ПАNa диапазоне рН от кислой до щелочной области.
Известно, что при уменьшении степени полимеризации блокирующего полиэлектролита будет происходить понижение устойчивости комплекса в растворах с высокой ионной силой при соблюдении условия, что его степень полимеризации много меньше степени полимеризации лиофилизирующего полиэлектролита [16]. Поэтому для дальнейших исследований в качестве полианиона была выбрана ПАNa100 (в дальнейшем просто ПАNa).
Водорастворимые ИПЭК весьма чувствительны к ионной силе раствора. Увеличение последней может привести к солевому фазовому расслоению ИПЭК [24]. По методике, описанной ранее, были получены критические концентрации низкомолекулярной соли NaCl ($С_{{{\text{NaCl}}}}^{*}$), соответствующие началу фазового разделения в растворах ИПЭК различного состава. Результаты представлены на рис. 4 в виде фазовой диаграммы.
Рис. 4.
Значения критической концентрации соли NaCl, соответствующие началу фазового расслоения в зависимости от состава ИПЭК χ. Трис-буфер, рН 7.0.
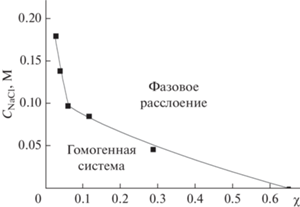
Из графика видно, что для малых значений χ ≤ 0.06 значения $С_{{{\text{NaCl}}}}^{*}$ увеличением доли ПАNa значения $С_{{{\text{NaCl}}}}^{*}$ закономерно снижаются, достигая значения 0.005 М для ИПЭК с χ = 0.65. Поэтому, для создания покрытий и исследования их свойств нами был выбран ИПЭК состава χ = 0.12, обладающий оптимальным набором свойств. С одной стороны, данный ИПЭК содержит высокую долю гидрофобных блоков, сохраняя при этом устойчивость к фазовому разделению в растворах с относительно высокой ионной силой. С другой стороны, данный ИПЭК имеет большую долю свободных катионных групп, обеспечивающих биоцидное действие – значение ЭФП для ИПЭК данного состава составляло 3.1 ± 0.2 (мкм/с)/(В/см), в то время как для раствора ПДАДМАХ значение ЭФП составляло 3.3 ± 0.2 (мкм/с)/(В/см).
Покрытия из ИПЭК с χ = 0.12 на гидрофильной стеклянной поверхности (угол смачивания ≈38°) и относительно гидрофобной поверхности поликарбоната (угол смачивания ≈85°) получали путем нанесения раствора ИПЭК на подложку и последующим удалением растворителя высушиванием.
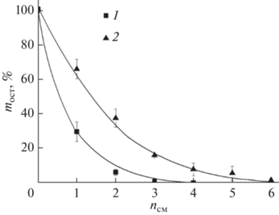
Устойчивость к смыванию покрытий из ПДАДМАХА и ИПЭК с χ = 0.12 количественно оценивали методом гравиметрии. Результаты для покрытий, сформированных на стеклянной поверхности представлены на рис. 5 в виде зависимостей остаточной массы покрытий от номера цикла смывания (nсм). Для поликатиона около 70% потери веса покрытия наблюдалось после первого цикла смывания, а после четырех циклов покрытие перестало фиксироваться на поверхности гравиметрически. Для покрытия, полученного из раствора ИПЭК с χ = 0.12, сохранялось около 55–60% массы после первого цикла смывания и около 10% после четырех циклов, и только после шести циклов точность весов оказалась недостаточной для оценки массы сохранившейся пленки.
Рис. 5.
Зависимость процента оставшейся массы пленок (mост), сформированных из ПДАДМАХ (1) и ИПЭК (2) на поверхности стекла от количества циклов смывания (nсм).
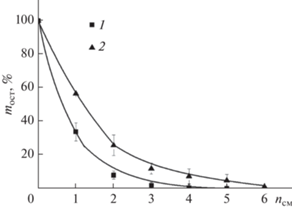
Очевидно, что значительная потеря массы покрытий при первом цикле смывания обусловлена наличием макромолекул, не связанных с поверхностью стекла. Такие ИПЭК и ПДАДМАХ обладают повышенной мобильностью и легко могут быть удалены при смывании.
На следующем этапе были изучены морфология и толщина покрытий, формируемых из ПДАДМАХ и ИПЭК. Для начала методом оптической микроскопии были определены начальные толщины покрытий, которые составили порядка 6–7 мкм для покрытий из ПДАДМАХ и покрытий из ИПЭК.
Далее покрытия были проанализированы после четвертого цикла смывания, поскольку в этих условиях покрытия из ПДАДМАХ уже не регистрировались гравиметрически. По описанной выше методике были приготовлены покрытия из ПДАДМАХ и ИПЭК на стеклянной подложке, затем проведены четыре цикла смывания водой. Полученные образцы были исследованы методом АСМ. Изображения покрытий из ПДАДМАХ и ИПЭК представлены на рис. 6а и 7а соответственно. Видно, что и для индивидуального поликатиона, и для комплекса равномерные покрытия сохраняются даже после четвертого цикла смывания. С помощью скретч-теста было установлено, что покрытие из ИПЭК обладают большей толщиной после четвертого цикла смывания, чем покрытие из ПДАДМАХ. Так, толщина покрытия из ПДАДМАХ после четвертого цикла смывания составляла порядка 100 нм (рис. 6б), в то время как покрытие из комплекса ПАNa/ПДАДМАХ обладало толщиной не менее 250 нм (рис. 7б). В результате анализ покрытий методом АСМ позволяет зарегистрировать наличие полноценных покрытий, даже несмотря на невозможность их фиксирования гравиметрически.
Рис. 6.
АСМ-изображение покрытия из ПДАДМАХ после четырех циклов смывания (а), и поперечное сечение покрытия после скретч-теста (б).
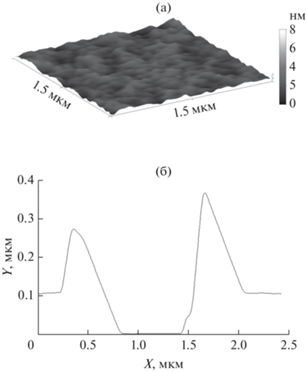
Рис. 7.
АСМ-изображение покрытия из ИПЭК после четырех циклов смывания (а), и поперечное сечение покрытия после скретч-теста (б).
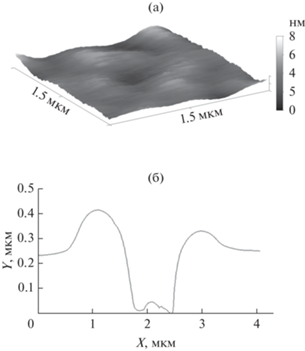
Таким образом, гидрофобизация ПДАДМАХ с помощью ПАNa приводит к формированию покрытий, обладающих большей толщиной по сравнению с покрытиями из индивидуального ПДАДМАХ.
Устойчивость покрытий из ПДАДМАХ и ИПЭК, сформированных на поликарбонате, также исследовали методом гравиметрии. Результаты представлены на рис. 8. Видно, что покрытия, сформированные из ИПЭК на поликарбонатной подложке, также оказались более устойчивыми к смыванию, чем покрытия из ПДАДМАХ. Так, масса пленки из поликатиона перестала фиксироваться гравиметрически уже после третьего цикла смывания, а за массой ИПЭК все еще можно было следить до шестого цикла. Для индивидуального ПДАДМАХ покрытия, сформированные на поликарбонате, удалялись при смывании незначительно быстрее, чем покрытия, сформированные на стекле.
Рис. 8.
Зависимость процента оставшейся массы пленок (mост), сформированных из ПДАДМАХ (1) и ИПЭК (2) на поверхности поликарбоната, от количества циклов смывания (nсм).
Таким образом, вне зависимости от типа подложки (гидрофильный/гидрофобный субстрат) покрытия из ИПЭК демонстрировали повышенную устойчивость к смыванию водой по сравнению с покрытиями из индивидуального поликатиона.
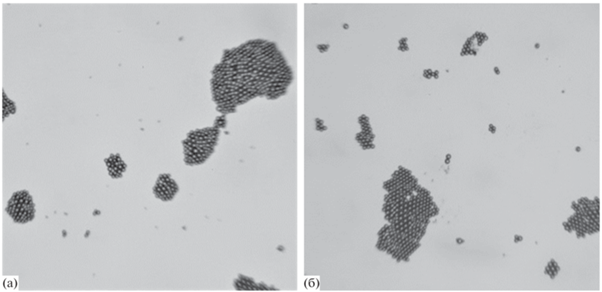
Важно определить, влияет ли гидрофобизация ПДАДМАХ на способность покрытий на его основе к взаимодействию с микроорганизмами. Известно, что мембраны бактерий содержат значительное число отрицательно заряженных групп, что обеспечивает возможность их электростатического взаимодействия с положительно заряженными поверхностями, в том числе поликатионами [25]. Очевидный интерес представляет механизм взаимодействия полимерных покрытий на основе ПДАДМАХ и ИПЭК на его основе с бактериальными микроорганизмами и, в частности, роль в этом функциональных групп, локализованных во внешних слоях полимерного покрытия. Поскольку большинство бактерий имеет размер в несколько микрон, для работы были использованы латексные шарики размером 2 мкм, покрытые липидным бислоем, моделирующим оболочку бактерий. Суспензию ЛМЛ наносили на: очищенную стеклянную подложку; подложку, модифицированную ПДАДМАХ; подложку, модифицированную ИПЭК. После удаления жидкости с неадсорбированными ЛМЛ покрытия анализировали с помощью оптической микроскопии. Результаты представлены на рис. 9.
Рис. 9.
Микрофотографии стеклянной подложки (а), стеклянной подложки с покрытием из ПДАДМАХ (б) и стеклянной подложки с покрытием из ИПЭК (в), полученные после обработки суспензией ЛМЛ.

На микрофотографии, полученной на чистом стекле, присутствует малое количество адсорбированных микрочастиц (рис. 9а). По-видимому, их адсорбция на отрицательно заряженную поверхность стекла обусловлена адсорбцией за счeт вандерваальсовых сил. Этот результат имеет принципиальное значение, поскольку демонстрирует, что электростатические силы отталкивания не позволяют полностью предотвратить адсорбцию бактерий на чистое стекло. Для покрытий из ПДАДМАХ и ИПЭК продемонстрировано, что на поверхности плeнок адсорбировалось значительное количество ЛМЛ (рис. 9б, 9в). Таким образом, покрытие из ПДАДМАХ эффективно связывает отрицательно заряженные биомиметические мембраны, а формирование покрытия из ИПЭК не приводит к потере этой способности поликатиона.
Аналогичный эксперимент был также проведен для покрытий после 4 циклов смывания водой для ПДАДМАХ и 6 циклов смывания водой для ИПЭК, поскольку в этих условиях покрытия уже не фиксировались гравиметрически. На поверхности покрытий из ПДАДМАХ и ИПЭК было также зафиксировано наличие ЛМЛ (риc. 10). Из полученных результатов можно сделать вывод, что даже после интенсивного смывания водой биоцидные покрытия на основе ПДАДМАХ не утратят способности иммобилизировать отрицательно заряженные микроорганизмы.
Отдельно был проанализирован супернатант суспензии ЛМЛ, которая была удалена после контакта с покрытий на основе ПДАДМАХ и ИПЭК. ЭФП суспензии ЛМЛ до контакта с покрытиями составляла –1.20 ± 0.15 (мкм/с)/(В/см). Суспензия супернатанта ЛМЛ после контакта с покрытиями из ПДАДМАХ составляла 1.13 ± 0.15 (мкм/с)/(В/см), а в случае контакта с поверхностью ИПЭК составляла 1.21 ± 0.08 (мкм/с)/(В/см). Таким образом, для частиц ЛМЛ в супернатантах наблюдалась перезарядка поверхности, свидетельствующая о взаимодействии с макромолекулами поликатиона.
Движущей силой адсорбции ЛМЛ на поверхности пленок является электростатическое притяжение отрицательно заряженных групп на поверхности ЛМЛ и свободных катионных звеньев ПДАДМАХ. Таким образом, при анализе механизма действия ИПЭК на микроорганизмы следует учитывать, как способность покрытий из ИПЭК иммобилизировать микронные частицы на своей поверхности, так и способность поликатиона в составе комплекса взаимодействовать с микрочастицами, адсорбируясь на их поверхности без иммобилизации на пленке. Из полученных результатов можно предположить, что иммобилизация микроорганизмов позволит вызвать их гибель и предотвратить формирование биопленок, а при дальнейшем смывании покрытия водой поликатионы в составе комплексом могут обеспечить нарушение функционирования микроорганизмов [26, 27].
Ранее было показано, что исследуемый поликатион обладает биоцидной активностью [28]. Для оценки влияния введения 12 мол. % полианиона на антибактериальные свойства ПДАДМАХ были проведены эксперименты по определению МИК – минимальных ингибирующих концентраций, необходимых для подавления роста бактериальных культур (табл. 1). Из полученных результатов можно сделать вывод, что образование комплекса с ПАNa при соотношении групп χ = 0.12 не снижает биоцидного действия ПДАДМАХ.
ВЫВОДЫ
Модификация катионной макромолекулы ПДАДМАХ противоположно заряженными молекулами ПАNa приводит к образованию положительно заряженного водорастворимого ИПЭК в диапазоне составов χ ≤ 0.45 в широком диапазоне рН c устойчивостью к фазовому разделению в растворах с высокой ионной силой (до 0.1–0.2 М хлорида натрия). Методом гравиметрии установлено, что модификация ПДАДМАХ противоположно заряженным ПАNa приводит к увеличению устойчивости к смыванию покрытий, формируемых из водного раствора положительно заряженного ИПЭК с соотношением анионных и катионных групп полимеров χ = 0.12, как с гидрофильной стеклянной поверхности, так и с менее гидрофильной поверхности из поликарбоната. В то время как покрытие из свободного ПДАДМАХ было практически удалено с поверхности стекла или поликарбоната, ИПЭК с χ = 0.12 сохранил около 10% своей первоначальной массы. Методом АСМ в ходе скретч-теста было установлено, что при одинаковом количестве циклов смывания средняя толщина покрытия из ИПЭК превышает среднюю толщину покрытия из ПДАДМАХ. С помощью метода оптической микроскопии на примере модельных клеточных мембран была показана способность покрытий из комплексов связывать отрицательно заряженные микроорганизмы. Также методом определения минимальных ингибирующих концентраций было установлено, что введение 12 мол. % полианиона не снижает биоцидного действия ПДАДМАХ. Полученные результаты делают исследуемые ИПЭК перспективными для применения в качестве функциональных катионных покрытий для поверхностей различной природы.
Список литературы
Giaouri E., Heir E., Desvaux M. et al. Intra- and inter-species interactions within biofilms of important foodborne bacterial pathogens // Front. Microbiol. 2015 V. 6. P. 841.
Carrascosa C., Raheem D., Ramos F. et al. Microbial biofilms in the food industry — A comprehensive review // Int. J. Environ. Res. Public Health. 2021. V. 18. № 4.
Galié S., García-Gutiérrez C., Miguélez E. et al. Biofilms in the food industry: Health aspects and control methods // Front Microbiol. 2018. V. 9. P. 898.
Ji W., Koepsel R.R., Murata H. et al. Bactericidal specificity and resistance profile of poly(quaternary ammonium) polymers and protein-poly(quaternary ammonium) conjugates // Biomacromolecules. 2017. V. 18. № 8. P. 2583–2593.
Zhao X., Zhang Yu. Bacteria-removing and bactericidal efficiencies of PDADMAC composite coagulants in enhanced coagulation treatment // Clean. 2013. V. 41. P. 37–42.
Dos Santos R.L.O., Sarra G., Lincopan N., Petri D.F.S., Aliaga J., Marques M.M., Dias R.B., Coto N.P., Sugaya N.N., Paula C.R. Preparation, antimicrobial properties, and cytotoxicity of acrylic resins containing poly(diallyldimethylammonium chloride) // Int. J. Prosthodont. 2021. V. 34. № 5. P. 635–641.
Tran P.L., Huynh E., Hamood A.N., de Souza A., Schu-ltz G., Liesenfeld B., Mehta D., Webster D., Reid T.W. The ability of quaternary ammonium groups attached to a urethane bandage to inhibit bacterial attachment and biofilm formation in a mouse wound model // Int. Wound J. 2017. V. 14. № 1. P. 79–84.
Panova I., Drobyazko A., Spiridonov V., Sybachin A., Kydralieva K., Jorobekova S., Yaroslavov A. Humics-based interpolyelectrolyte complexes for antierosion protection of soil: Model investigation // Land Degradation and Development. 2019. V. 30. P. 337–347.
Vitorazi L., Ould-Moussa N., Sekar S., Fresnais J., Loh W., Chapel J.-P., Berret J.-F. Evidence of a two-step process and pathway dependency in the thermodynamics of poly(diallyldimethylammonium chloride)/poly(sodium acrylate) complexation // Soft Matter. 2014. V. 10. P. 9496–9505.
Wang X., Sun S., Zhu, Xing G., Peiying L., Xinhua L., Chunlin L., Meng L. Application of amphoteric polymers in the process of leather post-tanning // J. Leather Sci. Eng. 2021. V. 3. P. 1–9.
Chen C., Illergård J., Wågberg L., Ek M. Effect of cationic polyelectrolytes in contact-active antibacterial layer-by-layer functionalization // Holzforschung. 2017. V. 71. № 7–8. P. 649–658.
Yaroslavov A.A., Efimova A.A., Sybachin A.V. et al. Stability of anionic liposome-cationic polymer complexes in water-salt media // Colloid J. 2011. V. 73. P. 430–435.
Kusaia V.S., Kozhunova E.Y., Stepanova D.A., Pigareva V.A., Sybachin A.V., Zezin S.B., Bolshakova A.V., Shchelkunov N.M., Vavaev E.S., Lyubin E.V., Fedya-nin A.A., Spiridonov V.V. Synthesis of magneto-controllable polymer nanocarrier based on poly(N-isopropylacrylamide-co-acrylic acid) for doxorubicin immobilization // Polymers. 2022. V. 14. № 24. P. 5440.
Pigareva V., Senchikhin I., Bolshakova A., Sybachin A. Modification of polydiallyldimethylammonium chloride with sodium polystyrenesulfonate dramatically changes the resistance of polymer-based coatings towards wash-off from both hydrophilic and hydrophobic surfaces // Polymers. 2022. V. 14. № 6. P. 1247.
Yan Y., Chang S., Wang T., Geng Y. Scratch on polymer materials using AFM tip-based approach: A review // Polymers. 2019. V. 11. № 10. P. 1590.
Izumrudov V.A., Sybachin A.V. Phase separation in solutions of polyelectrolyte complexes: The decisive effect of a host polyion // Polym. Sci., Series A. 2006. V. 48. № 10. P. 1098–1104.
Izumrudov V.A., Paraschuk V.V., Sybachin A.V. Controlled phase separations in solutions of polyelectrolyte complexes-potential for gene delivery // J. Drug Deliv. Sci. Technol. 2006. V. 16. № 4. P. 267–274.
Queirós M.V.A., Loh W. Preparation of poly(acrylate)/poly(diallyldimethylammonium) coacervates without small counterions and their phase behavior upon salt addition towards poly-ions segregation // Polymers. 2021. V. 13. № 14. P. 2259.
Pochard I., Couchot P., Geffroy C., Foissy A., Persello J. Counterions contributions in polyelectrolyte adsorption // Rev. Inst. Francais Pétrole. 1997. V. 52. № 2. P. 251–253.
Vleugels L.F.W., Ricois S., Voets I.K., Tuinier R. Determination of the ‘apparent pKa’ of selected food hydrocolloids using ortho-toluidine blue // Food Hydrocoll. 2018. V. 81. P. 273–283.
Anufrieva E.V., Birshtein T.M., Nekrasova T.N., Ptitsyn O.B., Sheveleva T.V. The models of the denaturation of globular proteins. II. Hydrophobic interactions and conformational transition in polymethacrylic acid // J. Polym. Sci. 1967. № 16. P. 3519.
Yoshida K., Dubin P.L. Complex formation between polyacrylic acid and cationic/nonionic mixed micelles: Effect of pH on electrostatic interaction and hydrogen bonding // Colloids and Surfaces A: Physicochem. Eng. Aspects. 1999. V. 147. P. 161–167.
Kabanov V.A. Physical and chemical foundations and prospects for the use of soluble interpolyelectrolyte complexes // Polym. Sci. 1994. V. 36. № 2. P. 183.
Izumrudov V.A., Parashchuk V.V., Sybachin A.V. Unusual behavior of saline solutions of polyelectrolyte complexes containing guest oligomers // Polym. Sci. Ser. B. 2006. V. 48. № 2. P. 78–79.
Alfei S., Schito A.M. Positively charged polymers as promising devices against multidrug resistant Gram-negative bacteria: A review // Polymers. 2020. V. 12. № 5. P. 1195.
Pan Y., Xia Q., Xiao H. Cationic polymers with tailored structures for rendering polysaccharide-based materials antimicrobial: An overview // Polymers. 2019. V. 11. № 8. P. 1283.
Qiu H., Si Z., Luo Y., Feng P., Wu X., Hou W., Zhu Y., Chan-Park M.B., Xu L., Huang, D. The mechanisms and the applications of antibacterial polymers in surface modification on medical devices // Front. Bioeng. Biotechnol. 2020. V. 8. P. 910.
Pigareva V.A., Marina V.I., Sybachin A.V. Biocide coating from polydiallyldimethylammonium chloride. What molecular weight should we choose? // Ph-yschem. 2023. V. 3. P. 147–155.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал