Координационная химия, 2019, T. 45, № 1, стр. 3-12
Синтез, спектральные исследования и квантово-химическое моделирование строения комплексных соединений Co(II), Ni(II), Cu(II) с (Z)-10-(2-(4-амино-5-тиоксо-4,5-дигидро-1Н-1,2,4-триазол-3-ил)гидразоно)-9-фенантрономР. В. Линко, Н. А. Полянская, М. А. Рябов, В. С. Сергиенко, П. В. Страшнов, В. В. Давыдов, Г. М. Дрогова
Р. В. Линко 1, *, Н. А. Полянская 1, М. А. Рябов 1, В. С. Сергиенко 2, П. В. Страшнов 3, В. В. Давыдов 1, Г. М. Дрогова 1
1 Российский университет дружбы народов
, Москва, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
, Москва, Россия
3 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
, Москва, Россия
* E-mail: rlinko@mail.ru
Поступила в редакцию 05.02.2018
После доработки 15.06.2018
Принята к публикации 07.05.2018
Аннотация
Синтезированы и изучены комплексы (Z)-10-(2-(4-амино-5-тиоксо-4,5-дигидро-1Н-1,2,4-триазол-3-ил)гидразоно)-9-фенантрона (HL) с солями Co(II), Ni(II) и Cu(II) состава [CoLAcДМФА] (I), [NiLAcДМФА] (II), [CuL(Н2О)]ClO4 (III) и [CuLAc] (IV). При титровании раствора HL в ДМФА водными растворами CoAc2, NiAc2, Cu(ClO4)2, CuAc2, Cd(NO3)2, ZnSO4 в ЭСП наблюдается батохромный сдвиг длинноволновой полосы поглощения на 35–77 нм. По результатам титрования определены константы образования и состав комплексов в растворах. На основании расчетов методом DFT и спектральных данных высказано предположение о строении комплексов I–IV: лиганд, находясь в депротонированной форме тионного таутомера, координируется катионами металлов через атом кислорода карбонильной группы, атомы азота гидразо- и аминогрупп с образованием двух металлоциклов – шестичленного и пятичленного (6 + 5); координационный узел достраивается ацетат-ионом и молекулой ДМФА (в I и II), ацетат-ионом (в IV) или молекулой Н2О (в III).
Металлосодержащие соединения гетероциклических азопроизводных 9,10-фенантренхинона могут применяться в качестве красителей для синтетических волокон [1], цветной печати [2], а также носителей для записи и хранения информации [3] и остаются малоизученными.
Строение некоторых гетероциклических азопроизводных 9,10-фенантренхинона, содержащих фрагменты 3,3-диметил-3,4-дигидроизихинолина (HL1) [4], бензотиазола (HL2) [5] и фталазина (HL3) [6] было рассмотрено ранее.
Эти соединения представляют интерес для координационной химии, поскольку содержат несколько электронодонорных центров и способны образовывать с d-металлами разные по составу комплексные соединения, которые могут обладать новыми полезными свойствами. Каждый из этих лигандов, находясь в анионной форме, присоединяется к атому металла N,N,O-тридентатно-хелатным способом с замыканием двух пятичленных (5 + 5) металлоциклов и образованием комплексов состава 1 : 2 для Co(II), Ni(II), Cd(II) [6–9] и состава 1 : 1 для Cu(II) [10, 11].
Различные производные, содержащие 1,2,4-триазольный цикл, обладают широким спектром биологической активности и представляют интерес для получения новых лекарственных форм. Они используются для борьбы с ВИЧ и в качестве противогрибковых препаратов [12, 13], противовоспалительных [14, 15] и антибактериальных средств [16], а также как агонисты бензодиазепиновых рецепторов [17]. Производные 4-амино-4Н-1,2,4-триазол-3-тиола взаимодействуют с солями переходных металлов, входя в состав металлокомплексов в нейтральной тионной форме и образуя хелатные связи с участием атомов азота аминогруппы и атома серы [18].
Настоящее исследование – продолжение работ [4–11], цель которого – получение, изучение строения и свойств комплексных соединений Co(II), Ni(II) и Cu(II) с новым азопроизводным 9,10-фенантренхинона, содержащим аминомеркапто-4Н-1,2,4-триазол в качестве гетероциклической составляющей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез СoLАс · ДМФА (I), NiLАс · ДМФА (II), CuLClO4 · H2O (III) (L– = анион (Z)-10-(2-(4-амино-5-тиоксо-4,5-дигидро-1Н-1,2,4-триазол-3-ил)гидразоно)-9-фенантрона). К свежеприготовленному раствору 0.297 ммоль HL [19] в 20 мл ДМФА добавляли при перемешивании небольшими порциями 0.297 ммоль соли соответствующего металла (CoAc2 · 4H2O, NiAc2 · 4H2O, Cu(ClO4)2 · 6H2O) в 5 мл ДМФА и выдерживали на водяной бане при ~90°С 2 ч. Реакционную смесь охлаждали до комнатной температуры и оставляли на сутки. Образовавшиеся осадки отфильтровывали на стеклянном фильтре Шотта, промывали этанолом, водой и высушивали при пониженном давлении до постоянной массы.
Синтез CuLAc (IV). К свежеприготовленному раствору 0.149 ммоль HL в 10 мл ДМФА приливали 1 мл концентрированного раствора NH3, после чего при перемешивании небольшими порциями добавляли раствор 0.149 ммоль CuAc2 · H2O в 3 мл ДМФА и выдерживали реакционную смесь на водяной бане при ~90°С 3 ч. Реакционную смесь охлаждали до 8°С и оставляли на 3 сут. Образовавшийся осадок отфильтровывали на стеклянном фильтре Шотта, промывали этанолом, водой и высушивали при пониженном давлении до постоянной массы.
Данные элементного анализа, ИК-спектроскопии и ЭСП соединений I–IV, а также результаты изучения процессов комплексообразования в растворах приведены в табл. 1.
Таблица 1.
Состав, данные элементного анализа, ИК-спектроскопии и ЭСП соединений I–IV, а также результаты титрования HL солями некоторых d‑металлов
| Соеди-нение | Брутто-формула (цвет кристаллов, выход, %) |
Элементный анализ, %, найдено (вычислено) |
ИК-спектр ν, см–1 |
ЭСП λmax, нм | Титрование HL солями металлов | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| C | H | N | S | M | ЭСП λmax, нм (lg ε) | lg β | M2+ : L | ||||
| I | C21H21N7O4SCo (зеленые, 57.30) |
47.72 (47.93) |
4.74 (3.99) |
18.49 (18.62) |
5.86 (6.09) |
10.90 (11.20) |
1673 ср 1607 сл 1564 сл 1535 сл 1507 сл |
511 | 5092 (4.16) | 6.08 | 1 : 1 |
| II | C21H21N7O4SNi (фиолетовые, 42.50) |
47.78 (47.95) |
4.55 (3.99) |
18.29 (18.63) |
5.87 (6.10) |
10.83 (11.16) |
1677 сл 1639 сл 1540 сл 1528 сл |
542 | 5621 (4.11) 5442 (4.23) |
6.29 | 1 : 1 |
| III | C16H13N6O6SClCu (фиолетовые, 54.70) |
38.67 (37.23) |
2.66 (2.52) |
16.87 (16.27) |
6.37 (6.21) |
12.15 (12.31) |
1626 cл 1576 сл 1514 сл |
549 | 5461 (4.09) 5322 (4.20) |
6.17 | 1 : 1 |
| IV | C18H14N6O3SCu (фиолетовые, 71.98) |
46.84 (47.23) |
3.65 (3.06) |
18.06 (18.35) |
6.95 (7.00) |
13.69 (13.88) |
1639 ср 1589 сл 1564 сл 1540 сл 1511 сл |
539 | 5391 (4.07) | 6.87 | 1 : 1 |
ИК-спектры регистрировали на ИК-Фурье-спектрометре Infralum FT-801 в кристаллическом состоянии (таблетки KBr) в диапазоне 4000–400 см–1. Точность определения частот, зависящая от полуширины полос, составляет ±0.1 см–1.
ЭСП растворов I–IV в ДМФА снимали на спектрофотометре Varian Cary 50 Scan в кварцевых кюветах толщиной 1.0 см. На основании результатов спектрофотометрического титрования HL (с = = 3.4–3.5 × 10–5 моль/л) растворами соответствующих солей металлов (с = 2.0–2.4 × 10–3 моль/л) по методу насыщения [20] рассчитывали константы образования и состав комплексов в растворах (табл. 1).
Квантово-химическое моделирование электронной структуры молекул комплексов проводили в рамках приближения теории функционала плотности с использованием гибридного трехпараметрического обменного функционала Беке [21] с корреляционным функционалом Ли–Янга–Парра [22] (B3LYP) [23] и базисного набора def2-SV(P) и def2-TZVP [24]. Для анализа электронной структуры основного состояния молекул лигандов и комплексов применяли подход естественных связывающих орбиталей (NBO) [25]. Все вычисления проводили средствами программного комплекса Firefly 7.1.G [26].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
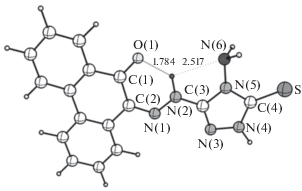
Молекула HL (рис. 1) содержит два “подвижных” атома водорода, что предполагает потенциальную возможность наличия для нее как азо-гидразонной, так и тион-тиольной таутомерии [19]. Наиболее вероятной формой нахождения HL в кристаллическом состоянии и в насыщенных растворах является форма тионного хинонгидразонного таутомера, стабилизированного внутримолекулярной водородной связью О(1)···H–N(2), что, однако, не исключает изменение таутомерной формы в разбавленных растворах и в процессе комплексообразования.
Наличие в молекуле HL нескольких электронодонорных атомов дает возможность координироваться к d-металлам различными способами. С одной стороны, молекула HL, аналогично HL1, HL2 и HL3 [7–11], находясь в анионной форме и изменив свою изомерную форму, может взаимодействовать с катионом металла через атомы О(1), N(1) и N(3) с образованием двух пятичленных металлоциклов. С другой стороны, наличие в HL группы NН2 и атома S, которые отсутствовали в HL1, HL2 и HL3, предполагает два новых способа координации металлов: в анионной форме – с образованием пятичленного и шестичленного или шестичленного и пятичленного металлоциклов с участием, соответственно, атомов О(1), N(1) или N(2) и N(6), в нейтральной форме – с участием атомов S и N(6) и образованием пятичленного металлоцикла, как показано для соединения, содержащего аминомеркапто-4Н-1,2,4-триазольный фрагмент [18, 27].
При взаимодействии HL с солями Co(II), Ni(II) и Cu(II) получены в кристаллическом состоянии комплексные соединения СoLАсДМФА, NiLАсДМФА, CuL(Н2О)(ClO4) и CuLAc, состав и строение которых установлены на основании данных элементного анализа, ИК- и электронной спектроскопии, квантово-химических расчетов методом DFT.
С целью изучения процесса комплексообразования в растворах выполнено спектрофотометрическое титрование HL солями некоторых d-металлов по методу насыщения, которое позволяет определить максимумы длинноволновой полосы поглощения (ДПП), константы образования и состав комплексов в растворах. Поскольку ЭСП соединения HL в растворе претерпевает изменения с течением времени (максимум ДПП свежеприготовленного раствора 485 нм смещается гипсохромно до 474 нм после выдерживания его 48 ч [19]), проведено изучение процесса комплексообразования для обоих случаев (табл. 1).
При титровании свежеприготовленного раствора HL (λmax = 485 нм) в ДМФА водными растворами NiAc2, Cu(ClO4)2, CuAc2, Cd(NO3)2, ZnSO4 (рис. 2, 3) наблюдается батохромный сдвиг ДПП на 77, 61, 54, 46 и 48 нм соответственно, а при титровании выдержанного 48 ч раствора HL (λmax = = 474 нм) растворами CoAc2, NiAc2 и Cu(ClO4)2 в ЭСП (рис. 4) наблюдается аналогичный сдвиг ДПП на 35, 70 и 58 нм соответственно. Необходимо отметить, что во всех ЭСП наблюдается одна изобестическая точка, наличие которой свидетельствует о присутствии в исследуемых растворах двух форм – свободного лиганда и лиганда в составе комплекса, а также практически во всех случаях наблюдается значительный рост интенсивности ДПП. Можно утверждать, что наблюдаемый характер изменения ЭСП обусловлен процессами комплексообразования, а поскольку аналогичное изменение ЭСП наблюдалось при титровании HL раствором NaOH [19], то это свидетельствует о вхождении лиганда в состав комплексов в депротонированной форме.
Рис 2.
ЭСП, полученные по результатам титрования свежеприготовленного раствора HL (с = 3.4 × 10–5 моль/л, линия 1) раствором Ni(Ac)2 (с = 2.0 × 10–3 моль/л, линии 2–10) (а); раствором Cu(ClO4)2 (с = 2.0 × 10–3 моль/л, линии 2–18) (б).
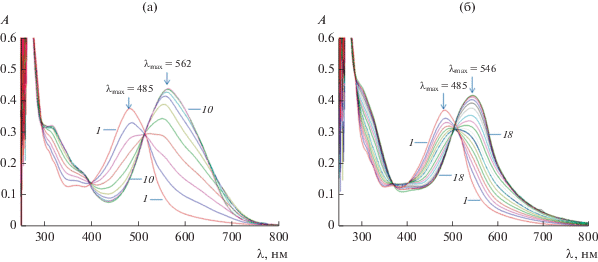
Рис. 3.
ЭСП, полученные по результатам титрования свежеприготовленного раствора HL (с = 3.4 × 10–5 моль/л, линия 1) раствором Cd(NO3)2 (с = 2.05 × 10–3 моль/л, линии 2–10) (а); раствором ZnSO4 (с = 2.4 × 10–3 моль/л, линии 2–10) (б).
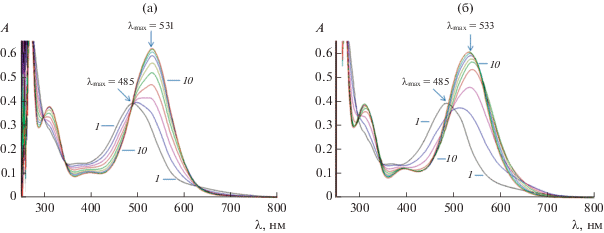
Рис. 4.
ЭСП, полученные по результатам титрования выдержанного 48 ч раствора HL (с = 3.52 × 10–5 моль/л, линия 1) раствором Ni(Ac)2 (с = 2.0 × 10–3 моль/л, линии 2–6) (a); раствором Cu(ClO4)2 (с = 2.0 × 10–3 моль/л, линии 2–11) (б).
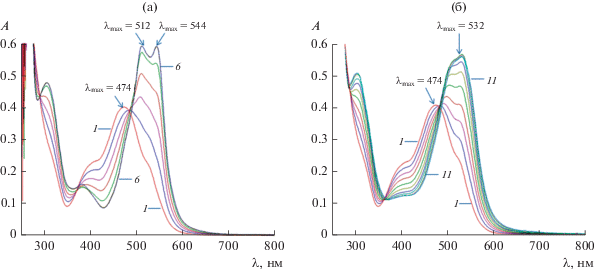
Анализ кривых насыщения позволил определить значения констант образования, а также состав комплексов в растворах (табл. 1). Установлено, что при титровании HL солями Co(II), Ni(II) и Cu(II) в растворе образуются комплексы состава 1 : 1, что согласуется с составом полученных комплексов I–IV, при титровании солями Cd(II) и Zn(II) в растворе образуются комплексы с соотношением металл : лиганд 1 : 2, которые, однако, не удалось выделить в кристаллическом состоянии. Ранее показано [8], что HL2, отличающийся от HL только гетероциклическим фрагментом, в растворах и в кристаллическом состоянии образует комплексы 1 : 2 с солями Co(II), Ni(II), Cd(II) и Zn(II), но только с солями Cu(II) наблюдается различие: в кристаллическом состоянии образует комплексы 1 : 2, в растворах присутствуют комплексы 1 : 1 и 1 : 2.
Положения ДПП в ЭСП комплексов I–IV, выделенных в кристаллическом состоянии, и комплексов, образующихся в растворах при титровании HL солями Co(II), Ni(II), Cu(II), приведены в табл. 1. Следует обратить внимание на то, что для синтеза комплексных соединений I–IV использованы свежеприготовленные растворы HL, однако положение ДПП в ЭСП комплексов I и II соответствует положению ДПП при титровании выдержанного 48 ч раствора HL солями Co(II), Ni(II), чего не наблюдается для комплексов с Cu(II) – III и IV, для которых ДПП в ЭСП соответствует титрованию свежеприготовленного раствора HL.
Возможная причина наблюдаемого различия может состоять в том, что НL в кристаллической форме и в концентрированных растворах существует в димерной “сэндвичеобразной” форме [28], в которой молекулы НL и НL' связаны π–π-стекинг взаимодействием по типу PD (parallel – displaced) [29], в разбавленных растворах – в мономерной форме. Предположение о переходе из димерной формы в мономерную объясняет гипсохромный характер изменения ЭСП соединения HL во времени. Наблюдаемое различие в ЭСП комплексов можно объяснить тем, что в состав I и II лиганд входит в мономерной форме, в состав III и IV – в димерной, как для димерного комплекса [Cu2(L3)2(H2O)4](ClO4)2 [10]. В этой связи строение комплексов III и IV можно описать формулами [Cu2L2(Н2О)2](ClO4)2 и [Cu2L2Ac2].
В ИК-спектрах выделенных комплексных соединений I–IV в поликристаллическом состоянии при ~3430 см–1 сохраняется широкая интенсивная полоса, отнесенная в случае HL к валентным колебаниям группы N(4)–H, и отсутствуют полосы, отнесенные в [19] к валентным колебаниям групп N(2)–H и NH2, связанной внутримолекулярной водородной связью. Характерная для HL полоса ν(С=О) 1618 см–1 отсутствует, полосы с максимумами поглощения в области 1573–1501 см–1, относящиеся к колебаниям связей C=N и C=C, немного сдвигаются относительно HL в низкочастотную область с одновременным перераспределением их относительной интенсивности. В состав комплексных соединений I и II входят молекулы ДМФА, что подтверждается наличием в их ИК-спектрах полосы ν(С=О) 1677 см–1, характерной для координированной молекулы ДМФА [30]. Наличие в ИК-спектрах соединений I, II и IV полос средней интенсивности при 1639 см–1, которые можно отнести к валентным колебаниям координированной карбоксильной группы ацетат-аниона, позволяет предположить, что ацетат-ион достраивает внутреннюю координационную сферу Co(II), Ni(II) и Cu(II) в этих комплексах.
Данные элементного анализа указывают на то, что лиганд входит в состав комплекса в анионной форме. Анализ распределения электронной плотности в молекуле HL указывает на смещение 0.166 ē с триазольного фрагмента на гидразогруппу. Это уменьшает донорные свойства атомов триазольного фрагмента и делает координацию нейтральной молекулы HL с участием атомов S и N(6) маловероятной.
Для определения наиболее вероятного способа координации L– катионами металлов мы выполнили квантово-химический расчет строения модельного комплекса ZnLAс · ДМФА (V). Состав этого комплекса аналогичен выделенным комплексам I и II, однако сам подобный комплекс выделен не был. На рис. 5 приведено молекулярное строение возможных форм комплекса V и их относительные энергии в кДж/моль.
Рис. 5.
Молекулярное строение некоторых форм комплекса V (a–г) и их относительные энергии (кДж/моль).
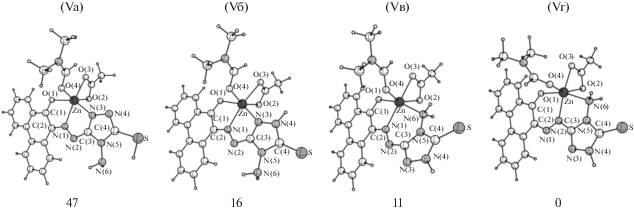
В первых двух комплексах Vа и Vб лиганд в анионной форме играет роль тридентатного лиганда и координируется катионом металла через атомы O(1), N(1) и N(3) с образованием двух пятичленных металлоциклов, как это имело место ранее [7–11]. Комплекс Vб, в котором лиганд находится в тионной форме, более устойчив, чем комплекс Vа, в котором лиганд имеет тиольную форму. Можно предположить, что в комплексах с другими металлами лиганд HL будет присутствовать в анионной форме тионного таутомера. Однако HL имеет возможность координироваться не только через атом азота N(3) гетероциклического фрагмента [7–11], но и через атом азота N(6) аминогруппы. При этом также образуются два металлоцикла: пятичленный и шестичленный. Наиболее устойчивая форма Vг, в которой атом О(1) участвует в шестичленном металлоцикле, а атом N(6) – в пятичленном.
В рассчитанных комплексах (Vа–Vг) координационный полиэдр цинка – искаженный октаэдр. При этом анион L– тридентатный, ацетат-ион бидентатный, ДМФА – монодентатный лиганд (рис. 5).
Моделирование строения выделенного комплекса CoLAc · ДМФА (VI), помимо выбора оптимальной схемы координации, включает и выбор спинового состояния иона кобальта в комплексе. Здесь возможны два варианта: высокоспиновый комплекс с мультиплетностью 4 и низкоспиновый с мультиплетностью 2. Высокоспиновый комплекс на 31 кДж/моль устойчивее низкоспинового. Аналогично для комплекса NiLAc · ДМФА: высокоспиновый комплекс с мультиплетностью 3 на 41 кДж/моль устойчивее, чем низкоспиновый с мультиплетностью 1. Из значений энергий следует, что высокоспиновые комплексы кобальта и никеля более устойчивы, чем низкоспиновые, и можно предположить, что синтезированные комплексы I и II имеют строение, приведенное на рис. 6.
Рис. 6.
Молекулярное строение комплексов CoLAc · ДМФА (VIа) и NiLAc · ДМФА (VIб) по данным расчета методом DFT.
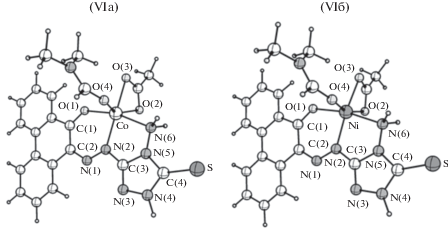
В высокоспиновых комплексах кобальта и никеля координационный полиэдр металла – искаженный октаэдр. При этом анион L– тридентатный, ацетат-ион бидентатный, ДМФА – монодентатный лиганд (рис. 6).
Комплекс меди IV имеет состав CuLAc, т.е. в составе комплекса нет молекулы ДМФА. В этой связи мы выполнили расчет как для комплекса CuLAc (рис. 7а), так и для CuLAc · ДМФА (рис. 7б), аналогичного ранее рассмотренным комплексам никеля и кобальта.
Рис. 7.
Молекулярное строение комплексов CuLAc (VIIа), CuLAc · ДМФА (VIIб) и CuLClO4 · H2O (VIIв) по данным расчета методом DFT.
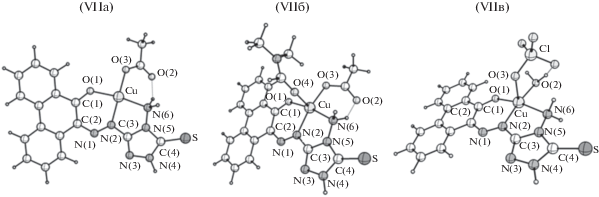
В расчетном комплексе CuLAc (VIIа) координационный полиэдр меди – искаженный квадрат. При этом анион L– является тридентатным, а ацетат-ион – монодентатный лиганд. В модельном комплексе CuLAc · ДМФА (VIIб) координационным полиэдром меди является вытянутая тетрагональная пирамида, в которой расстояние между атомом Cu и атомом O(4) ДМФА (2.302 Å) больше, чем в случае октаэдрических комплексов кобальта (2.166 Å) и никеля (2.132 Å) (рис. 6). Можно полагать, что отмеченное в расчете для газовой фазы ослабление связи меди с молекулой ДМФА приводит к ее отрыву и образованию в твердой фазе характерного для меди квадратного комплекса.
Выделенный нами комплекс меди III имеет состав CuLClO4 · H2O. Расчет этого комплекса (рис. 7в) показывает, что координационный полиэдр меди – вытянутая тетрагональная пирамида, в которой расстояние между металлом и атомом кислорода перхлорат-иона (2.284 Å) заметно больше, чем расстояния между атомом меди и атомами O(1), O(2), N(2), N(6) (табл. 2). Наличие слабой связи перхлорат-иона с металлом, несмотря на наличие водородной связи (1.760 Å) между атомом водорода аминогруппы и одним из атомов кислорода перхлорат-иона (рис. 7в), может привести к выходу перхлорат-ион из внутренней сферы комплекса III, которому можно приписать следующий состав [CuL(H2O)]ClO4. В этом случае координационный полиэдр меди – искаженный квадрат. Аналогичная ситуация наблюдалась для рассчитанного комплекса CuLAc · ДМФА, где есть слабая связь между атомом меди и атомом кислорода ДМФА, а выделенный комплекс IV не содержал молекул ДМФА. Вывод о том, что перхлорат-ион находится во внешней сфере комплекса III, согласуется с данными о строении комплекса [Cu2(L3)2(H2O)4](ClO4)2 [10]. На основании выше сказанного можно предположить, что и комплексы III и IV имеют димерное строение: [Cu2L2(Н2О)2](ClO4)2 и [Cu2L2Ac2].
Таблица 2.
Длины некоторых связей (Å) в молекуле HL и в комплексах CoLAc · ДМФА, NiLAc · ДМФА, CuLAc и CuLClO4 · H2O по данным расчета методом DFT
| Связь | Молекула | ||||
|---|---|---|---|---|---|
| HL | CoLAc · ДМФА | NiLAc · ДМФА | CuLAc | CuLClO4 · H2O | |
| M–O(1)* | 2.028 | 2.011 | 1.952 | 1.941 | |
| M–O(2) | 2.118 | 2.115 | 2.024 | ||
| M–O(3) | 2.168 | 2.096 | 1.924 | 2.284 | |
| M–O(4) | 2.166 | 2.132 | |||
| M–N(2) | 2.072 | 2.036 | 1.979 | 1.963 | |
| M–N(6) | 2.248 | 2.179 | 2.086 | 2.139 | |
| O(1)–C(1) | 1.239 | 1.263 | 1.262 | 1.265 | 1.268 |
| C(1)–C(2) | 1.481 | 1.451 | 1.453 | 1.455 | 1.454 |
| C(2)–N(1) | 1.312 | 1.334 | 1.336 | 1.328 | 1.328 |
| N(1)–N(2) | 1.314 | 1.293 | 1.289 | 1.289 | 1.282 |
| N(2)–C(3) | 1.375 | 1.378 | 1.375 | 1.382 | 1.380 |
| C(3)–N(3) | 1.302 | 1.306 | 1.306 | 1.302 | 1.301 |
| C(3)–N(5) | 1.382 | 1.387 | 1.389 | 1.384 | 1.384 |
| N(3)–N(4) | 1.372 | 1.371 | 1.371 | 1.371 | 1.370 |
| N(4)–C(4) | 1.360 | 1.363 | 1.362 | 1.368 | 1.367 |
| C(4)–N(5) | 1.395 | 1.387 | 1.387 | 1.391 | 1.391 |
| N(5)–N(6) | 1.382 | 1.385 | 1.386 | 1.384 | 1.386 |
| C(4)–S | 1.659 | 1.660 | 1.660 | 1.653 | 1.653 |
Рассчитанные длины некоторых связей в молекулaх HL, CoLAc · ДМФА, NiLAc · ДМФА, CuLAc и CuLClO4 · H2O приведены в табл. 2, рассчитанные заряды некоторых атомов в этих молекулах – в табл. 3.
Таблица 3.
Рассчитанные NBO заряды на атомах в молекуле HL и в комплексах CoLAc · ДМФА, NiLAc · ДМФА, CuLAc и CuLClO4 · H2O по данным расчета методом DFT
| Атом | Молекула | ||||
|---|---|---|---|---|---|
| HL | CoLAc · ДМФА | NiLAc · ДМФА | CuLAc | CuLClO4 · H2O | |
| M* | +1.482 | +1.433 | +1.261 | +1.289 | |
| O(1) | –0.613 | –0.736 | –0.725 | –0.698 | –0.710 |
| O(2) | –0.787 | –0.762 | –0.714 | –0.960 | |
| O(3) | –0.793 | –0.802 | –0.825 | –0.895 | |
| O(4) | –0.740 | –0.734 | |||
| C(1) | +0.511 | +0.498 | +0.503 | +0.508 | +0.513 |
| C2) | +0.114 | +0.077 | +0.070 | +0.088 | +0.088 |
| N(1) | –0.199 | –0.188 | –0.182 | –0.165 | –0.148 |
| N(2) | –0.385 | –0.498 | –0.478 | –0.493 | –0.458 |
| C(3) | +0.614 | +0.607 | +0.607 | +0.599 | +0.601 |
| N(3) | –0.334 | –0.326 | –0.326 | –0.318 | –0.311 |
| N(4) | –0.383 | –0.379 | –0.379 | –0.380 | –0.377 |
| C(4) | +0.217 | +0.221 | +0.221 | +0.214 | +0.213 |
| S | –0.233 | -0.239 | –0.240 | –0.199 | –0.195 |
| N(5) | –0.292 | -0.289 | –0.291 | –0.295 | –0.293 |
| N(6) | –0.637 | -0.684 | –0.683 | –0.729 | –0.705 |
Рассчитанные длины связей металла с атомами O(1), O(2), O(3), O(4), N(2) и N(6) в комплексах кобальта и никеля (табл. 2) находятся в сравнительно узких пределах, при этом связи металла с атомом О(4) ДМФА короче, чем связи металла с атомами N(6). В этой связи можно заключить, что молекула ДМФА находится в комплексах I и II во внутренней сфере и они могут иметь формулы [CoLAc · ДМФА] и [NiLAc · ДМФА]. В ряду Co–Ni–Cu длины связей металла с атомами кислорода и азота несколько уменьшаются (табл. 2). Однако связь Сu с O(3) перхлорат-иона в комплексе CuLClO4 · H2O (2.284 Å) заметно длиннее других связей металла с гетероатомами, в частности длиннее связи Сu с O(2) воды (2.024 Å). Можно предположить, что во внутренней сфере комплекса находится молекула воды, а перхлорат- ион – во внешней сфере, удерживаясь водородными связями. Это и позволяет, как было сделано ранее, предложить для комплекса III формулу [CuL(H2O)]ClO4 или [Cu2L2(H2O)2](ClO4)2.
Рассчитанные заряды атомов металла лежат в пределах от +1.482 до +1.261 и заметно отличаются от значения +2, указывая на перенос электронной плотности с лигандов на катион металла (табл. 3). Значение переноса электронной плотности от моноаниона L– на катион металла равно 0.248, 0.279, 0.452 и 0.536 ē для четырех выделенных комплексов соответственно. При этом на атомах О(1), N(2) и N(6), непосредственно связанных с металлом, электронная плотность при координации существенно возрастает (табл. 3), а перенос плотности осуществляется за счет атомов, непосредственно с металлом не связанных, в том числе с атомов водорода.
Учитывая характер ИК-, электронных спектров, а также данные квантово-химического расчета, можно считать, что лиганд входит в состав комплекса в анионной форме, образуя координационные соединения состава 1 : 1. Согласно квантово-химическим расчетам методом DFT наиболее вероятно образование комплексных соединений, в которых атом металла координирован атомом О(1) с образованием шестичленного цикла и атомом N(6) с образованием пятичленного цикла (6 + 5). При этом координационный полиэдр в высокоспиновых комплексах никеля и кобальта – искаженный октаэдр, в медных комплексах – искаженный квадрат. Предположено вхождение лиганда в состав комплексов с медью в димерной “сэндвичеобразной” форме.
Публикация подготовлена при поддержке Программы РУДН “5-100”.
Список литературы
Wunderlich H., Wolfrum G. Patent FR 1.442.867, C09b/D06p, 1966.
Foster C.E., James R.A. Patent WO 2006/125951 A2, C09B 27/00, C09B 45/34, C09D 11/00, 30 November 2006.
Tosaki Y.I., Hosaka T.Y., Kunieda T.M. et al. Patent US 6.551.682 B1, B32B 3/02, 22 April 2003.
Давыдов В.В., Сокол В.И., Рычагина Н. В. и др. // Журн. неорган. химии. 2009. Т. 54. № 6. С. 958 (Davydov V.V., Rychagina N.V., Linko R.V. et al. // Russ. J. Inorg. Chem. 2009. V. 54. № 6. P. 893. doi 10.1134/S0036023609060126).
Давыдов В.В., Сокол В.И., Полянская Н.А. и др. // Кристаллография. 2012. Т. 57. № 2. С. 276 (Davydov V.V., Polyanskaya N.A., Linko R.V. et al. // Crystallogr. Rep. 2012. V. 57. № 2. P. 227. doi 10.7868/ S0044457X14010097).
Линко Р.В., Сокол В.И., Полянская Н.А. и др. // Журн. неорган. химии. 2013. Т. 58. № 3. С. 332 (Linko R.V., Polyanskaya N.A., Ryabov M.A. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 3. P. 284. doi 10.1134/ S0036023613030091).
Давыдов В.В., Сокол В.И., Рычагина Н.В. и др. // Журн. неорган. химии. 2011. Т. 56 № 5 С. 728 (Davydov V.V., Rychagina N.V., Linko R.V. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 5. P. 680. doi 10.1134/ S003602361105007X).
Линко Р.В., Сокол В.И., Полянская Н.А. и др. // Журн. неорган. химии. 2013. Т. 58. № 2. С. 178 (Linko R.V., Polyanskaya N.A., Ryabov M.A. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 2. P. 144. doi 10.1134/S0036023613020150)
Линко Р.В., Сокол В.И., Полянская Н.А. и др. // Кристаллография. 2013. Т. 58. № 3. С. 416 (Linko R.V., Polyanskaya N.A., Ryabov M.A. et al. // Crystallogr. Rep. 2013. V. 58. № 3. P. 427. doi 10.1134/ S1063774513030103).
Линко Р.В., Сокол В.И., Полянская Н.А. и др. // Журн. неорган. химии. 2014. Т. 59. № 1. С. 28 (Linko R.V., Polyanskaya N.A., Ryabov M.A. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 12. P. 1457. doi 10.1134/S0036023614010094).
Давыдов В.В., Сокол В.И., Рычагина Н.В. и др. // Журн. неорган. химии. 2014. Т. 59. № 9. С. 1158 (Davydov V.V., Rychagina N.V., Linko R.V. et al. // Russ. J. Inorg. Chem. 2014. V. 59. № 9. P. 927. doi 10.1134/ S0036023614090046).
Pandeya S.N., Sriram D., Nath G. et al. // Arzneimittelforschung. 2000. V. 50. № 1. P. 55. doi 10.1055/s-0031-1300164.
Holla B. S., Poojary K.N., Kalluraya B., and Gowda P.V. // Farmaco. 1996. V. 51. P. 793.
Labanauskas L., Kalcas V., Udrenaite E. et al. // Pharmazie. 2001. V. 56. № 8. P. 617.
Kamble P.N., Mote D.A., Chalke S.A. et al. // Intern. J. Univ. Pharm. Bio Sci. 2015. V. 4. № 4. P. 13.
Ulusoy N. G., Ergenc N., Otuk G., Kiraz M. // Boll. Chim. Farm. 2001. V. 140. № 6. P. 417.
Akbarzadeh T., Tabatabai S. A., Khoshnoud M. J. et al. // Bioorg. Med. Chem. 2003. V. 11. № 5. 769.
Haddad R., Yousif E., Ahmed A. // SpringerPlus. 2013. V. 2. P. 510. doi 10.1186/2193-1801-2-510
Полянская Н.А., Рябов М.А., Страшнов П.В. и др. // Изв. вузов. Химия и хим. технология. 2018. Т. 61. № 1. С. 55 (Polyanskaya N.A., Ryabov M.A., Strashnov P.V. et al. // Izv. Vyssh. Uchebn. Zaved. Kh-im. Khim. Tekhnol. 2018. V. 61. № 1. P. 55. doi 10.6060/ tcct.20186101.5677).
Бек М., Надьпал И. Исследование комплексообразования новейшими методами М.: Мир. 1989. 413 с.
Becke A.D. // J. Chem. Phys. 1993. V. 98. P. 5648.
Lee C., Yang W., Parr R.G. // Phys. Rev. B. 1988. V. 37. P. 785.
Stephens P.J., Devlin F.J., Chabalowski C.F., Frisch M.J. // J. Phys. Chem. 1994. V. 98. P. 11623.
Schaefer A., Huber C., Ahlrichs R. // J. Chem. Phys. 1994. V. 100. P. 5829.
NBO 5.G Madison (WI, USA): Theoretical Chemistry Institute, Univ. of Wisconsin, 2004. http:// www.chem. wisc.edu/~nbo5.
Granovsky A., Firefly version 7.1.G. http://classic.chem.msu.su/gran/firefly/index.html.
Yousif E., Haddad R., Ameer A.A. et al. // Eur. J. Chem. 2014. V. 5. № 4. P. 607.
Шаров К.С., Иванов В.М. // Вестн. Моск. ун-та. Сер. хим. 2003. Т. 44. № 6. С. 397.
Janiak C. // Dalton Trans. 2000. № 22. P. 3885.
Шундалов М.Б., Чибирай П.С., Комяк А.И. и др. // Журн. прикл. спектроскопии. 2011. Т. 78. № 3. С. 351 (Shundalau M. B., Chibirai P. S., Komyak A. I. et al. // J. Appl. Spectrosс. 2011. V. 78. № 3. P. 326).
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия