Координационная химия, 2019, T. 45, № 1, стр. 13-23
Синтез, кристаллическая структура и люминесцентные свойства координационных полимеров Zn и Cd на основе двух изомерных азиновых лигандовВ. Лозован, Э. Б. Коропчану, П. Н. Боурош, А. Мику, М. С. Фонарь
В. Лозован 1, 2, Э. Б. Коропчану 1, 2, *, П. Н. Боурош 2, 3, А. Мику 3, М. С. Фонарь 3, **
1 Институт химии
, Кишинев, Республика Молдова
2 Тираспольский государственный университет
, Кишинев, Республика Молдова
3 Институт прикладной физики
, Кишинев, Республика Молдова
* E-mail: ecoropceanu@yahoo.com
** E-mail: fonari.xray@phys.asm.md
Поступила в редакцию 20.01.2018
После доработки 15.06.2018
Принята к публикации 04.06.2018
Аннотация
Получены одномерные металл-органические координационные полимеры Zn(II) и Cd(II) состава: [{Zn(3-Bphz)(H2O)4}(3-Bphz)(NO3)2]n (I), [Zn(3-Bphz)I2]n (II), [Cd(3-Bphz)I2]n (III), [Cd(4-Bphz) (CH3COO)2(H2O)]n (IV) и [Cd(4-Bphz)(NO3)2(H2O)2]n (V), содержащие в качестве мостиковых лигандов азины N,N'-типа, 1,2-бис(пиридин-3-илметилен)гидразин (3-Bphz) и 1,2-бис(пиридин-4-илметилен)гидразин (4-Bphz). Состав и строение соединений подтверждены данными элементного анализа, ИК- и ЯМР-спектроскопии, а также монокристальным РСА (CIF files CCDC № 1812634–1812638 для I–V). Координационные полимеры I–III имеют зигзагообразную структуру. В I октаэдрическое окружение иона Zn2+ формируют два лиганда 3-Bphz и четыре молекулы воды. Во внешней сфере присутствуют нитрат-анионы и некоординированныe молекулы 3-Bphz. В изоморфных соединениях II и III тетраэдрическое окружение металла формируют два атома азота двух мостиковых лигандов 3-Bphz и два атома иода. Координационные полимеры IV и V имеют линейную структуру. В соединении IV координационный полиэдр иона Cd2+ – пентагональная бипирамида, две вершины которой заняты атомами азота двух молекул 4-Bphz, а экваториальную плоскость формируют два бидентатно-хелатных ацетат-аниона и молекула воды. В соединении V октаэдрическое окружение иона Сd2+ формируют две молекулы лиганда 4-Bphz, два монодентатных нитрат-аниона и две молекулы воды. Все комплексы – слабые люминофоры со свечением в сине-зеленой области спектра.
Координационные полимеры (КП) [1, 2], включая трехмерные координационные каркасы [3], являются одними из важнейших представителей полиядерных комплексов и остаются в центре внимания современной координационной химии. Наряду с другими исследователями, ранее, с целью получения дискретных биядерных координационных соeдинений и КП, мы применяли один из наиболее эффективных синтетических приемов, состоящий в объединении строительных блоков посредством мостиковых лигандов, в качестве которых выступали неорганические анионы [4], азотсодержащие ароматические дипиридиновые [5–7] или дикарбоксильные лиганды [8, 9]. Благодаря стабильности и полидентатности, N-донорные лиганды, содержащие в молекуле два и более функциональных атомов азота, широко используются при сборке КП разной размерности [10–16]. Последние обладают потенциально полезными свойствами, включающими катализ, оптическую активность, проводимость, люминесценцию, магнетизм, пористость [17–31]. Среди важнейших факторов, влияющих на размерность координационной сетки и топологию КП, следует отметить молекулярную структуру и дентатность органических лигандов, электронную конфигурацию и координационную емкость иона металла-комплексообразователя, природу растворителя, молярное соотношение металл : лиганд [23–35].
Наряду с трехмерными координационными каркасами [3], низкоразмерные (одно- и двумерные) КП, как объекты исследования материаловедения и инженерии кристаллов [36, 37], демонстрируют примеры молекулярных ферромагнетиков, синтетических проводников, нелинейно-оптических материалов и сегнетоэлектриков, чьи кристаллические структуры и полезные свойства можно варьировать путем подгонки составляющих их молекул [38, 39]. В литературе приведены примеры КП, содержащих в качестве мостиковых лигандов азины N,N'-типа, 1,2-бис(пиридин-3-илметилен)гидразин (3-Bphz) и 1,2-бис(пиридин-4-илметилен)гидразин (4-Bphz) [14, 17, 21–28]. Эти длинные ароматические молекулы с сопряженной системой чередующихся связей С=N и N–N, способны координировать ионы переходных металлов как атомами азота концевых пиридиновых, так и азиновых фрагментов [40], образуя новые КП, а также участвовать в водородных связях (ВС) в присутствии сильных протоно-донорных агентов [41]. Наряду с разнообразной архитектурой для КП Zn(II) и Cd(II) с этими лигандами в некоторых публикациях отмечены их люминесцентные свойства [17, 42, 43], причем для ряда соединений Cd(II) c 4-Bphz авторы демонстрируют корреляцию структура–свойство с учетом тонких эффектов упаковки [42].
В продолжение наших исследований по изучению КП Zn и Cd с люминесцентными свойствами [4, 44–46] мы осуществили синтез двух изомерных азиновых лигандов 3-Bphz и 4-Bphz по несколько модифицированной по сравнению с опубликованной методикой [26], а также получены четыре новых одномерных координационных полимера на их основе: [{Zn(3-Bphz)(H2O)4}(3-Bphz)(NO3)2]n (I), [Cd(3-Bphz)I2]n (II), [Zn(3-Bphz)I2]n (III), [Cd(4-Bphz)(CH3COO)2(H2O)]n (IV), изучено их строение и эмиссионные свойства. Депонированы также в Кембриджский банк структурных данных в виде CIF-файла улучшенные по сравнению с опубликованными ранее [17] результаты РСА для полученного по аналогичной методике одномерного КП [Cd(4-Bphz)(NO3)2(H2O)2]n(V).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез 3-Bphz. Навеску гидразин сульфата 6.5 г (0.05 моль) растворяли в 250 мл воды. Полученный раствор нагревали на магнитной мешалке до 70°C. К раствору добавляли 9.4 мл (0.1 моль) 3‑пиридинкарбоксальдегида. Далее добавляли раствор NaOH до нейтральной реакции и перемешивали еще ~2 ч. Полученную массу фильтровали, промывали водой для удаления сульфата натрия и растворяли в 50 мл этанола. Раствор оставляли для медленного испарения при комнатной температуре для кристаллизации. Выход ~70%.
ИК (ν, cм–1): 3087, 3038, 3012, 1625, 1586, 1571, 1511.
Синтез 4-Bphz проводили по аналогичной для 3-Bphz методике, заменив 3-пиридинкарбоксальдегид на 4-пиридинкарбоксальдегид. Выход ~70%.
ИК (ν, cм–1): 3072, 3054, 3038, 3030, 3018, 1628, 1594, 1551, 1496.
Синтез комплекса I. В 10 мл метанола растворяли при перемешивании 0.03 г (0.1 ммоль) Zn(NO3)2 · 6H2O. После растворения добавляли 0.042 г (0.2 ммоль) 3-Bphz. Смесь нагревали при 70°C в течение 5 мин на магнитной мешалке, затем добавляли 1 мл ДМФ. Полученный раствор фильтровали и оставляли для медленного испарения при комнатной температуре. После 2 нед. из раствора выпадали кристаллы желтого цвета, пригодные для РСА. Выход ~35%. Вещество растворимо в спиртах, ДМФ, ДМСО, воде.
ИК (ν, cм–1): 3085, 3039, 3021, 1627, 1595, 1578, 1412, 1395, 1227, 1223, 1033, 1029.
Синтез комплекса II. В 6 мл ДМФ растворяли 0.031 г (0.1 ммоль) ZnI2 с последующим добавлением 0.021 г (0.1 ммоль) 3-Bphz. Раствор перемешивали при 70°С в течение 10 мин, после чего раствор фильтровали и оставляли при комнатной температуре для кристаллизации. Через 3 нед. из раствора выпадали желтые кристаллы, которые отфильтровывали, промывали этанолом и сушили при комнатной температуре. Выход ~23%. Вещество нерастворимо в воде и спиртах, растворимо в ДМФ, ДМСО.
ИК (ν, cм–1): 3080, 3026, 1630, 1600, 1580.
Синтез комплекса III. В 4 мл воды растворяли 0.036 г (0.1 ммоль) CdI2, переносили раствор в пробирку и медленно добавляли пипеткой смесь 2 мл воды и этанола (1 : 1). После этого добавляли этанольный раствор (4 мл), содержащий 0.021 г (0.1 ммоль) 3-Bphz. Пробирку закрывали и оставляли при комнатной температуре. Через неделю в растворе образовывались кристаллы желтого цвета, которые отфильтровывали и высушивали при комнатной температуре. Выход ~30%. Вещество растворимо в ДМФ, ДМСО, нерастворимо в воде и спиртах.
ИК (ν, cм–1): 3083, 3024, 1629, 1597, 1578.
Синтез комплекса IV. В 10 мл этанола растворяли при перемешивании (70°C) 0.026 г (0.1 ммоль) Cd(CH3COO)2 · 2H2O. К раствору добавляли 0.021 г (0.1 ммоль) 4-Bphz, что сопровождалось выпадением осадка. После добавления 2 мл воды осадок растворялся, и раствор становился прозрачным. Полученный раствор фильтровали и оставляли для медленного испарения при комнатной температуре. Через неделю из раствора выпадали кристаллы желтого цвета, пригодные для РСА.
Выход ~42%. Вещество растворимо в ДМФ, ДМСО, нерастворимо в спиртах.
ИК (ν, cм–1): 3088, 3035, 1630, 1605, 1551, 1485, 1410, 681, 679.
Синтез комплекса V. В 10 мл метанола растворяли при перемешивании (70°C) 0.035 г (0.1 ммоль) Cd(NO3)2 · 6H2O. К раствору добавляли 0.021 г (0.1 ммоль) 4-Bphz, что сопровождалось выпадением осадка. После добавления 3 мл ДМФ осадок растворялся, и раствор становился прозрачным. Полученный раствор фильтровали и оставляли для медленного испарения при комнатной температуре. Через 3 нед. из раствора выпадали кристаллы желтого цвета, пригодные для РСА. Выход ~37%. Вещество растворимо в ДМФ, ДМСО, нерастворимо в спиртах.
ИК (ν, cм–1): 3099, 3043, 1652, 1611, 1558, 1423, 1386, 1342, 1304, 1021.
Состав и строение соединений установили на основе элементного анализа и данных ИК- и ЯМР-спектроскопии. ИК-спектры снимали на FT-IR Perkin-Elmer Spectrum100 спектрометре в вазелиновом масле в области 4000–400 см–1 и ATР в области 4000–650 cм–1. Спектры ЯМР записывали на спектрометре Bruker Avance III. Кристаллические структуры I–V установили методом монокристального РСА. Твердотельные спектры люминесценции записывали с использованием импульсного азотного лазера (λвозб = 337.1 нм) при 300°С. Длительность импульса возбуждения 15 нс, частота повторения 50 Гц, энергия импульса 0.2 мДж. Регистрировали излучение с помощью ФЭУ-79 (мультищелочной фотокатод, Sb(Na2K) с адсорбированным слоем цезия на поверхности, характеристика типа S20). Собственное время регистрирующей системы 20 нс. Длительность послесвечения (при 300°С) для всех исследуемых в работе соединений была меньше, чем временное разрешение регистрирующей системы.
РСА. Структурные данные для I–V получены при комнатной температуре на дифрактометрe Xcalibur ССD Oxford Diffraction (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор, ω‑сканирование). Параметры элементарных ячеек уточнены по всему массиву экспериментальных данных. Кристаллические структуры решены прямыми методами и уточнены методом наименьших квадратов в анизотропном полноматричном варианте для неводородных атомов (SHELX-97) [47]. Позиции атомов водорода молекул воды найдены из разностных синтезов Фурье, положения остальных атомов Н рассчитаны геометрически и уточнены изотропно в модели “жесткого тела”. Массив экспериментальных дифракционных данных для соединения II получен с немероэдрического двухкомпонентного двойникового кристалла. Разрешение двойникования выполнено в комплексе программ CrysAlisPro, матрица двойникования [0.9992 0.0148 0.0196–0.0255 0.9987 0.0093–0.0668–0.0162 1.0011], соотношение блоков 0.524 : 0.476. Уточнение проведено по набору F 2 структурных данных в формате SHELX HKLF 5. Кристаллографические данные и характеристики эксперимента для I–IV приведены в табл. 1, межатомные расстояния и валентные углы – в табл. 2. Позиционные и тепловые параметры для структур I–V депонированы в Кембриджском банке структурных данных (CCDC № 1812634–1812638; deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk).
Таблица 1.
Кристаллографические данные и характеристики эксперимента для соединений I–V
| Параметр | Значение | ||||
|---|---|---|---|---|---|
| I | II | III | IV | V | |
| М | 892.17 | 529.41 | 576.44 | 458.74 | 482.69 |
| Сингония | Триклинная | Pомбическая | Pомбическая | Pомбическая | Моноклинная |
| Пр. гр. | P1 | Pnma | Pnma | Pnna | P21/c |
| а, Å | 7.4374(7) | 8.5990(7) | 8.5789(3) | 8.4218(3) | 9.0563(5) |
| b, Å | 11.1666(7) | 15.7232(14) | 15.7532(7) | 13.5348(5) | 12.9302(5) |
| с, Å | 12.8277(9) | 11.4567(12) | 11.7425(5) | 16.5056(5) | 7.2618(4) |
| α, град | 102.093(6) | 90 | 90 | 90 | 90 |
| β, град | 93.377(7) | 90 | 90 | 90 | 90.282(5) |
| γ, град | 94.644(7) | 90 | 90 | 90 | 90 |
| V, Å3 | 1035.13(15) | 1549.0(3) | 1586.95(11) | 1881.42(11) | 850.35(7) |
| Z | 1 | 4 | 4 | 4 | 2 |
| ρ(выч.), г/см3 | 1.431 | 2.270 | 2.413 | 1.620 | 1.885 |
| μ, мм–1 | 0.666 | 5.563 | 5.259 | 1.194 | 1.342 |
| F(000) | 462 | 984 | 1056 | 920 | 480 |
| Размеры кристалла, мм | 0.4 × 0.18 × 0.18 | 0.3 × 0.08 × 0.03 | 0.36 × 0.22 × 0.20 | 0.42 × 0.42 × 0.36 | 0.36 × 0.10 × 0.05 |
| Область θ, град | 3.091–25.499 | 2.962–24.993 | 3.21–25.05 | 3.010–25.045 | 3.151–25.499 |
| Интервалы индексов отражений | –9 ≤ h ≤ 8 –13 ≤ k ≤ 13 –15 ≤ l ≤ 11 |
–8 ≤ h ≤ 10 –11≤ k ≤ 18 –13 ≤ l ≤ 6 |
–10 ≤ h ≤ 6 –7 ≤ k ≤ 18 –9 ≤ l ≤ 13 |
–10 ≤ h ≤ 5 –10 ≤ k ≤ 16 –19 ≤ l ≤ 14 |
–7 ≤ h ≤ 10 –15 ≤ k ≤ 14 –7 ≤ l ≤ 8 |
| Число измеренных/независимых рефлексов (Rint) | 5780/3835 (0.0248) | 2842/2842 | 3348/1447 (0.0223) | 4007/1654 (0.0226) | 2948/1567 (0.0222) |
| Число рефлексов с I > 2σ(I) | 3106 | 1406 | 1228 | 1281 | 1262 |
| Число уточняемых параметров | 290 | 92 | 92 | 122 | 130 |
| GOOF | 0.967 | 0.922 | 1.038 | 1.000 | 1.048 |
| R1, wR2 (I > 2σ(I)) | 0.0459, 0.1059 | 0.0534, 0.1156 | 0.0271, 0.0568 | 0.0288, 0.0764 | 0.0302, 0.0673 |
| R1, wR2 (весь массив) | 0.0621, 0.1148 | 0.1093, 0.1237 | 0.0358, 0.0605 | 0.0426, 0.0849 | 0.0417, 0.0725 |
| Δρmax/Δρmin, e Å–3 | 0.337/–0.296 | 1.273/–1.156 | 0.751/–0.796 | 0.341/–0.303 | 0.392/–0.340 |
Таблица 2.
Основные межатомные расстояния и валентные углы в соединениях I–IV*
| Cвязь | d, Å | Cвязь | d, Å |
|---|---|---|---|
| I | |||
| Zn(1)−O(4) | 2.0355(19) | Zn(1)−N(1) | 2.2081(19) |
| Zn(1)−O(5) | 2.097(2) | ||
| II | |||
| Zn(1)−N(1) | 2.087(9) | Zn(1)−I(1) | 2.557(3) |
| Zn(1)−I(2) | 2.544(2) | ||
| III | |||
| Cd(1)−N(1) | 2.311(3) | Cd(1)−I(2) | 2.6854(6) |
| Cd(1)−I(1) | 2.6954(6) | ||
| IV | |||
| Cd(1)−N(1) | 2.413(2) | Cd(1)−O(2) | 2.354(2) |
| Cd(1)−O(1) | 2.439(2) | Cd(1)−O(3) | 2.332(3) |
| Угол | ω, град | Угол | ω, град |
| I | |||
| O(4)Zn(1)O(5) | 88.40(9) | O(5)Zn(1)N(1) | 89.95(8) |
| O(4)Zn(1)N(1) | 89.37(7) | ||
| II | |||
| N(1)Zn(1)N(1)i | 99.0(5) | N(1)Zn(1)I(1) | 106.2(3) |
| N(1)Zn(1)I(2) | 109.4(3) | I(2)Zn(1)I(1) | 123.79(8) |
| III | |||
| N(1)Cd(1)N(1)i | 92.41(17) | I(2)Cd(1)I(1) | 134.51(2) |
| N(1)Cd(1)I(2) | 106.91(8) | N(1)Cd(1)I(1) | 104.12(8) |
| IV | |||
| O(3)Cd(1)O(2) | 85.50(5) | N(1)Cd(1)O(1)ii | 87.71(9) |
| O(3)Cd(1)N(1) | 83.71(6) | O(3)Cd(1)O(1) | 138.33(6) |
| O(2)Cd(1)N(1) | 87.54(9) | O(2)Cd(1)O(1) | 53.98(8) |
| N(1)Cd(1)O(2)ii | 91.47(9) | N(1)Cd(1)O(1) | 101.76(9) |
| O(2)Cd(1)O(1)ii | 134.86(8) | ||
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
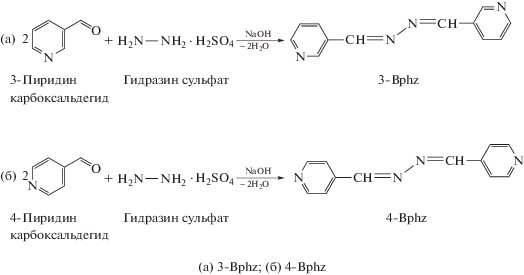
Лиганды 3-Bphz и 4-Bphz получали по реакции конденсации соответствующего пиридинкарбоксальдегида с гидразин сульфатом (схема 1). Структура полученных лигандов подтверждена ИК- и ЯМР-спектроскопией.
Cхема 1.
В ИК-спектрах лигандов 3-Bphz и 4-Bphz присутствуют полосы при 1625.8 и 1628.3 cм–1, соответствующие колебаниям ν(C=N)ar. В комплексе I присутствуют полосы, характерные для нитрат-анионов: 1412, 1395 νas(NO2); 1227, 1223 νs(NO2); 1029, 1033 cм–1 ν(NO). Полосы, обусловленные связанной группой ν(OH), проявляются при 3500–2800; а также имеются полосы при 3021, 3039, 3085ν(CH); 1627 ν(C=N)ar; 1595, 1578 cм–1 ν(C=C)ar. В ИК-спектрах II и III наблюдаются следующие полосы поглощения (cм–1): 1629 и 1630 ν(C=N)ar; 1597, 1578 и 1600, 1580 ν(C=C)ar; 3024, 3083 и 3026, 3080 ν(CH) соответственно. Для ацетат-ионов в спектре IV характерны полосы поглощения при 1605, 1551 νas(C–O); 1410, 1485 νs(C–O); 681, 679 cм–1 ν(O–C–O). К колебаниям ν(OH) связанной группы могут быть отнесены полосы при 3400–3000 cм–1. Полосы (cм–1): 3035, 3088 ν(CH); 1630 ν(C=N)ar; 1604 ν(C=C)ar относятся к мостиковому лиганду. В ИК-спектре соединения V присутствуют полосы (cм–1): 3500–2800 ν(OH) (связанная группа); 3043, 3099 ν(CH); 1652 ν(C=N)ar; 1611, 1558 ν(C=C)ar; 1423, 1386 νas(NO2); 1342, 1304 νs(NO2), а также 1021 ν(NO). Эти значения подтверждают, что нитрат-анион координирован монодентатно.
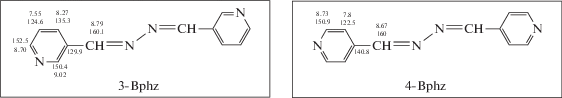
Различная точечная симметрия лигандов (Ci для 3-Bphz и Cs для 4-Bphz) определяет различия в их спектрах ЯМР 1H и 13С. Для лиганда 3-Bphz характерны пять сигналов, соответствующих пяти типам неэквивалентных атомов водорода: 8.79, 9.02, 8.70, 8.27 м.д. В спектре ЯМР 1H лиганда 4-Bphz регистрируются только три сигнала: 8.67, 7.80, 8.73 м.д. В спектре ЯМР 13C лиганда 3‑Bphz наблюдаются шесть характерных сигналов для шести типов неэквивалентных атомов углерода: 160.1, 129.9, 124.6, 124.6, 135.3. 150 м.д.; для лиганда 4-Bphz характерны четыре сигнала: 160, 140.8, 122.5, 150.9 м.д. ЯМР 1H и 13С сигналы 3-Bphz и 4-Bphz представлены на схемe 2:
Схема 2.
В спектре соединения IV имеются пять протонных сигналов, три из которых относятся к лиганду 4-Bphz, и никаких значительных смещений не наблюдается. Один сигнал относится к CH3-группе ацетат-аниона (1.83 м.д.). Сигнал для ЯМР 1H в молекуле воды, координированной к металлу, совпадает с сигналом воды в ДMСO-d (3.4 м.д.). В спектре ЯМР 13C присутствуют шесть углеродных сигналов – четыре при тех же значениях, что и в лиганде 4-Bphz и два характерных сигнала для атомов углерода ацетатного аниона: δ(CH3) 22.13 м.д. и δ(COО–) 178.39 м.д.
Для спектров ЯМР 1H и 13C соединений I–III, V существенных сдвигов сигналов по сравнению со значениями лигандов 3-Bphz и 4-Bphz не обнаружено.
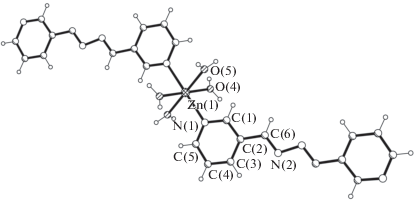
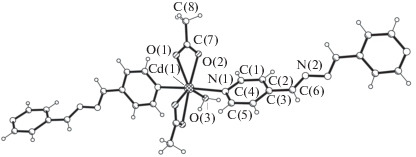
В состав соединения I помимо положительно заряженной полимерной цепочки [Zn(3-Bphz)(H2O)4$]_{n}^{{2 + }}$, фрагмент которой изображен на рис. 1, входят внешнесферные нитрат-анионы и сольватные молекулы 3-Bphz. Атом цинка и координированный лиганд 3-Bphz занимают позиции в центрах инверсии. Координационный полиэдр атома металла – искаженный октаэдр, образованный набором донорных атомов (N2О4), который формируют четыре молекулы воды, определяющие экваториальную плоскость, и два лиганда 3-Bphz, практически перпендикулярные к этой плоскости; двугранный угол между соответствующими плоскостями равен 87.46°. Расстояния Zn–N 2.208(2), Zn–О 2.036(2) и 2.097(2) Å (табл. 2). В полимерной цепочке расстояние между атомами цинка, разделенными бидентатно-мостиковым лигандом 3-Bphz, равно 14.44 Å.
В отличие от центросимметричного плоского лиганда, координированного к металлу, внешнесферная молекула 3-Bphz (в общем положении) характеризуется твист-конформацией с двугранным углом между пиридиновыми фрагментами, равным 38.81°. Причину этому следует искать в супрамолекулярной архитектуре кристалла, которая формируется за счет ВС ОН…N с участием координированных молекул воды и внешнесферных лигандов. Лиганды 3-Bphz присоединены к катионной полимерной цепочке по хелатному типу посредством двух ВС, O(4)–H(4A)···N(3) (x + 1, y, z) (O···N 2.713(3), H···O 1.87(2) Å, угол OHN 172(3)°); O(4)–H(4B)···N(6) (x, y, z – 1) (O···N 2.733(3), H···O 1.89(2) Å, угол ОHN 176(3)° (рис. 2а). В свою очередь, внешнесферные нитрат-анионы служат мостиками между соседними цепочками за счет ВС О–Н···О с координированными к металлу молекулами воды: O(5)–H(5A)···O(2) (О···О 2.840(3); H···O 2.01(2) Å, угол OHO 166(3)°); O(5)–H(5A)···O(3) (О···О 3.218(4); H···O 2.54(3) Å, угол OHO 138(3)°); O(5)–H(5B)···O(2) (1 – x, 2 – y, 1 – z) (О···О 3.102(4), H···O 2.47(3) Å, угол OHO 132(3)°), формируя таким образом супрамолекулярный 2D-слой (рис. 2б).
Рис. 2.
Фрагменты упаковки в соединении I: катионные координационные цепочки, окруженные внешнесферными лигандами 3-Bphz (а); объединение координационных цепочек в супрамолекулярный слой посредством внешнесферных нитрат-анионов; нефункциональные атомы водорода опущены (б).
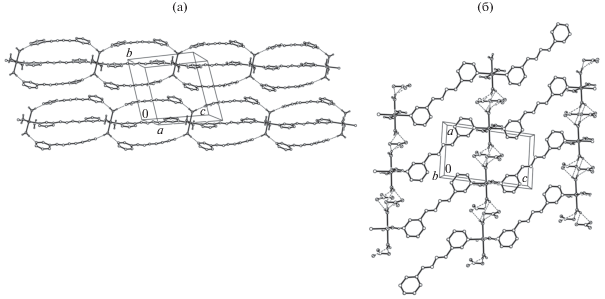
Из ближайших композиционных и структурных аналогов соединения I можно отметить моноядерный комплекс [Zn(NO3)2(H2O)2(3-Bphz)2] [48] и 1D-координационный полимер {[Zn(NO3)2 (H2O)(3-Bphz)] . H2O}n [49]. В обоих случаях азиновый лиганд занимает два координационных места в октаэдрическом полиэдре металла, в то время как четыре другие позиции заняты молекулами воды и нитрат-анионами в соотношении 2 : 2 в первом случае и 1 : 2 во втором.
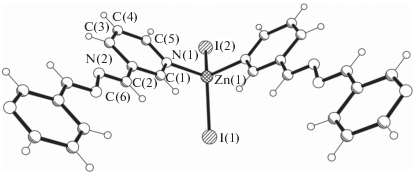
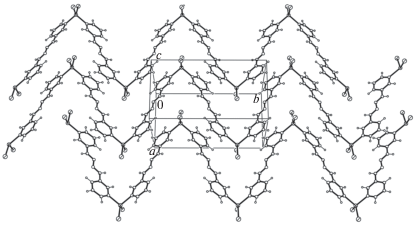
Изоморфные кристаллы соединений II и III различаются лишь катионом металла (рис. 3). Все компоненты занимают частные позиции: атом металла и иодид-анионы – на плоскости m, лиганд 3-Bphz – в центре инверсии. Тетраэдрическая конфигурация атома металла N2I2 формируется двумя иодид-анионами и двумя 3-Bphz лигандами (Zn–I 2.544(2) и 2.557(3), Zn–N 2.086(9) Å, соответствующие валентные углы находятся в интервале 106.2(3)°–123.79(8)°). В комплексе III наблюдается незначительное увеличение соответствующих расстояний, диктуемое бóльшим радиусом атома Cd в сравнении с Zn (табл. 2). Двугранный угол между плоскими координированными лигандами равен 72.09° в II и 76.26° в III.
Зигзагообразные координационные цепочки параллельны кристаллографической оси b кристаллов II, III (рис. 4), и расстояния между атомами металла, разделенными бидентатно-мостиковым лигандом 3-Bphz, равны 14.217 и 14.622 Å в II и III, соответственно. Антипараллельные цепочки пакуются вдоль кристаллографической оси а с существенным перекрыванием пиридиновых циклов лиганда, о чем свидетельствуют расстояния между центроидами этих циклов, равные 3.497 и 3.483 Å в II и III соответственно.
Кристаллы соединений II и III изоморфны ранее изученным соединениям Hg(II), [HgI2(3-Bphz)2]n и [HgBr2(3-Bphz)2]n [49, 50].
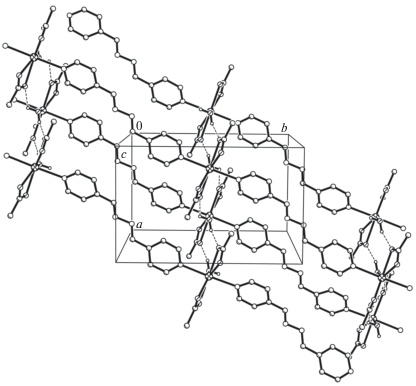
Cтруктура соединения IV 1D-цепочечная. Атом кадмия и молекула воды занимают позиции на двойной оси, проходящей также через середину связи N–N лиганда 4-Bphz. Координационный полиэдр атома кадмия – пентагональная бипирамида (рис. 5), в которой две аксиальные позиции занимают лиганды 4-Bphz, а в экваториальной плоскости располагаются молекула воды и два ацетат-аниона, координированные бидентатно-хелатным образом. Расстояния Cd–N 2.413(2), Cd–O 2.332(3)–2.439(2) Å (табл. 2). Симметрия двойной оси лиганда 4-Bphz определяет его твист-форму с двугранным углом между пиридиновыми циклами, равным 71.64°.
В кристалле IV линейные координационные цепочки параллельны направлению [110] (рис. 6); расстояние между атомами металла, разделенными бидентатно-мостиковым лигандом 4-Bphz, равно 15.94 Å. Ассоциация цепочек в кристалле осуществляется посредством ВС O–H···O с участием молекул воды и ацетат-анионов: O(3)–H(3A)···O(2) (x + 1/2, y, 1 – z) (О···О 2.681(3), H…O 1.89 Å, угол OHO 150.9°), за счет чего формируется супрамолекулярный 2D-слой, параллельный кристаллографической плоскости ab. Между слоями в кристалле IV осуществляются только ван-дер-ваальсовые взаимодействия.
Ближайший композиционный аналог соединения IV – одномерный КП лестничного типа [Zn2(4-Bphz)2(CH3COO)4. 2(MeOH)2]n, в котором бипиридиновый и один из ацетатных лигандов выполняют бидентатно-мостиковую функцию [17].
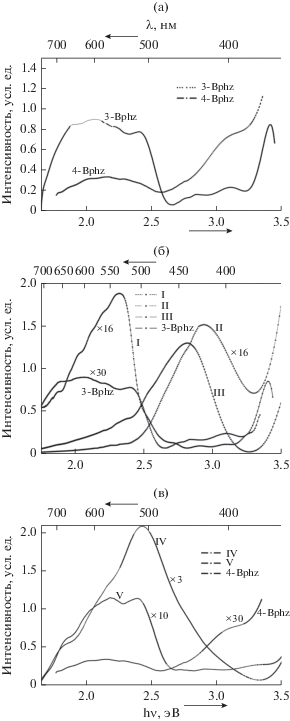
Хотя оба основания Шиффа 3-Bphz и 4-Bphz, использованные в синтезе КП I–V, обладают расширенной сопряженной системой с включением ароматических фрагментов, что является необходимой предпосылкой для регистрации эмиссионных свойств [51], в литературе приведены ограниченные сведения лишь для соединений на основе лиганда 4-Bphz [17, 42, 43], что мотивировало наши исследования. Спектры фотолюминесценции (ФЛ) для исходных лигандов 3-Bphz и 4-Bphz (рис. 7а) и КП I–V (рис. 7б, 7в) регистрировали в твердом теле при комнатной температуре. Спектры ФЛ имеют сложную структуру, что указывает на суперпозицию нескольких излучательных процессов. Все КП демонстрируют свечение от умеренной (для I–III, рис. 7б) до слабой (для IV, V, рис. 7в) интенсивности в сине-зеленой области спектра с максимумами излучения при 530 (I), 425 (II), 440 (III), 515 (IV) и 520 и 580 нм (V). Интенсивность излучения падает в ряду: III > I $ \gg $ II > IV > V. Одинаковые профили спектров для II и III коррелируют с идентичностью кристаллических структур этих соединений. В сравнении с соответствующими лигандами, спектры соединений I–IV демонстрируют нетривиальный для КП выраженный гипсохромный сдвиг максимумов излучения, что по аналогии с литературными данными [42] можно объяснить существенным вкладом дестабилизирующих π–π-стэкинг-взаимодействий между пиридиновыми кольцами соседних лигандов. Из-за закрытой d10-электронной конфигурации катионов Zn2+ и Cd2+, наиболее вероятный механизм излучательных процессов базируется на внутрилигандных π*–π-переходах.
Список литературы
Janiak C. // Dalton Trans. 2003. P. 2781.
RobinA.Y., Fromm K.M. // Coord. Chem. Rev. 2006. V. 250. P. 2127.
Rowsell J.L.C., Yaghi O.M. // Microporous Mesoporous Mater. 2004. V. 73. P. 3.
Croitor L., Coropceanu E., Masunov A. et al. // J. Phys. Chem. C. 2014. V. 118. P. 9217.
Coropceanu E., Rija A., Lozan V. et al. // Cryst. Growth Des. 2016. V. 16. P. 814.
Croitor L., Coropceanu E., Chisca D. et al. // Cryst. Growth Des. 2014. V. 14. P. 3015.
Coropceanu E.B., Croitor L., Wicher B. et al. // Inorg. Chim. Acta. 2009. V. 362. P. 2151.
Croitor L., Coropceanu E., Petuhov O. et al. // Dalton Trans. 2015. V. 44. P. 7896.
Chisca D., Croitor L., Coropceanu E. et al. // CrystEngComm. 2016. V. 18. P. 384.
Chen C.-L., Kang B.-S., Su C.-Y. // Aust. J. Chem. 2006.V. 59. P. 3.
Robinson F., Zaworotko M.J. // Chem. Commun.1995. P. 2413.
Sailaja S., Rajasekharan M.V. // Inorg. Chem. 2000. V. 39. P. 4586.
Du M., Bu X.-H., Huang Z. et al. // Inorg. Chem. 2003. V. 42. P. 552.
Gao E.-Q., Cheng A.-L., Xu Y.-X. et al. // Cryst. Growth Des. 2005. V. 5. P. 1005.
MacGillivray L.R., Groeneman R.H., Atwood L. // J. Am. Chem. Soc. 1998. V. 120. P. 2676.
Liu Y.-Y., Yi L., Ding B. et al. // Inorg. Chem. Commun. 2007. V. 10. P. 517.
Zhang G.-Q., Yang G.-Q., Ma J.-S. // Cryst. Growth Des. 2006. V. 6. P. 1897.
Kumar D.K., Das A., Dastidar P. // Cryst. Growth Des. 2006. V. 6. P. 1903.
Huang X.-C., Zhang J.-P., Chen X.-M. // Cryst. Growth Des. 2006. V. 6. P. 1194.
Oh M., Stern C.L., Mirkin C.A. // Inorg. Chem. 2005. V. 44. P. 2647.
Ciurtin D.M., Dong Y.-B., Smith M.D. et al. // Inorg. Chem. 2001. V. 40. P. 2825.
Diskin-Posner Y., Patra G.K., Goldberg I. // Dalton Trans. 2001. P. 2775.
Gao E.-Q., Cheng A.-L., Xu Y.-X. et al. // Inorg. Chem. 2005. V. 44. P. 8822.
Withersby M.A., Blake A.J., Champness N.R. et al. // Inorg. Chem. 1999. V. 38. P. 2259.
Carlucci L., Ciani G., Proserpio D.M. // Dalton Trans. 1999. P. 1799.
Dong Y.-B., Smith M.D., Layland R.C., zur Loye H.-C. // Chem. Mater. 2000. V. 12. P. 1156.
Yang W., Xiang Lin X. // Inorg. Chem. 2009. V. 48. № 23. P. 11067.
Granifo J., Moreno Y., Garland M. T. et al. // J. Mol. Struct. 2010. V. 983. P. 76.
Jung O.-S., Park S.H., Kim K.M., Jang H.G. // Inorg. Chem. 1998.V. 37. P. 5781.
Zaman M.B., Smith M.D., Ciurtin D.M., zur Loye H.-C. // Inorg. Chem. 2002. V. 41. P. 4895.
Chen C.-L., Goforth A.M., Smith M.D. et al. // Inorg. Chem. 2005.V. 44. P. 8762.
Patra G.K., Glodberg I. // Cryst. Growth Des. 2003.V. 3. P. 321.
Chen C.-L., Kang B.-S., Su C.-Y. // Aust. J. Chem. 2006.V. 59. P. 3.
Dong Y.-B., Layland R.C., Smith M.D. et al. // Inorg. Chem. 1999. V. 38. P. 3056.
Cui Y., Ngo H.L., Lin W. // Chem. Commun. 2003. P. 1388.
Chen C.-T., Suslick K.S. // Coord. Chem. Rev. 1993. V. 128. P. 293.
Leong W.L., Vittal J.J. // Chem. Rev. 2011 V. 111. P. 688.
Song Y., Yu L., Gao Y. et al. // Inorg. Chem. 2017. V. 56. P. 11603.
Miyasaka H., Julve M., Yamashita M., Clérac R. // Inorg. Chem. 2009. V. 48. P. 3420.
Mahmoudi G., Gurbanov A.V., Rodríguez-Hermida S. et al. // Inorg. Chem. 2017. V. 56. P. 9698.
Kennedy A.R., Waterson F.R.N. // Acta Crystallogr. C. 2003. V. 59. P. o613.
Calahorro A.J., San Sebastian E., Salinas-Castillo A. et al. // CrystEngComm. 2015. V. 17. P. 3659.
Manna B., Singh S., Ghosh S.K. // J. Chem. Sci. 2014. V. 126. № 5. P. 1417.
Croitor L., Coropceanu E.B., Siminel A.V. et al. // Cryst. Growth Des. 2011. V. 11. P. 3536.
Croitor L., Coropceanu E.B., Masunov A.E. et al. // Cryst. Growth Des. 2014. V. 14. P. 3935.
Croitor L., Coropceanu E.B., Duca G. et al. // Polyhedron. 2017. V. 129. P. 9.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Paulin S., Kelly P., Williams K.B. et al. // Acta Crystallogr. E. 2007. V.63. P. m420.
Wang Q., Liang, B., Zhang J.-Y. et al. // Z. Anorg. Allg. Chem. 2007. V. 633. P. 2463.
Mahmoudi G., Morsali A., Hunter A.D., Zeller M. // CrystEngComm. 2007. V. 9. P. 704.
Метелица A.В., Бурлов А.С., Безуглый С.О. и др. // Коорд. химия. 2006. Т. 32. № 12. С. 894 (Metelitsa A.V., Burlov A.S., Borodkina I.G., et al. // Russ. J. Coord. Chem. 2006. V. 32. № 12. P. 858. doi 10.1134/ S1070328406120025).
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия