Координационная химия, 2019, T. 45, № 1, стр. 48-57
Нитрило-трис-метиленфосфонатные комплексы РЗЭ [Na(H2O)x]2[LnIIINa6H(H2O)10{N(CH2PO3)3}2] · nH2O (LnIII = Pr, Nd)Н. В. Сомов, Ф. Ф. Чаусов, Н. В. Ломова, Р. М. Закирова, И. В. Федотова, В. Г. Петров, М. А. Шумилова, Д. К. Жиров
Н. В. Сомов 1, *, Ф. Ф. Чаусов 2, 3, Н. В. Ломова 2, Р. М. Закирова 3, И. В. Федотова 3, В. Г. Петров 2, М. А. Шумилова 2, Д. К. Жиров 2
1 Нижегородский государственный университет им. Н.И. Лобачевского
, Россия
2 Удмуртский федеральный исследовательский центр УрО РАН
, Ижевск, Россия
3 Удмуртский государственный университет
, Ижевск, Россия
* E-mail: somov@phys.unn.ru
Поступила в редакцию 12.03.2018
После доработки 15.06.2018
Принята к публикации 05.04.2018
Аннотация
Получены, выделены и исследованы натриевые соли нитрило-трис-метиленфосфонатных комплексов РЗЭ [Na(H2O)x]2[LnIIINa6H(H2O)10{N(CH2PO3)3}2] · nH2O, где LnIII = Pr (I), Nd (II). Изоструктурные кристаллы моноклинные, пр. гр. P21/c, Z = 2; для комплекса I a = 11.8168(7), b = 10.5403(9), c = = 19.8094(10) Å, β = 94.232(5)°; для комплекса II a = 11.7999(2), b = 10.5495(2), c = 19.7976(3) Å, β = 94.158(2)°. Ионы лантанидов координированы в центре клетки, состоящей из двух кислотных остатков {N(CH2PO3)3} и шести ионов натрия, образующих мостики P–O–Na–O–P. Координационный полиэдр Ln – практически правильный ромбоэдр (СIF files CCDC № 1825702 (I), 1825700 (II)).
Координационные соединения лантанидов с N,O-лигандами являются объектами пристального исследования и находят разнообразное практическое применение. Наиболее изучены комплексы РЗЭ с аминополикарбоновыми кислотами (комплексонами) [1–4], находящие применение в технологии разделения РЗЭ, аналитической химии, в качестве диагностических контрастных средств, люминофоров и т.д.
Особенностью N,O-координированных комплексов РЗЭ, отличающей их от аналогичных соединений большинства других элементов, является значительная разность расстояний M–N и M–O [5]. Для комплексов большинства металлов величина 〈M–N〉–〈M–O〉 составляет 0.0–0.2 Å; для f-элементов же характерны значения 〈M–N〉–〈M–O〉 от 0.3 Å и более [3, 5], что приводит к предположению [6] о наличии особенностей в координационной связи лантанидов. В то время как атом N содержит одну неподелeнную электронную пару (НЭП) и способен образовать с атомом металла-комплексообразователя лишь одинарную координационную связь, атом O содержит две НЭП и способен к образованию кратной координационной связи с атомом металла-комплексообразователя. Это и реализуется при координации лантанидов, особенно легких, имеющих достаточное количество вакантных электронных состояний в валентной зоне и значительный интервал HO-MO–LUMO [7], обусловливающий предпочтение РЗЭ к образованию координационной связи с наиболее жесткими лигандами [8, 9].
Ярким примером N,O-лигандов являются аминополифосфоновые кислоты, в частности нитрило-трис-метиленфосфоновая кислота N(CH2PO3)3H6 (NTPH6), способная к реализации разнообразных мотивов связывания с металлами [10–18]. Комплексы NTP с металлами находят применение в качестве ингибиторов коррозии [19–21] и бактерицидов [22]. Комплексы некоторых лантанидов с NTP обнаруживают свойства протонных проводников [23]. Комплексы LnIIINTPH3 · nH2O обстоятельно исследованы И.В. Тананаевым с сотрудниками [24]. По спектроскопическим данным, атом N молекулы NTP в этих комплексах протонирован и не участвует в связи с Ln. Термогравиметрический (ТГ) анализ показал, что разрушение связей N–C–P происходит при температуре свыше 400°С. Аналогичный комплекс Pr в виде мелкокристаллического порошка выделен и структурно охарактеризован методом Ритвельда [25]. Кристаллическая структура комплекса Nd со сходным строением также изучена в [26]. Комплекс [Na(H2O)6]2[LaNa6H(H2O)10{NTP}2] · 3H2O выделен в монокристаллическом виде и исследован [27]. В этом комплексе ион La3+ инкапсулирован в клетку, образованную двумя молекулами NTP, соединенными неорганическими мостиками P–O–Na–O–P. Представляет интерес попытка синтеза изоморфного ряда кристаллов с заменой La на другие РЗЭ и изучение их структурных особенностей.
В настоящей работе описан синтез и структуры комплексов [Na(H2O)x]2[LnIIINa6H(H2O)10 {N(CH2PO3)3}2] · nH2O, где LnIII = Pr, Nd.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез I. Гидроксид соответствующего лантанида, свежеосажденный 0.006 моль (0.24 г) NaOH (“х. ч.”) из раствора 0.001 моль (0.44 г) Ln(NO3)3 · · 6H2O (“х. ч.”) и промытый водой до нейтральной реакции, вносили в водный раствор 0.002 моль (0.600 г) NTP (предварительно дважды перекристаллизованной) и 0.008 моль (0.320 г) NaOH (“х. ч.”). Реакционную массу перемешивали до получения однородного прозрачного раствора (pH 8.8–9.2) и фильтровали. При медленном испарении растворителя образовались кристаллы в виде светло-зеленых (комплекс I) или красновато-сиреневых (комплекс II) моноклинных призм пластинчатого габитуса. Полученные кристаллы промывали 45%-ным водным раствором этанола, затем диэтиловым эфиром и высушивали при комнатной температуре. Выход комплекса I 0.92 г (65%), комплекса II 0.84 г (59%).
Количественное определение содержания РЗЭ проводили по ГОСТ 10398-76, фосфора общего по ПНД Ф 14.1:4.248-07.
| Найдено для I, %: | Pr 10.1 ± 0.4; | P 13.0 ± 0.2. |
| Вычислено, %: | Pr 9.95; | P 13.12. |
| Найдено для II, %: | Nd 10.3 ± 0.4; | P 13.2 ± 0.2. |
| Вычислено, %: | Nd 10.16; | P 13.09. |
РСА. Первичные фрагменты структур I и II найдены прямым методом, положения атомов определены из разностных синтезов электронной плотности. Параметры неводородных атомов уточнены в анизотропном приближении методом наименьших квадратов по |F|2. Положения атомов H уточнены в изотропном приближении, на параметры некоторых атомов водорода наложены ограничениями. Положения протонов, относящихся к разупорядоченным молекулам воды, локализовать не удалось. Кристаллографические характеристики, параметры рентгеноструктурных экспериментов и уточнения структур приведены в табл. 1. Основные длины связей и валентные углы в структурах I и II приведены в табл. 2.
Таблица 1.
Кристаллографические характеристики, данные эксперимента и уточнения структур I, II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C6H69N2O46P6Na8Pr | C6H69N2O46P6Na8Nd |
| M | 1416.26 | 1419.60 |
| Сингония, пр. гр., Z | Моноклинная, P21/c, 2 | |
| a, Å | 11.8168(7) | 11.7999(2) |
| b, Å | 10.5403(9) | 10.5495(2) |
| c, Å | 19.8094(10) | 19.7976(3) |
| β, град | 94.232(5) | 94.158(2) |
| V, Å 3 | 2460.6(3) | 2457.98(7) |
| ρ(выч.), г/см 3 | 1.866 | 1.894 |
| Излучение; λ, Å | MoKα; 0.71073 | |
| μ, мм –1 | 1.375 | 1.442 |
| T, K | 100(1) | |
| Размеры образца, мм | 0.94 × 0.52 × 0.59 | 0.54 × 0.33 × 0.20 |
| Дифрактометр | XtaLAB Pro MM003, PILATUS 200K | |
| Тип сканирования | ω | |
| Учет поглощения | Аналитический [28] | |
| Tmin/Tmax | 0.336/0.458 | 0.482/0.770 |
| θmin /θmax, град | 3.648 / 34.103 | 3.462 / 32.996 |
| Пределы инднесов h, k, l | –16 ≤ h ≤ 18, –12 ≤ k ≤ 15, –31 ≤ l ≤ 30 |
–17 ≤ h ≤ 17, –16 ≤ k ≤ 15, –30 ≤ l ≤ 29 |
| Отражений измеренных/ независимых (N1) (RInt) |
34 979/8625 (0.075) | 77 711/8622 (0.033) |
| Отражений с I > 2σ(I) (N2) | 7516 | 8000 |
| Метод уточнения | Полноматричный МНК по F2 | |
| Число параметров/ограничений | 349/3 | 354/3 |
| S | 1.125 | 1.057 |
| R1/wR1 по N1 | 0.083/0.1659 | 0.037/0.0807 |
| R1/wR1 по N2 | 0.0733/0.1625 | 0.0339/0.0794 |
| Δρmin/Δρmax , е/Å3 | –1.897/2.693 | –0.974/2.014 |
| Программы | CrysAlisPro [29], SHELX-2014 [30], WinGX [31], VESTA 3.0 [32] |
|
Таблица 2.
Основные межатомные расстояния (d), валентные (ω) и торсионные (θ) углы в структурах I, II
| Связь | d, Å | |
|---|---|---|
| I | II | |
| Ln–N | 2.986(4) | 2.9728(16) |
| Ln–O | 2.408(3)–2.438(4) | 2.3922(13)–2.4193(15) |
| N–C | 1.462(7)–1.485(6) | 1.473(3)–1.484(2) |
| C–P | 1.813(6)–1.825(5) | 1.816(2)–1.820(2) |
| P–O | 1.520(4)–1.530(3) | 1.5223(17)–1.5301(17) |
| P–O(Ln) | 1.540(3)–1.542(4) | 1.5383(14)–1.5407(14) |
| Na(1)–O | 2.391(5)–2.589(4) | 2.3808(18)–2.585(2) |
| Na(2)–O | 2.391(4)–2.526(4) | 2.386(2)–2.5837(17) |
| Na(3)–O | 2.380(5)–2.580(6) | 2.3748(18)–2.5194(17) |
| Na(4)–O | 2.160(17)–2.980(14) | 2.156(7)–2.985(6) |
| Угол | ω, град | |
| NLnO | 63.71(11)–64.75(11) | 63.79(5)–64.73(4) |
| 115.25(11)–116.29(11) | 115.27(4)–116.21(5) | |
| OLnO | 100.85(12)–103.16(12) | 100.98(5)–103.19(5) |
| CNLn | 108.1(3)–109.0(3) | 108.44(10)–108.88(11) |
| CNC | 109.9(4)–110.7(4) | 110.11(15)–110.41(14) |
| OPC | 104.1(2)–110.0(2) | 103.80(9)–110.13(9) |
| OPO | 110.1(2)–113.5(2) | 110.40(8)–113.33(8) |
| ONa(1)O | 131.06(13)–162.42(19) | 132.18(6)–161.33(6) |
| 73.98(13)–124.39(16) | 60.44(5)–122.75(6) | |
| ONa(2)O | 133.51(15)–157.76(16) | 130.63(5)–162.98(8) |
| 60.77(13)–127.91(15) | 58.54(5)–124.70(7) | |
| ONa(3)O | 132.72(15)–161.16(16) | 132.98(6)–158.12(7) |
| 60.35(13)–122.35(15) | 61.00(5)–128.47(6) | |
| ONa(4)O | 15.2(3)–174.3(2) | 12.59(19)–174.96(8) |
| Угол | θ, град | |
| LnNCP | 42.45(5)–43.69(5) | 42.06(4)–43.73(4) |
Результаты РСА депонированы в Кембриджском банке структурных данных (CCDC № 1825702 (I) и 1825700 (II); deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk/data_request/cif).
ТG анализ I и II проводили на автоматизированном дериватографе Shimadzu DTG-60H в интервале 30–500°С при скорости нагрева 3°С/мин в атмосфере аргона. Рентгенофазовый анализ (РФA) продуктов термического разложения I и II проводили на двукружном дифрактометре ДРОН-6 в CoKα излучении (λ = 1.79026 Å) в интервале углов 2θ = 6–100°. ИК-спектры I, II и продуктов их термического разложения регистрировали в таблетках KBr на Фурье-спектрометре ФСМ-1201 в интервале 450–5000 см–1. ЭСП водных растворов I и II и продуктов их термического разложения регистрировали в таблетках KBr на Фурье-спектрометре ФСМ-1201 в интервале 450–5000 см–1. Спектры комбинационного рассеяния (КР) монокристаллов I и II регистрировали на микроскопе-микроспектрометре Centaur U-HR в интервале 475–575 нм с возбуждением лазером с длиной волны 473 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Строение координационной сферы РЗЭ для атомов Ln в I, II (рис. 1а) близко к ранее описанному для комплекса La [27]. Атомы РЗЭ, расположенные в центрах инверсии, инкапсулирован внутри клетки, состоящей из двух молекул NTP, соединенных друг с другом шестью неорганическими мостиками P–O–Na–O–P. Ось, соединяющая атомы азота молекул NTP, проходит через атом РЗЭ, а молекулы лиганда повернуты друг относительно друга на 60°.
Рис. 1.
Координационные полиэдры металлов, входящих в состав комплексного иона [LnNa6H(H2O)10{N-(CH2-PO3)3}2]2–: Ln (a), Na+ (б) (на примере атома Na(1); полиэдры атомов Na(2) и Na(3) аналогичны). Симметрично эквивалентная позиция: * –x, –y, –z.
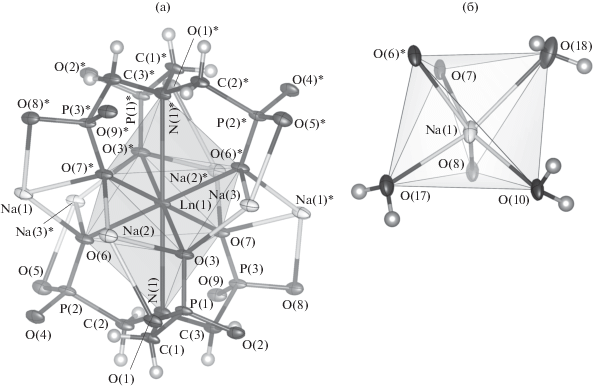
Атом Ln координирован двумя атомами азота молекул NTP и шестью атомами кислорода. О наличии связей Ln–N свидетельствует близость валентных углов при атомах азота к тетраэдрическому, указывающая на кватернизацию азота с вовлечением льюисовской электронной пары в химическую связь. В каждой группе PO3 один атом кислорода координирует атом РЗЭ и атом Na, другой – только атом Na, третий образует водородные связи с молекулами воды. Все атомы кислорода групп PO3 депротонированы, о чем свидетельствуют расстояния P–O (1.520(4)–1.5426(16) Å). Как показывает анализ структур других фосфонатных комплексов, протонирование атома O ведет к увеличению расстояния P–O на ~0.06 Å [12–18, 22, 27] из-за смещения электронной плотности к протону. Однако расстояния P–O для атомов кислорода, связанных с Ln, несколько больше (в среднем на 0.014(4) Å), чем для остальных атомов кислорода групп PO3. Это свидетельствует о заметном участии электронной плотности атомов кислорода в образовании связи Ln–O, которая имеет, таким образом, известную ковалентную составляющую в отличие от типично ионной связи Na–O.
Каждый из ионов Na(1)–Na(3), входящих в комплексный анион [LnNa6H(H2O)10{N(CH2PO3)3}2]2–, координирован двумя атомами кислорода группы PO3 одной молекулы NTP и одним атомом кислорода группы PO3 другой молекулы NTP, занимающей, таким образом, мостиковое положение. Еще три меридионально расположенные позиции в координационной сфере каждого из указанных ионов Na+ занимают молекулы воды.
При образовании комплексного аниона замыкаются хелатные циклы: шесть пятичленных Ln–N–C–P–O с общими связями Ln–N, шесть восьмичленных Ln–O–P–C–N–C–P–O, шесть четырехчленных P–O–Na–O. Всего молекула NTP координирует семь атомов металла.
Среднее расстояние Ln–O (2.423(12) Å для Ln = Pr и 2.407(11) Å для Ln = Nd) значительно меньше, чем сумма ковалентных радиусов [33] (rC(Pr) = 2.03(7), rC(Nd) = 2.01(6), rC(O) = 0.66(2) Å). Это объясняется, очевидно, образованием кратной координационной связи Ln$\overline {...} $O. Расстояние La–N для комплексов I, II (соответственно, 2.986(4), 2.9728(16) Å) существенно превышает сумму ковалентных радиусов Ln и N [33]. Разность расстояний M–N и M–O для комплексов I, II составляет, соответственно, 0.562(16), 0.565(13) Å.
Для оценки геометрической конфигурации координационных полиэдров (КП) ионов металлов, входящих в комплексный анион [LnNa6H(H2O)10 {N(CH2PO3)3}2]2–, рассчитывали коэффициент подобия Φ(T,S) для экспериментально определенного КП (T) и эталонного полиэдра (S) по методике, подробно описанной в [16, 34]. Расчеты проводили по программе Polyhedron из пакета программ PseudoSymmetry (http://phys.unn.ru/ps) с параметром чувствительности λ = 1.1914 рад–1. Представлению КП атома РЗЭ [LnN2O6] как искаженной гексагональной пирамиды соответствует коэффициент подобия (ΦPr, Nd ≈ 0.05). Максимальному подобию (ΦPr, Nd ≈ 0.58) соответствует описание КП [LnN2O6] в соединениях I и II как ромбоэдра (табл. 3). Ромбоэдр представляет собой искаженный куб, вытянутый вдоль пространственной диагонали. Каждая из граней ромбоэдра представляет собой ромб, вытянутый вдоль одной из диагоналей. Для комплекса I ребро ромбоэдра 2.96(6) Å, диагонали граней 3.77(4) и 4.60(2) Å; для II, соответственно, 2.97(7), 3.75(3) и 4.57(2) Å. Ромбоэдрическая координация, достаточно редкая для РЗЭ, обычно координирующихся в конфигурации асимметричных 9–12-вершинников. Координационный полиэдр [NaO6] (рис. 1б) можно рассматривать как тригональную призму (ΦNa ≈ 0.10–0.13) или скрученный вокруг оси третьего порядка октаэдр (ΦNa ≈ 0.08).
Таблица 3.
Степени подобия (Ф) координационных полиэдров для структур I, II
| Атом, КЧ | Тригональная призма | Кубический октаэдр | Гексагональная бипирамида | Ромбоэдр |
|---|---|---|---|---|
| I | ||||
| Na(1), 6 | 0.10014(18) | 0.07860(18) | ||
| Na(2), 6 | 0.1302(2) | 0.08211(18) | ||
| Na(3), 6 | 0.10285(19) | 0.08544(19) | ||
| Pr(1), 6 | 0.02939(17) | 0.2782(2) | ||
| Pr(1), 8 | 0.05297(17) с/a ≈ 1.11 |
0.5823(4) c/a ≈ 1.21 |
||
| II | ||||
| Na(1), 6 | 0.10024(17) | 0.08331(17) | ||
| Na(2), 6 | 0.09943(17) | 0.07919(17) | ||
| Na(3), 6 | 0.13209(17) | 0.08399(17) | ||
| Nd(1), 6 | 0.02268(17) | 0.27653(18) | ||
| Nd(1), 8 | 0.05276(17) с/a ≈ 1.11 |
0.5780(2) c/a ≈ 1.18 |
||
Кристаллическая упаковка комплексов I и II изображена на рис. 2. Структура включает слои (рис. 2а), чередующиеся вдоль оси a.
Рис. 2.
Кристаллическая упаковка I и II: (а) – слоистая упаковка в проекции на плоскость (101); (б) – слой (100); (в) – фрагменты слоя (200) для комплексов I и II. Симметрично эквивалентные позиции: * –x, –y, –z; # x, –y – 1/2, z – 1/2.
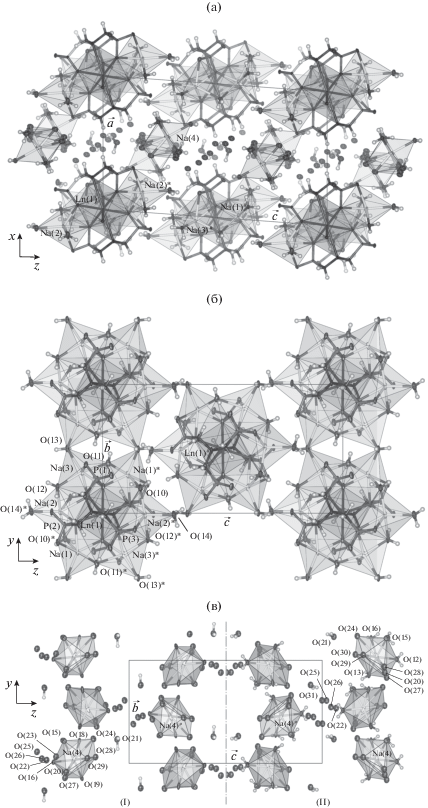
Эти слои, лежащие в плоскостях (100), состоят из комплексных анионов [LnNa6H(H2O)10 {N(CH2PO3)3}2]2–. Их структура одинакова для комплексов I и II и представляет собой простирающиеся вдоль оси b ленты, выполненные комплексными анионами, которые соединены друг с другом мостиковыми молекулами воды O(13) (рис. 2б). Каждая лента расположена наклонно к плоскости слоя (100), из-за чего каждый слой анионов оказывается гофрированным.
Слои, лежащие в плоскостях (200), содержат комплексные катионы [Na(H2O)x]+ и сольватные молекулы воды, размещенные в пространствах между комплексными катионами. Структура этих слоев различна для комплексов I и II (рис. 2в). Расположение молекул воды в слоях (200) сильно разупорядочено. Это создает известную неоднозначность формального описания комплексов. Количество молекул воды x, условно включаемых в координационную сферу иона Na(4), и количество сольватных молекул воды n зависит от выбора предельной длины координационной связи Na–OH2, которая, конечно, принимается сугубо условно. Значения x и n для структур I и II при предельной длине связи Na–OH2, принятой 3 Å, представлены ниже:
Условный характер определения координационной сферы иона Na(4), большинство позиций молекул воды в которой имеет нецелочисленную заселенность, делает нецелесообразным анализ геометрии КП иона Na(4). Молекулы воды в структуре I и II соединены друг с другом и с атомами кислорода фосфонатных групп водородными связями. Однако из-за значительной разупорядоченности молекул воды локализовать положение большинства атомов водорода и водородных связей не удалось.
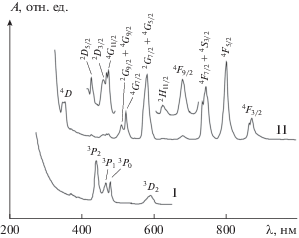
ЭСП комплексов I и II в водных растворах (рис. 3) характерны для трехзарядных ионов РЗЭ. Спектр комплекса I содержит линии переходов Pr3+ (терм основного состояния 3H0) в состояния 3P (423, 468 и 481 нм) и 1D2 (583 нм) [35]. ЭСП комплекса II характеризуется переходами Nd3+ (терм основного состояния 4I9/2) в состояния 4D (неразрешенный мультиплет 347–359 нм), 2D (427 и 461 нм), 4G (475, 511, 524 и 582 нм), 2G (511 и 582 нм), 2H11/2 (526 нм), 4F (682, 736, 803 и 872 нм), 4S3/2 (745 нм) [36].
Молекулярно-колебательные спектры (рис. 4) комплексов I и II сходны. Группы полос 150–230, 270, 350 см–1 относятся к колебаниям комплексных ионов как целого; отличия спектров комплексов I и II в этой области соответствуют различиям в строении комплексных ионов [Na(H2O)x]+. Широкая полоса 390–430 см–1 и группа полос около 490, 520, 560, 580 и 620 см–1 соответствуют модам колебаний δ(O–P–O(M)) в координационном окружении ионов металлов. Высокая симметрия комплексного иона [LnIIINa6H(H2O)10{N(CH2PO3)3}2]2– проявляется в альтернативном запрете большинства этих колебательных мод. Полосы в области 700–920 см–1 относятся к колебаниям связей N–C–P в структуре комплексного аниона. При этом частоты около 720, 750 и 770 см–1, проявляющиеся только в спектрах КР, относятся к симметричным, а частоты 790, 850 и 910 см–1, не подчиняющиеся правилу альтернативного запрета – к асимметричным колебательным модам. Колебаниям ν(P–O) соответствуют альтернативно запрещенные ИК-активные полосы около 970, 990, 1050 и 1110 см–1 и КР-активные – около 1000, 1070 и 1150 см–1. Колебания локализованной π-связи P–O (~1250 см–1) интенсивно проявляются в спектре КР и слабо – в ИК-спектре. Также наблюдаются полосы (см–1): 1430 δ(CH2), 1500–1600 δ(H2O), 2950–2980 ν(CH2).
Рис. 4.
Спектры КР (интенсивность I как функция волнового числа ν) монокристаллов комплексов I (1), II (2); ИК-спектры (пропускание T как функция в-олнового числа ν) комплексов I (3), II (4), продуктов термического разложения в среде аргона комплексов I (5) и II (6).
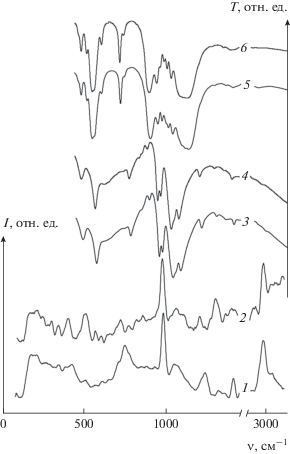
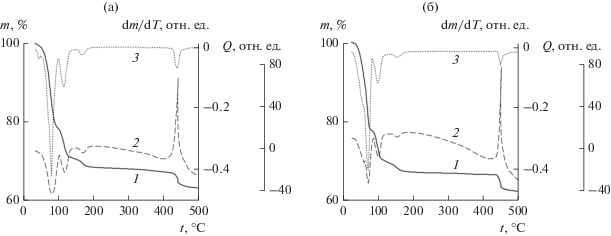
Термическое разложение I и II в атмосфере аргона протекает в несколько стадий (рис. 5). В интервале 40–180°С происходит отщепление молекул воды с сопутствующими эндотермическими эффектами; вследствие сложного строения комплексов их дегидратация протекает в несколько стадий: 30–100°C (–19H2O), 100–130°C (–7H2O), 150–180°C (–2H2O). При дальнейшем нагревании вплоть до 410°C никаких эффектов не проявляется. В интервале 410–470°C наблюдается потеря массы образца, соответствующая отщеплению молекулы N2 и двух молекул H2O с сильным экзотермическим эффектом; это согласуется с отмеченным в [24] разрушением N–C–P скелета свыше 400°C. В ИК-спектрах продуктов термического разложения (рис. 4, 5, 6) обнаруживаются полосы метафосфата натрия NaPO3 [37, 38] (см–1: 485, 525 δ(O–P–O), 1010, 1030, 1060, 1110–1150 ν(PO3)) и полосы, близкие к ортофосфату лантана LnPO4 [39, 40] (см–1: 555, 570, 620, 730 δ(O–P–O), 960, 990, 1060 ν(PO3)). РФА продуктов термического разложения I и II свидетельствует о наличии монацита (LnPO4, пр. гр. P21/n) [41].
Рис. 5.
Термогравиграммы I (а), II (б) в среде аргона: масса образца m (1), тепловой эффект Q (2) и производная dm/dT (3) как функции температуры Т.
Работа выполнена в рамках базовой части государственного задания высшим учебным заведениям и научным организациям в сфере научной деятельности (проект №3.6502.2017/БЧ).
Список литературы
Координационная химия редкоземельных элементов / Под ред. Спицына В.И., Мартыненко Л.И. М.: МГУ, 1979. 254 с.
Comprehensive Coordination Chemistry / Eds. Wilkinson G., Gillard R.D., McCleverty J.A. Pergamon Press, 1987. V. 3.1601 p.
Comprehensive Coordination Chemistry II / Eds. Mc-Cleverty J.A., Meyer T.J. Elsevier, 2003. V. 3. 608 p.
Rare Earth Coordination Chemistry. Fundamentals and Applications / Ed. Chunhui H. John Wiley & Sons, 2010. 575 p.
Порай-Кошиц М.А., Полынова Т.Н., Школьникова Л.М. // Журн. Высш. хим. об-ва им. Д.И. Менделеева. 1984. Т. 29. № 3. С. 43.
Stezowski J.J., Hoard J. // Isr. J. Chem. 1984. V. 24. P. 323. doi 10.1002/ijch.198400055
Schinzel S., Bindl M., Visseaux M., Chermette H. // J. Phys. Chem. A. 2006. V. 110. P. 11324. doi 10.1021/jp060876d
Pearson R.G. // J. Chem. Educ. 1999. V. 76. № 2. P. 267. doi 10.1021/ed076p267
Geerlings P., De Proft F., Langenaeker W. // Chem. Rev. 2003. V. 103. № 5. P. 1793. doi 10.1021/cr990029p
Cabeza A., Ouyang X., Sharma C.V.K. et al. // Inorg. Chem. 2002. V. 41. P. 2325. doi 10.1021/ic0110373
Demadis K.D., Katarachia S.D., Koutmos M. // Inorg. Chem. Commun. 2005. V. 8. P. 254. doi 10.1016/j.inoche.2004.12.019
Сомов Н.В., Чаусов Ф.Ф. // Кристаллография. 2014. Т. 59. № 1. С. 71 (Somov N.V., Chausov F.F. // Crystallogr. Rep. 2014. V. 59. № 1. P. 66. doi 10.1134/ S1063774513050118).
Сомов Н.В., Чаусов Ф.Ф. // Кристаллография. 2015. Т. 60. № 2. С. 233 (Somov N.V., Chausov F.F. // Crystallogr. Rep. 2015. V. 60. № 2. P. 210. doi 10.1134/ S1063774515010228).
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М., Федотова И.В. // Кристаллография. 2016. Т. 61. № 2. С. 238 (Somov N.V., Chausov F.F., Zakirova R.M., Fedotova I.V. // Crystallogr. Rep. 2016. V. 61. № 2. P. 216. doi 10.1134/S1063774516020243).
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М., Федотова И.В. // Координационная химия. 2015. Т. 41. № 12. С. 729 (Somov N.V., Chausov F.F., Zakirova R.M., Fedotova I.V. // Russ. J. Coord. Chem. 2015. V. 41. № 12. P. 798. doi 10.1134/S1070328415110081).
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М. и др. // Кристаллография. 2017. Т. 62. № 6. С. 896 (Somov N.V., Chausov F.F., Zakirova R.M et al. // Cryst. Rep. 2017. V. 62. № 6. P. 857. doi 10.1134/S1063774517050224).
Сомов Н.В., Чаусов Ф.Ф., Ломова Н.В и др. // Коорд. химия. 2017. Т. 43. № 9. С. 545 (Somov N.V., Chausov F.F., Lomova N.V. et al. // Russ. J. Coord. Chem. 2017. V. 43. № 9. P. 583. doi 10.1134/S1070328417090093).
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М. и др. // Коорд. химия. 2017. Т. 43. № 12. С. 765 (N.V. Somov, F.F. Chausov, R.M. Zakirova, et al. // Russ. J. Coord. Chem. 2017. V. 43. № 12. P. 864. doi 10.1134/ S1070328417120090].
Кузнецов Ю.И. // Успехи химии. 2004. Т. 73. № 1. С. 79.
Чаусов Ф.Ф., Шабанова И.Н., Казанцева И.С., Наймушина Е.А. // Изв. АН. Сер. Физ. 2014. Т. 78. № 4. С. 436.
Shabanova I.N., Chausov F.F., Naimushina E.A., Somov N.V. // Surf. Interface Anal. 2014. V. 46. P. 750. doi 10.1002/sia.5479
Сомов Н.В., Чаусов Ф.Ф. // Кристаллография. 2016. Т. 61. С. 45. (Somov N.V., Chausov F.F. // Crystallogr. Rep. 2016. V. 61. P. 39. doi 10.1134/ S1063774516010235).
Bazaga-García M., Angeli G.K., Papathanasiou K.E. et al. // Inorg. Chem. 2016. V. 55. P. 7414. doi 10.1021/ acs.inorgchem.6b00570
Тананаев И.В., Терешин Г.С., Кузнецова О.Б. и др. // Журн. неорган. химии. 1981. Т. 26. № 1. С. 276.
Cunha-Silva L., Mafra L., Ananias D. et al. // Chem. Mater. 2007. V. 19. P. 3527. doi 10.1021/cm070596q
Береснев Е.Н., Кузнецова О.Б., Копьева М.А. // Журн. неорган. химии. 2009. Т. 54. №7. С. 1086. (Beresnev E.N., Kuznetsova O.B., Kop’eva M.A. // Russ. J. Inorg. Chem. 2009. V. 54. №. 7. P. 1023. doi 10.1134/ S0036023609070067).
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М и др. // Коорд. химия. 2017. Т. 43. С. 369 (Somov N.V., Chausov F.F., Zakirova R.M et al. // Russ. J. Coord. Chem. 2017. V. 42. P. 373. doi 10.1134/S1070328417060082).
Clark R.C., Reid J.S. // Acta Crystallogr. A. 1995. V. 51. P. 887. doi 10.1107/S0108767395007367
CrysAlisPro. Version 1.171.38.41. Rigaku Oxford Diffraction, 2015.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112. doi 10.1107/S0108767307043930
Farrugia L.J. // J. Appl. Cryst. 1999. V. 32. P. 837. doi 10.1107/S0021889899006020
Momma K., Izumi F. // J. Appl. Cryst. 2011. V. 44. P. 1272. doi 10.1107/S0021889811038970
Cordero B., Gómez V., Platero-Prats A E. et al. // Dalton Trans. 2008. № 21. P. 2832. doi 10.1039/b801115j
Сомов Н.В., Андреев П.В. // Кристаллография. 2018. Т. 63. № 1. С. 38 (Somov N.V., Andreev P.V. // Crystallogr. Rep. 2018. V. 63. № 1. P. 32. doi 10.1134/ S1063774518010170).
Cai Z., Umar V.M., Fischer C.F. // Phys. Rev. Lett. 1992. V. 68. P. 297. doi 10.1103/PhysRevLett.68.297
Wyart J.-F., Meftah A., Bachelier A. et al. // J. Phys. B. 2006. V. 39. P. L77. doi 10.1088/0953-4075/39/5/L01
Ogden J.S., Williams S.J. // J. Chem. Phys. 1980. V. 73. № 4. P. 2007.
Bencivenni L., Gingerich K.A. // J. Mol. Struct. 1983. V. 98. P. 195.
Savchyn P., Karbovnyk I., Vistovskyy V. et al. // J. Appl. Phys. 2012. V. 112. P. 124309.
Patil Y.S., Chaudhari K.G., Murthy K.V.R., Poornachandra Rao N.V. // Arch. Appl. Sci. Res. 2012. V. 4. № 2. P. 757.
Ni Y., Hughes J.M., Mariano A.N. // Am. Mineral. 1995. V. 80. P. 21.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия